Similar presentations:
Классификация химических реакций
1. Классификация химических реакций
2. Задачи урока:
1.2.
3.
Расширить и углубить знания о химических
реакциях, сравнить их с другими видами
явлений.
Научиться выделять существенные
признаки, которые могут быть положены
в основу классификации химических
реакций
Рассмотреть классификацию химических
реакций по различным признакам.
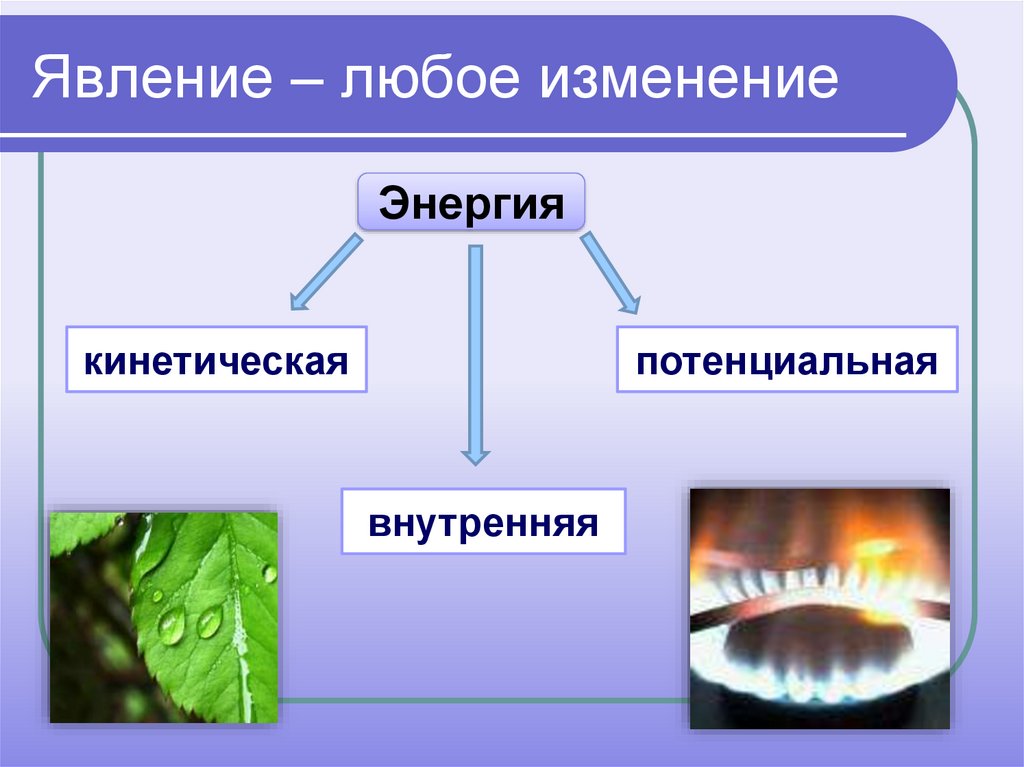
3. Явление – любое изменение
Энергиякинетическая
потенциальная
внутренняя
4. К каким явлениям относятся данные превращения?
5. Химическая реакция (или химическое явление)
это процесс, в результате которого из однихвеществ образуются другие вещества,
отличающиеся от исходных по составу или
строению,
а
следовательно,
и
по
свойствам.
6. Будут ли данные реакции химическими?
7N + 2Не
92
U + 0n
1Н
36
+ 8О
Kr + 56 Ba + 2 0 n
Ядерные реакции- это процесс
превращения атомных ядер в результате их
взаимодействия с другими ядрами или
элементарными частицами.
7. Назовите химические процессы:
Скисаниемолока.
Горение свечи.
Измельчение куска мела.
Испарение воды.
Ржавление железа
Брожение виноградного сока
Плавление воска.
Взбивание масла.
8. Признаки химических реакций
изменениецвета
образование(растворение)
осадка
изменение запаха
выделение (поглощение)
энергии
выделение газа
9. Сущность химических процессов
Разрывхимических связей в
реагентах.
Возникновение новых связей в
продуктах реакции.
Получение готового продукта,
возможность выделить его из общей
массы веществ и дальнейшее
использование
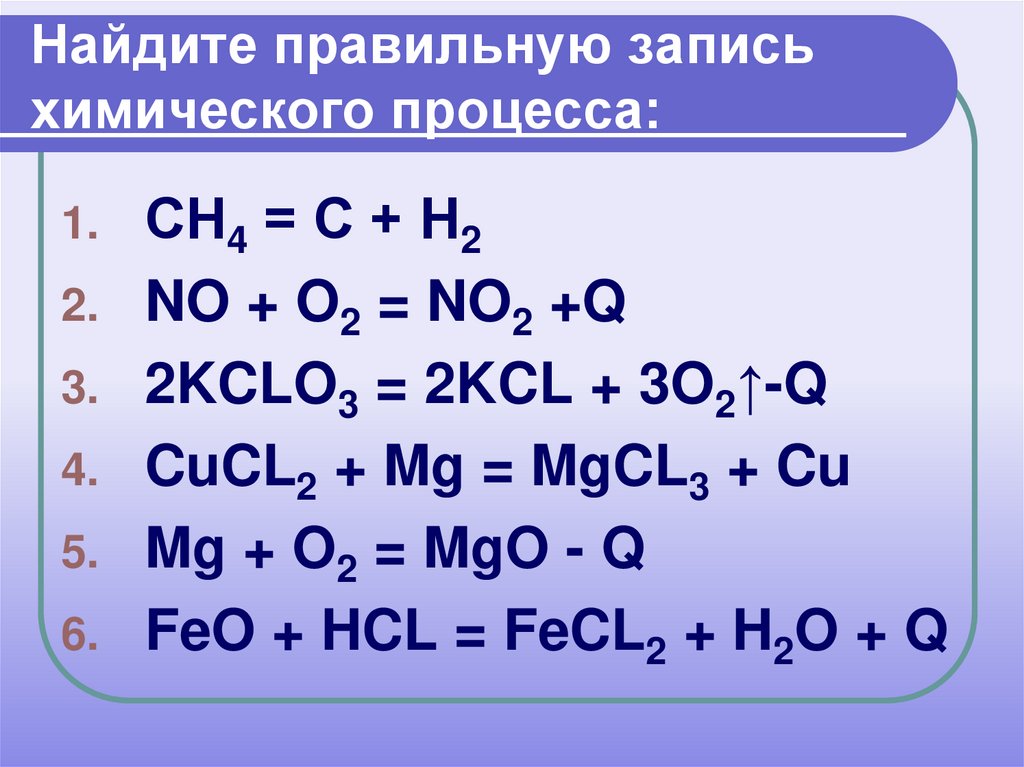
10. Найдите правильную запись химического процесса:
1.2.
3.
4.
5.
6.
СН4 = С + Н2
NO + O2 = NO2 +Q
2KCLO3 = 2KCL + 3O2↑-Q
CuCL2 + Mg = MgCL3 + Cu
Mg + O2 = MgO - Q
FeO + HCL = FeCL2 + H2O + Q
11. Историческая справка.
В 1748 году сформулирован законсохранения массы веществ
«Все перемены, в натуре случающиеся,
такого суть состояния, что сколько
чего у одного тела отнимается,
столько присовокупится к другому»
М.В.Ломоносов
12. Признаки классификации химических реакций
1.2.
3.
4.
5.
6.
Число и состав реагентов.
Изменение степеней окисления
элементов
Направление процесса.
Участие катализатора.
Тепловой эффект реакции.
Наличие раздела фаз (агрегатное
состояние веществ).
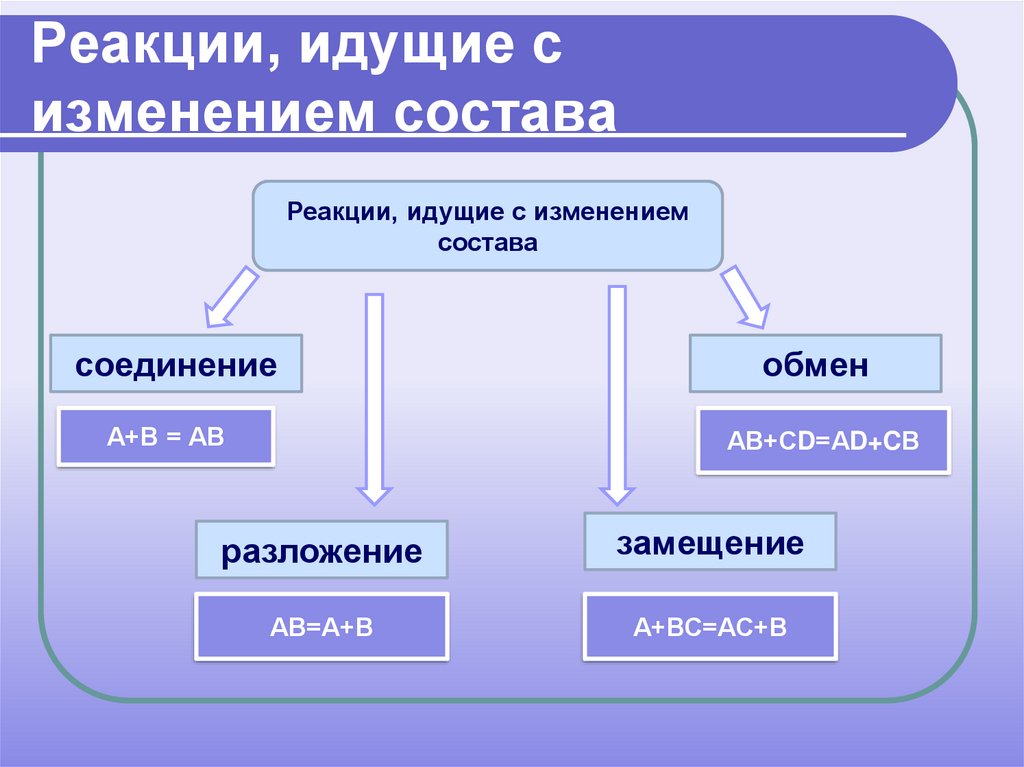
13. Реакции, идущие с изменением состава
Реакции, идущие с изменениемсостава
соединение
А+В = АВ
обмен
АВ+СD=АD+CВ
разложение
замещение
АВ=А+В
А+ВС=АС+В
14. По изменению степеней окисления химических элементов
Окислительно – восстановительныеОкисление
Восстановление
Не окислительно- восстановительные
( С. О. – const)
15. По направлению процесса
Необратимые -реакции,протекающие в одном
направлении.(→)
Условия:
Обратимые -реакции,
протекающие в обоих
направлениях.(↔)
16. По участию катализатора
Каталитические- Катализатор
- Ингибитор
Некаталитические
17. По тепловому эффекту
Экзотермические реакции( +Q)Эндотермические реакции( - Q)
18. По фазовому составу
Гомогенный процессГетерогенный процесс
19. РЕАКЦИИ ВОКРУГ НАС
В печени человека протекает около20 000 000 химических реакций
Ежесекундно в организме человека происходят сотни и тысячи
всевозможных реакций.















 chemistry
chemistry








