Similar presentations:
Электрохимическая термодинамика и кинетика
1. Электрохимическая термодинамика и кинетика
12.
A.J. Bard, L.R. Faulkner “Electrochemical Methods:Fundamentals and Applications”
J. Wang “Analytical Electrochemistry”
E. Barsoukov, J.R. Macdonald “Impedance Spectroscopy
Theory, Experiment, and Applications”
C. Gabrielli “Identification of Electrochemical Processes by
Frequency Response Analysis”
2
3.
Electroanalysis:• widest dynamic range
(down to a single molecule detection)
• less sensitive to matrix effects
(insensitive to color, turbidity etc.)
• the cheapest equipment
3
4.
ЭлектрохимияХимия посредством электричества
Электричество посредством химии
4
5.
Дополнительная степень свободыХимия
хим. состав, температура, давление
Электрохимия
хим. состав, температура, давление
+ электричество
5
6.
Первый закон термодинамикив химии
(изобарно-изотермический потенциал)
=Q–A
A = p∆ V
Q = T∆S
∆H = ∆U +p∆ V
∆G = ∆H - T∆S = ∆U +p∆ V- T∆S
∆G = 0
∆U
6
7.
Первый закон термодинамикив электрохимии
(изобарно-изотермический потенциал)
=Q–A
A = p∆ V+q∆E
Q = T∆S
∆H = ∆U +p∆ V
∆G = ∆H - T∆S = ∆U +p∆ V- T∆S = - q∆E
q=nF
∆G = -nF∆E
∆U
7
8.
Ток – кинетический параметрdQ
i ( Ампер )
( кулон / с )
dT
Q
N ( моль)
nF
dN
i
v ( моль / с )
dt nF
8
9. Электрохимическая ячейка
электродыэлектролит
(раствор, расплав и пр.)
9
10.
Электронный проводник в контакте сионным проводником
Zn/Zn2+, Сlˉ/AgCl/Ag
10
11.
Что влияет на электродные процессы11
12.
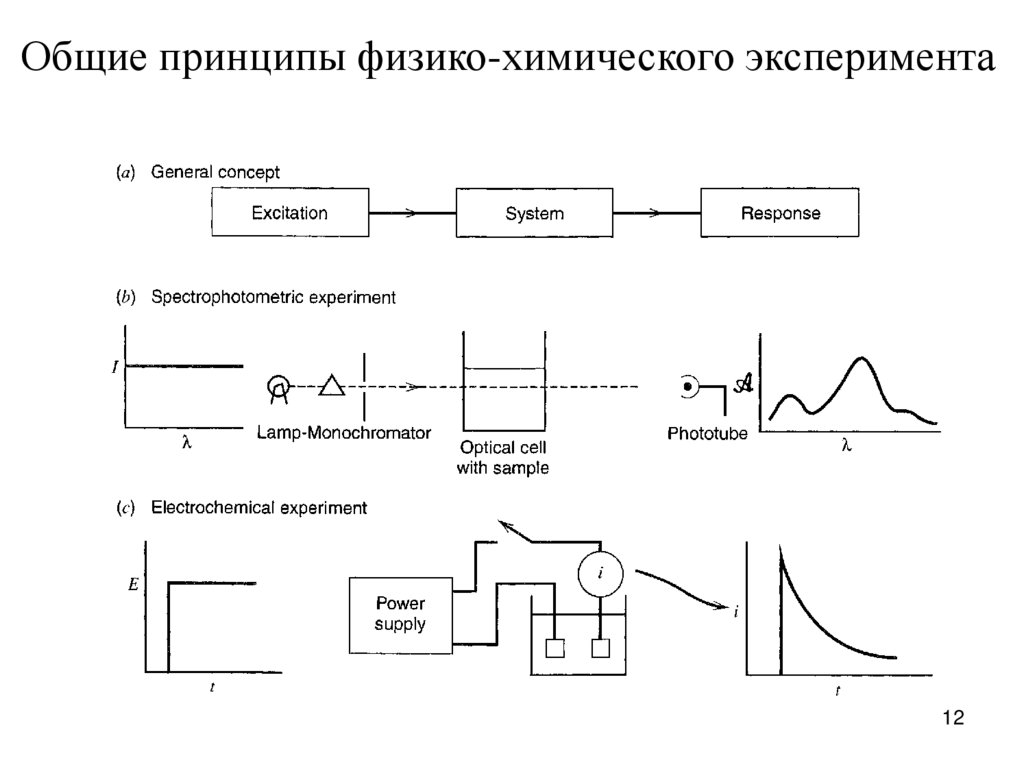
Общие принципы физико-химического эксперимента12
13.
Граница раздела фаз(interphase)
фаза б
б’
а’
фаза а
область раздела
13
14. Определения
Поляризация –смещение потенциалаотносительно его равновесного (стационарного)
значения под действием тока.
Катод – электрод с отрицательной поляризацией.
Анод – электрод с положительной поляризацией.
14
15.
Гальваническая и электролитическая ячейкиВажен не заряд относительно внешней цепи, а знак (направление)
поляризации
На аноде идет процесс окисления (анодный), на катоде –
восстановления (катодный)
15
16.
Граница раздела фаз(interphase)
r
Фарадевский процесс
идеально неполяризуемый
(r 0)
Нефарадевский процесс
идеально поляризуемый
c
16
17.
Реальная граница раздела фазRandles-Sevcik interface
r
c
17
18.
Электрохимическаятермодинамика
18
19.
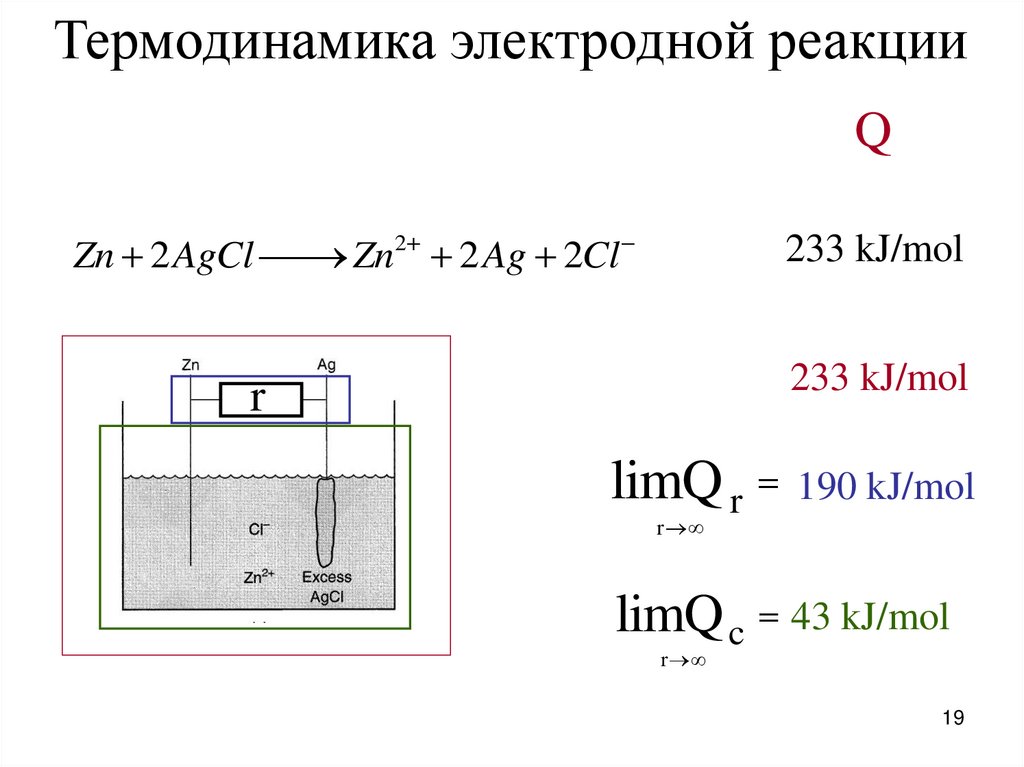
Термодинамика электродной реакцииQ
Zn 2 AgCl
Zn2 2 Ag 2Cl
233 kJ/mol
233 kJ/mol
r
limQ r
190 kJ/mol
r
limQ c 43 kJ/mol
r
19
20.
Термодинамика электродной реакцииr
∆Hº
= -Q = -233 kJ
T∆Sº = - limQ c -43 kJ
r
∆G
∆Gº
= ∆H - T∆S
= - limQ r
-190 kJ/mol
r
20
21.
ЭДС реакции2
Zn 2 AgCl
Zn 2 Ag 2Cl
Zn/Zn2+(a = 1), Cl-(a = 1)/AgCl/Ag
G
E 0.985V
nF
0
21
22.
Полуреакции и восстановительныепотенциалы
2 H 2e H 2
Pt/H+(a = 1)/H2(a = 1)
NHE
Ag e Ag
Ag+(a = 1)/Ag
E
0
Ag / Ag
0.779 V vs NHE
22
23.
ЭДС и концентрацияOO ne R R
O
RT
a
E E0
ln O R
nF aR
Nernst
уравнение для потенциала электрода
23
24.
Формальные потенциалыOO ne R R
O
O
O
RT
a
RT
RT
C
0
0
O
E E
ln R E
ln O R
ln O R
nF aR
nF R
nF CR
E0’
O
RT
C
E E 0'
ln O R
nF CR
24
25.
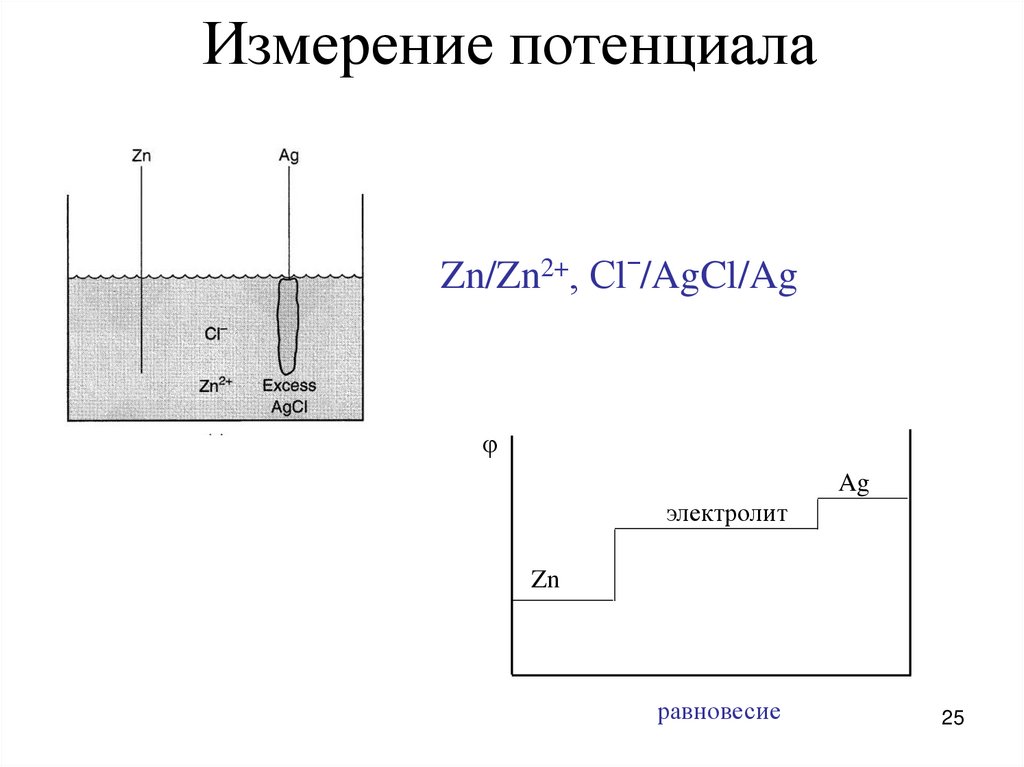
Измерение потенциалаZn/Zn2+, Сlˉ/AgCl/Ag
φ
Ag
электролит
Zn
равновесие
25
26.
Двух- и трехэлектродные схемыA
A
W
W
A
R
V
V
26
27.
Электрохимический потенциалG
i
N i T ,P , N j i
i i zi F
для незаряженных частиц
для равновесия между фазами α и
i i
i i
27
28.
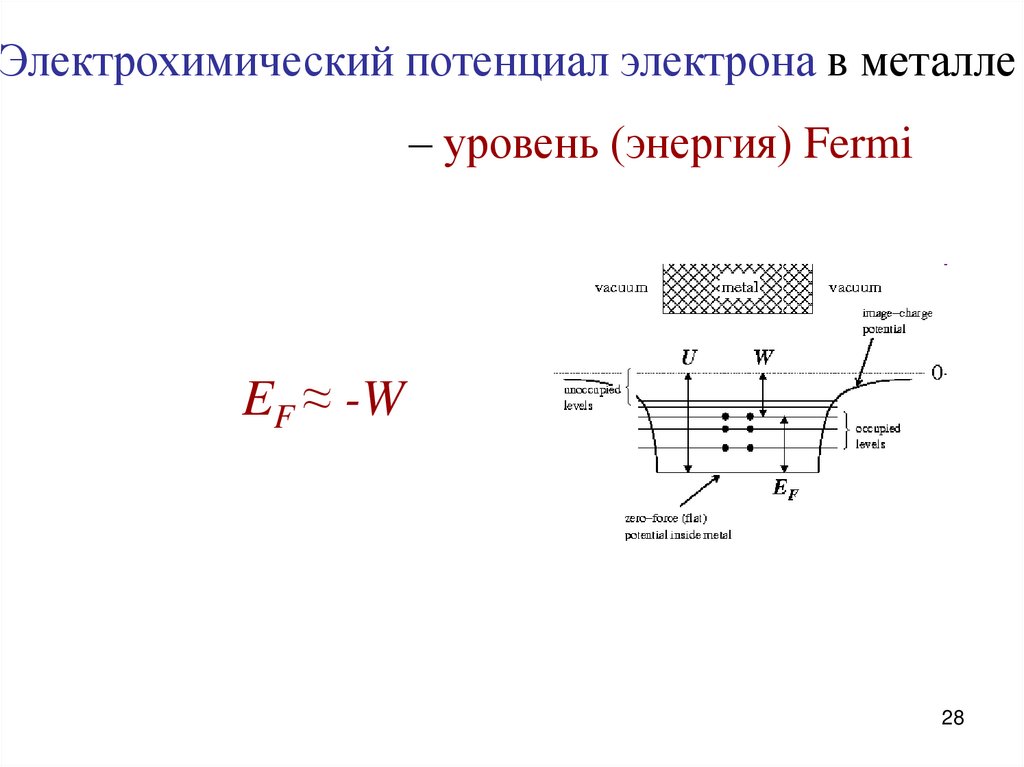
Электрохимический потенциал электрона в металле– уровень (энергия) Fermi
EF ≈ -W
28
29.
Разность потенциалов электродоввакуум
W’
W”
Fermi level
EF’
∆E
∆
E
= EF’ – EF” ≈ W” – W’
Fermi level
EF”
29
30.
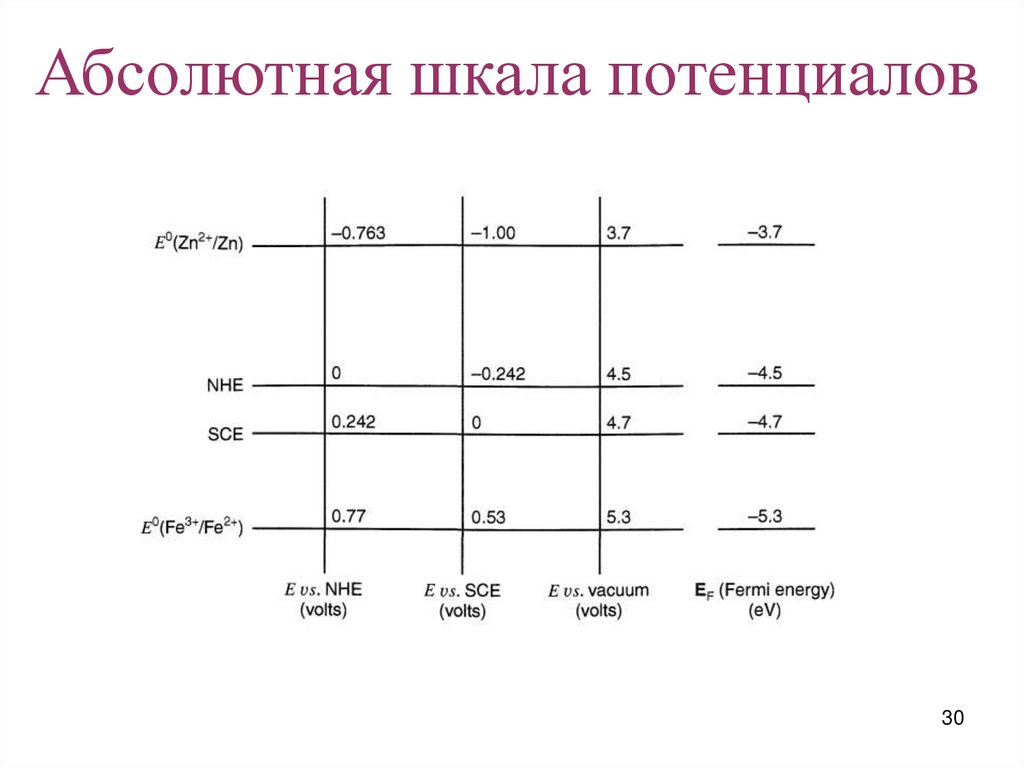
Абсолютная шкала потенциалов30
31.
Потенциалы границы жидкость|жидкостьметалл
α
металл
Диффузионный потенциал
31
32.
Строение двойного электрического слояc
32
33.
Строение двойного электрического слояРаспределение Больцмана:
Уравнение Пуассона:
Уравнение Пуассона - Больцмана
33
34.
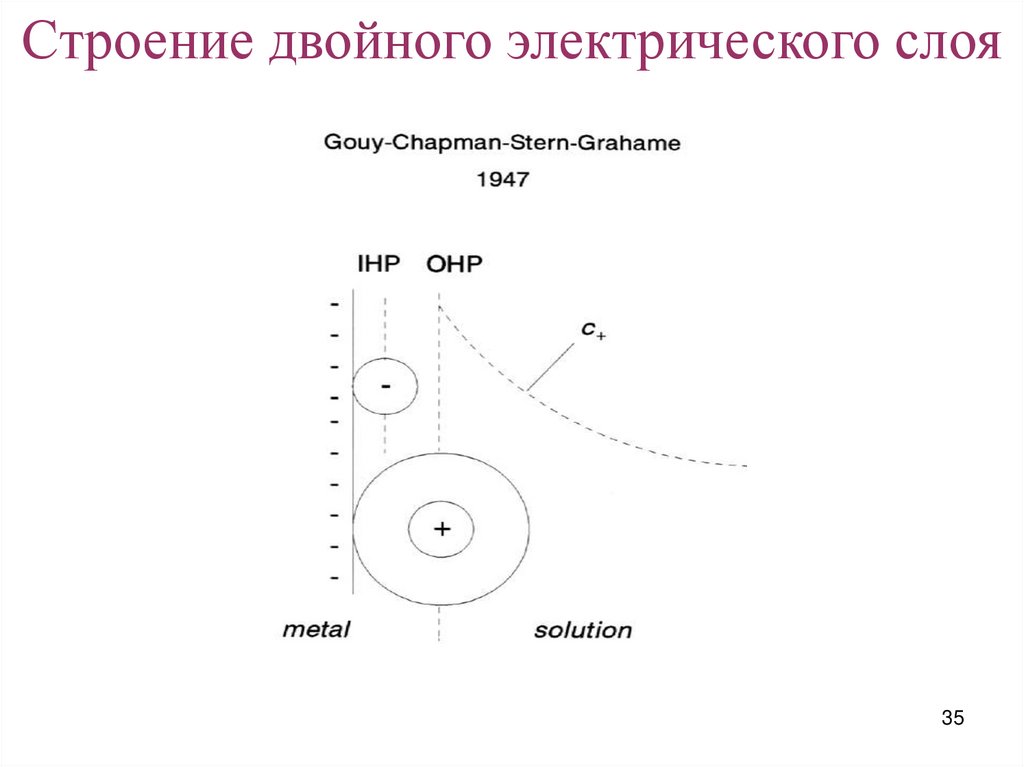
Строение двойного электрического слоя34
35.
Строение двойного электрического слоя35
36.
Электрохимическая кинетика36
37.
Электрохимические методы:i = f(E, t)
i
кинетика
E = f(i, t)
E
термодинамика
37
38.
термодинамикакинетика
G
Bronsted
≠
∆G0
0≠
≠
∆G0
∆G0
∆G0
0≠
= ∆G0 + α ∆G0
≠
∆∆G0
r
=α
∆∆G0
0 1
38
39.
Безактивационные и безбарьерные реакцииG
Безбарьерный разряд при
восстановлении Н+
Л.И. Кришталик, 1965
α = f(∆G0 )
r
39
40.
термодинамикакинетика
G0
i nFv nFAC exp
RT
≠
∆G0
0≠
= ∆G0 + α ∆G0
∆G0 =
-nF(E-E0)
0
см
0
G0
0
[k ]
k exp
с
RT
nF ( E E0 )
0
i nFACk exp
RT
40
41.
Электрохимическая обратимостьk
O ne
R
k
RT [O ]0
E E
ln
nF [ R]0
0'
41
42.
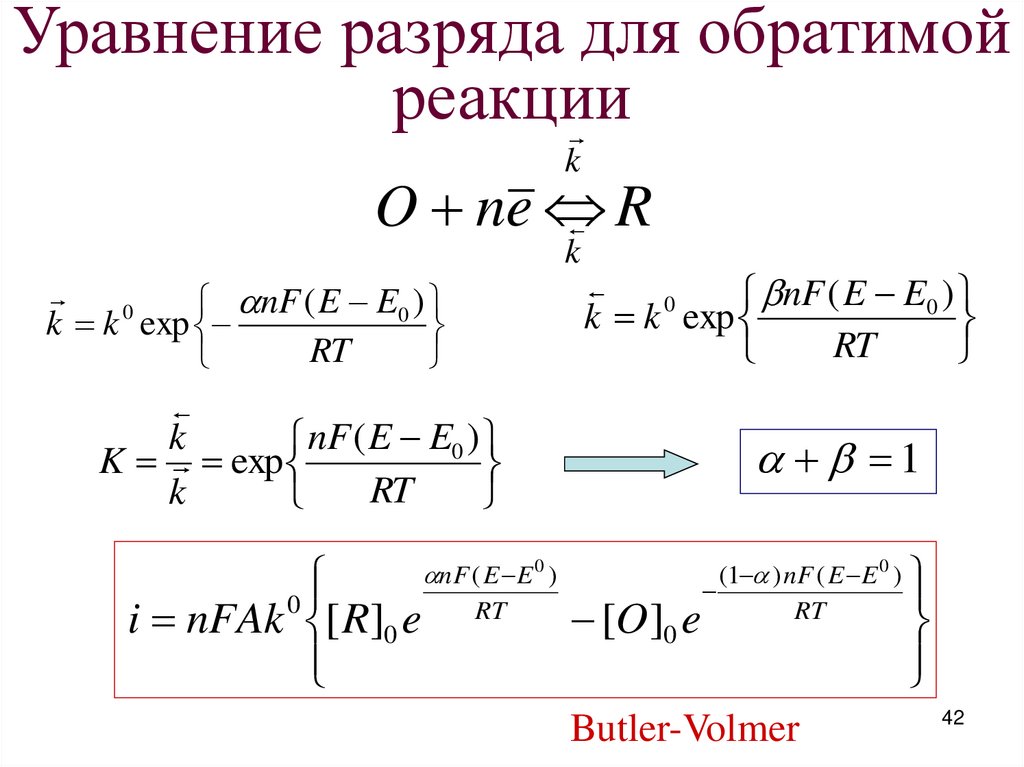
Уравнение разряда для обратимойреакции
k
O ne
R
k
nF ( E E0 )
k k 0 exp
RT
nF ( E E0 )
0
k k exp
RT
k
nF ( E E0 )
K exp
RT
k
i nFAk [ R]0 e
0
nF ( E E 0 )
RT
1
[O ]0 e
(1 ) nF ( E E 0 )
RT
Butler-Volmer
42
43.
Равновесие. Ток обмена.k
O ne
R
k
Равновесие:
[O ] k [ R] k
i i i0
RT [O ]*
Eeq E
ln
nF [ R]*
0'
(1 )
*
i0 nFAk [O ]* [ R]
0
43
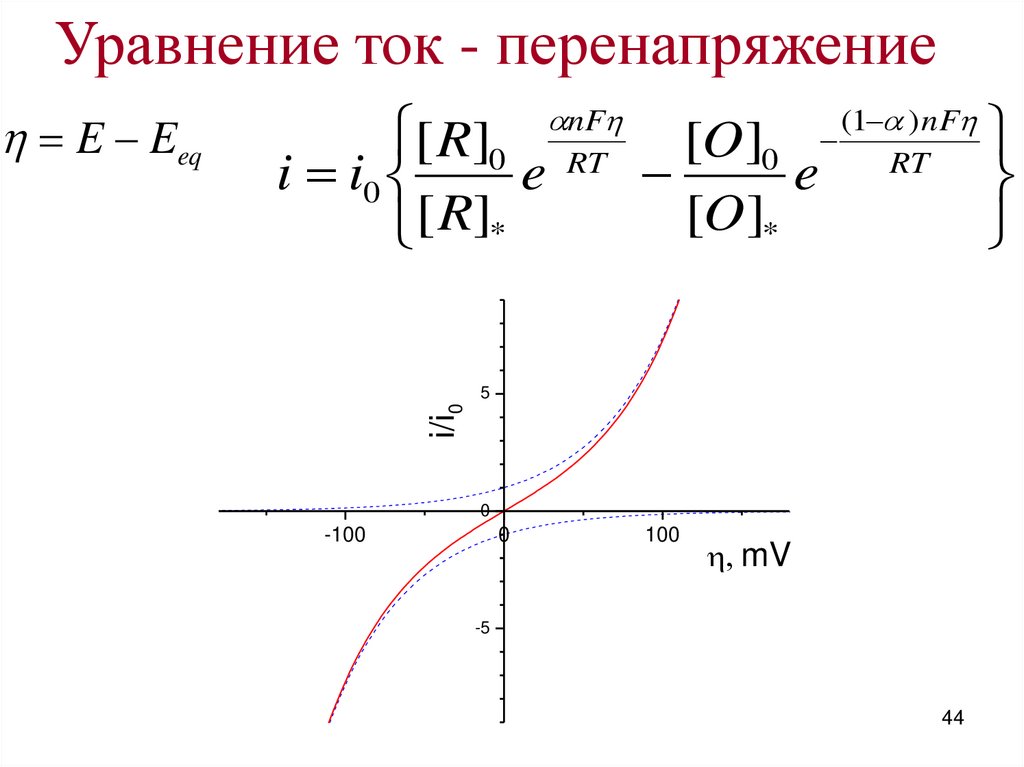
44.
Уравнение ток - перенапряжение5
i/i0
E Eeq
nF
(1 ) nF
[ R]0 RT
[O]0
i i0
e
e RT
[O]*
[ R]*
0
-100
0
100
mV
-5
44
45.
Предельные случаиа) отсутствие влияния массопереноса
nF
(1 ) nF
RT
RT
i i0 e
e
Butler-Volmer
а1) малые перенапряжения
nF
i i0
RT
RT/F ≈ 25 mV
а2) большие перенапряжения
i i0 e
nF
RT
45
46.
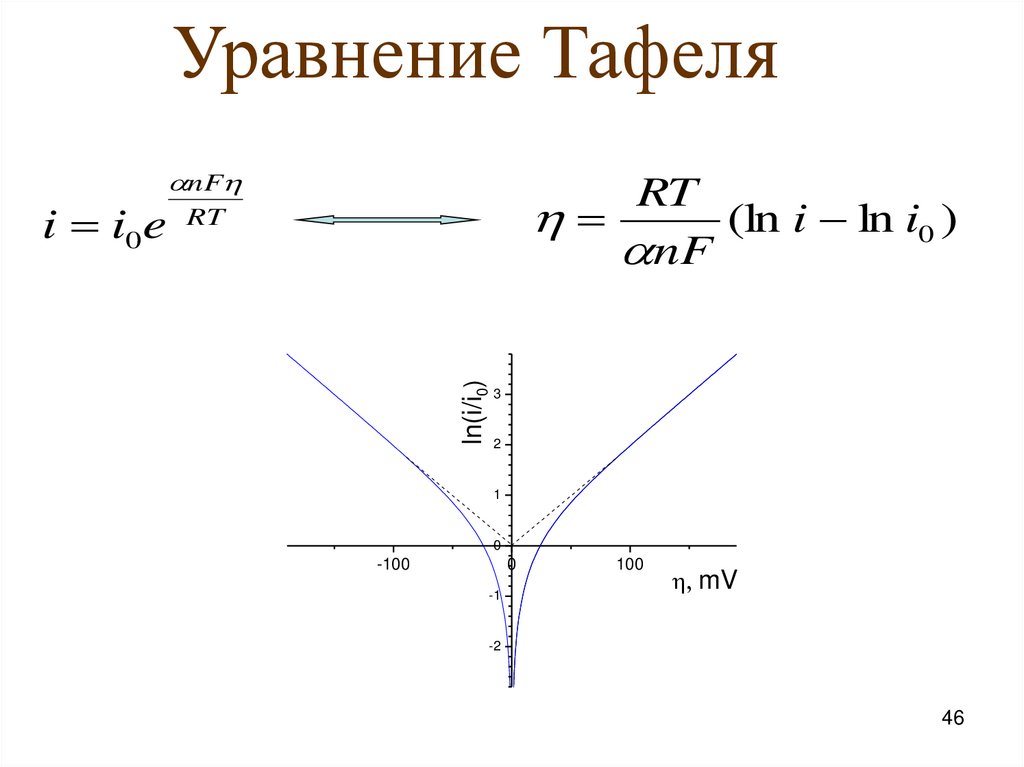
Уравнение ТафеляRT
(ln i ln i0 )
nF
RT
ln(i/i0)
i i0 e
nF
3
2
1
0
-100
0
-1
100
mV
-2
46





































 physics
physics chemistry
chemistry








