Similar presentations:
Химическая кинетика
1. Химическая кинетика
2.
При рассмотрении химического процесса, например, реакцииполучения нужного вещества, могут возникнуть 2 вопроса:
(1) возможна ли вообще реакция при данных условиях?
На этот вопрос ответ даёт химическая термодинамика, с
которой мы познакомились на прошлых двух лекциях.
(2) при каких условиях реакция будет протекать достаточно
быстро, чтобы данный процесс имел практическое значение?
Изучением скоростей химических реакций занимается
химическая кинетика.
3.
Как и всегда, при измерении скорости (т.е. как и вмеханике, электротехнике, оптике), изучается временная
зависимость какого – либо
свойства (параметра)
системы.
В механике это путь, пройденный за единицу времени, в
электротехнике – изменение заряда в единицу времени и т.п.
В химии же таким свойством, изменяющимся во времени
в ходе реакции, является концентрация реагирующего
вещества или продукта. Например, если за 10 минут 0.2
моля реагента претерпело изменение (исчезло), то средняя
скорость реакции равна 0.2 моль/10 мин.
4.
На скорость реакции влияют:1. состав реагирующих веществ;
2. их физическое состояние;
3. интенсивность перемешивания;
4. температура;
5. давление;
6. концентрации реагирующих веществ;
7. особые
физические
условия,
например,
облучение
реакционной смеси светом; УФ или рентгеновскими лучами,
нейтронами, а также другими лучами или частицами;
8. наконец, от присутствия других веществ, влияющих на ход
реакции, но не претерпевающих при этом изменений.
5.
Для завершения любой химической реакции требуетсявремя, однако, одни реакции идут чрезвычайно быстро,
другие крайне медленно. Реакции между ионами в растворе,
не сопровождаемые изменением степеней окисления,
протекают исключительно быстро.
Пример: нейтрализация кислоты основанием происходит с
той же скоростью, с какой смешиваются растворы. Повидимому, каждое столкновение иона Н+
с ионом ОН–
приводит к реакции, а число столкновений чрезвычайно
велико. Реакция идёт быстро. Образование осадка, например,
AgCl
происходит мгновенно при сливании растворов,
содержащих ионы Ag+ и Cl– :
Ag+(водн) +
Cl– (водн) →
AgCl(т)
6.
Иногдаже
ионные
окислительно-восстановительные
реакции протекают очень медленно:
2Fe3+
Эта
Sn2+
+
реакция
столкновении
протекания
этой
→
происходит
Sn4+ + 2Fe2+
не
при каждом
двумя ионами Fe3+. Для
иона Sn2+ с
реакции необходимо,
перескочили от иона
происходят редко.
Sn2+
к ионам
чтобы
электроны
Fe3+, а такие столкновения
Пример
реакции,
протекающей
при
комнатной
температуре чрезвычайно медленно – взаимодействие между
Н2
и
О2:
2 Н2 + О2 → 2Н2О
газообразная смесь (2Н2 + О2) может
Эта
храниться
несколько лет и никакого заметного взаимодействия реагентов
не происходит.
7.
ГОМОГЕННЫЕ И ГЕТЕРОГЕННЫЕРЕАКЦИИ
Реакция, протекающая в гомогенной системе (т.е. системе,
состоящей из одной фазы) называется гомогенной реакцией.
Наиболее важными гомогенными реакциями являются реакции в
газовой фазе и в жидких растворах.
Например:
N2 + O2 ⇄
2NO
Вообще говоря, наиболее важные химические процессы очень сложны
и анализ скоростей этих процессов (даже для гомогенных реакций)
связан с большими трудностями.
8.
В ходе реакции:(1) расходуются реагирующие вещества и образуются
новые вещества - продукты;
(2) температура системы изменяется в результате
выделения или поглощения тепла при протекании реакции;
(3) могут наблюдаться и другие эффекты, сложным
образом влияющие на ход реакции. Так, например, если
каплю перманганата калия KMnO4 внести в раствор,
содержащий смесь (H2O2 + H2SO4), то в течение нескольких
минут заметной реакции не происходит. Затем реакция
ускоряется, и в конце её скорость сожжет настолько возрасти,
что
струя
приливаемого
раствора
KMnO4
будет
обесцвечиваться моментально, как только попадёт в стакан с
восстанавливающим раствором.
Такое ускорение реакции объясняется очень сильным
каталитическим действием продуктов, образующихся при
восстановлении
перманганат
–
иона.
Это
пример
автокаталитической реакции.
9.
Химические реакции могут протекать с огромнойскоростью, примером этого может служить скорость
распространения детонации в образце нитроглицерина или
другого взрывчатого вещества. Скорость детонации равна
примерно 650 м/с. Следовательно, несколько граммов
взрывчатого вещества полностью разложатся за
10–5 ÷ 10–6
секунды. Однако, установить скорости подобных реакций
чрезвычайно трудно из-за больших изменений температуры и
давлений, (вспомним о скорости надувания airbag’a в
автомобиле при лобовом столкновении , этот процесс
происходит за ≃ 35 мсек ).
10.
Гетерогенной реакциейназывается такая реакция,
в которой участвуют несколько фаз, например, окисление
углерода перхлоратом калия:
KClO4(т) + 2C(т) → KCl(т)
+ 2СО2(г)
(Эта реакция используется для облегчения взлета самолётов
и для запуска ракет: берётся тонкая смесь порошков угля и
перхлората калия, удерживаемая связующим веществом).
Или другой пример гетерогенной реакции – растворение Zn в
кислоте:
Zn (т) + 2 Н+(водн) →
Zn2+(водн) +
Н2(г)
В этой реакции участвуют 3 фазы: твёрдая – Zn, 2) жидкая
– раствор и 3) газовая.
11.
Гетерогенные реакциипротекают на поверхности
(границе) раздела реагирующих фаз, и такую реакцию можно
ускорить, если увеличить размеры этих поверхностей. Так,
тонкоизмельчённый Zn (т) реагирует значительно быстрее,
чем гранулированный. Железо – очень медленно окисляется на
воздухе, а пирофорное железо
(тонкий порошок из
металлического Fe) – самовозгорается; это свойство
используют при изготовлении бенгальских огней.
Реагирующее вещество вблизи поверхности, на которой
происходит реакция, расходуется и тогда реакция замедляется.
Перемешивание смеси ускоряет реакцию, поскольку в
реакционную область вводятся новые количества реагента.
Катализаторы
гомогенные
реакции.
могут
ускорять
(Например,
и
MnO2
гетерогенные
резко
и
ускоряет
процесс выделения кислорода из хлората калия (KClO3(т)), а
небольшое количество ионов
растворения в кислоте Zn
(т).
Cu2+(aq)
ускоряет процесс
12.
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ СОСТАВАРЕАГИРУЮЩИХ ВЕЩЕСТВ
Уже говорилось, что ионные реакции протекают чрезвычайно
Ag+ и Cl– несут на себе заряды, обладающие
ненаправленным действием. То есть электрическое поле,
быстро. Ионы
создаваемое вокруг каждого иона, действует равномерно во всех
направлениях и поэтому кулоновские силы притяжения между
двумя ионами с зарядами противоположного знака не зависят от
взаимной ориентации этих ионов.
В отличие от этого реакция между ковалентно образованными
молекулами или группами атомов протекают значительно
медленнее.
13.
Во-первых, в ходе реакции между такими частицамидолжен произойти разрыв одной или нескольких связей, а для
этого
сталкивающиеся
молекулы
должны
иметь
подходящую взаимную ориентацию.
Доля
столкновений, действительно приводящих к химической
реакции, оказывается небольшой и реакция протекает
медленно, потому что многие столкновения оказываются или
недостаточно энергичными, или достаточно энергичные
столкновения осуществляются с неподходящей ориентацией.
Чтобы
пояснить
ориентации
для
необходимость
правильной
реагентов
с
ковалентными
рассмотрим реакцию между молекулами CO2 и
H2O.
взаимной
связями,
14.
Могут быть, по крайней мере, 2столкновений между этими молекулами:
различных
типа
Опыт показывает, что CO2 и H2O образуют раствор с
небольшой
кислотностью,
следовательно,
необходимо
признать, что схема (2) даёт более правильную картину
столкновений, приводящих к реакции, чем схема (1).
15.
ФИЗИЧЕСКОЕ СОСТОЯНИЕ РЕАГЕНТОВ.Жидкий бензин сгорает достаточно медленно. Однако, если
смешать пары бензина с воздухом, то произойдёт взрыв.
ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ
РЕАГЕНТОВ.
В результате экспериментального исследования большого
числа химических реакций было установлено правило:
скорость химической реакции пропорциональна
концентрации реагирующих веществ.
Рассмотрим, почему это так.
Пусть реагируют гипотетические вещества А и В. Чтобы
молекулы А и В прореагировали друг с другом, они должны
войти в контакт, т.е. столкнуться. В соответствии с теорией
столкновений скорость реакции определяется:
(1) числом столкновений между молекулами (атомами или
ионами) реагентов в единицу времени,
(2) долей столкновений, которые эффективно приводят к
химическому превращению.
16.
Пусть в единице объёма имеется 1 молекулаВ.
А
и 1 молекула
Тогда можно, воспользовавшись результатами кинетической
теории газов, подсчитать вероятность столкновений между А и В
за единицу времени. Поместив в этот же единичный объём ещё
одну молекулу
А, мы увеличим вероятность столкновений между
А и В вдвое за тот же промежуток времени.
В,
то можно убедиться, что вероятность столкновений между А и В
Если теперь увеличивать во взятом объёме число молекул
будет возрастать пропорционально произведению числа молекул
А на число молекул В (nA· nB).
На рисунке 1 изображены различные возможности
столкновений между молекулами А и молекулами В. Если взять 6
молекул А и 3 молекулы В, то столкновения между ними могут
осуществляться в результате 18 различных комбинаций, а это
число равно произведению чисел реагирующих молекул.
17.
18.
Теперь перейдём от числа молекул в единице объёма кобычным единицам измерения концентраций – молям на литр
(молярность) или к парциальным давлениям. Концентрации
обозначаются квадратными скобками [A], [B]: [A] обозначает
число молей А в 1 л раствора.
Если А представляет собой газ, то для указания его
концентрации обычно используют символ рА, обозначающий
парциальное давление газа А в смеси.
Возвращаясь к реакции между молекулами А и В,
попытаемся вывести уравнение, выражающее соотношение
между скоростью реакции и концентрациями реагентов.
Скорость реакции = k[A][B]
Для гипотетической реакции: (2А + В) → Продукты
из теории столкновений легко получить выражение для её
скорости:
скорость = k[A]2[B]
19.
В общем случае скорость реакции, описываемой уравнениемаA + bB
+ cC + ….→ Продукты
равна: скорость = k[A]a[B]b[C]c …
Таким образом:
скорость
реакции
пропорциональна
произведению
молярных концентраций всех реагентов, каждая из которых
возводится в степень равную коэффициенту, стоящему при
соответствующем реагенте в уравнении реакции.
Это есть закон Гульдберга и Вааге (открыт в 1867г.).
20.
Как же измерить скорость реакции?Скорость реакции измеряется изменением концентраций
реагирующих веществ в единицу времени.
В ходе реакции концентрации вступающих в реакцию
веществ – реагентов уменьшаются, а концентрации продуктов
возрастают.
Пусть при Т = const концентрация одного из веществ
уменьшилась от С1 до С2 за время от τ1 до τ2.
Тогда :
c2 c1
v
2 1
Знак (–) необходим потому, что v в принципе положительная
величина, а c2 < c1, т.е. числитель < 0,
или (средняя скорость за время △τ)
c
v
21.
Истиннаяdc
v
d
Рисунок
2.
Первичная
информация,
получаемая
в
эксперименте – зависимость концентрации реагента (1) или
продукта (2) от времени. Определив производные в нескольких
точках любой из этих кривой, построим график зависимости
скорости реакции от времени (часть рисунка справа).
22.
Примеры.Рассмотрим 2 реакции:
(1) H2 + I2 → 2HI ;
H2O
(2)
2NO + H2 → N2O +
Обозначим концентрации реагирующих веществ через:
cH 2 , cI 2 , c NO
Тогда будем иметь:
v1 k1cH 2 cI 2
v2 k c
2
2 NO
cH 2
Константы пропорциональности ki (в данном случае k1 и k2)
зависят 1) от природы реагирующих веществ и 2) от температуры,
но не зависят от концентраций.
23.
Всё, что до сих пор обсуждалось, имеет под собой однуоснову – теорию столкновений. По этой теории молекулы
реагирующих веществ уподобляются шарикам А и В.
Химическая природа реагирующих веществ “задаётся константой
k ”. Следует отметить, что применение закона действия масс к
реальным реакциям часто наталкивается на трудности.
Стехиометрическое уравнение реакции образования воды
имеет вид:
2H2 + О2 → 2 H2О (*)
По закону действия масс выражение для скорости реакции
имеет вид
скорость
v k [ H 2 ] [O2 ]
2
Однако, экспериментальные данные говорят, что это не так.
На деле оказывается, что эта реакции протекает через
множество стадий (а именно 8), одни из которых быстрые,
другие – медленные.
24.
1.2.
3.
4.
5.
6.
7.
8.
H2 + O2 → HO2 + H
H2 + HO2 → OH + H2О
OH + H2 → H + H2О
O2 + H → OH + O
H2 + O → OH + H
HO2 + стенка сосуда → Обрыв цепи
H + стенка сосуда
→ Обрыв цепи
ОН + стенка сосуда → Обрыв цепи
Если взглянуть на уравнение скорости реакции (*):
d [O2 ]
2
k[ H 2 ] [O2 ]
d
то можно ожидать, что это реакция 3 порядка.
Порядком реакции называется сумма показателей степеней
в кинетическом уравнении.
25.
Реакция разложения оксида азота (V) выглядит следующимобразом:
2N2O5
→ 4NO2 + O2
Из этого уравнения можно ожидать, что в реакцию вступают
две молекулы N2O5 и кинетическое уравнение имеет вид:
d [ N 2O5 ]
v
k [ N 2O5 ]2
d
На самом деле экспериментальные данные показывают, что
реакция протекает не так, а в 2 стадии:
1. N2O5 → N2O3 + O2 – медленная
2. N2O5 + N2O3 → 4 NO2 – очень быстрая
26.
Первая стадия – медленная и она, естественно, определяетскорость реакции в целом, а вторая – очень быстрая. Если
построить график зависимости lg [A0] / [A] от времени (τ),
то получится зависимость, представленная на рис.3.:
A0
времени
–
концентрация реагента N2O5 в начальный момент
τ = 0;
А
– концентрация этого же реагента в
произвольный момент времени τ.
27.
Покажем,что
линейный
характер
приведённого
экспериментального графика указывает на то, что разложение
N2O5 является реакцией первого порядка. Действительно,
Пусть уравнение скорости разложения N2O5 описывается
уравнением:
d [ N 2O5 ]
v
k [ N 2O5 ],
d
или для простоты записи
dx
v
kx
d
(**)
28.
Теперь, интегрируя это уравнение (**) по времени, получим:[ A]
τ
dx
k dτ
x
[ A0 ]
0
и
[ A]
ln
k
[ A0 ]
или
Т.е. линейную зависимость логарифма отношения
[ A0 ]
ln
kτ
[ A]
[ A0 ]
ln
[ A]
от τ (времени), что и получилось на опыте.
Отсюда и следует предположение о том, что стадия,
определяющая общую скорость реакции, имеет первый порядок
по концентрации N2O5 , а не второй.
29.
ЭНЕРГИЯ АКТИВАЦИИИтак, мы говорили, что на скорость реакции оказывает
влияние температура. Согласно общепринятому правилу,
повышение температуры на 10°С
приводит к возрастанию
скорости реакции приблизительно в 2 раза. Это есть правило
Вант Гоффа.
Температурный коэффициент скорости реакции γ:
kt 10
2 4
kt
γ = 2.9, то при увеличении температуры на
100° скорость реакции увеличится в 2.910 = 40 000.
Например, если
Это правило Вант Гоффа весьма полезно. Но оно
справедливо лишь в первом приближении. Реакции, в которых
участвуют очень крупные молекулы, такие как молекулы белка,
характеризуются
очень
большими
температурными
коэффициентами; скорость денатурации яичного альбумина
(процесс, происходящий при варке яиц ) возрастает примерно в
50 раз при повышении температуры на 10 °С.
30.
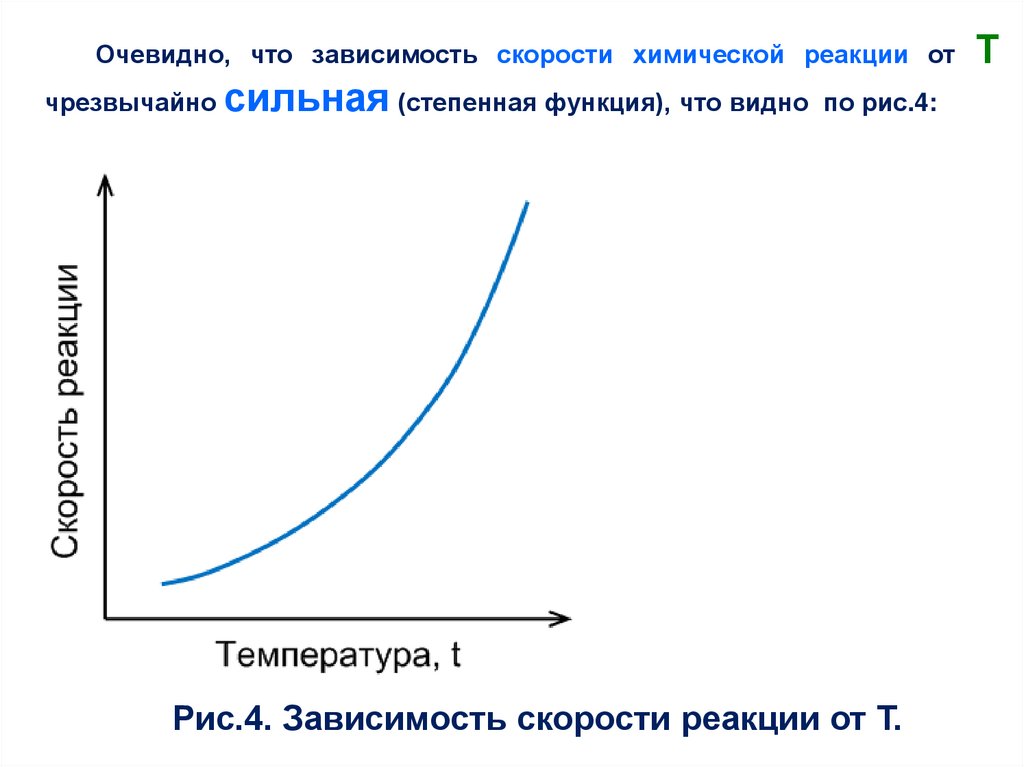
Очевидно, что зависимость скорости химической реакции отчрезвычайно сильная (степенная функция), что видно по рис.4:
Рис.4. Зависимость скорости реакции от Т.
Т
31.
Вопрос: в чём же дело? Почему столь резко увеличиваетсяскорость реакции при росте температуры?
Естественно предположить, что увеличение скорости –
результат возрастании числа соударений между молекулами.
Почему? Потому, что при повышении Т увеличивается скорость
молекул и число соударений увеличивается. Однако,
кинетическая теория предсказывает, что число соударений,
Т1 = 273 К
число соударений равно Z1, а при температуре Т2 = 373 К ,
соответственно, Z2, то мы будем иметь:
Z T
следовательно, если при температуре
Z 373
Z 273
373
1.2
273
32.
А скорость возрастает, как мы видели в 40 000 раз. Дело,следовательно, в другом.
Оказывается, не всякое соударение оказывается
эффективным.
Химическое взаимодействие имеет место только, если
сталкивающиеся
молекулы
обладают
определённым
избытком энергии по сравнению со средней энергией
данных молекул.
Если же молекулы сталкиваются с относительно
небольшими скоростями, то в результате действия
вандерваальсовых
сил
отталкивания
они
упруго
отталкиваются друг от друга.
Чтобы реакция произошла, следовательно, необходима
так называемая энергия активации. Если для
осуществления реакции в систему необходимо ввести
некоторую энергию, то мы говорим, что данной реакции
присущ активационный
барьер.
33.
ЭНЕРГИЯ АКТИВАЦИИ ХИМИЧЕСКОЙРЕАКЦИИ, РАВНОВЕСИЕ И КАТАЛИЗ
34.
МЕТОД АКТИВНЫХ СТОЛКНОВЕНИЙСледует ожидать, что в ходе химической реакции происходит
разрыв одной или нескольких старых связей и образование
новых связей. Для того, чтобы положить начало этому процессу,
необходима определённая энергия ЕА.
Например, для зажигания спички её предварительно
нагревают посредством трения, а в автомобильном двигателе
для зажигания смеси паров бензина с воздухом используется
энергия искры.
Итак, мы говорим, что для эффективного столкновения
молекул необходимо, чтобы они обладали достаточной
пороговой энергией, которая позволила бы им преодолеть
энергетический барьер реакции.
В кинетической теории газов показано, что при некоторой
температуре распределение молекул газа, находящихся в
замкнутом сосуде, по скоростям (или по энергиям) имеет вид
колоколобразной кривой:
35.
Это распределение молекул по скоростям описываетсяуравнением Максвелла. Согласно этому уравнению
существуют молекулы с очень высокими скоростями, которые обладают
наибольшим запасом кинетической энергии. Именно эти молекулы
способны преодолеть энергетический барьер активации.
36.
При повышении температуры газа мы смещаем распределениеего молекул по скоростям в сторону больших энергий и при
этом существенно увеличится доля молекул с высокими
энергиями, способных вступить в реакцию. На рисунке
показаны кривые распределения молекул по энергиям при двух
температурах. Можно видеть, что при более высокой
температуре
Т2
имеется значительно больше молекул с
энергиями, превышающими EА , которая и называется
энергетическим барьером активации.
Количественное описание зависимости скорости реакции от
температуры выражается уравнением Аррениуса; константа
скорости реакции
k = A e EA/RT
(1)
где: А – константа (стерический фактор, рассчитываемый в
квантовой механике, он учитывает взаимную ориентацию
сталкивающихся молекул);
R- газовая постоянная; Т – температура; е – основание натуральных
логарифмов. Это выражение e EA/RT
имеет смысл доли молекул, обладающих энергией достаточной для вступления в реакцию.
37.
Количественное описание зависимости скорости реакции оттемпературы
выражается
уравнением
Аррениуса;
константа скорости реакции k
:
k = A e EA/RT
А – константа (стерический
(1)
где:
фактор, рассчитываемый в
квантовой механике, он учитывает взаимную ориентацию
сталкивающихся молекул);
R- газовая постоянная; Т – температура; е – основание
натуральных логарифмов. Это выражение
e
-E A / RT
имеет смысл доли молекул, обладающих энергией достаточной
для вступления в реакцию.
38.
Какие свойства ЕА можно отметить?e
E A1 / RT
e
E A2 / RT
ЕА не зависит от температуры. (2) Чем выше ЕА - энергия
активации, тем медленнее идёт реакция при данной
температуре. Почему?
Потому что если
E A1 E A2
E A1
RT
и
e
E A1 / RT
e
, то
E A2
RT
E A2 / RT
т.е. в случае реакции (1) доля активных молекул меньше.
39.
Очевидно, что из (1) следует:ln k = – EA/RT
+
ln A
(2)
Следовательно, если на опыте определяются значения
некоторой реакции (например. H2 + I2
температурах в некотором интервале,
k для
2HI
) при разных
скажем 550–800К, то
lnk от 1/T
должен быть линейной
функцией с наклоном –ЕА/R . Зная R, можно найти ЕА.
график функции
Так для реакции
H2 + I2
2HI
ЕА = 180 кДж/моль.
40.
lnk6
4
2
0
-2
-4
-6
1,2
1,4
1,6
1,8
1000 / T
Уравнения (1) и (2) называются уравнениями Аррениуса для
скорости реакции (1889г).
Размерность константы скорости зависит от стехиометрии
реакции.
41.
Для осуществления реакции, например, H2 + I2, каждая парамолекул должна пройти через конфигурацию, которая является
промежуточной между начальной А
и
конфигурациями.
Эта
промежуточная
называется активированным
конечной В
конфигурация
комплексом.
42.
Эта конфигурация обладает более высоким значениемэнергии (энтальпии) по сравнению с исходными реагентами.
43.
H2 + I22HI
H = –10 кДж/моль
Координата реакции – это тот путь, по которому
развиваются изменения межатомных расстояний по мере
того, как система переходит от исходных реагентов к
активированному комплексу и далее к продуктам реакции.
Из рисунка очевидно, что энергия активации ЕА’ обратной
реакции отличается от энергии активации ЕА прямой реакции на
разность энтальпий исходных реагентов и продуктов реакции.
Поэтому ЕА’ обратной реакции равна 180 +10 = 190 кДж/моль.










































 chemistry
chemistry








