Similar presentations:
Химическая кинетика
1.
Химическая кинетикаСписок литературы:
“Общая химия” - Н.Л. Глинка: Глава
“Химическая кинетика”
Учебное пособие “Химическая кинетика” Красноперов
А.В. Леванов, Л.Е. Антипенко - “Введение в
химическую кинетику” МГУ 2006 г.
Задачи и упражнения по общей химии Н.А.
Глинка уч.пос. 2014 г. “Химическая кинетика”
Н.В. Фок, М.Я. Мельников Сборник задач по
химической кинетике
2.
ВведениеГлава 1. Предмет химической кинетики.
Химическая кинетика –
наука о скоростях и
механизмах химических
реакций.
В отличие от
термодинамики,
химическая кинетика
изучает протекание
химических реакций во
времени.
3.
1.2 Основные понятия химической кинетики1. Механизм химической реакции – это
совокупность стадий, из которых она
складывается.
Пример:
Реакция
окисления
водорода
кислородом.
Стехиометрическое уравнение:
2 H2 + O2 → 2 H2O.
исходные вещества
продукты реакции
4.
Механизм реакции:(0) H2 + O2 → 2 OH •– зарождение цепи.
Это – разветвленный цепной механизм. За открытие
разветвленных цепных реакций советский ученый акад. Н. Н.
Семенов и английский ученый С. Хиншельвуд были
удостоены Нобелевской премии. Звено цепи повторяется
много раз, пока не погибнут в побочных реакциях
промежуточные частицы – атомы • H, •• O и свободный
радикал O H • , или пока не израсходуется хотя бы одно из
исходных веществ.
5.
2. Простые и сложные реакции. Простыминазываются реакции, состоящие только из одной
стадии.
Сложными
называются
реакции,
состоящие из двух и более стадий.
3. Скорость химической реакции – это число
актов превращения в единице объема в единицу
времени.
4. Кинетическое уравнение – это уравнение,
описывающее зависимость скорости химической
реакции
от
концентраций
компонентов
реакционной смеси.
5. Порядок реакции.
6.
6. Константа скорости химической реакции иэнергия активации.
7.
7. Элементарные акты химического превращения иэлементарные реакции.
Совокупность однотипных элементарных актов
называют элементарной реакцией или элементарной
стадией.
В зависимости от числа молекул, участвующих в
элементарной реакции, она может быть
мономолекулярной, бимолекулярной или
тримолекулярной.
8.
8. Замкнутые и открытые системы. Замкнутойназывается система, в которой отсутствует
материальный обмен с окружающей средой.
Открытой называется система, в которой имеет
место материальный обмен с окружающей средой.
9.
Глава 2. Формальная кинетикапростых реакций
2.1 Закон действующих масс
Формальная
кинетика
– это раздел
кинетики,
рассматривающий временной ход превращений вне связи с
конкретной
природой
объектов,
участвующих
в
превращении.
Закон действующих масс формулируется так:
Скорость простой химической реакции пропорциональна
концентрации взаимодействующих частиц.
10.
• Скорость химической реакции определяется какизменение
молярной
концентрации
одного
реагирующих веществ за единицу времени.
из
11.
12.
Мономолекулярные реакции – элементарные реакции, вкоторых участвует только одна частица (реакции распада
или изомеризации):
В бимолекулярных реакциях происходит столкновение и
взаимодействие двух частиц одинаковой или разной
природы:
В
тримолекулярных
реакциях
одновременно три частицы:
взаимодействуют
13.
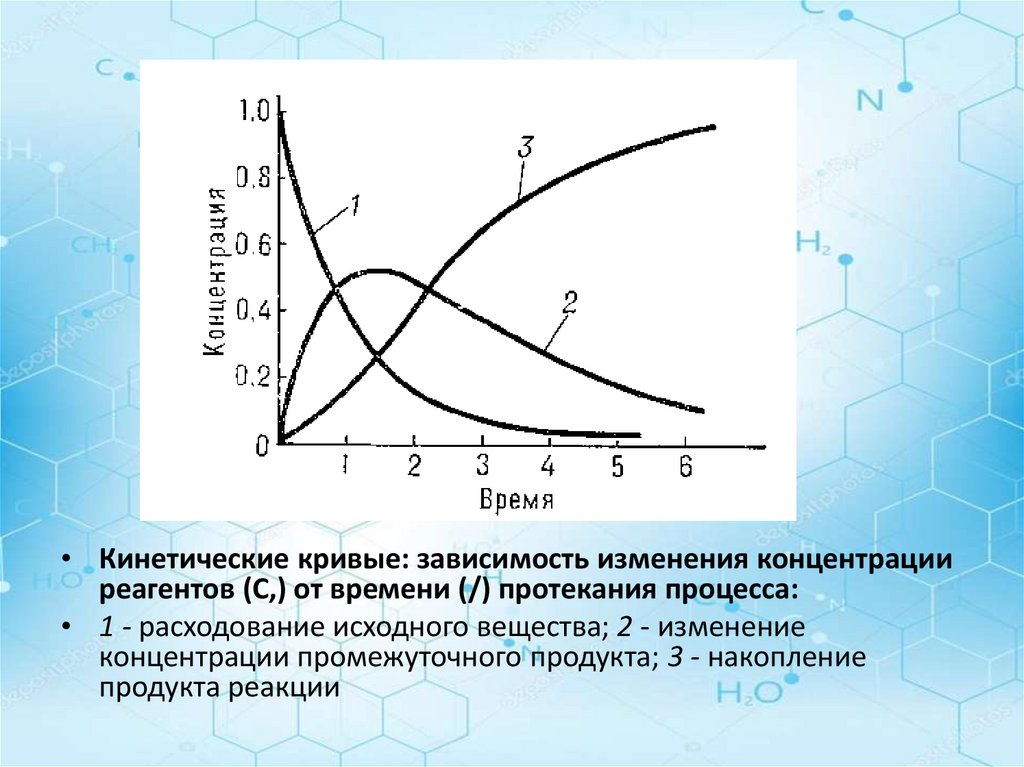
• Кинетические кривые: зависимость изменения концентрацииреагентов (С,) от времени (/) протекания процесса:
• 1 - расходование исходного вещества; 2 - изменение
концентрации промежуточного продукта; 3 - накопление
продукта реакции
14.
Величина v выражает среднюю скоростьхимического процесса на некотором
отрезке времени, т.е. чем меньше величина
Δτ и чем ближе на кривой KL точки m и n,
тем средняя скорость будет ближе к
истинной.
15.
• Молекулы, обладающие такойизбыточной энергией,
называются активными, а сам избыток
энергии - энергией активации(Еа).
Понятно, что, чем больше доля
активных молекул, тем выше скорость
реакции.
• Для того, чтобы произошла реакция,
необходимо сначала преодолеть
отталкивание электронных оболочек
молекул, ослабить связи между
атомами исходных веществ. На это
надо затратить определенную энергию.
При этом вещества переходят в
неустойчивое промежуточное
состояние. Это состояние
называется активированным
комплексом или переходным
состоянием. Именно для его
образования и необходима энергия
активации (рис.5).
16.
Важнейшие пути активации:1) Увеличение кинетической энергии молекулы (например, путем повышения
температуры системы);
2) Повышение внутримолекулярной энергии, в частности, возбуждение
молекулы в результате поглощения квантов света, лучистой энергии
соответствующей длины волны;
3) Образование свободных атомов или радикалов в результате диссоциации
при высоких температурах или ультрафиолетовом облучении. Эти частицы
обладают очень высокой реакционной способностью;
4) Образование ионов (при диссоциации, в результате воздействия радиации и
т.д.). Ионное состояние можно рассматривать как состояние активированное.
Именно этим объясняется обычно высокая скорость ионных реакций;
5) Активация при адсорбции, которая заключается в ослаблении
внутримолекулярных сил реагирующих веществ. Активация при адсорбции
играет большую роль в гетерогенном катализе.
E a
17.
Зависимость скорости реакции отреагирующий веществ
Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно,
выше скорость реакции.
Скорость химической реакции пропорциональна произведению концентраций реагирующих
веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон называют также законом действующих масс.
Для реакции А + В = D этот закон выразится так:
Для реакции 2А + В = D этот закон выразится так:
Здесь СА, СВ — концентрации веществ А и В (моль/л); k1 и k2 — коэффициенты пропорциональности, называемые константами скорости реакции.
Порядок химической реакции по данному веществу (или частный порядок реакции) – это число,
равное степени (например, в вышеприведенной реакции а и в), в которой концентрация этого
вещества входит в кинетическое уравнение реакции, т.е. в выражение скорости реакции по закону
действующих масс. Сумма показателей степеней (а + в +…), в которых концентрации всех
исходных веществ входят в кинетическое уравнение закона действующих масс, определяет общий
порядок реакции.
Для одностадийных реакций численные значения их порядка и молекулярность совпадают.
Несовпадение экспериментально определенного порядка реакции с молекулярностью
свидетельствует о её более сложном характере.
18.
Реакции первого порядка. В реакциях первого порядкаскорость пропорциональна концентрации одного
реагирующего вещества.
Выражение скорости, как функции концентрации, имеет вид:
Пусть концентрация исходного вещества в начальный момент
реакции, т.е. при τ = 0, равно «а» моль/л; в какой-то момент
времени (τ) x моль/л вещества А превращаются в продукты.
Следовательно, остается (а–x) моль/л вещества А (при
условии, что объем реакционной системы остается
постоянным).
Таблица 1
Изменение концентрации веществ во времени для реакции
первого порядка
Тогда уравнение скорости реакции первого порядка (1.7)
будет иметь вид:
19.
График зависимостиlg(a-x) от времени
Изменение концентрации реагирующего вещества как функция времени для
реакции первого порядка
На рисунке видно, что время полупревращения постоянно и не зависит от начальной
концентрации вещества. Например, если в момент времени имеется 1 моль реагента, то
потребуется одинаковое время, чтобы его концентрация понизилась до ½ моль, от ½ до ¼ моль,
от ¼ до ⅛ моль и т.д.
20.
Реакции второго порядка. В общем виде уравнение реакции второго порядка можно записатьследующим образом: A + B - продукт
Выражение скорости имеет вид:
Скорость реакции пропорциональна концентрациям реагентов в каждый момент времени, и
выражение:
превратится в выражение:
При решении этого уравнения возможны два случая:
а) начальные концентрации «а» и «в» равны, тогда выражение скорости будет выглядеть следующим
образом:
Решение этого уравнения имеет вид:
Видно, что константа скорости реакции второго порядка имеет размерность «л моль-1 с-1»).
Уравнение (1.16) можно представить в виде:
Время полупревращения для реакции
второго порядка вычисляем из уравнения
Видно, что время полупревращения для
реакции второго порядка обратно
пропорционально
начальной концентрации.
21.
б) начальные концентрации «а» и «в» не равны между собой, тогдавыражение скорости будет иметь вид:
и решение этого уравнения:
График зависимости
от времени дает прямую,
проходящую через начало координат, наклон которой равен
22.
Порядок реакции – это сумма показателей степеней концентрацийотдельных реагентов в выражении закона действующих масс.
Сумма показателей определяет общий порядок реакции, а отдельный показатель
степени – порядок по каждому из компонентов. Различают реакции первого, второго,
третьего и другого порядков.
H2 + I2 = 2HI
V = K[H2][I2] n = 2;
N2O5 = NO2 + NO + O2
V = K[N2O5] n = 1.
Скорость реакции первого порядка определяется следующим выражением:
V = K[A] = KCA.
Для реакции второго порядка возможны два варианта выражения для скорости реакции:
Если концентрации компонентов А и В равны, то второе уравнение превращается в
первое:
V = K[A][B] = K[A]2 при [A] = [B].
Если же [A]>>[B] и в процессе взаимодействия расходуется небольшая часть компонента
А, то формально данное уравнение сводится к уравнению для реакции первого порядка.
Скорости реакций третьего порядка могут быть описаны следующими уравнениями:
V = KCA3;
V = KCA2CB;
V = KCACBCC.
Размерность скорости химической реакции – моль/л.с или молекул/см3⋅с.
23.
По механизму реакции можно разделить на 6 типов:а) последовательные реакции: A → B → C.
Последовательными называются реакции, в которых продукт реакции В
является реагентом для следующей стадии, т.е. промежуточным.
Скорость такой реакции по веществу А определяется выражением
V1(A) = –dCA/dt = K1
Cкорость накопления вещества В в соответствии с реакцией превращения
А (1) описывается выражением
V1(B) = dCB/dt =
Соответственно, скорость расхода вещества В определяется выражением
V2(B) = -dCB/dt =
Так как вещество В участвует одновременно в двух реакциях, то его
концентрация изменяется в соответствии с разностью скоростей
накопления и расходования:
VB = (K1 – K2)CB.
Скорость накопления вещества С определяется выражением
V2(C) = dCC/dt = K2CC.
Cтадии последовательных реакций протекают с различной скоростью.
Самая медленная стадия и определяет общую скорость химической
реакции. Стадия, константа скорости которой минимальна, называется
лимитирующей. Она определяет кинетическую закономерность реакции
в целом;
24.
б) параллельные реакции: B ← A → CПараллельными называются реакции, имеющие одни
и те же исходные реагенты, которым соответствуют
различные продукты. Скорости параллельных
процессов реакции определяются выражениями
V1 = K1CA и V2 = K2C
Суммарная скорость процесса определяется
выражением
V = V1 + V2 = (K1 + K2)
Отсюда видно, что скорость параллельных реакций
равна сумме скоростей отдельных реакций. Это
правило применимо и для бимолекулярных
параллельных химических реакций:
A + B = C + D;
A + B = M + N;
V = (K1 + K2)CACB;
25.
в) сопряженные реакции (одна реакция идет вприсутствии другой).
Примером такого процесса являются следующие
реакции:
1. HBrO3 + 3H2SO3 = HBr + 3H2SO4;
2. HBrO3 + 3H3AsO3 = HBr + 3H3AsO4.
Вторая реакция идет только в присутствии первой,
так как H2SO3 более сильный восстановитель, чем
H3AsO3, и в системе протекают реакции
1) HBrO3 + H2SO3 = HBrO2 + H2S
более сильный окислитель, чем H3AsO3. Отсюда
2) HBrO2 + 2H3AsO3 = HBr +
В процессах данного типа одна реакция как бы
индуцирует протекание другой. Это явление
называется химической индукцией.
26.
г) цепные реакции. Цепные реакции распространены в химии. Этиреакции вызываются свободными радикалами, активными частицами,
образовавшимися из валентнонасыщенных молекул.
Основными стадиями цепных реакций являются: зарождение,
продолжение, разветвление и обрыв цепи. Различают два типа цепных
реакций: реакции с неразветвлёнными и с разветвлёнными цепями.
Зарождение цепи – это стадия цепной реакции, в результате которой
возникают радикалы из валентнонасыщенных молекул.
Например, при взаимодействии водорода
с хлором образование радикалов
происходит под действием кванта света:
Продолжение цепи – стадия цепной реакции, протекающая с
сохранением общего числа свободных радикалов.
Разветвление цепи – это стадия, в которой
единичная реакция одного свободного
радикала приводит к образованию
нескольких свободных радикалов
(число свободных связей увеличивается).
Примером такого процесса служит
реакция окисления водорода:
27.
Обрыв цепи – стадия реакции, в результатекоторой исчезают свободные радикалы.
Общая скорость неразветвлённой цепной
реакции определяется выражением
V = VOn = VO(Vпрод./V
где n – длина цепи; VO – скорость зарождения
цепи; Vпрод. – вероятность продолжения цепи;
Vобр. – вероятность обрыва цепи. Под длиной
цепи понимают среднее количество
элементарных стадий продолжения цепи после
возникновения свободного радикала до его
исчезновения (обрыва цепи);
28.
д) периодические реакции (автоколебательные реакции). Эти реакцииоткрыты Б.П. Белоусовым, исследованы А.М. Жаботинским и др. (СССР).
Периодические реакции – это сложные многостадийные
автокаталитические реакции с участием нескольких веществ. В этих
реакциях происходит периодическое колебание концентраций окисленной
и восстановленной форм веществ, участвующих в реакции. Частота и форма
колебаний зависят от концентраций исходных веществ, кислотности,
температуры. Примером таких реакций могут являться взаимодействия
броммалоновой кислоты с броматом калия в кислой среде. Катализатором
служит соль церия. В системе идут следующие реакции:
Реакция (1) является автокаталитической, в основе которой лежит
размножение активных промежуточных частиц (таких как H 2BrO2, HBrO,
BrO2, BrO, Br, BrO2). Выделяющийся в результате реакции ион Br– является
сильным ингибитором реакции (1), имеющей цепной характер. Поэтому
пока в системе присутствует Се4+ и в результате реакции (2) выделяется Br–,
реакция (1) не может начаться. В результате реакции весь церий переходит
в трёхвалентное состояние. После этого протекает быстрая реакция (1), и
цикл начинается сначала.
29.
е) реакции твёрдофазного горения (реакциисамораспространяющегося высокотемпературного синтеза –
СВС). Открыты в 1967 г. в институте химической физики АН СССР
А.Г. Мержановым и И.Г. Боровинской. Сущность метода СВС
заключается в том, что после локального инициирования реакции
взаимодействия реагентов фронт реакции горения
самопроизвольно распространяется по всей системе благодаря
теплопередаче от горячих продуктов к исходным веществам,
инициируя протекание в них реакции взаимодействия. Таким
образом осуществляется процесс горения, который является и
причиной, и следствием протекания реакции.
Термин “реакционная диффузия” определяет совокупность
явлений, происходящих при взаимодействии двух химически
различных компонентов, способных образовывать химические
соединения в виде твёрдых фаз.
Изучение скоростей химических реакций можно проводить с
помощью метода скрещенных молекулярных пучков.




























 chemistry
chemistry








