Similar presentations:
Химическая кинетика
1. 5. Химическая кинетика
• учение о механизме(стадиях) химических реакций• закономерности развития химических реакций во времени в
зависимости от условий(факторов) протекания.
Факторы, влияющие на скорость протекания реакции:
- концентрация реагирующих веществ,
- температура,
- давление,
- свойства среды протекания реакций,
-катализаторы, ….
Хим.кинетика содержит 2 раздела:
-учение о механизме хим.взаимодействия(стадии,
молекулярность)
-формальная кинетика- математ. описание изменения количества
реагирующих веществ во времени (без учета реального
механизма)
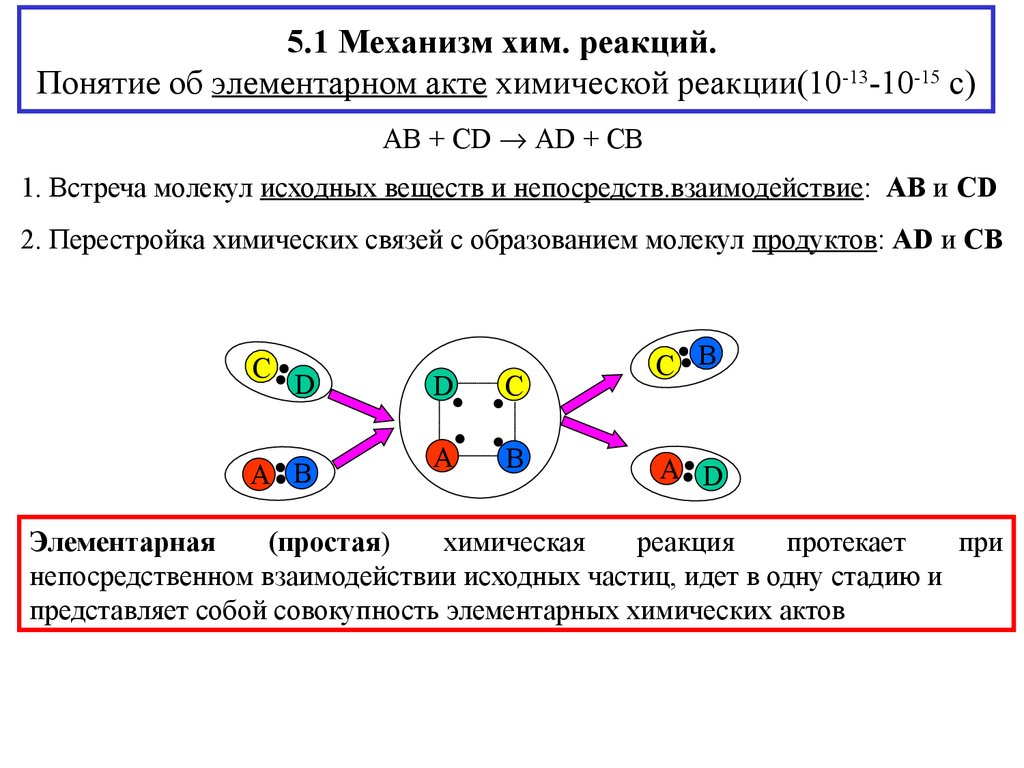
2. 5.1 Механизм хим. реакций. Понятие об элементарном акте химической реакции(10-13-10-15 с)
AB + CD AD + CB1. Встреча молекул исходных веществ и непосредств.взаимодействие: AB и CD
2. Перестройка химических связей с образованием молекул продуктов: AD и CB
C
D
A B
D
C
A
B
C B
A D
Элементарная
(простая)
химическая
реакция
протекает
при
непосредственном взаимодействии исходных частиц, идет в одну стадию и
представляет собой совокупность элементарных химических актов
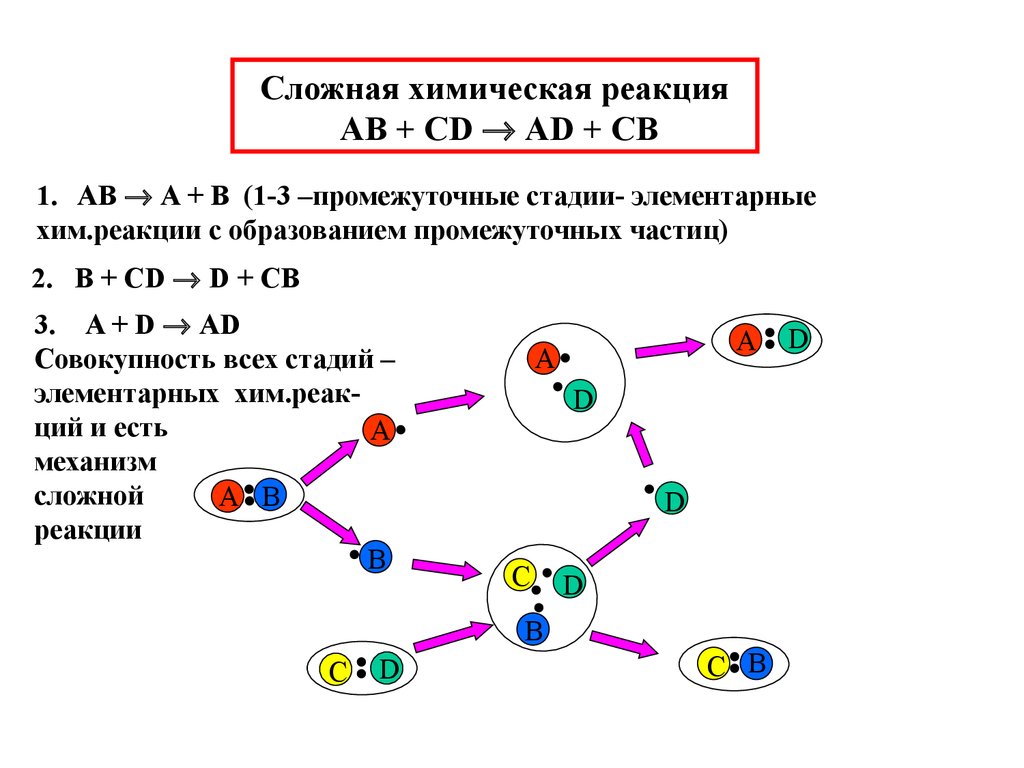
3. Сложная химическая реакция AB + CD AD + CB
Сложная химическая реакцияAB + CD AD + CB
1. AB A + B (1-3 –промежуточные стадии- элементарные
хим.реакции с образованием промежуточных частиц)
2. B + CD D + CB
3. A + D AD
Совокупность всех стадий –
элементарных хим.реакций и есть
A
механизм
сложной
A B
реакции
B
A
A
D
D
C
D
B
C
D
C B
D
4. Частицы, участвующие в элементарной химической реакции:
• Молекулы2 NO + O2 2 NO2
• Ионы
H+ + OH- H2O
• Радикалы(атомы)
H + Cl HCl
Макромолекулы (~102 –106 атомов)
Поверхностные атомы или молекулы
Классификация хим.реакций
Простые(элементарные), сложные, гомо(-фазные)-генные,
гетерогенные, необратимые, обратимые, моно(би-,
три)молекулярные[распад, диссоциация, фрагментация,
изомеризация, присоединение(ассоциация), димеризация,
рекомбинация, отрыв, замещение], полимеризация,
окислительно-восстановительные, гомо(гетеро)литические,
термические, фото-, радиационно-,электро-, механохимические
5. 5.2 Элементарная(одностадийная) химическая реакция-непосредственное взаимодействие исходных веществ-совокупность элементарных хим.актов
AA + B B DDПонятие молекулярности реакции
• реакционное пространство(место встречи) V - объем(гомогенн.процесс)
•реакционная поверхность
S - повть(гетерогенн.процесс)
• Число частиц, участвующих в элементарном химическом акте:
A + B - молекулярность реакции
мономолекулярные
A + B =1
бимолекулярные
A + B =2
тримолекулярные
A + B =3
АВ А + В
А + В АВ
2 А + В А2В
• скорость элементарной химической реакции
- число элементарных актов (r), совершающихся в единицу времени (t)
в единице реакционного объема V:
r
v
V t
6. Скорость элементарной(простой) реакции число элементарных актов(r) в единицу времени t в единице реакционного объёма V (определить сложно ил
Скорость элементарной(простой) реакциичисло элементарных актов(r) в единицу времени t в единице
реакционного объёма V (определить сложно или невозможно)
AA + B B DD
r
1 n A
1 n B
1 n D
v
V t
A V t B V t D V t
n i
NA
моль
~
i C i [
] ~ Pi [Па]
V
V
л
Сi моль
vi
[
] средняя скорость,
t л с
dСi
t 0 мгновенная vi
дифф. уравнение
dt
Р i Па
vi
[ ]
t с
t 0
dР i
vi
dt
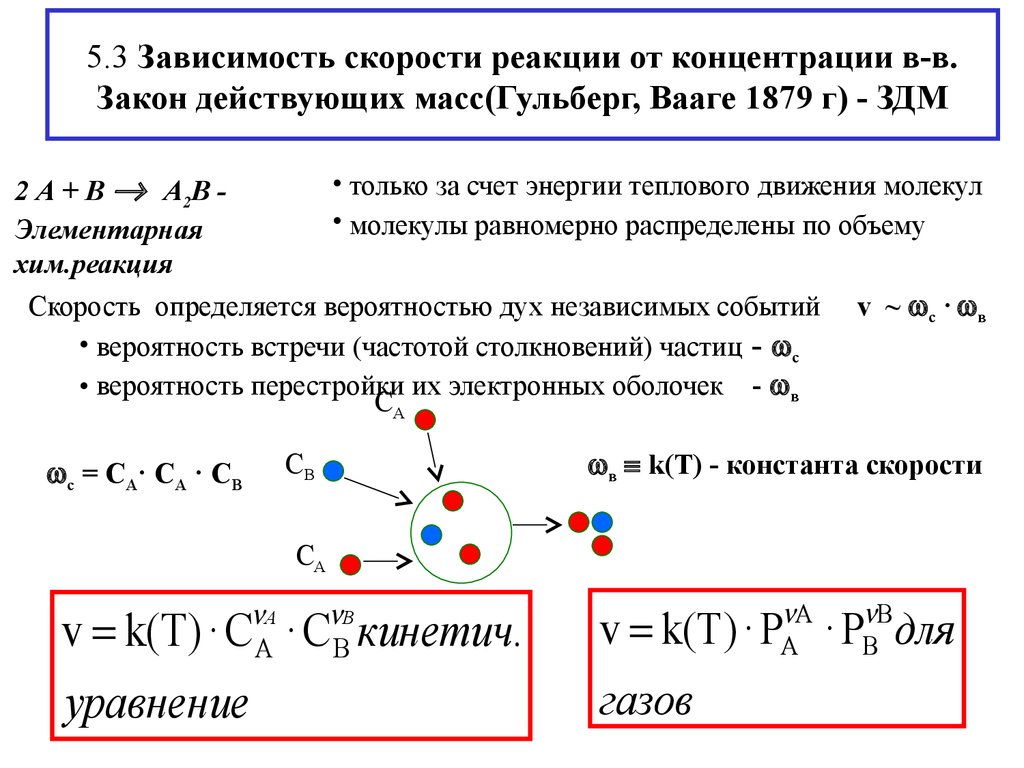
7. 5.3 Зависимость скорости реакции от концентрации в-в. Закон действующих масс(Гульберг, Вааге 1879 г) - ЗДМ
• только за счет энергии теплового движения молекул2 А + В А2В • молекулы равномерно распределены по объему
Элементарная
хим.реакция
Скорость определяется вероятностью дух независимых событий v ~ с · в
• вероятность встречи (частотой столкновений) частиц - с
• вероятность перестройки их электронных оболочек - в
СА
в k(T) - константа скорости
СВ
с = СА· СА · СВ
СА
А
A
В
B
A
A
B
B
v k(T) · С · С кинетич.
v k(T) · P · P для
уравнение
газов
8. 5.4 Зависимость скорости реакции от температуры
уравнениеАррениуса
k(T) k 0 e
E ак
R T
const
•Теория активных соударений
k0 p u
- сечения упругих столкновений
ū - средняя скорость движения молекул
Еак – энергия активации
k0 - предэкспоненциалый
множитель
(частотный фактор)
R – универс.газ.пост.
р - cтерический фактор
1
nE Eак
n0
e
E
ак
R T
2
3
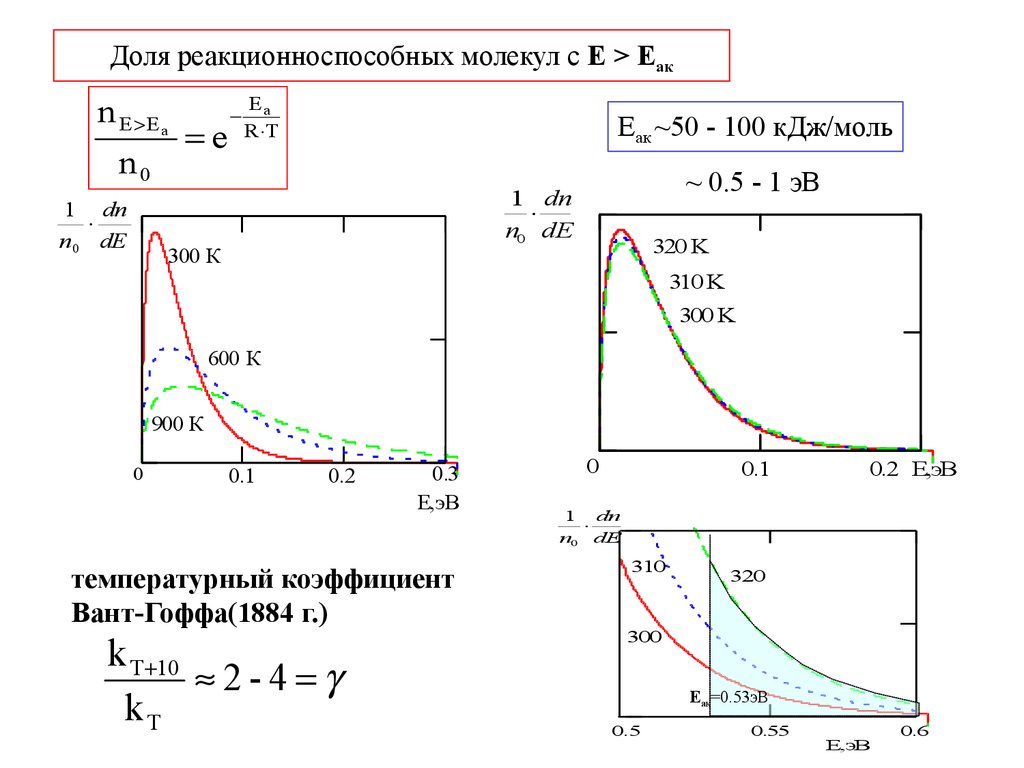
9. Доля реакционноспособных молекул с Е > Еак
Доля реакционноспособных молекул с Е > Еакn E E a
n0
1 dn
n 0 dE
e
Ea
R T
Еак ~50 - 100 кДж/моль
~ 0.5 - 1 эВ
1 dn
n0 dE
300 К
320 K
310 K
300 K
600 К
900 К
0
0.1
0.2
0.3
E,эВ
температурный коэффициент
Вант-Гоффа(1884 г.)
k T 10
2-4
kT
0
0.1
0.2 E,эВ
1 dn
n0 dE
310
320
300
Еак=0.53эВ
0.5
0.55
E,эВ
0.6
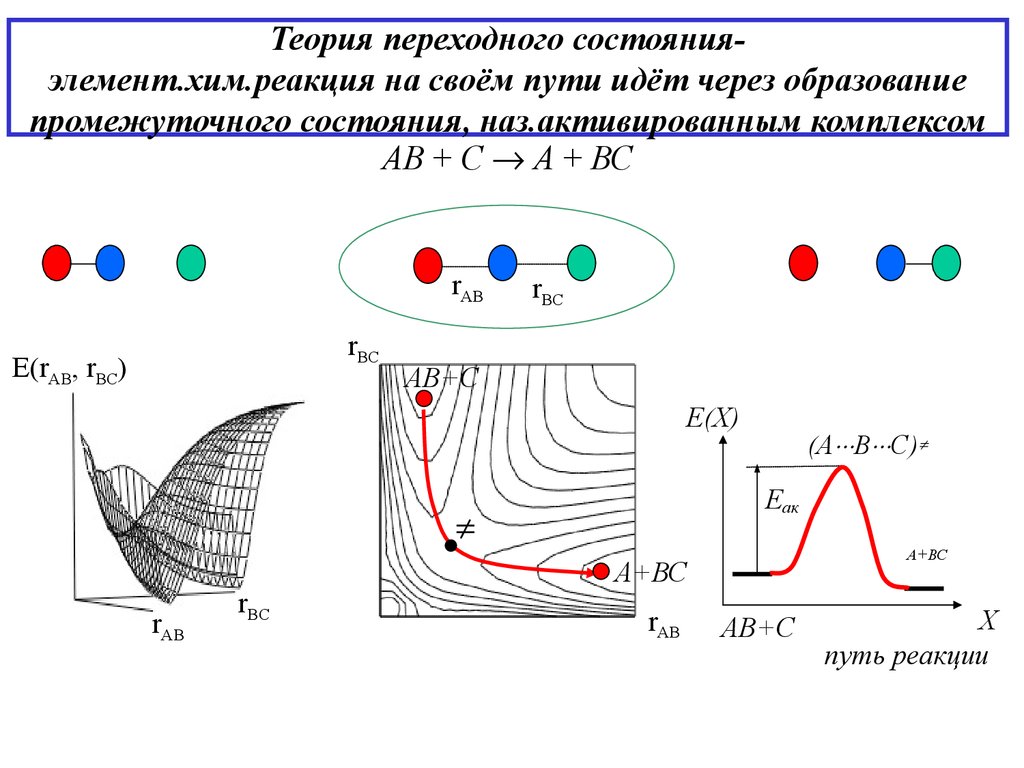
10. Теория переходного состояния- элемент.хим.реакция на своём пути идёт через образование промежуточного состояния, наз.активированным комп
Теория переходного состоянияэлемент.хим.реакция на своём пути идёт через образованиепромежуточного состояния, наз.активированным комплексом
АВ + С А + ВС
rAB
rBC
E(rAB, rBC)
rBC
АВ+С
Е(X)
rAB
rBC
UL
(А В С)
Еак
А+ВС
А+ВС
rAB
АВ+С
X
путь реакции
11. 5.5 Формальная кинетика. Сложные химические реакции AA + BB DD
5.5 Формальная кинетика.Сложные химические реакции
AA + B B DD
Общая скорость сложных многостадийных реакций определяется скоростью
самой медленной стадии – лимитирующая стадия сложной хим.реакции. Эту
стадию можно описать ЗДМ. Такие сложные химические реакции называют
формально простыми
ЗДМ для формально
простых
реакций(кинетическ.
V k(Т) C Ax C By
уравн.хим.р.)
уравнение
Аррениуса
x A y B
(x + y ) - суммарный порядок
реакции
x, y – порядок по компоненту
k(T) k 0 e
E ак
R T
Еак - энергия активации
k0 - предэкспоненциальный
множитель(частотный
фактор)
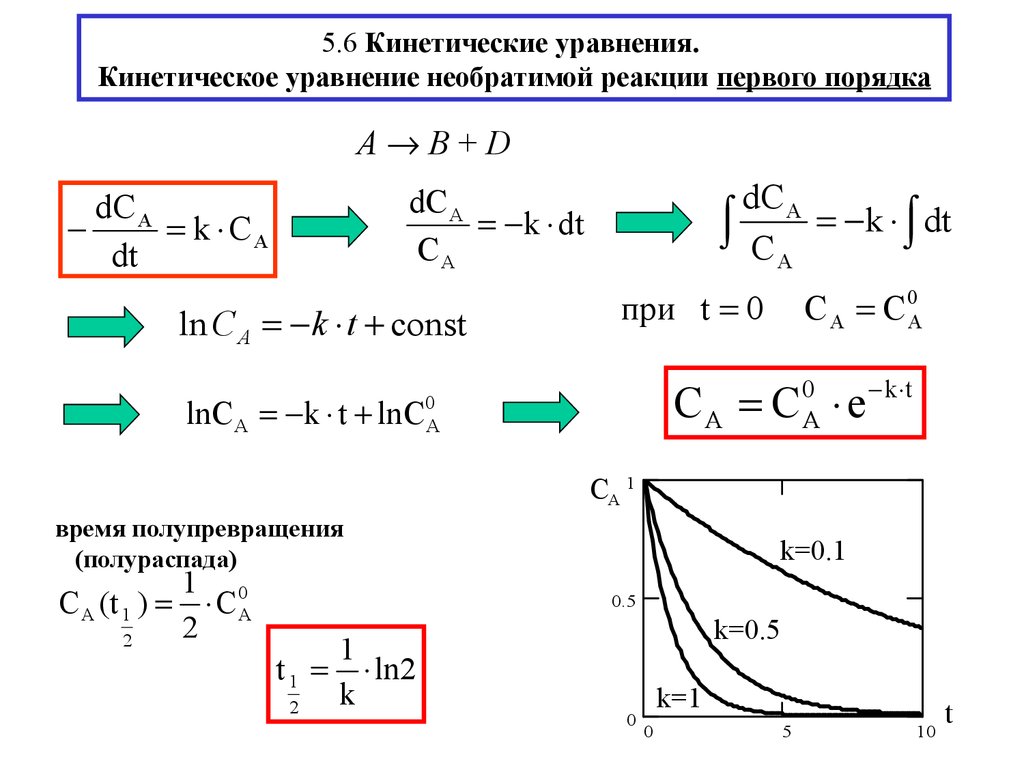
12. 5.6 Кинетические уравнения. Кинетическое уравнение необратимой реакции первого порядка
A B+DdС A
СA k dt
dС A
k dt
СA
dС A
k СA
dt
ln С A k t const
lnС A k t lnС
при t 0
C A C 0A
СA С e
0
А
0
А
k t
CA 1
время полупревращения
(полураспада)
С A (t 1 )
2
1 0
СА
2
k=0.1
0.5
1
t 1 ln2
k
2
k=0.5
0
k=1
0
5
10
t
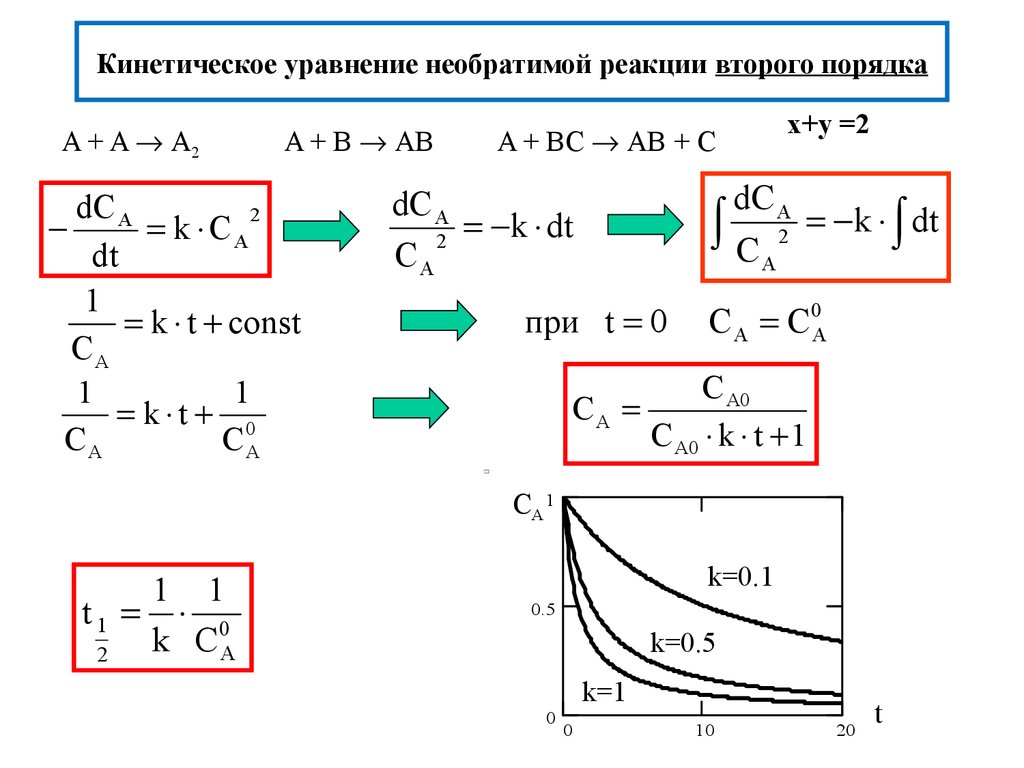
13. Кинетическое уравнение необратимой реакции второго порядка
A + A A2A + B AB
dC A
2
k CA
dt
1
k t const
CA
1
1
k t 0
CA
CА
A + BС AB + С
x+y =2
dC A
C A 2 k dt
dC A
k dt
2
CA
при t 0
C A C0A
C A0
CA
C A0 k t 1
CA 1
1 1
t1 0
k СА
2
k=0.1
0.5
k=0.5
k=1
0
0
10
20
t
14. 5.7 Цепной механизм химической реакции
Цепные реакции(особый класс сложных многостадийных реакций) - рядрегулярно повторяющихся элементарных реакций с участием активных частиц
(радикалов R ), которые взаимодействуют с молекулами реагентов с
образованием продуктов реакции и новых активных частиц (радикалов).
Пусть А В – цепная реакция
•Стадия зарождения цепи
А R 1 + R 2 -появление активной частицы
• Развитие цепи*
А + R 1 R 2+ В - большое кол-во
повтор.элементарных актов с образованием продуктов реакции и новых радикалов
• Обрыв цепи
R1 + R2 А -исчезновение активных
частиц
*
длина цепи (γ) - число актов взаимодействия от зарождения до обрыва цепи
по типу развития цепи:
- неразветвленный цепной процесс - коэфф.размножения n = 1
- разветвленный цепной процесс n 1( n - число активных частиц образ. в
элеменарном акте)
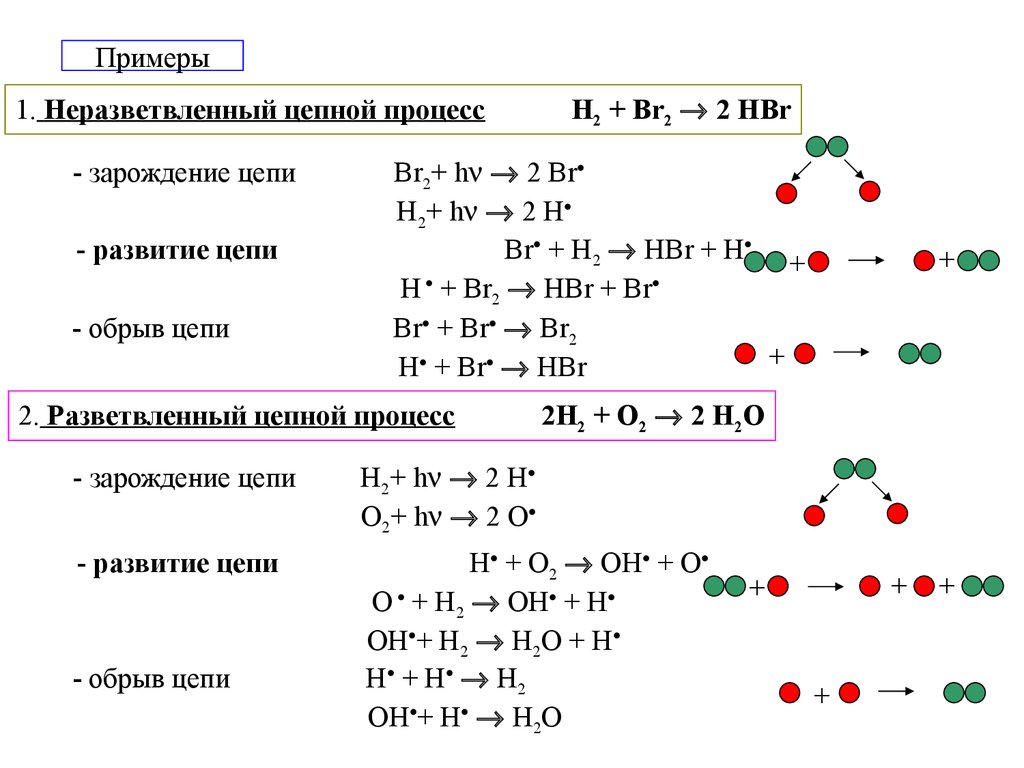
15. Примеры
1. Неразветвленный цепной процесс- зарождение цепи
- развитие цепи
- обрыв цепи
H2 + Br2 2 HBr
Br2+ h 2 Br
H2+ h 2 H
Br + H2 HBr + H
+
H + Br2 HBr + Br
Br + Br Br2
+
H + Br HBr
2. Разветвленный цепной процесс
2H2 + O2 2 H2O
- зарождение цепи
H2+ h 2 H
O2+ h 2 O
- развитие цепи
H + O2 OH + O
O + H2 OH + H
OH + H2 H2O + H
H + H H2
OH + H H2O
- обрыв цепи
+
+
+
+
+
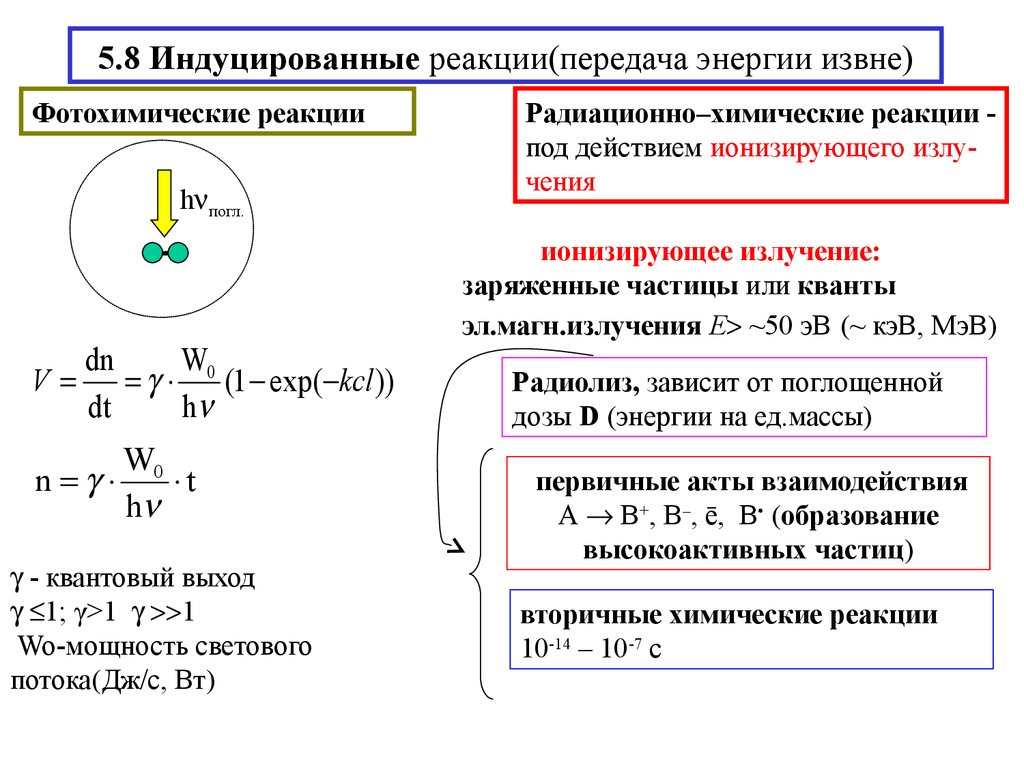
16. 5.8 Индуцированные реакции(передача энергии извне)
Фотохимические реакцииh погл.
V
dn
W
0 (1 exp( kcl ))
dt
h
W0
n
t
h
- квантовый выход
1; γ>1 1
Wo-мощность светового
потока(Дж/с, Вт)
Радиационно–химические реакции под действием ионизирующего излучения
ионизирующее излучение:
заряженные частицы или кванты
эл.магн.излучения Е ~50 эВ (~ кэВ, МэВ)
Радиолиз, зависит от поглощенной
дозы D (энергии на ед.массы)
первичные акты взаимодействия
А В+, В–, ē, В• (образование
высокоактивных частиц)
вторичные химические реакции
10-14 – 10-7 с
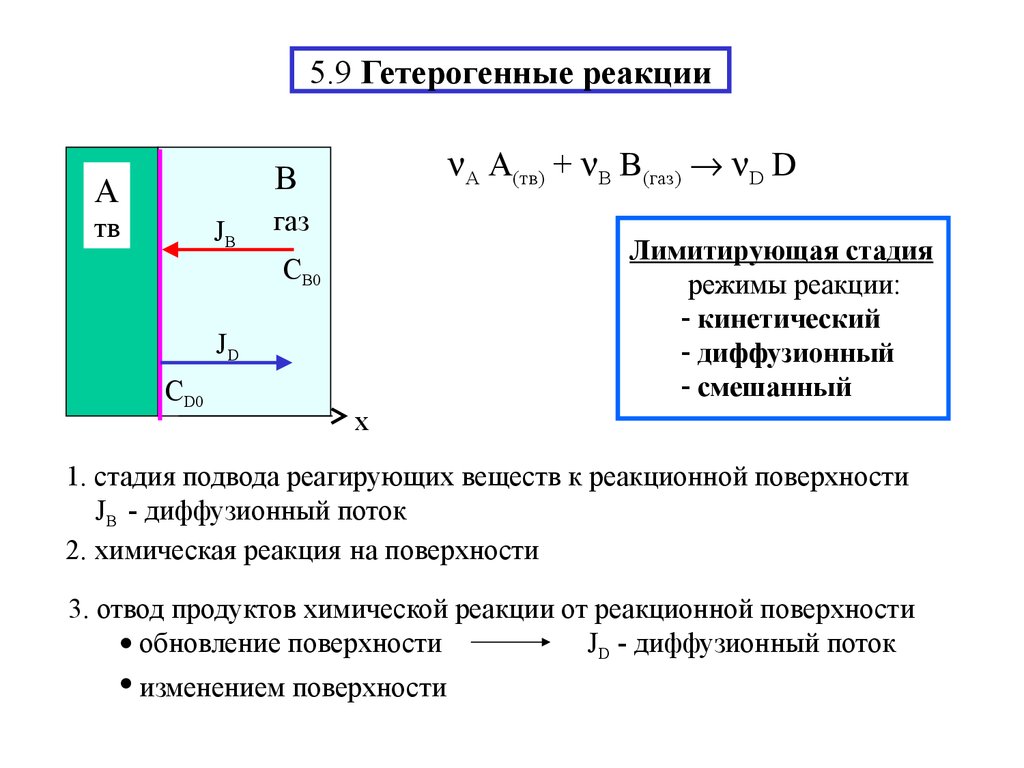
17. 5.9 Гетерогенные реакции
А A(тв) + В B(газ) D DB
A
тв
JB
газ
Лимитирующая стадия
режимы реакции:
- кинетический
- диффузионный
- смешанный
CB0
JD
CD0
x
1. стадия подвода реагирующих веществ к реакционной поверхности
JB - диффузионный поток
2. химическая реакция на поверхности
3. отвод продуктов химической реакции от реакционной поверхности
JD - диффузионный поток
обновление поверхности
изменением поверхности
18. А A(тв) + В B(газ) D D
А A(тв) + В B(газ) D D• Кинетический режим - З-н действующих масс(ЗДМ)
dC B
B
B
S
k (C А SA) C B k C B
dt
• Диффузионный режим – З-ны диффузии (J - диффузионный поток)
dm 1
J(x)
dt S
J(x, y, z) D gradС
dmB
dC B
D S A
dt
dx
закон Фика
D =f(T) – коэффициент диффузии
Газы - D~10-5 м2/с
Жидк. - 10-9
Тв.тела - 10-14
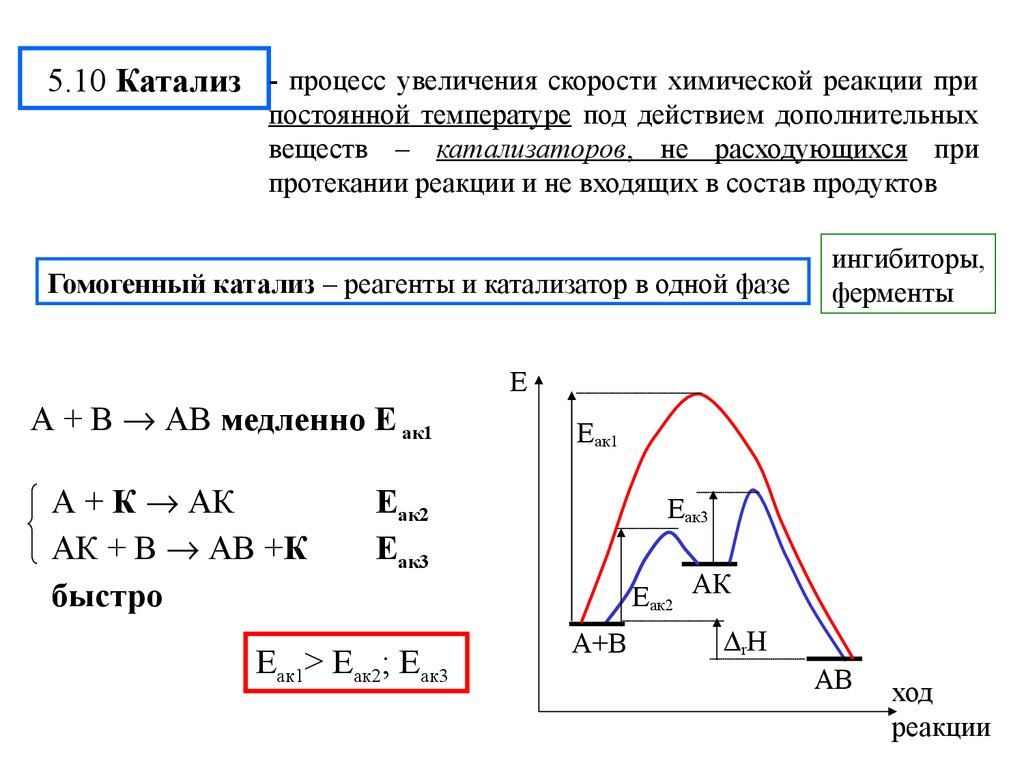
19. 5.10 Катализ
- процесс увеличения скорости химической реакции припостоянной температуре под действием дополнительных
веществ – катализаторов, не расходующихся при
протекании реакции и не входящих в состав продуктов
Гомогенный катализ – реагенты и катализатор в одной фазе
А + В АВ медленно Е ак1
А + К АК
АК + В АВ +К
быстро
Е
Еак1
Еак2
Еак3
Еак1> Еак2; Еак3
ингибиторы,
ферменты
Еак3
Еак2 АК
А+В
rH
АВ
ход
реакции
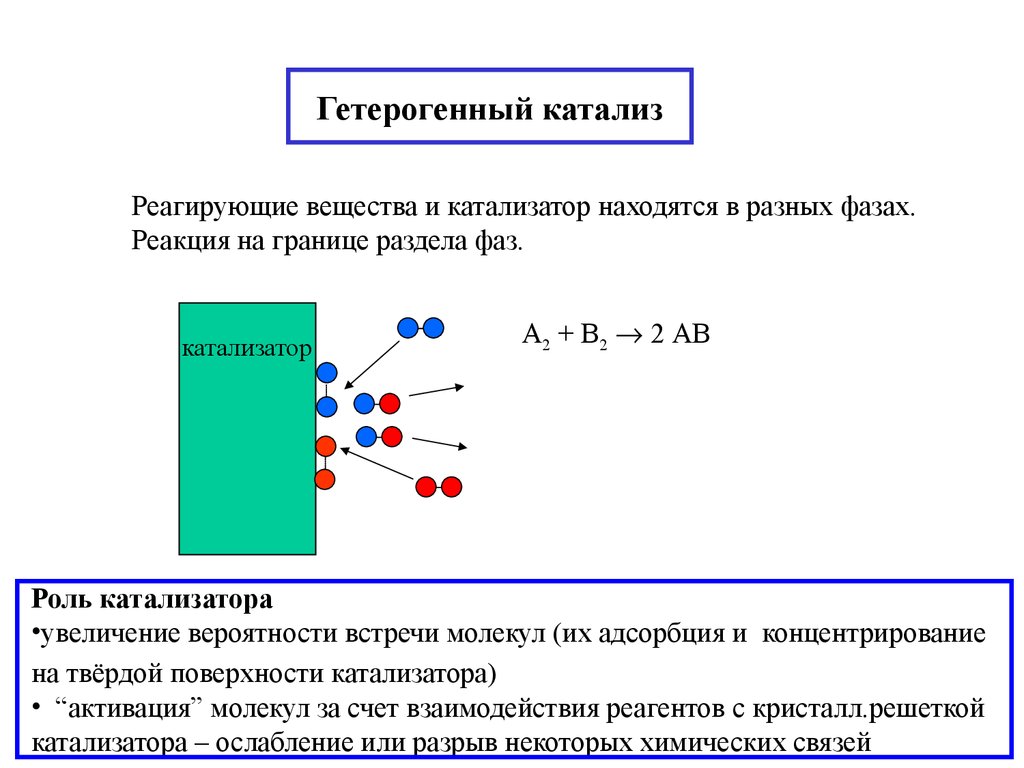
20. Гетерогенный катализ
Реагирующие вещества и катализатор находятся в разных фазах.Реакция на границе раздела фаз.
катализатор
А2 + В2 2 АВ
Роль катализатора
•увеличение вероятности встречи молекул (их адсорбция и концентрирование
на твёрдой поверхности катализатора)
• “активация” молекул за счет взаимодействия реагентов с кристалл.решеткой
катализатора – ослабление или разрыв некоторых химических связей
21. 5.11 Горение и взрыв(взрывчатые превращения)
Исходныевещества
Р1,Т1
v
Продукты
реакции
Р2,Т2
Область
химической реакции
Р3,Т3
Реакции:
•экзотермические Н 0
•высокая скорость
•газообразование
•самоускорение
•различная Т и хим.состав в
разл.частях системы
•Горение (лин.скорость области хим.реакции) v 10-3-102 м с; повышение Т, разогрев исходных веществ за счет теплопередачи, диффузии
•Взрыв v 103-104 м с; образуется ударная(сжатия) волна,
vmax - детонация(макс.скорость ударной волны равна скорости звука в
веществе)
22. Тепловой взрыв(инициирование) в замкнутой системе по Н.Н.Семёнову [ Q+ и Q - =f(Т) ]
v ~ const eQ ~ v r H еплоприход
Q+
Q–
Тг
Тв
E ак
R T
Q ~ const e
E ак
R T
Q– ~ S (T–T0)
теплоотвод(скорость отвода
тепла) – линейная зависимость
от Т (Т0 – пост.)
α- коэфф.теплопередачи
S- площадь
Т- температ.системы
Т0-температ.окруж.среды
Q
Т0
Т
Q+ - теплоприход(скорость
прихода тепла) - экспонента от
Т









![Тепловой взрыв(инициирование) в замкнутой системе по Н.Н.Семёнову [ Q+ и Q - =f(Т) ] Тепловой взрыв(инициирование) в замкнутой системе по Н.Н.Семёнову [ Q+ и Q - =f(Т) ]](https://cf.ppt-online.org/files/slide/r/RjfuVFwXDk196EJYhSaO0Gi45PqW8K7TNyLCsl/slide-21.jpg)
 chemistry
chemistry








