Similar presentations:
Кинетика
1.
Экзаменационныевопросы5. Химическая кинетика
1. Понятие о механизме реакций. Элементарная (простая) и сложная химические реакции. Частицы,
участвующие в элементарной химической реакции. Классификация химических реакций.
Элементарная химическая реакция и понятие молекулярности реакции.
2. Скорость элементарной реакции. Зависимость скорости реакции от концентрации веществ. Закон
действующих масс.
3. Зависимость скорости реакции от температуры. Уравнение Аррениуса. Константа скорости
элементарной реакции. Температурный коэффициент Вант-Гоффа. Энергия активации. Теория
переходного состояния (активированного комплекса).
4. Формальная кинетика. Сложные реакции. Кинетический порядок реакции. Зависимость скорости
реакции от температуры.
5. Изменение концентрации реагирующих веществ во времени. Кинетика первого и второго порядка.
6. Цепной механизм химической реакции.
7. Индуцированные химические реакции. Фотохимические реакции. Радиационно-химические
реакции.
8. Гетерогенные реакции.
9. Гомогенный и гетерогенный катализ.
10. Горение и взрыв
2. 5. Химическая кинетика
• учение о механизме (стадиях и их последовательности, молекулярности)химических реакций (процессов)
•исследование закономерностей развития химических реакций во времени в
зависимости от условий (факторов) протекания.
Факторы, влияющие на скорость протекания реакции:
- концентрация реагирующих веществ,
- температура,
- давление,
- свойства среды протекания реакций,
-катализаторы ….
Хим.кинетика содержит 2 раздела:
-учение о механизме хим.взаимодействия (стадии, молекулярность)
-формальная кинетика- математ. описание изменения количества
реагирующих веществ во времени (без учета реального механизма)
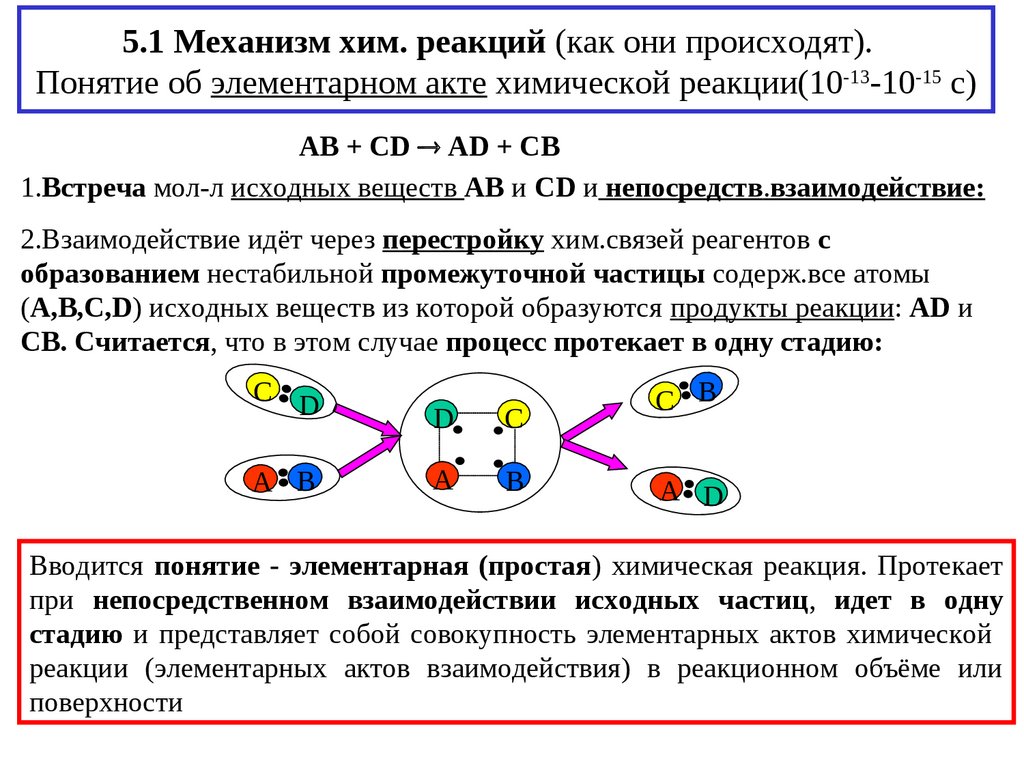
3. 5.1 Механизм хим. реакций (как они происходят). Понятие об элементарном акте химической реакции(10-13-10-15 с)
AB + CD AD + CB1.Встреча мол-л исходных веществ AB и CD и непосредств.взаимодействие:
2.Взаимодействие идёт через перестройку хим.связей реагентов с
образованием нестабильной промежуточной частицы содерж.все атомы
(А,В,С,D) исходных веществ из которой образуются продукты реакции: AD и
CB. Считается, что в этом случае процесс протекает в одну стадию:
C D
D
C
A B
A
B
C B
A D
Вводится понятие - элементарная (простая) химическая реакция. Протекает
при непосредственном взаимодействии исходных частиц, идет в одну
стадию и представляет собой совокупность элементарных актов химической
реакции (элементарных актов взаимодействия) в реакционном объёме или
поверхности
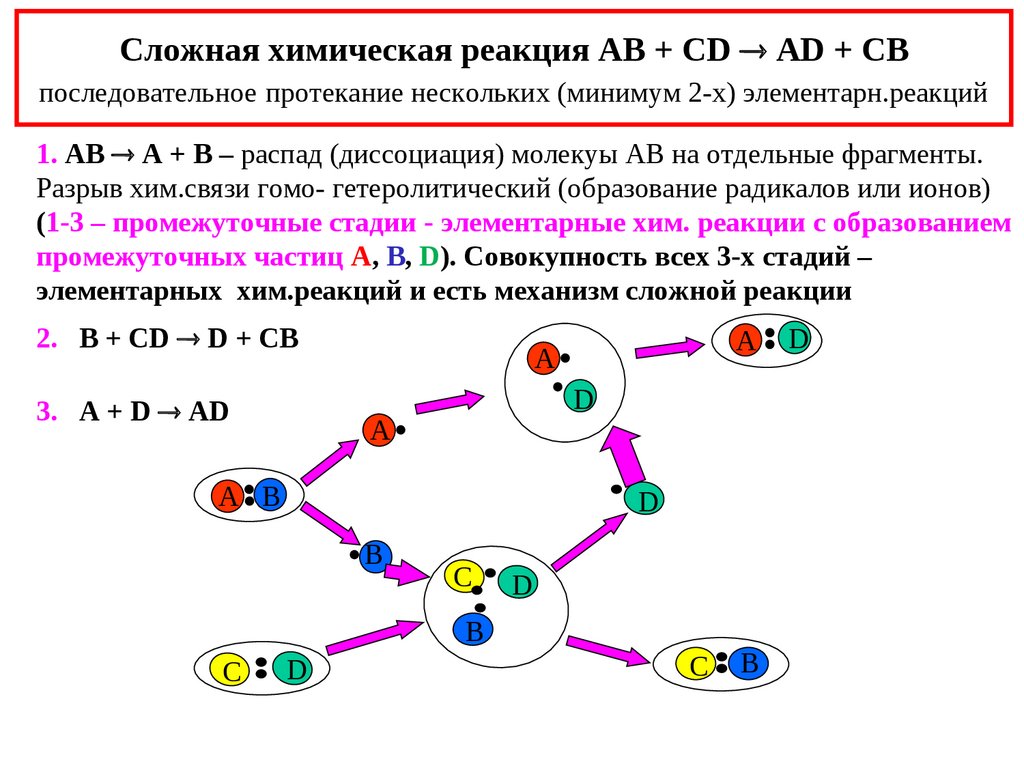
4. Сложная химическая реакция AB + CD AD + CB последовательное протекание нескольких (минимум 2-х) элементарн.реакций
Сложная химическая реакция AB + CD AD + CBпоследовательное протекание нескольких (минимум 2-х) элементарн.реакций
1. AB A + B – распад (диссоциация) молекуы АВ на отдельные фрагменты.
Разрыв хим.связи гомо- гетеролитический (образование радикалов или ионов)
(1-3 – промежуточные стадии - элементарные хим. реакции с образованием
промежуточных частиц A, B, D). Совокупность всех 3-х стадий –
элементарных хим.реакций и есть механизм сложной реакции
2. B + CD D + CB
3. A + D AD
A
A
D
A
A B
D
B
C
D
B
C
D
C
B
D
5. Частицы (в том числе промежуточные), участвующие в элементарной химической реакции:
• Молекулы2 NO + O2 2 NO2
• Ионы
H+ + OH- H2O
• Радикалы(частицы с неспаренным эл-ном) H + Cl HCl
Макромолекулы (~102 –106 атомов)
Поверхностные атомы или молекулы (особые свойства)
Классификация хим.реакций (по различным признакам)
Простые (элементарные), моно(би-, три) молекулярные [распад
или диссоциация - гомо-(гетеро-)литическая, фрагментация,
изомеризация, присоединение (ассоциация), димеризация,
рекомбинация, отрыв, замещение и т.д.]; сложные; гомо-,
гетеро(-фазные)-генные; необратимые, обратимые; цепные
(полимеризация); окислительно-восстановительные;
термические, фото-, радиационно-, электро-,
6. 5.2 Элементарная(одностадийная) химическая реакция: AA + BB DD -непосредственное взаимодействие исходных веществ.
5.2 Элементарная(одностадийная) химическая реакция: AA + BB DD-непосредственное взаимодействие исходных веществ. Совокупность
элементарн. актов (хим.взаимодействия) определяет протекание хим. реакции
Понятие молекулярности реакции
•реакционное пространство(место встречи) V -объем(гомогенн.процесс)
•реакционная поверхность
→ S –повть(гетерогенн.процесс)
• Число частиц, участвующих в элементарном химическом акте:
A + B - наз. молекулярность реакции
Пример:
Мономолекулярные (диссоциация) A + B =1
АВ А + В
бимолекулярные
A + B =2
А + В АВ
тримолекулярные (максимум)
A + B =3
2 А + В А2В
• скорость элементарной химической реакции v
- число элементарных хим.актов (взаимодействия) (r), совершающихся в
единицу времени (t) в единице реакционного объема V:
r
v
V t
7. Скорость элементарной(простой) реакции v - число элементарных актов (r) в единицу времени t в единице реакционного объёма V
Скорость элементарной(простой) реакции v число элементарных актов (r) в единицу времени t в единицереакционного объёма V (определить сложно или невозможно)
AA + BB DD
r
1 n A
1 n B
1 n D
v
V t
A V t B V t D V t
n i
NA
моль
~
i C i [
] ~ Pi [П
V
V
л
С моль
v i i [
] средняя скорость,
t л с
dСi
t 0 мгновенная vi
дифф. уравнение
dt
Р i Па
v i
[ ]
t с
t 0
dР i
v i
dt
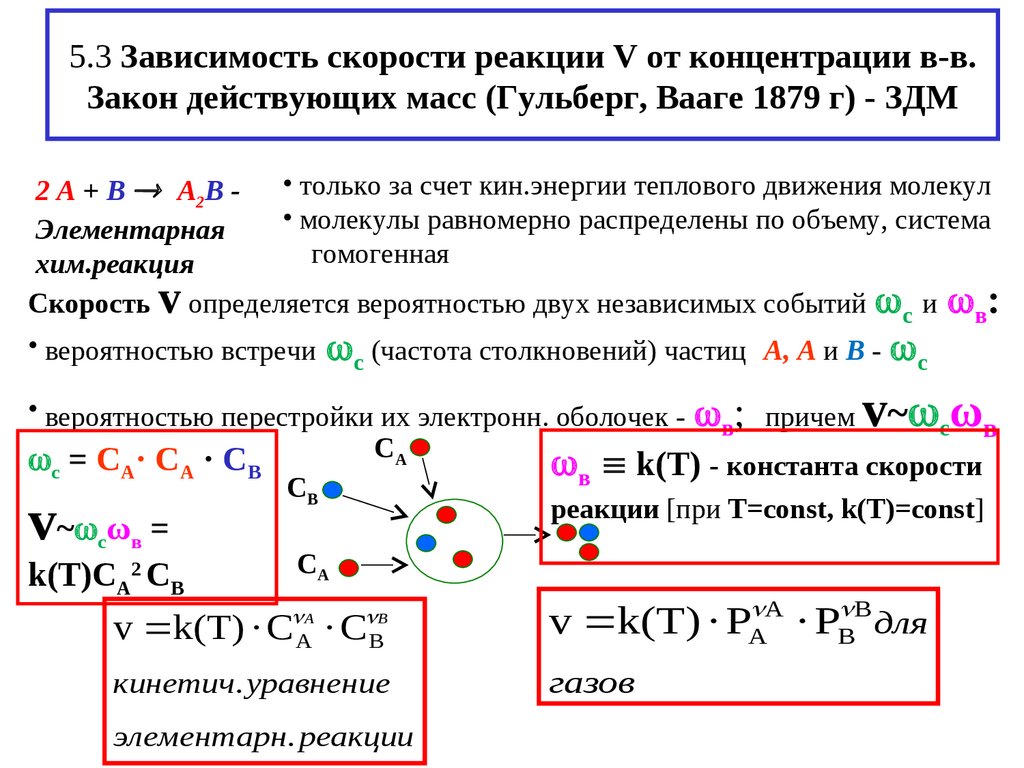
8. 5.3 Зависимость скорости реакции V от концентрации в-в. Закон действующих масс (Гульберг, Вааге 1879 г) - ЗДМ
2 А + В А2В - • только за счет кин.энергии теплового движения молекул• молекулы равномерно распределены по объему, система
Элементарная
гомогенная
хим.реакция
Скорость определяется вероятностью двух независимых событий с и в:
• вероятностью встречи (частота столкновений) частиц А, А и В -
v
с
с
v ω
• вероятностью перестройки их электронн. оболочек - ; причем ~
в
с в
СА
с = СА· СА · СВ
в k(T) - константа скорости
СВ
реакции [при Т=const, k(T)=const]
v~ ω
=
k(T)C CB
с
в
2
A
СА
v k(T) · С · С
v k(T) · PA A · PB B для
кинетич. уравнение
газов
А
A
В
B
элементарн. реакции
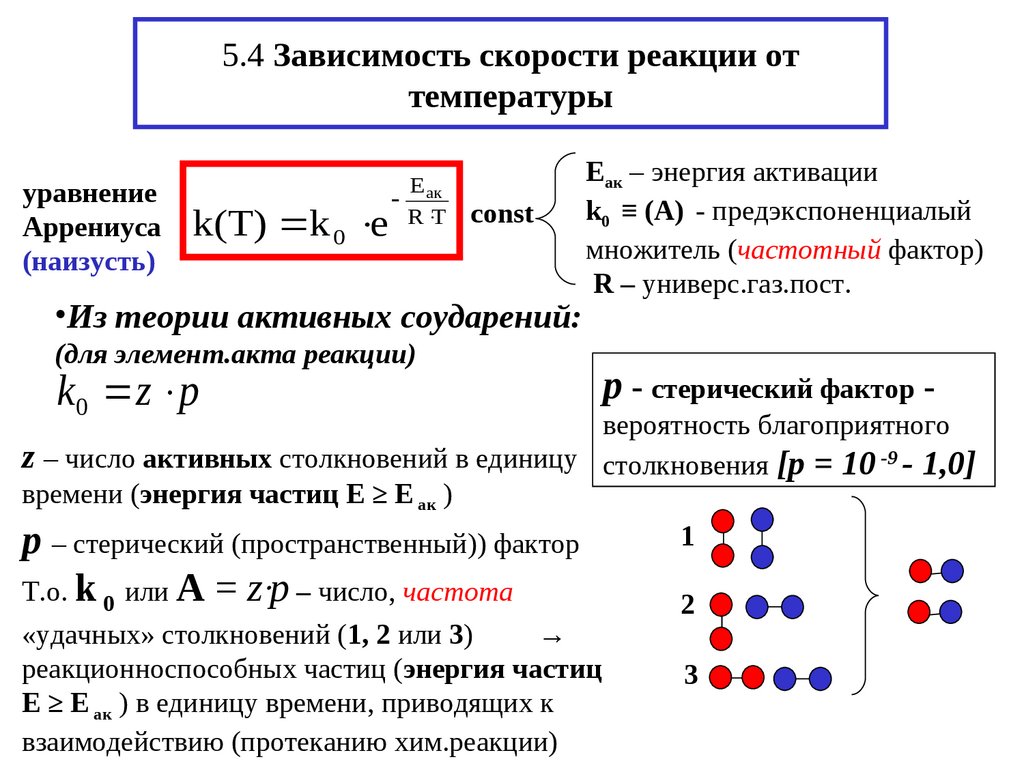
9. 5.4 Зависимость скорости реакции от температуры
уравнениеАррениуса
(наизусть)
k(T) k 0 e
E
ак
R T
const
•Из теории активных соударений:
Еак – энергия активации
k0 ≡ (А) - предэкспоненциалый
множитель (частотный фактор)
R – универс.газ.пост.
(для элемент.акта реакции)
k0 z p
р - cтерический фактор -
вероятность благоприятного
z – число активных столкновений в единицу столкновения [pp = 10 -9 - 1,0]
времени (энергия частиц Е ≥ Е ак )
1
p – стерический (пространственный)) фактор
Т.о. k 0 или А
= z‧pp – число, частота
«удачных» столкновений (1, 2 или 3)
→
реакционноспособных частиц (энергия частиц
Е ≥ Е ак ) в единицу времени, приводящих к
взаимодействию (протеканию хим.реакции)
2
3
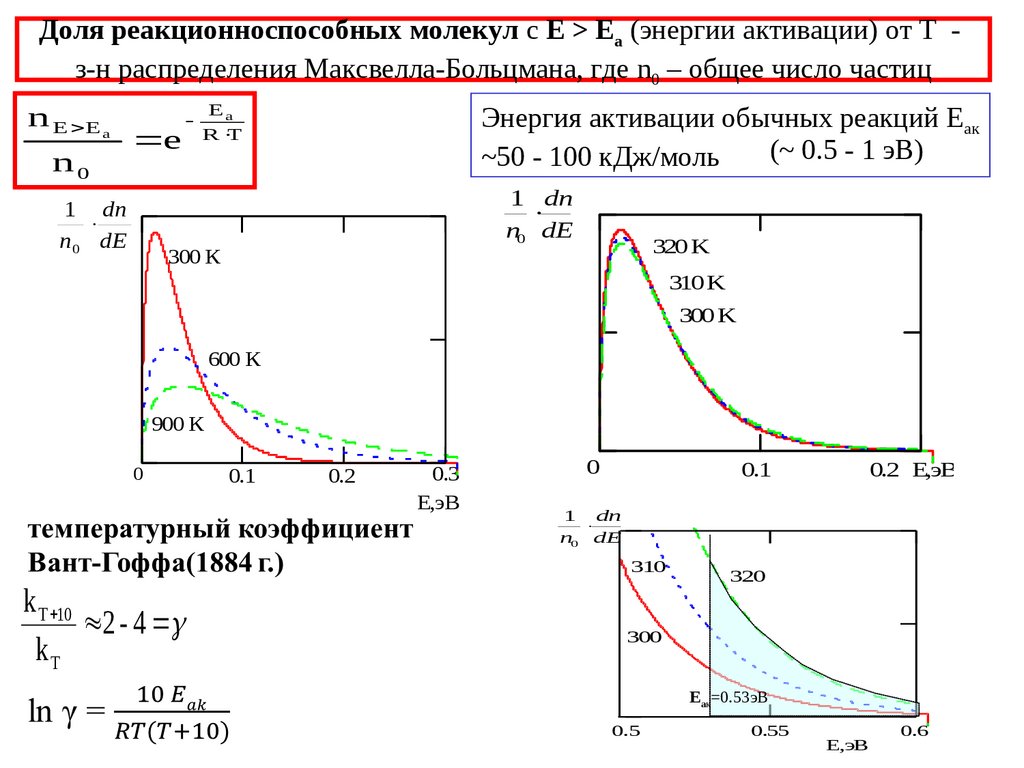
10. Доля реакционноспособных молекул с Е > Еа (энергии активации) от Т - з-н распределения Максвелла-Больцмана, где n0 – общее
Доля реакционноспособных молекул с Е > Еа (энергии активации) от Т з-н распределения Максвелла-Больцмана, где n0 – общее число частицn E E a
n0
e
1 dn
n 0 dE
Ea
R T
Энергия активации обычных реакций Еак
(~ 0.5 - 1 эВ)
~50 - 100 кДж/моль
1 dn
n0 dE
300 К
320 K
310 K
300 K
600 К
900 К
0
0.1
0.2
0.3
E,эВ
0
0.1
1 dn
n0 dE
310
k T 10
2 - 4
kT
0.2 E,эВ
320
300
Еак=0.53эВ
0.5
0.55
E,эВ
0.6
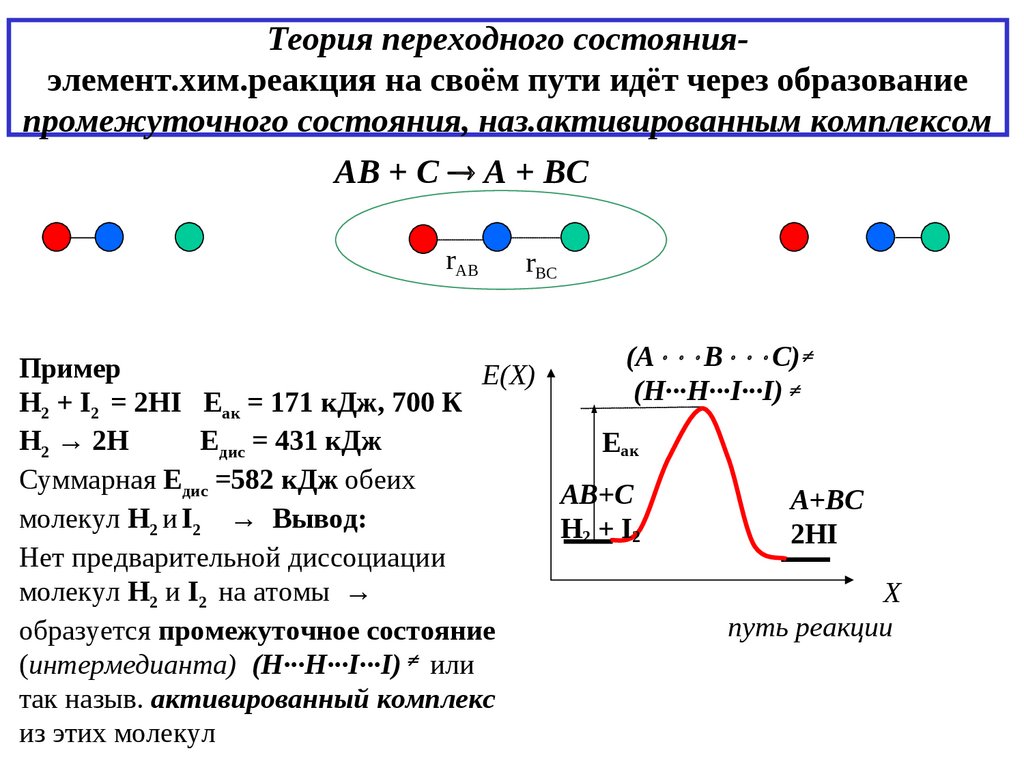
11. Теория переходного состояния- элемент.хим.реакция на своём пути идёт через образование промежуточного состояния,
Теория переходного состоянияэлемент.хим.реакция на своём пути идёт через образованиепромежуточного состояния, наз.активированным комплексом
АВ + С А + ВС
rAB
rBC
(А В С)
Пример
Е(X))
(Н∙∙∙H∙∙∙I∙∙∙I)
H2 + I2 = 2HI Eак = 171 кДж, 700 К
Н2 → 2Н
Едис = 431 кДж
Еак
Суммарная Едис =582 кДж обеих
АВ+С
А+ВС
молекул H2 и I2 → Вывод:
H2 + I2
2HI
Нет предварительной диссоциации
молекул Н2 и I2 на атомы →
X)
путь реакции
образуется промежуточное состояние
(интермедианта) (Н∙∙∙H∙∙∙I∙∙∙I) или
так назыв. активированный комплекс
из этих молекул
12. 5.5 Формальная кинетика (гомогенные реакции) Сложные химические реакции AA + BB DD
5.5 Формальнаякинетика (гомогенные реакции)
Сложные химические реакции
AA + BB DD
Общая скорость сложных многостадийных реакций определяется скоростью
самой медленной промежуточной стадии, являющейся элементарной
хим.реакцией – так наз. лимитирующей стадией сложной хим.реакции. Эту
лимитирующую стадию (элементарную хим.реакцию) можно описать ЗДМ.
Такие сложные химические реакции называют формально простыми
ЗДМ для формально
простых реакций
(кинетическое
уравнение хим.р.)
Применимо
уравнение
Аррениуса
для k(T)
V k(Т) C Ax C By
k(T) k 0 e
E ак
R T
x A y B
(x + y ) - суммарный
(кинетический) порядок реакции
x, y – порядок хим. реакции по
компоненту х или у – определяют
опытным путем
Еак - энергия активации
k0 или А - предэкспоненциальный
множитель (частотный фактор)
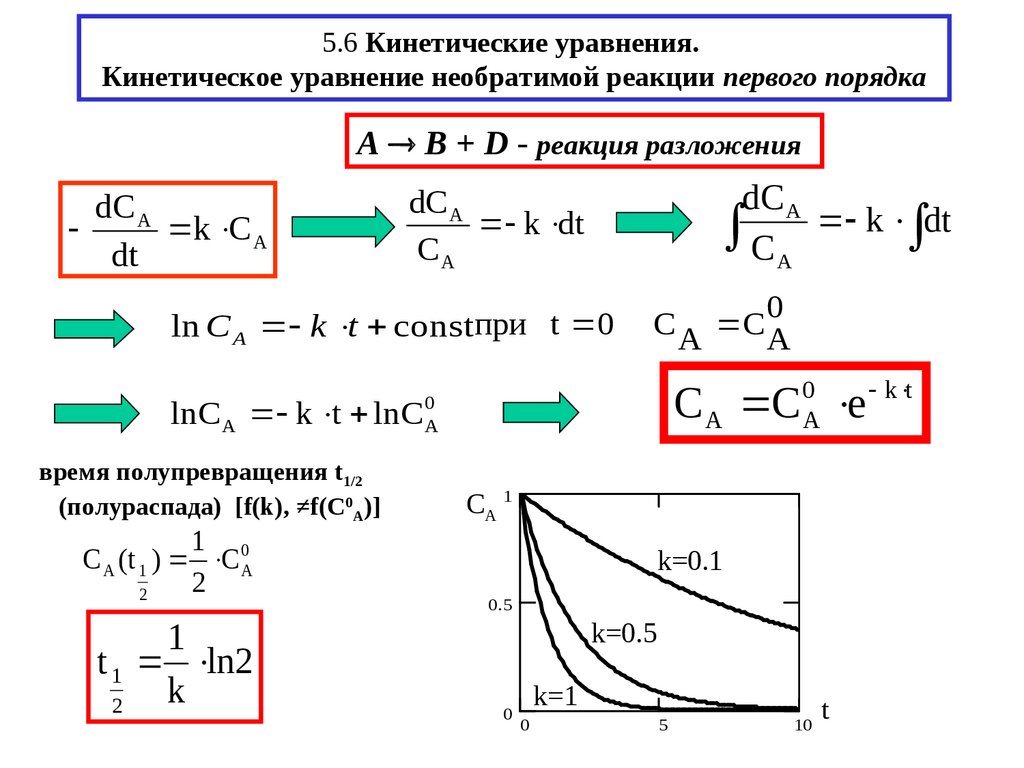
13. 5.6 Кинетические уравнения. Кинетическое уравнение необратимой реакции первого порядка
A B + D - реакция разложенияdС A
k С A
dt
dС A
СA k dt
dС A
k dt
СA
ln С A k t constпри t 0
lnС A k t lnС
время полупревращения t1/2
(полураспада) [f(k), ≠f(Cf(k), ≠f(C0A)]
1
С A (t 1 ) С 0А
2
2
1
t 1 ln2
k
2
0
C A C A
0
А
С A С e
0
А
CA 1
k=0.1
0.5
k=0.5
0
k=1
0
5
10
t
k t
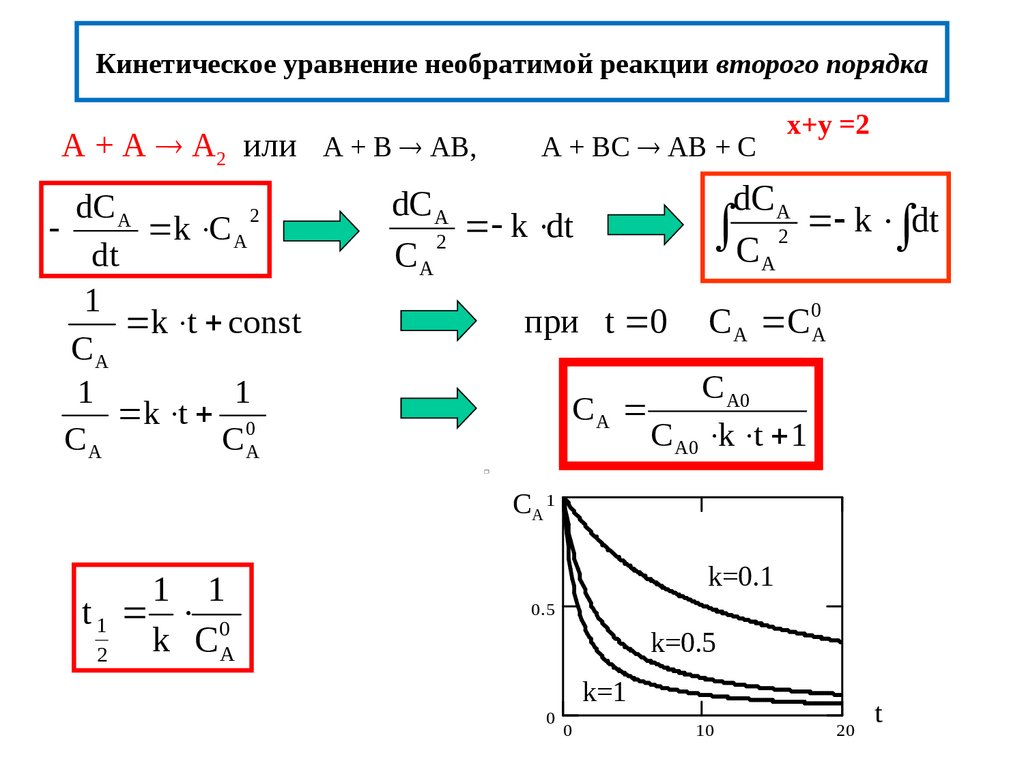
14. Кинетическое уравнение необратимой реакции второго порядка
A + A A2 или A + B AB,dC A
2
k C A
dt
1
k t const
CA
1
1
k t 0
CA
CА
A + BС AB + С
x+y =2
dC A
C A 2 k dt
dC A
k dt
2
CA
при t 0
C A C0A
C A0
CA
C A0 k t 1
CA 1
1 1
t1 0
k СА
2
k=0.1
0.5
k=0.5
k=1
0
0
10
20
t
15. 5.7 Цепной механизм химической реакции
Цепные реакции (особый класс сложных многостадийных реакций) - рядрегулярно повторяющихся элементарных реакций с участием активных
частиц (радикалов R ), которые взаимодействуют с молекулами реагентов с
образованием продуктов реакции и новых активных частиц (радикалов).
Пусть А В – цепная реакция, можно выделить 3 стадии:
•Стадия зарождения цепи*) А R 1 + R 2 - появление активных частиц
(радикалов) R‧1 , R‧2
• Развитие цепи**)
А + R 1 R 2+ В - большое кол-во повторяющихся
элементарных актов с образованием продуктов реакции В и новых радикалов
• Обрыв цепи
R1 + R2 А -исчезновение активных частиц
(рекомбинация)
*)скорость зарождения цепи υ0 –число радикалов в ед.времени; **)длина
цепи γ - число актов взаимодействия от зарождения до обрыва цепи; по типу
развития цепи:-неразветвленный цепной процесс- коэфф. размножения n= 1
(n - число активных частиц образ.в элемент.акте); - разветвл. цепной процесс
n 1. Скорость накопления продуктов цепн.реакции V= γυ0
16. Примеры
1. Неразветвленный цепной процесс (n=1)- зарождение цепи
- развитие цепи
- обрыв цепи
Br2+ h 2 Br
H2+ h 2 H
Br + H2 HBr + H
+
H + Br2 HBr + Br
Br + Br Br2
+
H + Br HBr
2. Разветвленный цепной процесс (n=2)
- зарождение цепи
- развитие цепи
- обрыв цепи
H2 + Br2 2 HBr
+
2H2 + O2 2 H2O
H2+ h 2 H
O2+ h 2 O
H + O2 OH + O
O + H2 OH + H
OH + H2 H2O + H
H + H H2
OH + H H2O
+
+
+
+
17. 5.8 Индуцированные реакции(передача энергии извне)
Фотохимические реакцииh погл.
V
W
dn
0 [1 exp( kcl )]
dt
h
W0
n t
h
k
- квантовый выход ( 1; γ>1
1- число продуктов на 1
hν); Wo-мощность светов.
потока (Дж/с, Вт),hν-энергия
поглощен. кванта, k-коэфф.
поглощения, с- концентрация
поглощающего вещества с
толщиной слоя l, n- число мол-
Радиационно–химические реакции (радиолиз) под действием
ионизирующего излучения (ИИ)
ионизирующее излучение:
заряженные частицы или кванты эл.
магн. излучения Е ~50 эВ (~ кэВ, МэВ)
Радиолиз включ. в себя стадии 1 и 2,
зависит от поглощенной дозы D
(энергии на ед. массы - Гр[Дж/кг ] и
мощности ИИ -[Гр/с)]
1-я стадия - первичные акты
взаимодействия ИИ с веществом
(образование высокоактивных частиц)
А В+, В–, ē, В•, В*
2-я стадия - вторичные хим.реакции
высокоактивных частиц 10-14 – 10-7 с
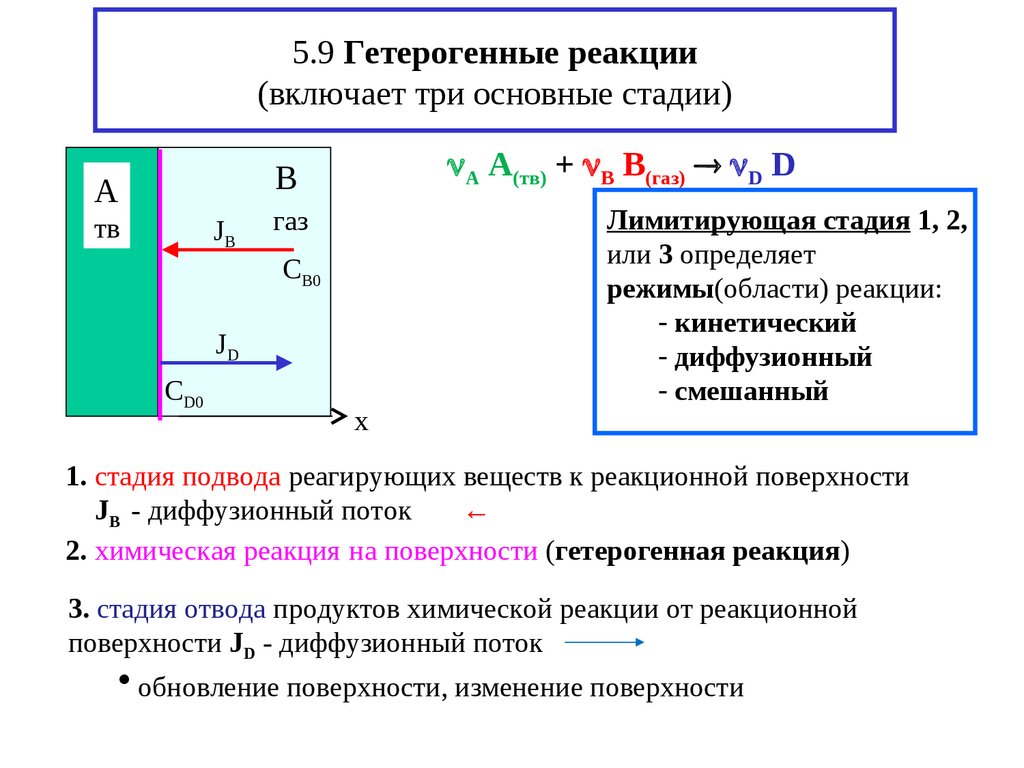
18. 5.9 Гетерогенные реакции (включает три основные стадии)
А A(тв) + В B(газ) D DB
A
тв
JB
газ
CB0
JD
CD0
x
Лимитирующая стадия 1, 2,
или 3 определяет
режимы(области) реакции:
- кинетический
- диффузионный
- смешанный
1. стадия подвода реагирующих веществ к реакционной поверхности
JB - диффузионный поток
←
2. химическая реакция на поверхности (гетерогенная реакция)
3. стадия отвода продуктов химической реакции от реакционной
поверхности JD - диффузионный поток
обновление поверхности, изменение поверхности
19. А A(тв) + В B(газ) D D
А A(тв) + В B(газ) D D• Кинетический режим - Закон действующих масс(ЗДМ)
CSA –поверхн. конц.твёрд.частиц А, SA –реакц. поверхность – Const
dC B
B
B
S
k (C А SA) C B k C B
dt
• Диффузионный режим – Законы диффузии [f(k), ≠f(Cвыравнивание
концентраций за счет тепл.движ.(J –диффузионн.поток в-ва)]
dm 1
J(x)
dt S
dmB
dC B
D S A
dt
dx
J(x, y, z) D grad С закон Фика
D = f(T) – коэффициент диффузии
Газы - D~10-5 м2/с D ~ √ T 3
Жидк. - 10-9 D=D0 exp(- E ak/RT)
Тв.тела - 10-14
Отношение скоростей диффузии
10 (6-19) : 10 (4-5) : 1
газы : жидк. : тв.т.
20. 5.10 Катализ
- процесс увеличения скорости химической реакции при5.10 Катализ постоянной температуре под действием дополнительных
веществ – катализаторов, не расходующихся при
протекании реакции и не входящих в состав конечных
продуктов
Ингибиторы
- замедляют,
Различают:
Ферменты
Гомогенный катализ – реагенты и катализатор в одной фазе (энзимы) –
Гетерогенный катализ
катализаторы
Е
в биохимич.
А + В АВ медленно Е ак1
реакциях
Еак1
А + К АК
АК + В АВ +К
быстро
Еак1> Еак2; Еак3
Еак2
Еак3
Суть катализа - выигрыш энергии
(снижение Еак ), изменение пути
реакции
Еак3
Еак2 АК
А+В
rH
АВ
ход
реакции
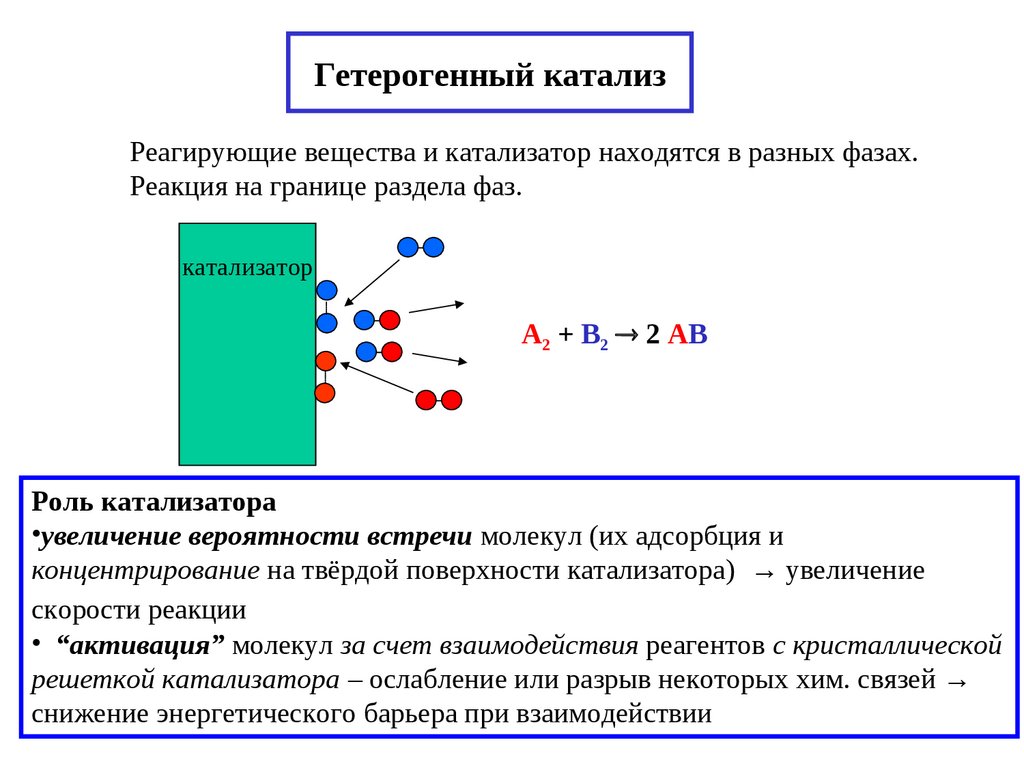
21. Гетерогенный катализ
Реагирующие вещества и катализатор находятся в разных фазах.Реакция на границе раздела фаз.
катализатор
А2 + В2 2 АВ
Роль катализатора
•увеличение вероятности встречи молекул (их адсорбция и
концентрирование на твёрдой поверхности катализатора) → увеличение
скорости реакции
• “активация” молекул за счет взаимодействия реагентов с кристаллической
решеткой катализатора – ослабление или разрыв некоторых хим. связей →
снижение энергетического барьера при взаимодействии
22. 5.11 Горение и взрыв (режимы взрывчатых превращений)
Исходныевещества
Р1,Т1
v
Продукты
реакции
Р2,Т2
Область
химической реакции
Р3,Т3
Реакции:
•экзотермические Н 0
•высокая скорость
•газообразование
•самоускорение
•различная Т и хим.состав в
разл.частях системы
•Горение (лин.скорость области хим.реакции) v 10-3-102 м с; повышение
Т медленное (разогрев исходных веществ за счет теплопередачи, диффузии )
•Взрыв v 103-104 м с; образуется ударная(сжатия) волна → быстрый
разогрев и самоускорение [vmax - детонация(макс.скорость ударной волны
равна скорости звука в веществе)]
23. Тепловой взрыв (инициирование) экзотермич. реакции в замкнутой системе по Н.Н.Семёнову [ Q+ и Q - = f(Т) ]
Тепловой взрыв (инициирование) экзотермич. реакциив замкнутой системе по Н.Н.Семёнову [f(k), ≠f(C Q+ и Q - = f(Т) ]
Q ~ v r H еплоприход
v ~ const e
E ак
R T
Q ~ const e
E ак
R T
Q+ - теплоприход (скорость
Q
прихода тепла за счет экзотерм.
реакции) - экспонента от Т
Q+
Q–
Q– ~ S (T–T0) теплоотвод
(скорость отвода тепла) –
линейная зависимость от Т (Т0 –
пост.)
α- коэфф.теплопередачи
Т0 Т
г
Тв
Т
S- площадь
Т- температ.системы
Т0-температ.окруж.среды












![Тепловой взрыв (инициирование) экзотермич. реакции в замкнутой системе по Н.Н.Семёнову [ Q+ и Q - = f(Т) ] Тепловой взрыв (инициирование) экзотермич. реакции в замкнутой системе по Н.Н.Семёнову [ Q+ и Q - = f(Т) ]](https://cf3.ppt-online.org/files3/slide/i/iwAIZBr8jEscaTqbQkgGWOeM3SF9nNHx7d0fCl/slide-22.jpg)
 chemistry
chemistry








