Similar presentations:
Теория электролитической диссоциации
1. Теория электролитической диссоциации
преподаватель химии ГОБУ СПО ВО«Воронежский авиационный техникум им
В.П.Чкалова»:
Кузнецова Е.В.
2.
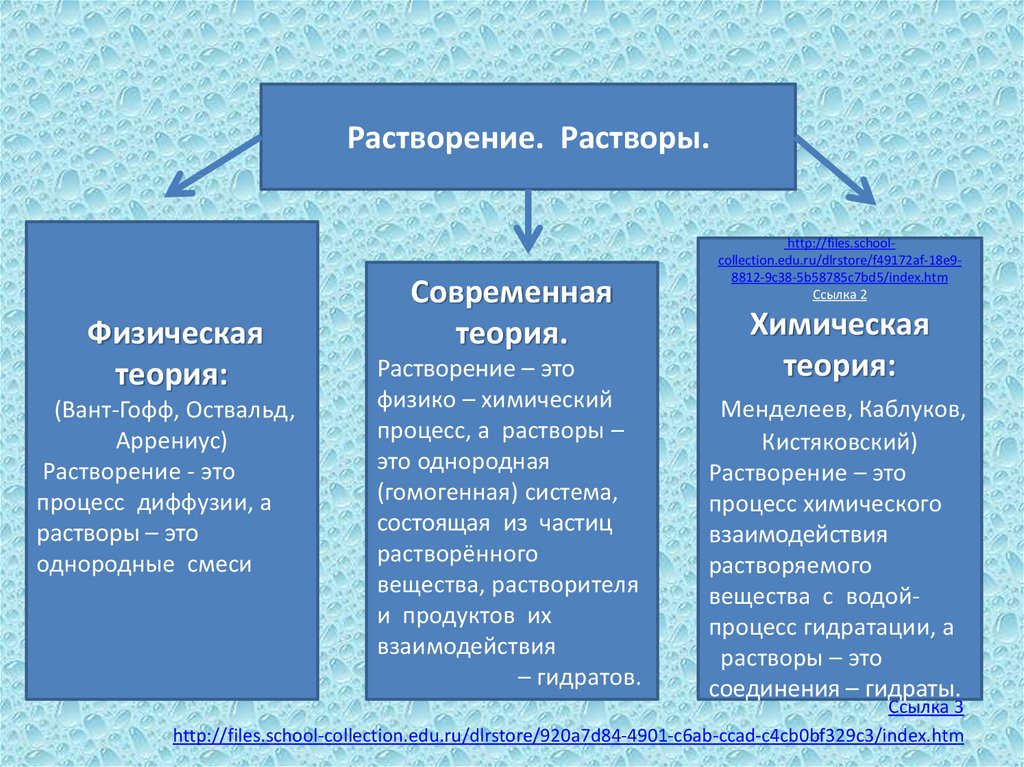
Растворение. Растворы.Физическая
теория:
(Вант-Гофф, Оствальд,
Аррениус)
Растворение - это
процесс диффузии, а
растворы – это
однородные смеси
Современная
теория.
Растворение – это
физико – химический
процесс, а растворы –
это однородная
(гомогенная) система,
состоящая из частиц
растворённого
вещества, растворителя
и продуктов их
взаимодействия
– гидратов.
http://files.schoolcollection.edu.ru/dlrstore/f49172af-18e98812-9c38-5b58785c7bd5/index.htm
Ссылка 2
Химическая
теория:
Менделеев, Каблуков,
Кистяковский)
Растворение – это
процесс химического
взаимодействия
растворяемого
вещества с водойпроцесс гидратации, а
растворы – это
соединения – гидраты.
Ссылка 3
http://files.school-collection.edu.ru/dlrstore/920a7d84-4901-c6ab-ccad-c4cb0bf329c3/index.htm
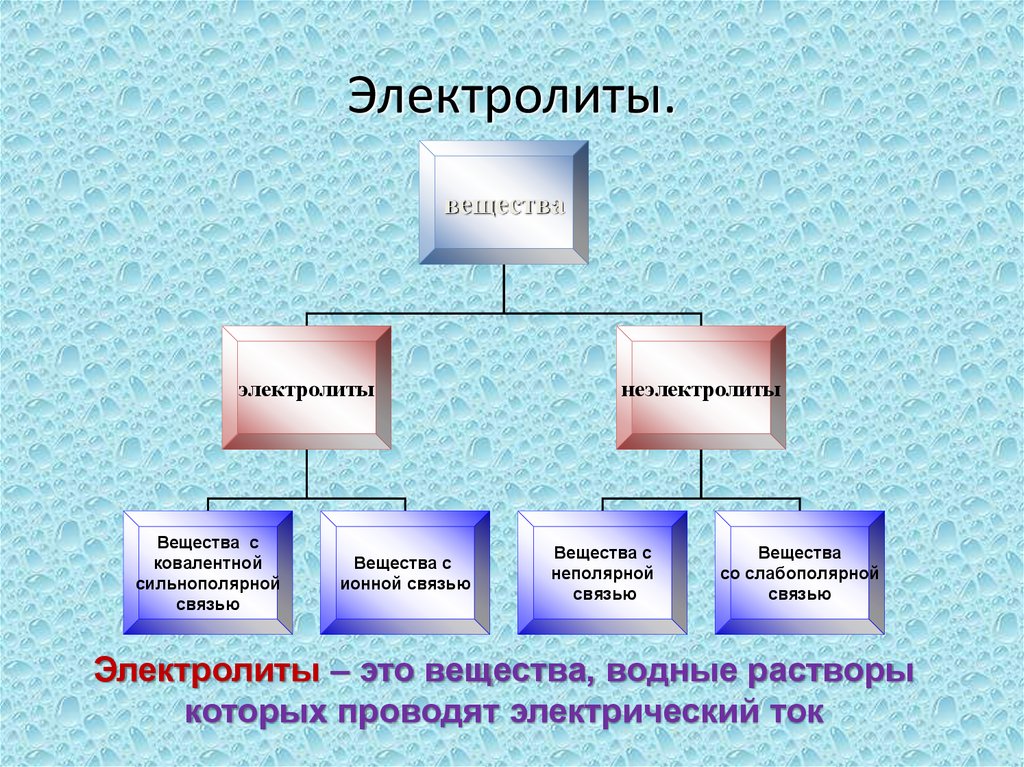
3. Электролиты.
веществаэлектролиты
Вещества с
ковалентной
сильнополярной
связью
Вещества с
ионной связью
неэлектролиты
Вещества с
неполярной
связью
Вещества
со слабополярной
связью
Электролиты – это вещества, водные растворы
которых проводят электрический ток
4. Основоположники ТЭД
Шведский ученый,физико-химик.
Автор теории
электролитической
диссоциации (1887 г.)
В 1903 г. награжден
Нобелевской премией.
Сванте Аррениус (1859-1927)
http://ru.wikipedia.org/wiki/%C0%F0%F0%E5%ED%E8%F3%F1,_%D1%E2%E0%ED%F2%E5_%C0%E2%E3%F3%F1%F2
Ссылка 5
5. Основоположники ТЭД
Русский ученый, академик.Ввел в 1889 – 1891 гг.
представление о гидратации
ионов. Положил начало
физической и химической
теории растворов.
Выдающийся педагог и
популяризатор науки.
Иван Алексеевич Каблуков
1857-1942 гг.
•http://ru.wikipedia.org/wiki/%CA%E0%E1%EB%F3%EA%EE%E2,_%C8%E2%E0%ED_%C0%EB%E5%EA%F1%E5%E5%E2%E8%F7
•Ссылка 6
6. Основоположники ТЭД
Русский ученый,физикохимик, академик .
В 1888 г. Высказал идею
об объединении
химической теории
растворов
Д.И.Менделеева с
учением С. Аррениуса об
электролитической
диссоциации
Кистяковский Владимир
Александрович
1865-1952 гг.
http://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D1%82%D1%8F%D0%BA%D0%BE%D0%B2%D1%81%D0%BA%D0%B8%D0
%B9,_%D0%92%D0%BB%D0%B0%D0%B4%D0%B8%D0%BC%D0%B8%D1%80_%D0%90%D0%BB%D0%B5%D0%BA%D1%81%D0
%B0%D0%BD%D0%B4%D1%80%D0%BE%D0%B2%D0%B8%D1%87 ссылка 7
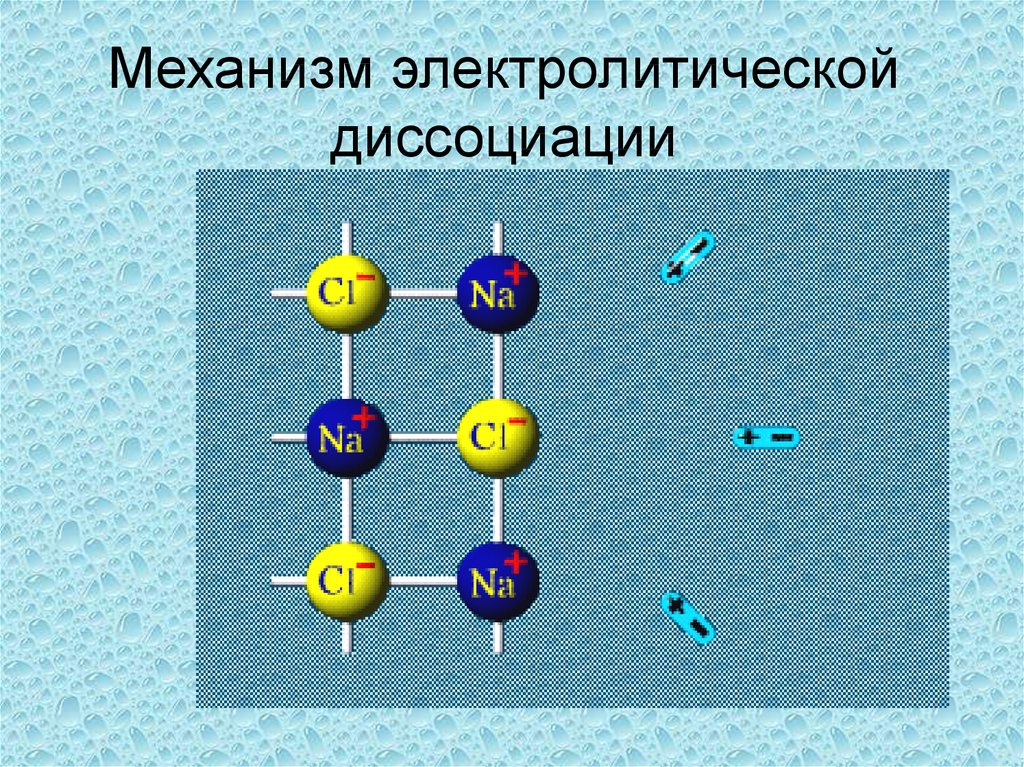
7. Электролитическая диссоциация
Распад электролита на ионы прирастворении или
расплавлении, называется
электролитической
диссоциацией.
Как происходит этот процесс?
8.
Механизм электролитическойдиссоциации
9.
запишите следующие незаконченные предложения втетрадь, закончите их.
1.Причиной тока в растворах являются….
Ионы
2.Молекула воды имеет особое строение и является….
диполем
3.Процесс взаимодействия воды с частицами вещества
называется …..
гидратацией
4.Лучше всего диссоциируют вещества с …. типом связи
ионным
5.Процесс распада электролита на ионы называется….
Электролитической диссоциацией
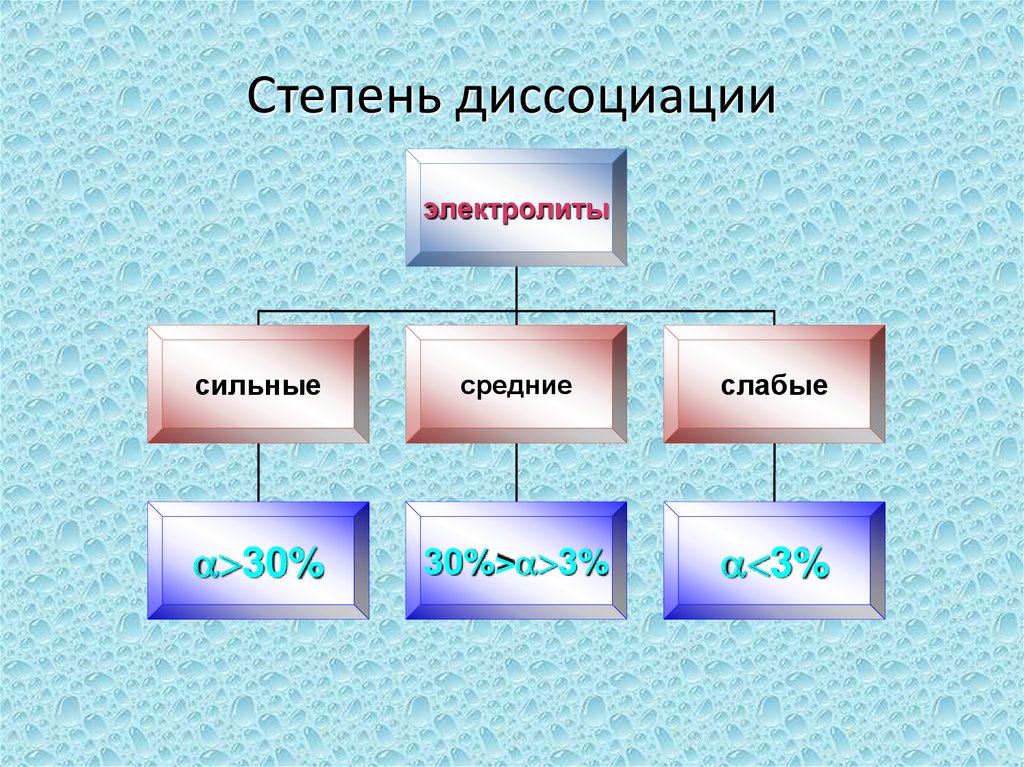
10. Степень диссоциации -
это отношение числа частиц,распавшихся на ионы (n), к общему
числу растворённых частиц (N).
11. Степень диссоциации
электролитысильные
средние
слабые
30%
30%> 3%
3%
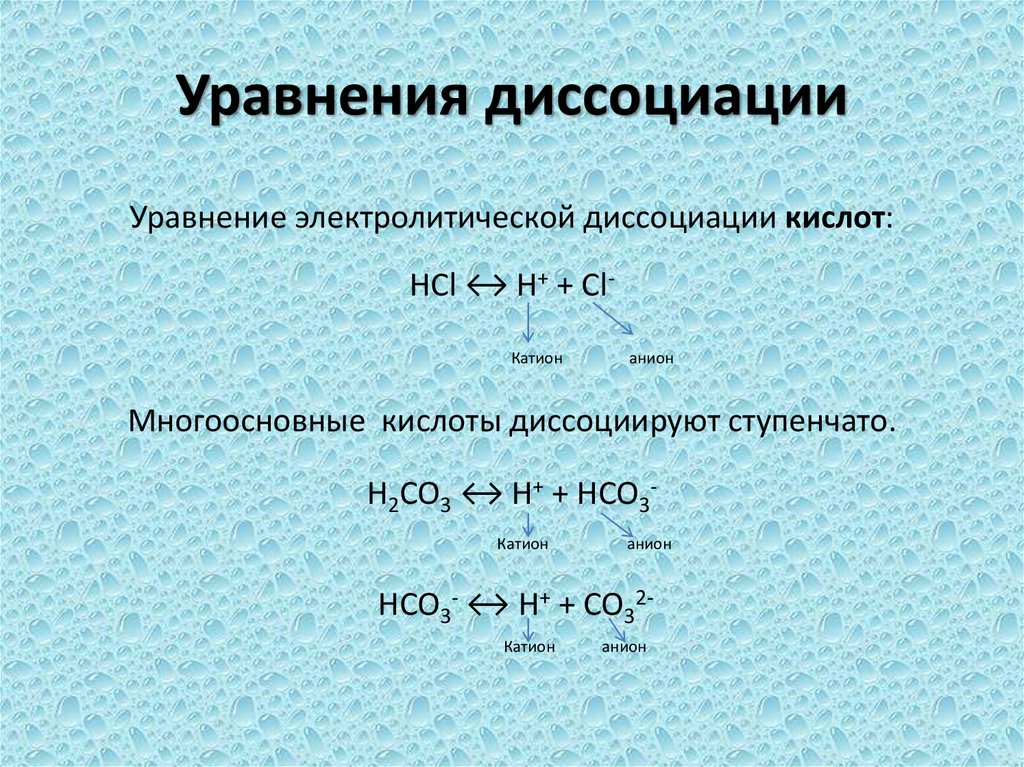
12. Уравнения диссоциации
Уравнение электролитической диссоциации кислот:HCl ↔ H+ + ClКатион
анион
Многоосновные кислоты диссоциируют ступенчато.
H2CO3 ↔ H+ + HCO3Катион
анион
HCO3- ↔ H+ + CO32Катион
анион
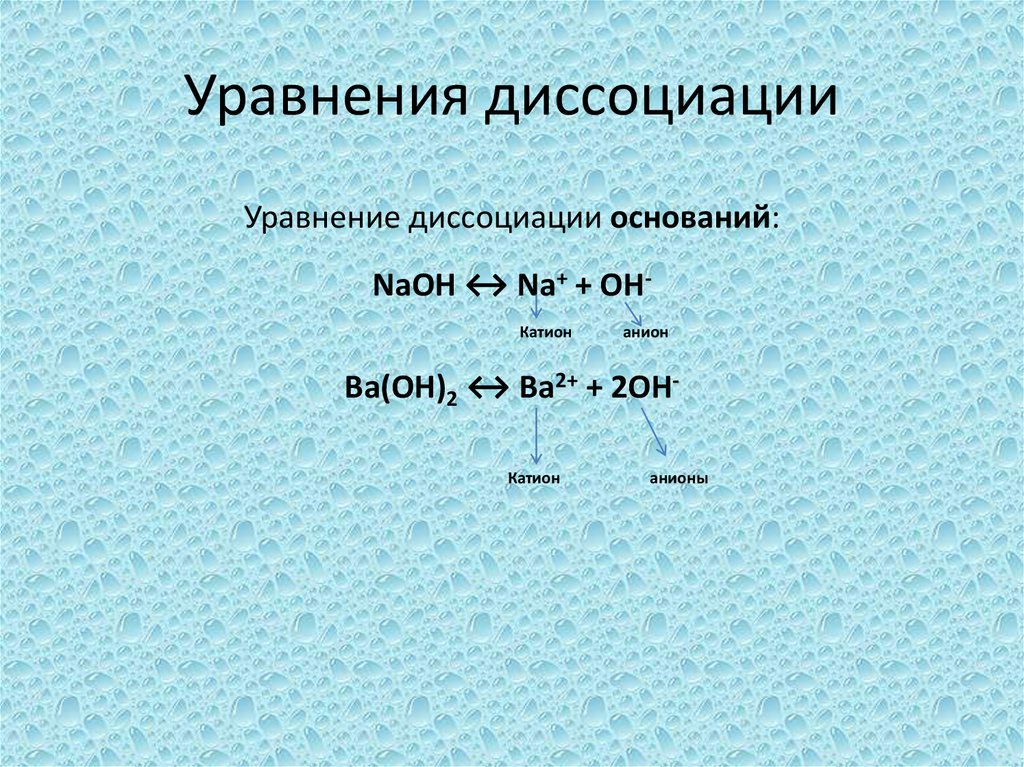
13. Уравнения диссоциации
Уравнение диссоциации оснований:NaOH ↔ Na+ + OHКатион
анион
Ba(OH)2 ↔ Ba2+ + 2OHКатион
анионы
14. Уравнения диссоциации
Соли:K2CO3 ↔ 2K+ + CO32Катионы
анион
Al2(SO4)3 ↔ 2Al3+ + 3SO42
Катионы
анионы
Катионы - положительно заряженные ионы
Анионы – отрицательно заряженные ионы.
15. вывод.
1. Кислоты – электролиты, которые придиссоциации образуют только один вид катионов
– катионы водорода Н+. Многоосновные кислоты
диссоциируют ступенчато.
2. Основания - электролиты, которые при
диссоциации образуют только один вид анионов
- гидроксид-ионы ОН.
3. Соли – сильные электролиты, образующие при
диссоциации катионы металла и анионы
кислотного остатка.
16. Домашнее задание
краткий конспект презентации5-7 реакций диссоциации веществ различных
классов










 chemistry
chemistry








