Similar presentations:
Фазовые превращения в однокомпонентных системах
1.
Фазовые превращенияв однокомпонентных системах
Фазовый переход (превращение) – процесс
равновесного превращения вещества из одной
термодинамической фазы в другую
В соответствии с правилом фаз Гиббса для
однокомпонентной системы:
s = k – f + 2;
при
k = 1;
s=0
f=3
s=3–f
2.
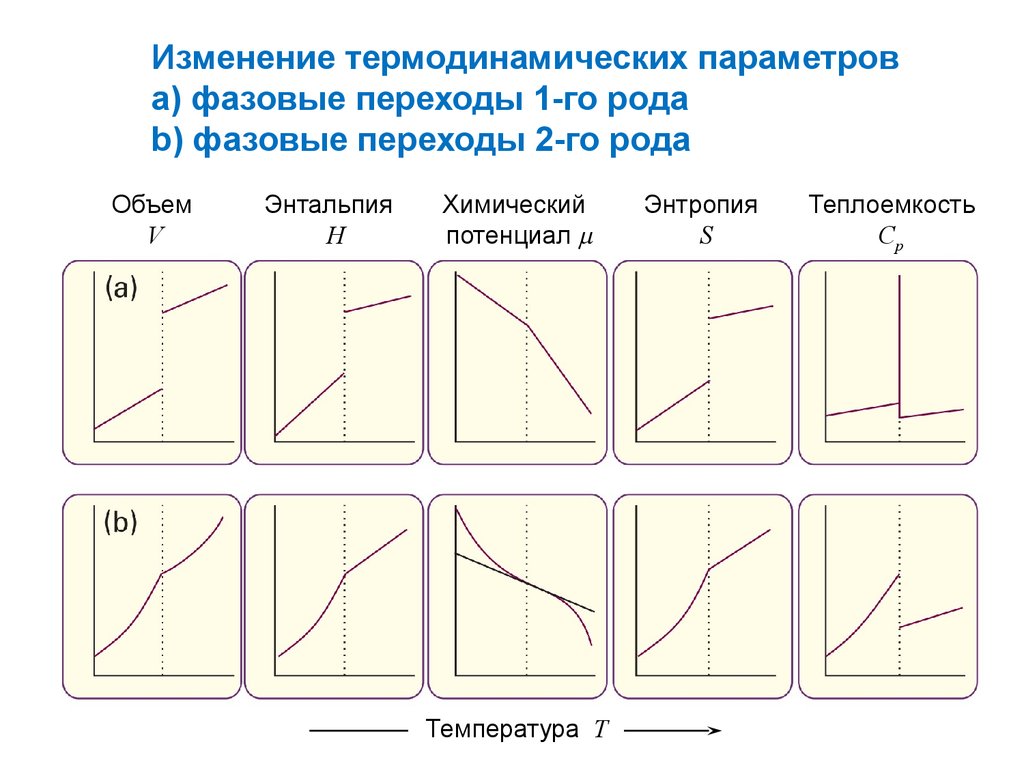
Изменение термодинамических параметрова) фазовые переходы 1-го рода
b) фазовые переходы 2-го рода
Объем
V
Энтальпия
H
Химический
потенциал
Температура Т
Энтропия
S
Теплоемкость
Cp
3.
Фазовые переходы I рода сопровождаютсяизменением агрегатного состояния: плавление,
кристаллизация, испарение, конденсация,
сублимация, десублимация
При фазовых переходах II рода не происходит
изменения агрегатного состояния:
-Fe (тв.)
-Fe (тв) при 1043 К (769 С)
ферромагнетик парамагнетик
He II (жидк.) He I (жидк.)
сверхтекучий
обычный
при 2,17 К
4.
dU = ТdS – рdV; T,p = constU2 – U1 = Т(S2 – S1) – р(V2 – V1)
U2 – TS2 + pV2 = U1 – TS1 + pV1
G2 = G1
dG1 = –S1dT + V1dp
dG2 = –S2dT + V2dp
G2 + dG2 = G1 + dG1,
dG2 = dG1
(V2 – V1) dp = (S2 – S1) dT ;
S = S2 – S1 =
H ф.п.
dp
dT T (V2 V1 )
dp S2 S1
dT V2 V1
Q H ф.п.
T
T
уравнение
Клаузиуса – Клапейрона
5.
Плавлениеdp
H пл.
dT T (Vж Vтв )
если принять, что Нпл и Vпл – const, то
p2 = p1 + ( Нпл/ Vпл)ln(T2/T1) ;
Нпл > 0;
Vж > Vтв;
dp/dT > 0
Vж < Vтв;
dp/dT < 0
6.
жидкая водалед
7.
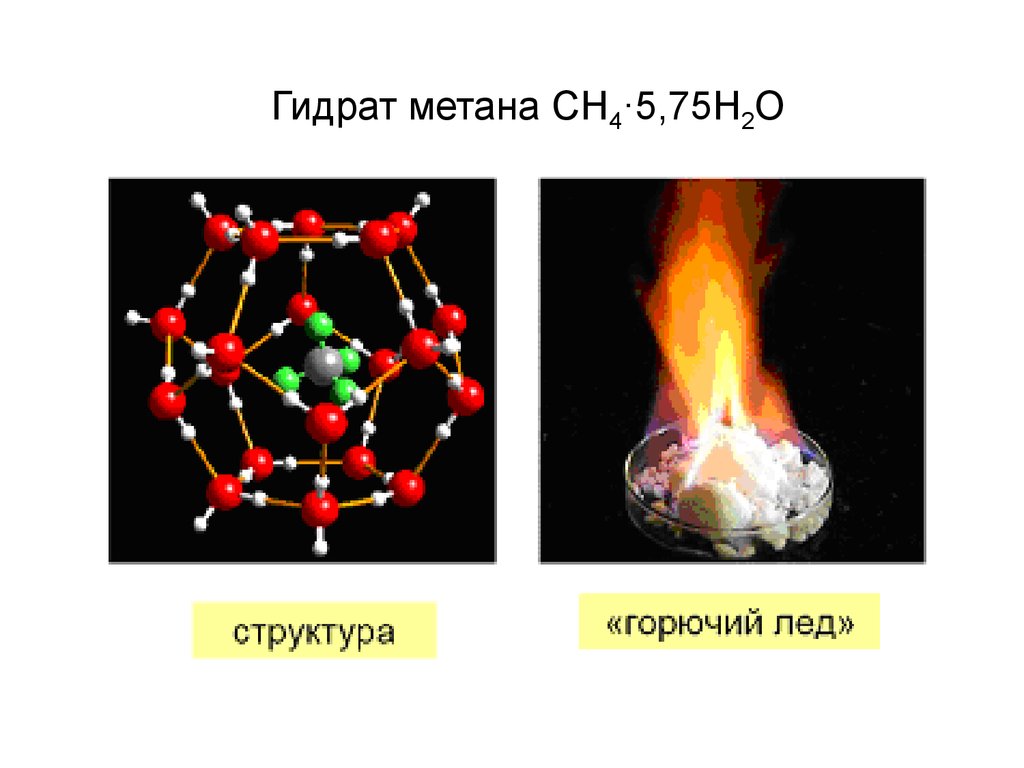
Гидрат метана СН4·5,75Н2О8.
9.
dpH исп.
dT T (Vгаз Vж )
Испарение
(Сублимация)
Vгаз .Vж;
V = RT/p; ∆Нисп ;
dp
p
dT RT 2
d ln p
dT
2
RT
dp
dT
2
p RT
lnp
tg = – /R
приняв, что – const
ln p
const
RT
1/T
10.
d ln pdT
2
RT
p2 1 1
ln
p1 R T1 T2
1 1
p2 p1 exp
R T1 T2
если известна зависимость pисп - T исп, то
f (T ) RT 2
d ln p
dT
11.
12.
Правило ТрутонаМолярная энтропия испарения разных веществ при
нормальной температуре кипения является постоянной
величиной и равняется константе Трутона
S vap
H vap
KTrouton
Tvap
KTrouton 87 88 кДж/ моль K
Правило Гильдебранда
Молярная энтропия испарения разных веществ является
постоянной величиной при температурах, при которых
молярные объемы насыщеного пара одинаковы
Svap = 87 88 кДж/(моль К) при Vm = 49,5 л/моль
13.
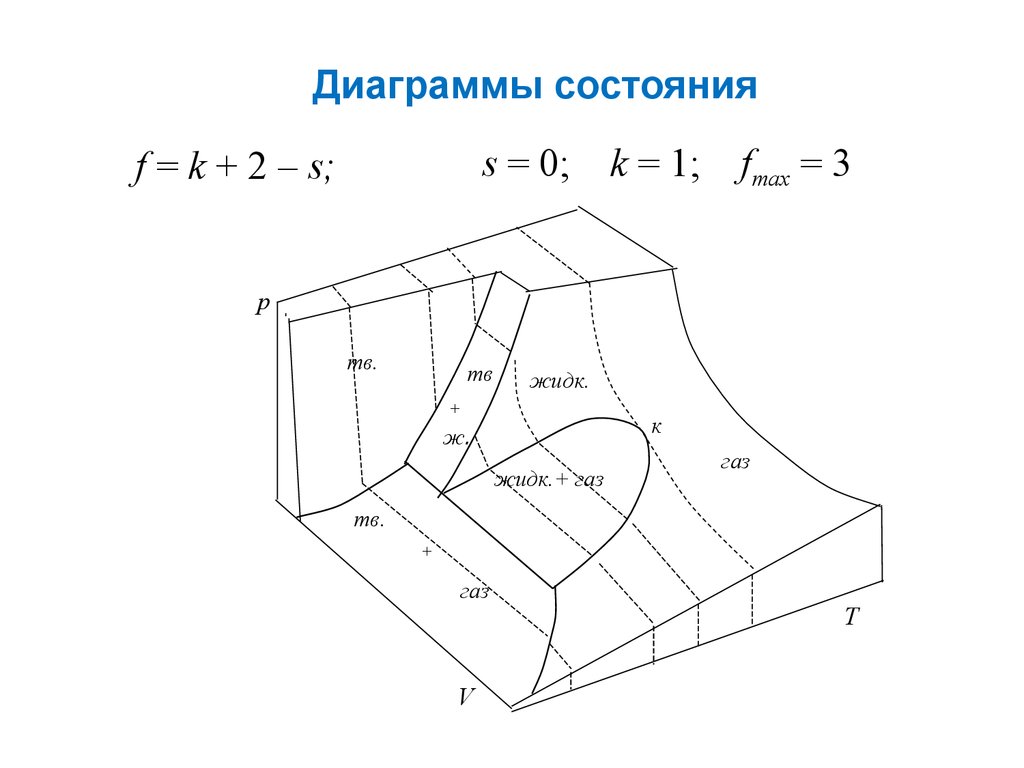
Диаграммы состоянияs = 0; k = 1; fmax = 3
f = k + 2 – s;
p
тв.
тв
жидк.
+
к
ж.
жидк.+ газ
газ
тв.
+
газ
V
T
14.
ртв.
жидк.
к
+ж.
тв.
газ
жидк.+ газ
a
р
жидк.
тв.+ газ
тв.
V
к
Т
тв.
жидк.
тв.
жидк.+ газ
+ж.
О
b
газ
тв.+ газ
V
к
газ
Т
15.
16.
Диаграммы состояния водыdp
H пл
6010
7 Па
1
.
1
10
dT T (Vж Vтв ) 273 ( 2 10 6 )
К
17.
Лед VII «горячий лед»Р 10 ГПа Т=630 К Плотность 1,59 г/см3, Vm 11,3 см3/моль
18.
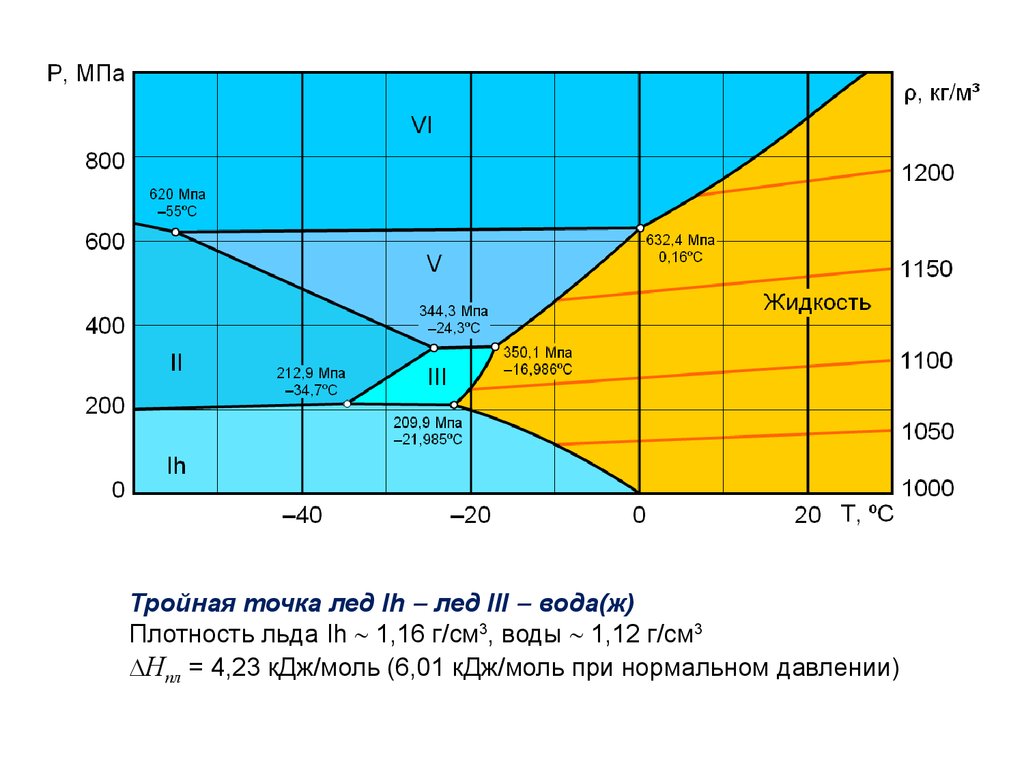
Тройная точка лед Ih лед III вода(ж)Плотность льда Ih 1,16 г/см3, воды 1,12 г/см3
Hпл = 4,23 кДж/моль (6,01 кДж/моль при нормальном давлении)
19.
20.
21.
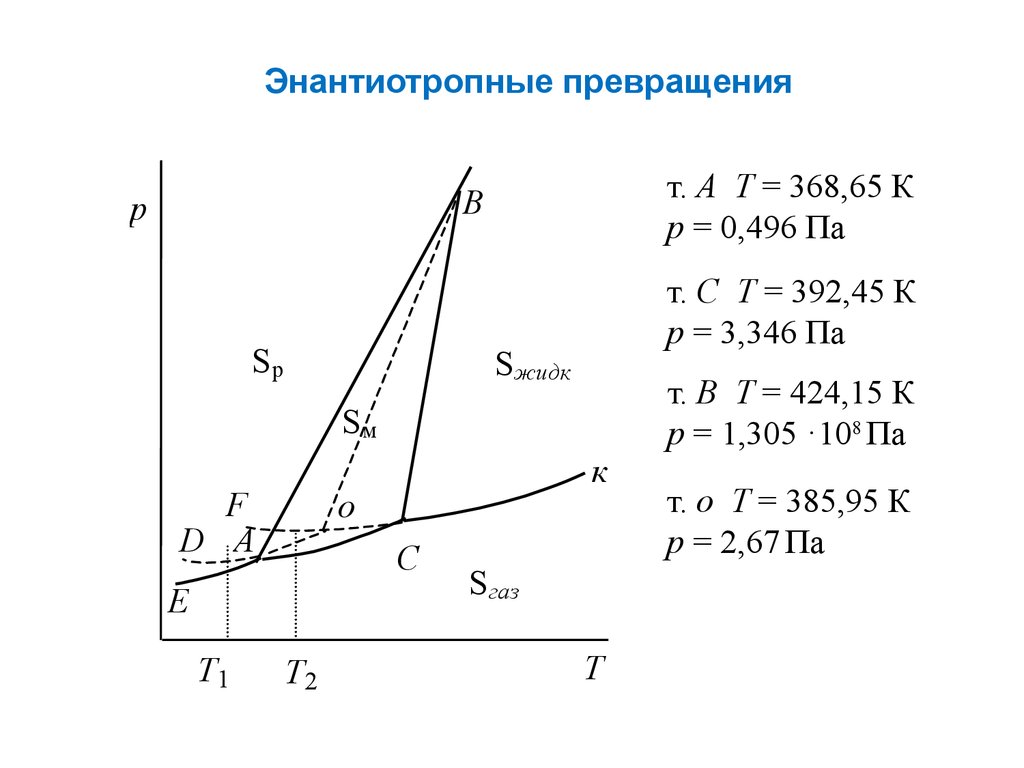
Энантиотропные превращеният. А Т = 368,65 К
р = 0,496 Па
B
p
Sp
т. С Т = 392,45 К
р = 3,346 Па
Sжидк
Sм
F
D A
o
C
E
T1
к
T2
Sгаз
T
т. В Т = 424,15 К
р = 1,305 ·108 Па
т. о Т = 385,95 К
р = 2,67 Па
22.
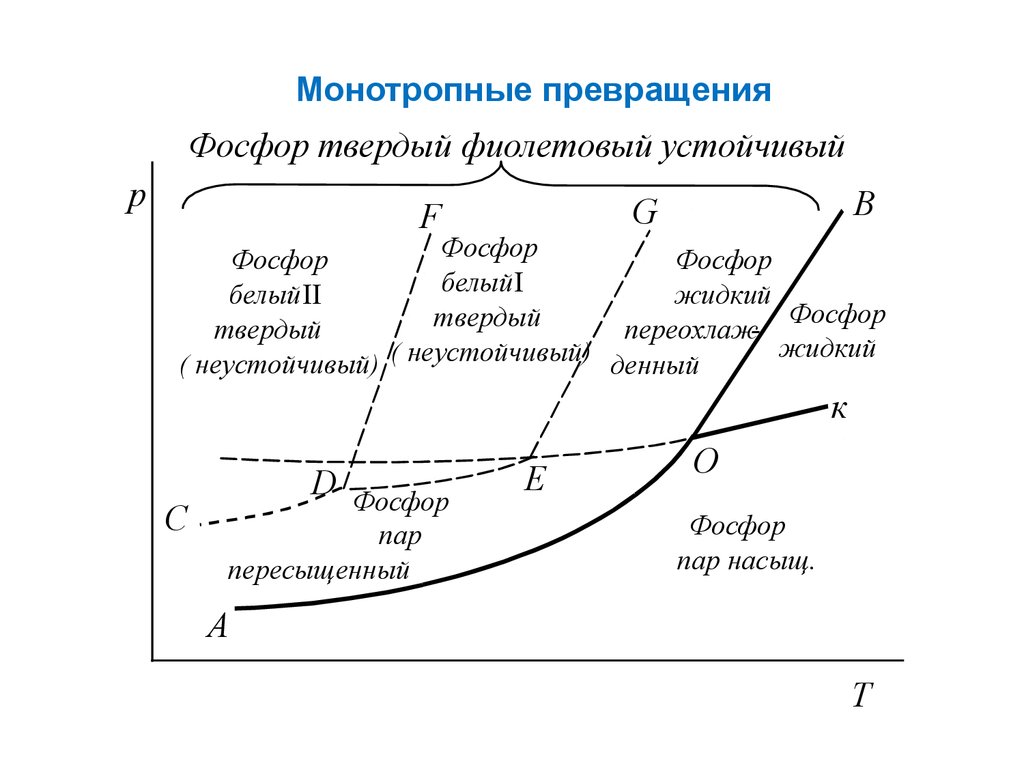
Монотропные превращенияФосфор твердый фиолетовый устойчивый
p
B
G
F
Фосфор
Фосфор
Фосфор
белый І
белый ІІ
жидкий
Фосфор
твердый
твердый
переохлажжидкий
( неустойчивый) ( неустойчивый) денный
к
C
D
Фосфор
пар
пересыщенный
E
О
Фосфор
пар насыщ.
A
T
















 mathematics
mathematics chemistry
chemistry








