Similar presentations:
Уравнения диссоциации
1. УРАВНЕНИЯ ДИССОЦИАЦИИ
+- -
+
+
-
+
+
2. КИСЛОТЫ
+→
+
HCl
Cl
+
H NO3 →
_
_
+
3. 1. КИСЛОТЫ – ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ИОНОВ ВОДОРОДА И КИСЛОТНОГО ОСТАТКА.
2. КИСЛОТЫ – ЭТОЭЛЕКТРОЛИТЫ, КОТОРЫЕ
ДИССОЦИИРУЮТ НА КАТИОНЫ
ВОДОРОДА И АНИОНЫ
КИСЛОТНОГО ОСТАТКА.
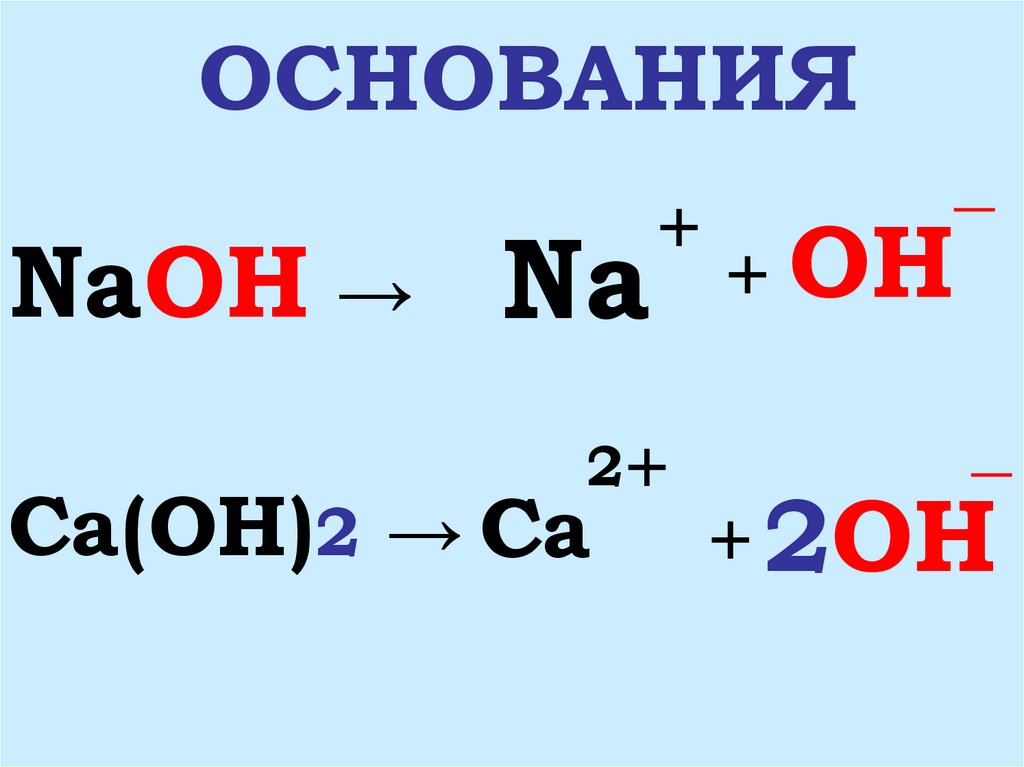
4. ОСНОВАНИЯ
NaOH → Na+
2+
Ca(OH)2 → Ca
+ OH
_
_
+ 2OH
5. 1. ОСНОВАНИЯ- ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ИОНОВ МЕТАЛЛА И ГИДРОКСИД-ИОНОВ OH
1. ОСНОВАНИЯ- ЭТО СЛОЖНЫЕВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ
ИОНОВ МЕТАЛЛА
И ГИДРОКСИД_
ИОНОВ OH
2. ОСНОВАНИЯ- ЭТО
ЭЛЕКТРОЛИТЫ, КОТОРЫЕ
ДИССОЦИИРУЮТ НА КАТИОНЫ
МЕТАЛЛА И АНИОНЫ_
ГИДРОКСОГРУПП OH
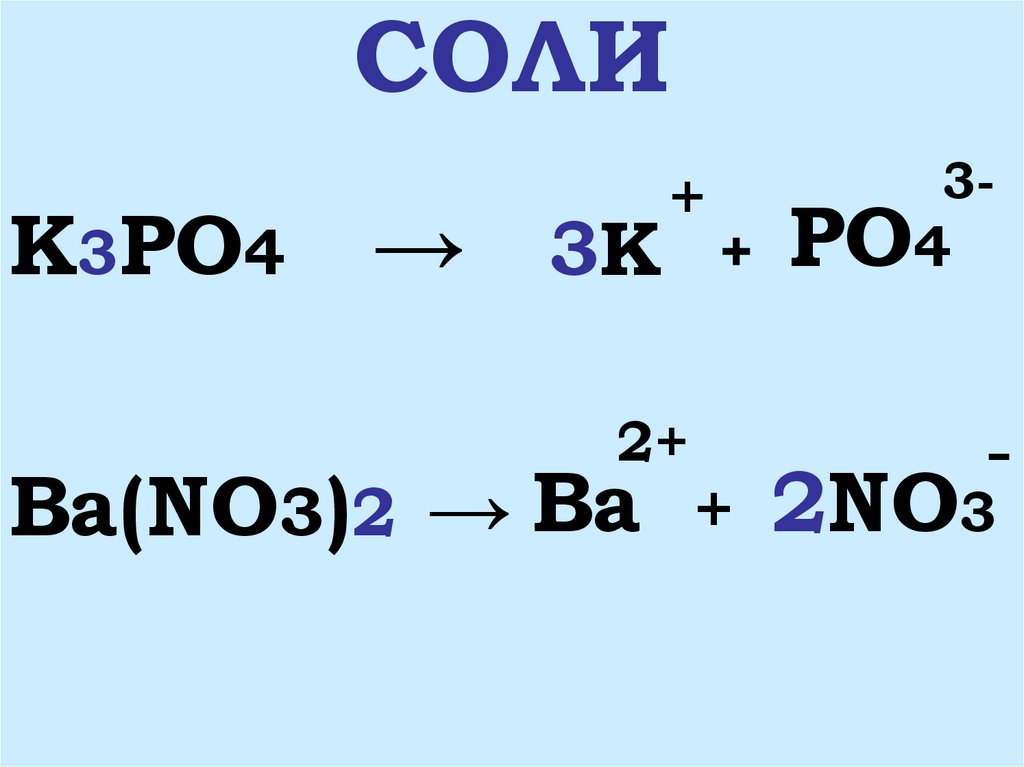
6. СОЛИ
K3PO4→ 3K
+
2+
Ba(NO3)2 → Ba
3-
+
+
PO4
-
2NO3
7. 1. Соли – это сложные вещества, состоящие из ионов металла и ионов кислотного остатка
2. Соли – это электролиты,которые диссоциируют на
катионы металла и анионы
кислотных остатков
8. Реакции ионного обмена
РР
Р
NаОН + НNО3 → NаNО3 + Н2О
Nа+ + ОН─ + Н+ + NО3─ → Nа+ + NО3─ + Н2О
ОН─ + Н+ → Н2О
1.
2.
3.
4.
5.
Определить растворимость веществ, подчеркнуть их;
Под чертой написать уравнение их диссоциации (учитывая
коэффициенты!!!). Ионы записывать с зарядами!!!!!
Вещества – не электролиты или слабые электролиты пишутся в
молекулярном виде
Находим ионы, оставшиеся СВОБОДНЫМИ , сокращаем их;
Записывает оставшиеся ионы в левой и правой части уравнения. Это
смысл данной реакции. Это ионы, которые НЕ могут находиться в
растворе одновременно!
9. Реакции обмена
Реакцииионного обмена
Реакции, в которых
электролиты меняются
ионами.
Реакции между ионами
Условия протекания реакций ионного обмена до конца
• Выпадение осадка (↓)
• Выделение газа (↑)
• Образование воды (Н2О)
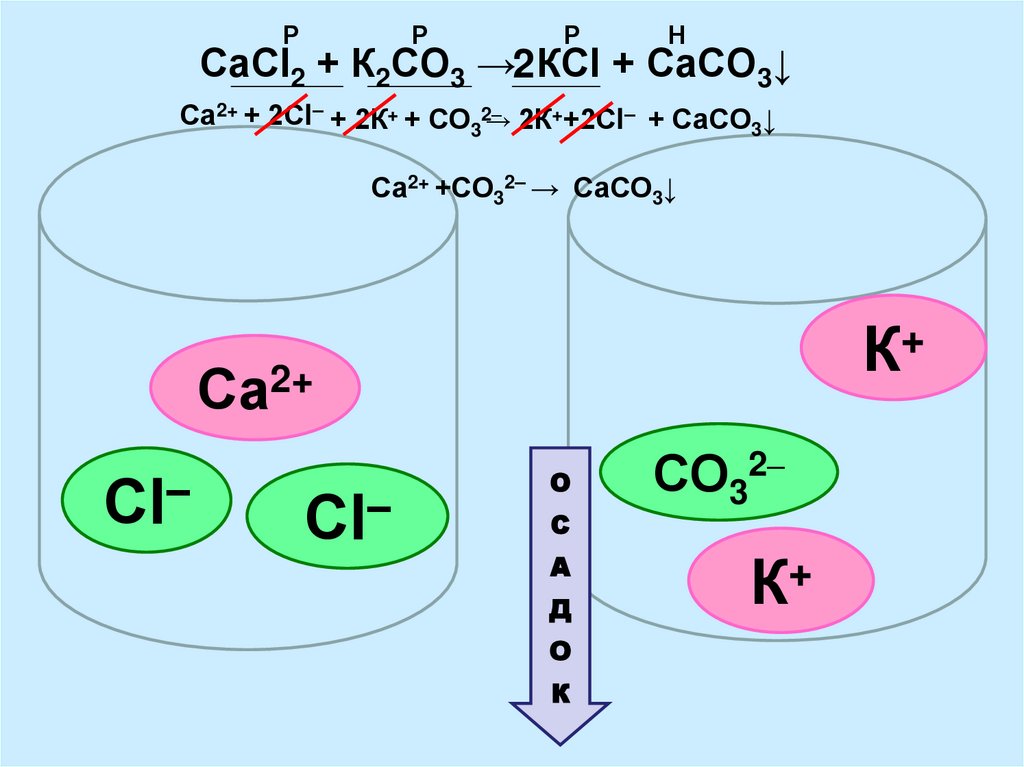
10. СаСl2 + К2СО3 → КСl + СаСО3↓
РР
Р
Н
СаСl2 + К2СО3 →2 КСl + СаСО3↓
Са2+ + 2Сl– + 2К+ + СО32–
→ 2К++2Сl– + СаСО3↓
Са2+ +СО32– → СаСО3↓
+
К
Са2+
–
Сl
Сl–
О
С
А
Д
О
К
СО32–
+
К
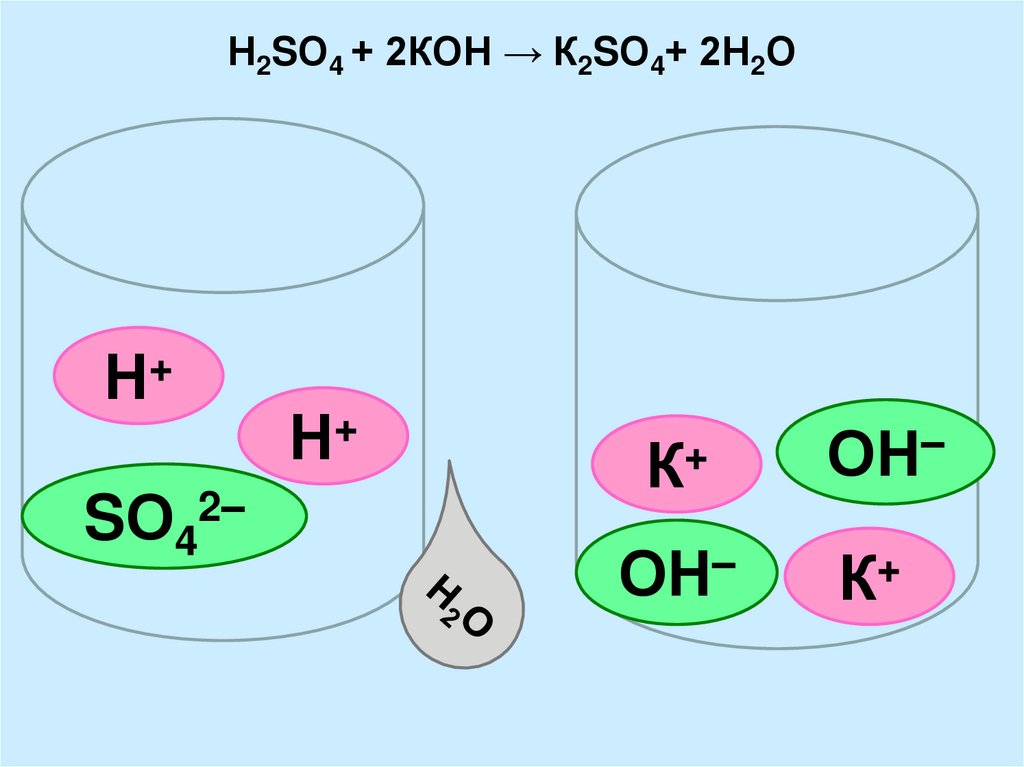
11. Н2SО4 + 2КОН → К2SО4+ 2Н2О
+Н
SО42–
Н+
К+
ОН–
ОН–
К+







 chemistry
chemistry








