Similar presentations:
Теория электролитической диссоциации
1.
2. Электролиты – вещества, водные растворы или расплавы которых проводят электрический ток
АнодКатод
- -
+
+ +
+
+
+
Раствор NaCl
+
-
3.
• Кислоты:HCl, H2SO4
• Основания:
NaOH,
Ba(OH)2
• Соли:
NaCl, CuSO4
• Органические
вещества
• Газы:
O2, H2, CO2
• Оксиды:
CuO, Fe2O3
4. Из предложенных веществ выпишите электролиты
HClNaCl
Cl2
KOH
H2SO4
SO2
5. Сванте Август Аррениус 1859 – 1927 гг. Шведский физикохимик, создатель теории электролитической диссоциации
6. Молекулы воды - диполи
Электролитическая диссоциация –распад электролита на ионы при
растворении в воде или расплавлении
δ-
О
δ+
109º28
Н
Н
+
δ+
-
Молекулы воды - диполи
7. Механизм электролитической диссоциации веществ с ионной связью 1 – ориентация и гидратация
+Na+
Cl-
Cl-
Na+
Кристалл NaCl
-
-
+
8. Механизм электролитической диссоциации веществ с ионной связью 2 - диссоциация
Na+Cl-
Cl-
Na+ -
Гидратированные
ионы
+
9. Механизм диссоциация веществ с ковалентной полярной связью 1 – ориентация и гидратация
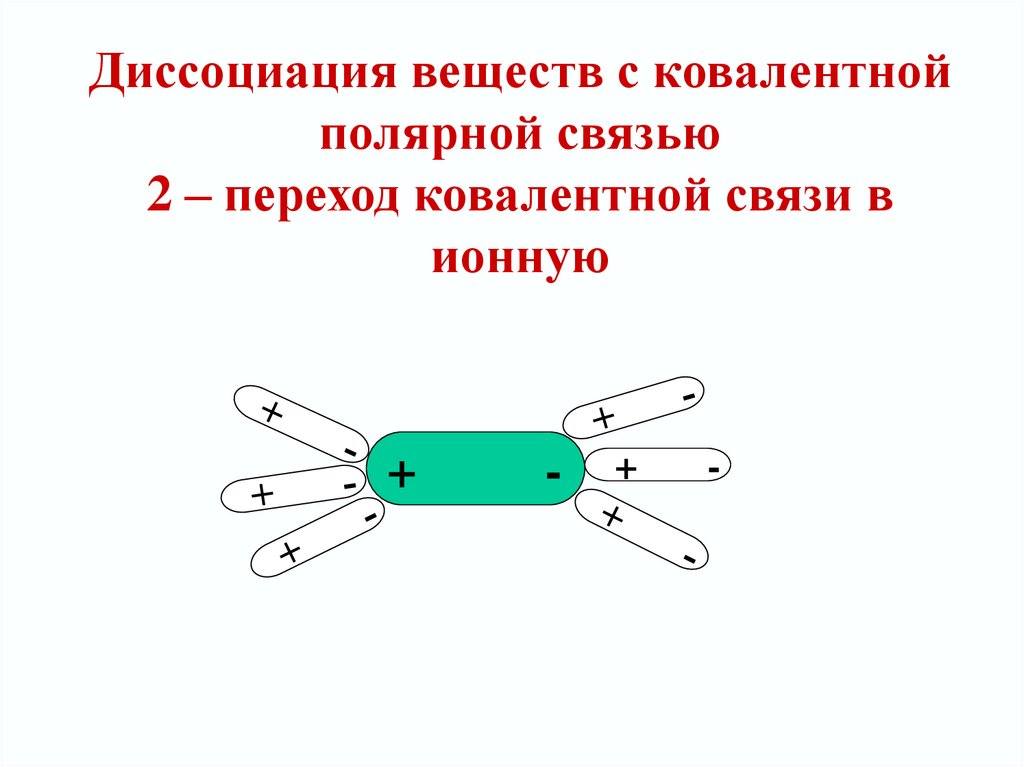
HCl10. Диссоциация веществ с ковалентной полярной связью 2 – переход ковалентной связи в ионную
+-
+
-
11. Механизм диссоциация веществ с ковалентной полярной связью 3 - диссоциация
H+ Cl-+
Гидратированные
ионы
-
12. Степень электролитической диссоциации α
Количественная характеристика процессадиссоциации
α=
n
N
n – число диссоциированных
молекул
N- общее число молекул,
введенных в раствор
13. Электролиты
Сильныеα>30%
Все соли
NaOH, KOH,
Ca(OH)2,
Ba(OH)2, HCl,
H2SO4, HNO3
Средние
30%>α>3%
Слабые
α<3%
Mg(OH)2,
H2SO3, HNO2,
H3PO4
NH3·H2O,
Al(OH)3,
Fe(OH)3,H2CO3,
H2SiO3, H2S,
H2O,
CH3COOH
14. Самостоятельная работа
• Задание: Назовите частицы ирассмотрите строение их электронных
оболочек.
а)Na0..................................... и
Na+………………….
15. Кислоты – электролиты, диссоциирующие в водном растворе на катионы водорода Н+
+ + Cl→H
HСl
+
HNO3→ H +
NO3
H2SO4→ 2H+ + SO42-
16. Основания – электролиты, диссоциирующие в водном растворе на гидроксид-ионы ОН-
Основания – электролиты,диссоциирующие в водном растворе
на гидроксид-ионы ОН+ + OH→
Na
NaOH
+
KOH → K
+ OH
Ca(OH)2 → Ca2+ + 2OH-
17. Соли – электролиты, диссоциирующие в водном растворе на катионы металла и анионы кислотного остатка
+ + Cl→Na
NaСl
AlCl3
3+
→ Al + Cl
Ba(NO3)2→ Ba2+ + 2NO3-
18. Напишите уравнения диссоциации электролитов
• KNO3• Mg(NO2)2
• Ba(OH)2
• HCl
• Na2SO4
NaOH
H2SO4
Fe2(SO4)3
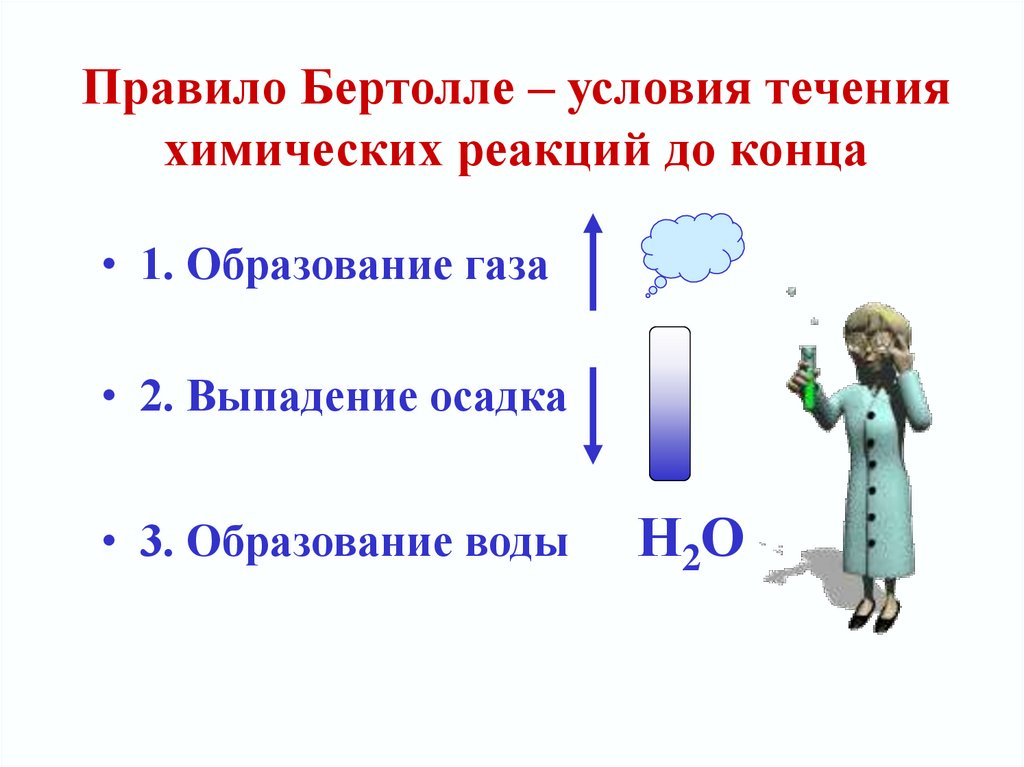
19. Правило Бертолле – условия течения химических реакций до конца
• 1. Образование газа• 2. Выпадение осадка
• 3. Образование воды
Н2О
20. Закончите уравнения реакций, протекающих до конца, составьте для них ионные уравнения:
FeCl2 + LiOH =KOH + H3PO4 =
BaCL2 + HNO3 =
Li2CO3 + НСl =


















 chemistry
chemistry








