Similar presentations:
Щелочноземельные металлы
1.
Щелочноземельные металлы2.
Открытие металлов*Магний и кальций были
впервые получены
английским химиком и
физиком Г. Дэви в 1808 г.
*Магний из белой
магнезии. По названию
минерала дали название
элементу.
*Название элемента
кальций происходит от
лат. Слова кальс, что
означает «известь, мягкий
камень».
Гемфри Дэви
(1778 – 1829)
3.
Положение в периодической таблице.Строение атома
В периодической системе находятся в главной подгруппе II
группы.
Являются сильными восстановителями, отдают 2 ē, во всех
соединениях проявляют степень окисления +2.
Mg +12 2ē, 8ē, 2ē
Ca +20 2ē, 8ē, 8 ē, 2ē
Sr +38 2ē, 8ē, 18 ē, 8ē, 2ē
Ba +56 2ē, 8ē, 18 ē, 18 ē, 8ē, 2ē
4.
Соединения щелочноземельныхметаллов
Оксиды щелочноземельных металлов легко
реагируют с оксидами неметаллов с образованием
соответствующих солей.
5.
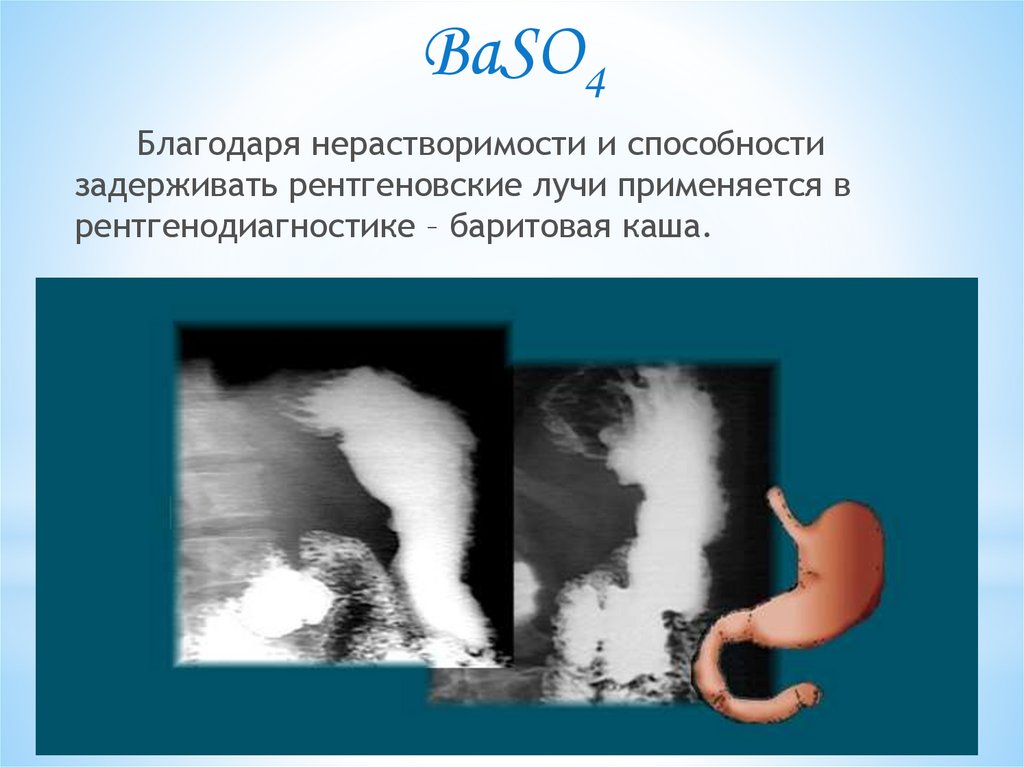
BaSO4Благодаря нерастворимости и способности
задерживать рентгеновские лучи применяется в
рентгенодиагностике – баритовая каша.
6.
Ca3(PO4)2Входит в состав фосфоритов и апатитов, а также в
состав костей и зубов. В организме взрослого человека
содержится 1 кг Са в виде фосфата кальция.
7.
CaCO3Карбонат кальция – одно из самых
распространённых на Земле соединений. Его содержат
горные породы – мел, мрамор, известняк.
8.
CaSO4∙ 2H2OВстречается в природе в виде минерала гипса,
представляющего собой кристаллогидрат. Используется
в строительстве, в медицине для наложения гипсовых
повязок, для получения слепков.
9.
MgCO3Широко применяется в производстве стекла,
цемента, кирпича, а также в металлургии для перевода
пустой породы в шлак.
10.
Са(ОН)2Гидроксид кальция или гашёная известь с песком и
водой называется известковым раствором и широко
используется в строительстве. При нагревании
разлагается на оксид и воду.
11.
Физические свойстваКальций - твердый и
пластичный
Магний - относительно
мягкий, пластичный,
ковкий
Щелочные металлы легкие,
мягкие и легкоплавкие,
серебристы, стронций имеет
золотистый оттенок.
Бериллий - светлосерый, твердый,
хрупкий
Стронций ковкий
12.
Химические свойства1. Металлы взаимодействуют
почти со всеми
неметаллами:
2Ме0 + О20 =2Ме+2О-2 (оксид)
Ме0 + Н20 = Ме+2Н2-1 (гидрид)
Ме0 + Cl20 = Mе+2Cl2-1 (хлорид)
Ме0 + S0 = Mе+2S-2 (сульфид)
3Ме0 + N20 = Mе3+2N2-3 (нитрид)
13.
Химические свойства2. Бериллий с водой не реагирует,
магний реагирует медленно,
остальные металлы реагируют с
водой, образуя щелочи и
восстанавливая воду до водорода:
Ме0 + 2Н2О = Ме+2 (ОН)2 + Н2
3. Магний реагирует с кислотами.
Ме0 + 2НCl = Ме+2 Cl2 + Н2
4. Магний и кальций реагирует с
оксидами.
2Мg0 + TiО2 = 2Мg +2О + Ti
14.
Нахождение в природеКак активные металлы, они
встречаются в природе только в виде
соединений
Кальциевые горные породы –
известняк, мрамор, мел.
Магниевая горная порода –
магнезит.
15.
Применение щелочноземельныхметаллов
• Стронций применяют при выплавке бронз и меди - он связывает серу, фосфор,
углерод и повышает текучесть шлака. Таким образом, Sr способствует очистке
металла от многочисленных примесей. Кроме того, добавка стронция повышает
механические характеристики меди (почти не снижая ее электропроводности),
чугуна, стали.
• Барий в основном находит применение в связанном состоянии. ВаSO4 хорошо
поглощает рентгеновское излучение, поэтому его используют при
рентгенодиагностике. Баритовые белила используют в качестве белой краски.
ВаСО3 входит в состав смеси для цементации стали.
• В виде чистого металла кальций применяют как восстановитель U, Th, Cr, V, Zr,
Cs, Rb, Na, K, Ti и некоторых редкоземельных металлов и их соединений. Его
используют также для раскисления сталей, бронз и других сплавов, очистки
свинца и олова от висмута и сурьмы. Также используют для удаления серы из
нефтепродуктов и обезвоживания органических жидкостей; для очистки аргона
от примесей азота и в качества поглотителя газов в электровакуумных
приборах.














 chemistry
chemistry








