Similar presentations:
Минеральные кислоты. Взаимодействие с простыми веществами
1. МИНЕРАЛЬНЫЕ КИСЛОТЫ. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ
2. активные | средней активности | малоактивные |благородные
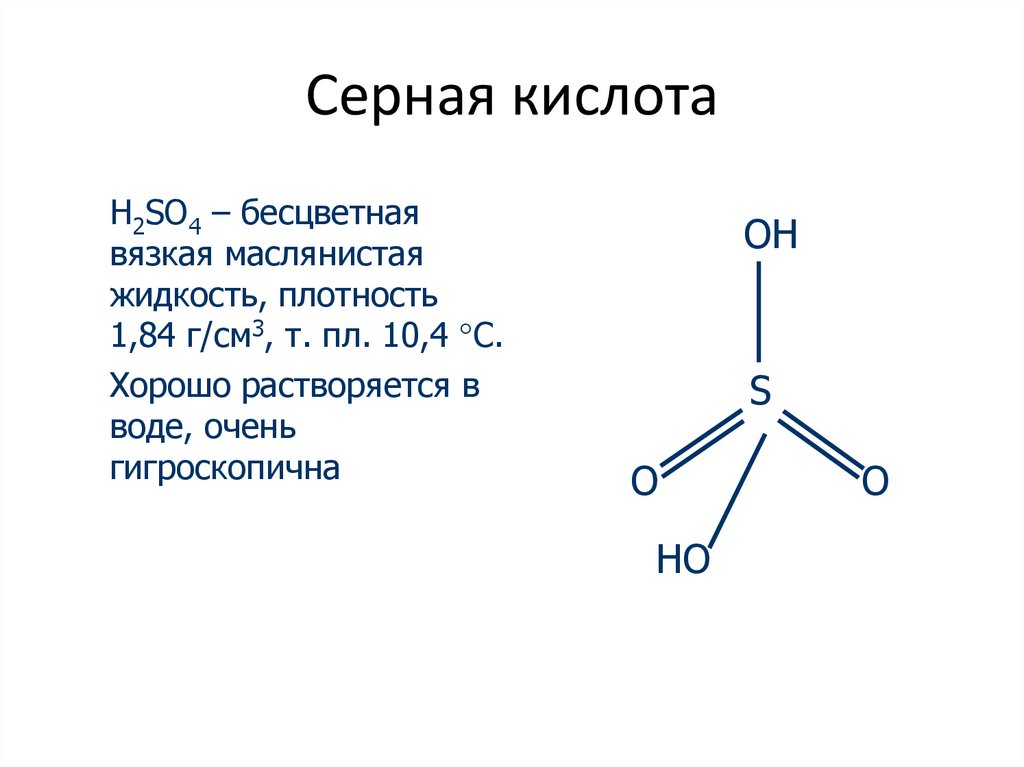
3. Серная кислота
H2SO4 – бесцветнаявязкая маслянистая
жидкость, плотность
1,84 г/см3, т. пл. 10,4 С.
Хорошо растворяется в
воде, очень
гигроскопична
OH
S
O
HO
O
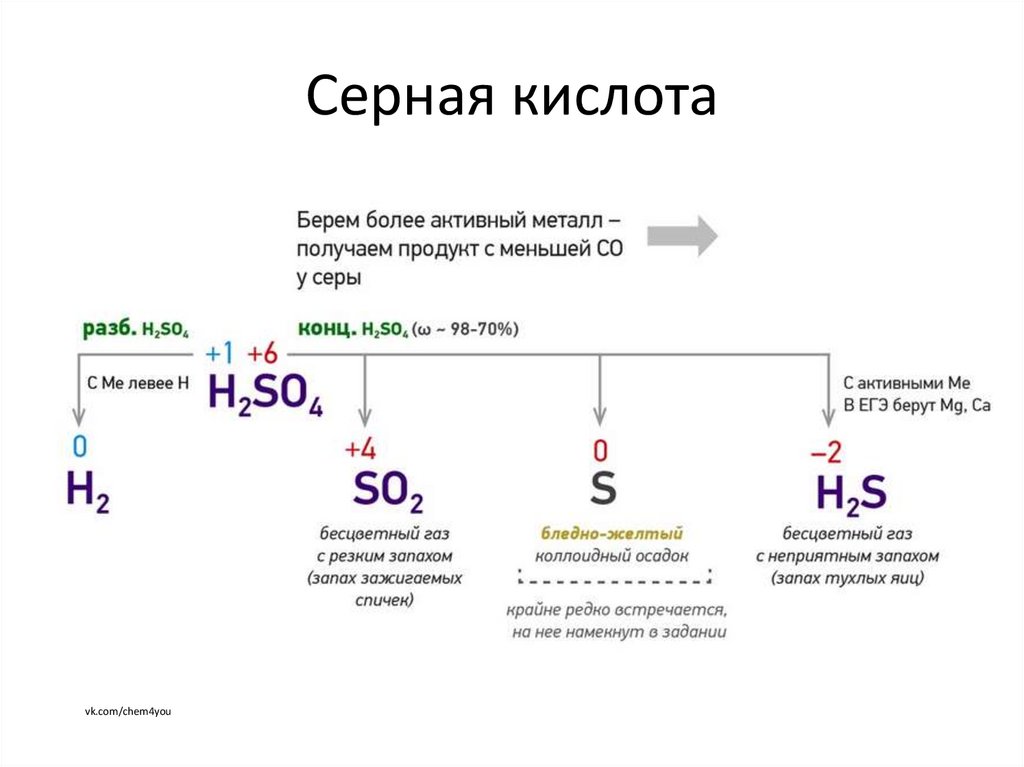
4. Серная кислота
vk.com/chem4you5. Серная кислота
В ряду напряжения до H 2разбавленная
концентрированная
SO2 чаще (как правило);
S (середина ряда) H 2 S (начало
H2 ;
ряда) – для активных металлов,
(Pb
напр., Zn;
пассивируется)
(Fe, Al, Cr на холоду
пассивируются)
В ряду напряжения после H 2
разбавленная
концентрированная
Не реагируют
SO2
(Pt, Au не реагируют)
6. Серная кислота
Zn + 2H2SO4 конц. → ZnSO4 +SO2 + 2H2O3Zn + 4H2SO4 конц. −t→ 3ZnSO4 + S + 4H2O (или H2S)
Cu + 2H2SO4 конц. → CuSO4 + SO2 + 2H2O
7. Серная кислота
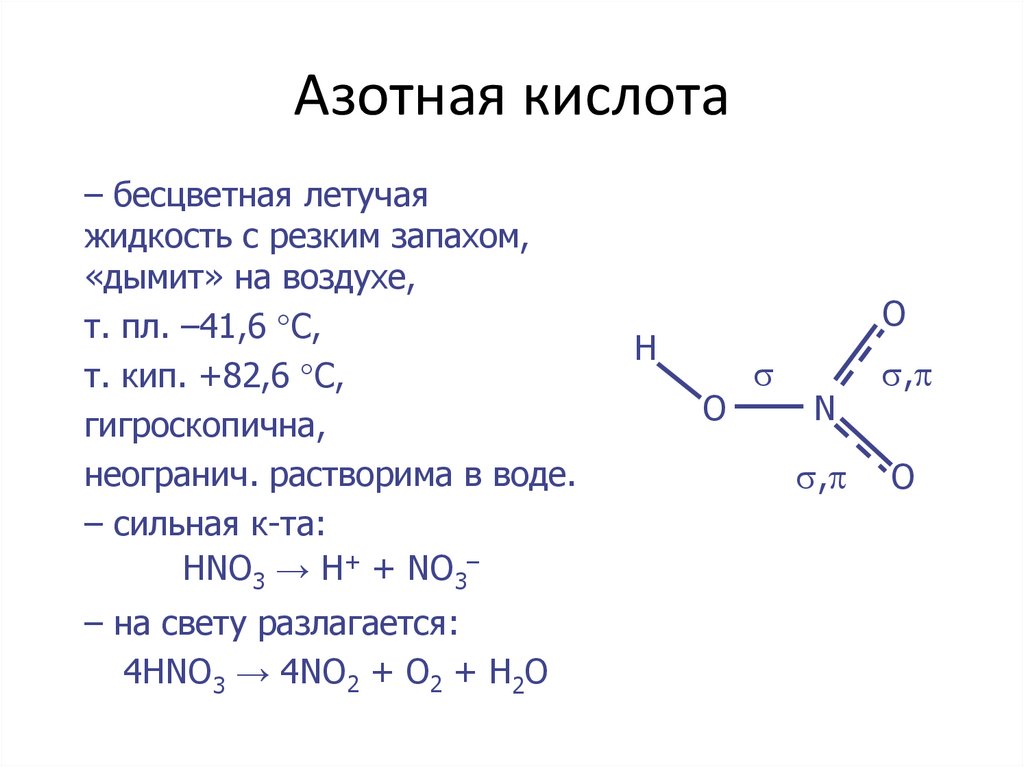
с неметаллами8. Азотная кислота
– бесцветная летучаяжидкость с резким запахом,
«дымит» на воздухе,
т. пл. –41,6 С,
т. кип. +82,6 С,
гигроскопична,
неогранич. растворима в воде.
– сильная к-та:
HNO3 → H+ + NO3–
– на свету разлагается:
4HNO3 → 4NO2 + O2 + H2O
O
H
O
N
,
,
O
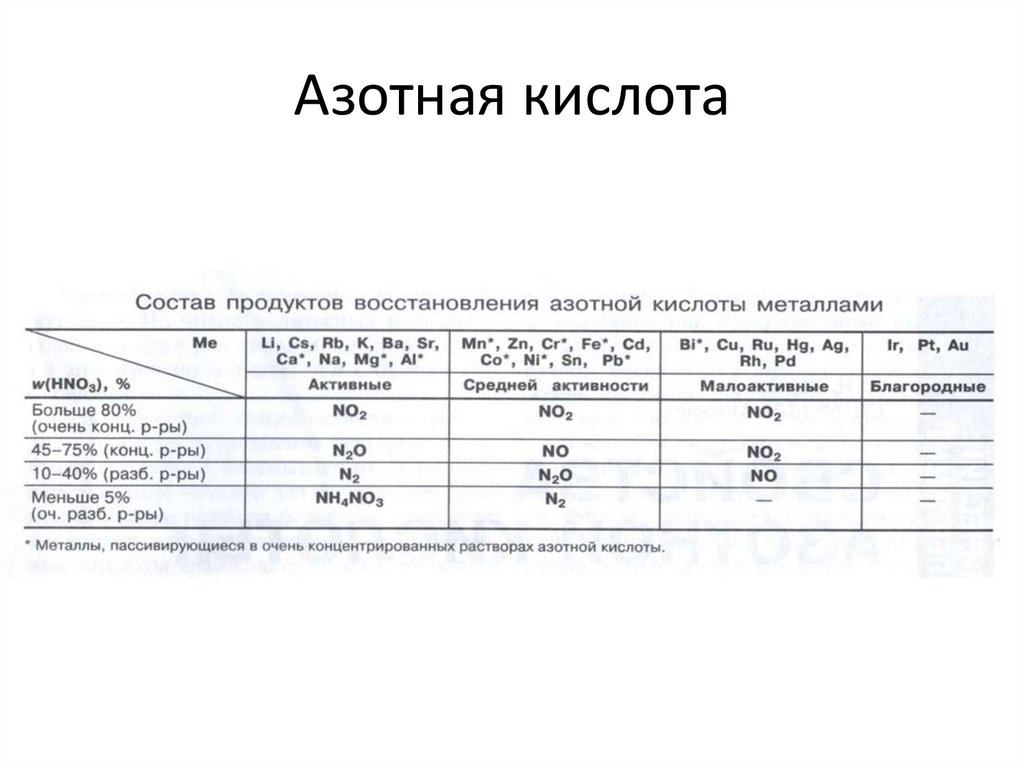
9. Азотная кислота
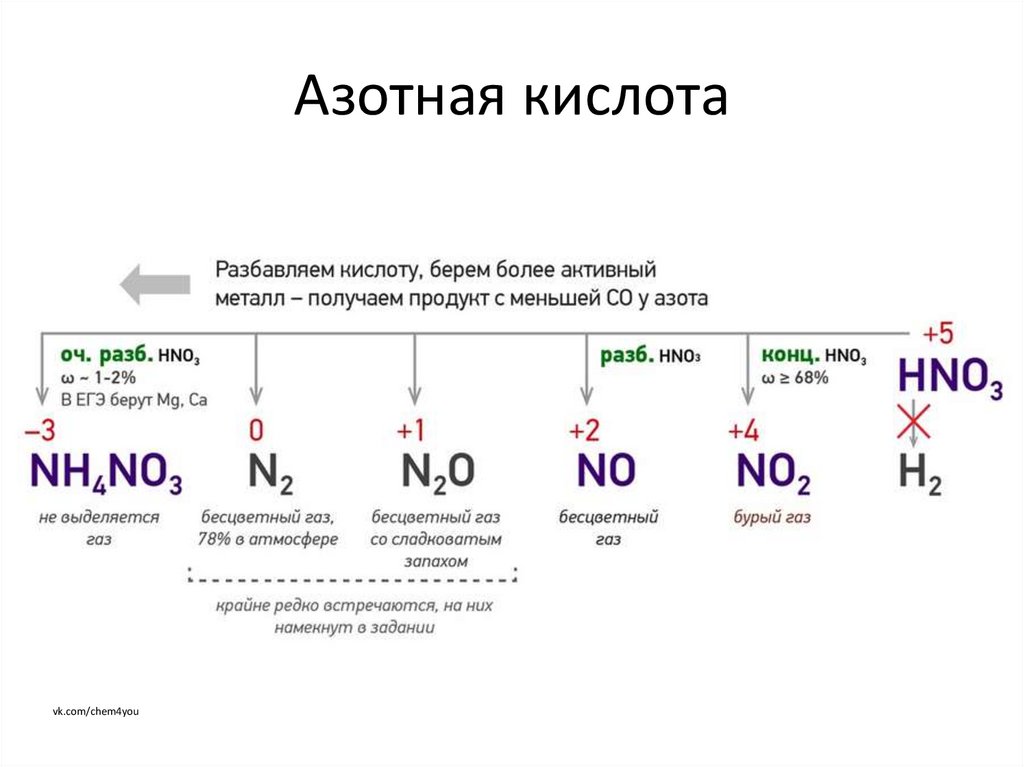
vk.com/chem4you10. Азотная кислота
Активные Ме(Ca, Mg, Zn)
оч. разб.
разб.
конц.
NH 4 NO3
N 2 O чаще;
N2
NO
Me средней активности
(Fe, Cr, Ni)
оч. разб.
разб.
конц.
NH 4 NO3 ;
N 2 реже
NO ;
N 2O
пассивируются
Малоактивные Me
(Pb, Cu, Hg, Ag)
разб.
конц.
NO
NO2
(Pb пассивируется)
Благородные Me
(Au, Pt,
Os, Ir, W)
не
реагируют
11. Азотная кислота
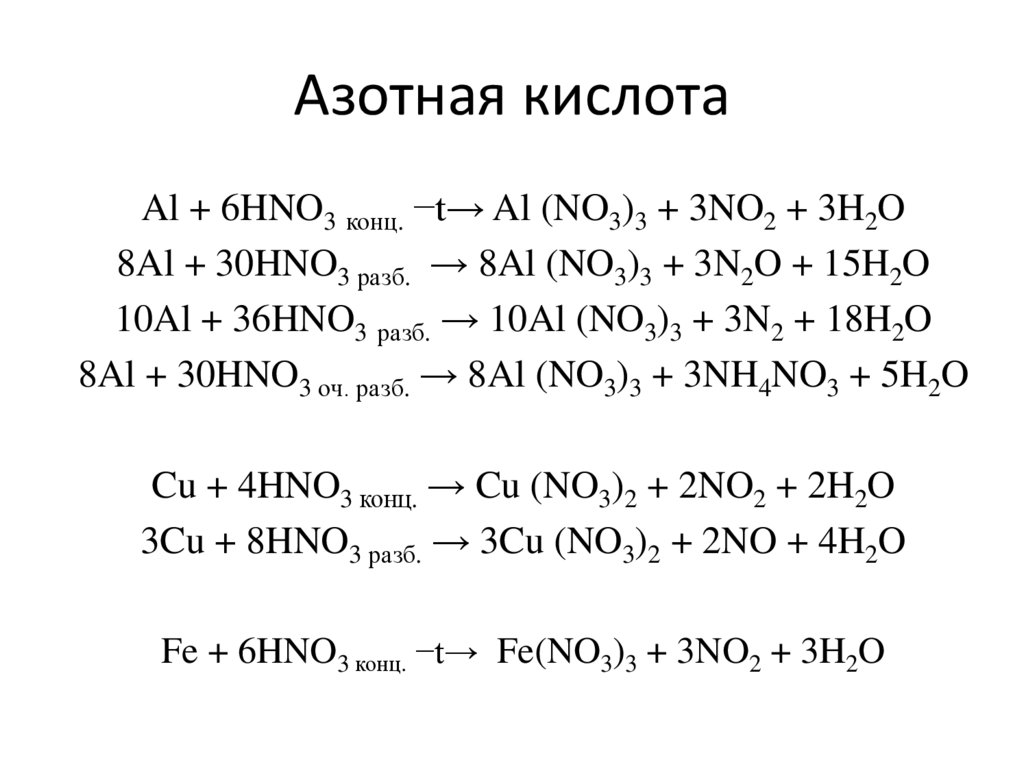
12. Азотная кислота
Al + 6HNO3 конц. −t→ Al (NO3)3 + 3NO2 + 3H2O8Al + 30HNO3 разб. → 8Al (NO3)3 + 3N2O + 15H2O
10Al + 36HNO3 разб. → 10Al (NO3)3 + 3N2 + 18H2O
8Al + 30HNO3 оч. разб. → 8Al (NO3)3 + 3NH4NO3 + 5H2O
Cu + 4HNO3 конц. → Cu (NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 разб. → 3Cu (NO3)2 + 2NO + 4H2O
Fe + 6HNO3 конц. −t→ Fe(NO3)3 + 3NO2 + 3H2O
13. Царская водка
3HCl + HNO3 NOCl + 2[Cl0] + H2O2NOCl → 2NO + Cl2
2NO + О2 → 2NО2
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O
14. Азотная кислота
из неметалла образуется соответствующая кислота, а HNO3 : конц. – NO2разб. – NO
например:
P 5HNO3( конц.) H 3 PO4 5 NO2 H 2 O
3P 5HNO3( разб.) 2 H 2 O 3H 3 PO4 5 NO
S 6 HNO3( конц.) H 2 SO4 6 NO2 2 H 2 O
S 2 HNO3( разб.) H 2 SO4 2 NO
I 2 10 HNO3( конц.гор.) 2 HIO 3 10 NO2 4 H 2 O
3I 2 10 HNO3( разб.) 6 HIO 3 10 NO 2 H 2 O









 chemistry
chemistry








