Similar presentations:
Закономерности изменения химических свойств элементов и их соединений. Лекция 2. Индустрия красоты
1. Химические вещества и материалы в индустрии красоты
E-mail: irkrav66@gmail.comХимические вещества
и материалы в
индустрии красоты
Лекция 2.Закономерности
изменения химических свойств
элементов и их соединений
лектор:
проф. Рохин Александр
Валерьевич
2.
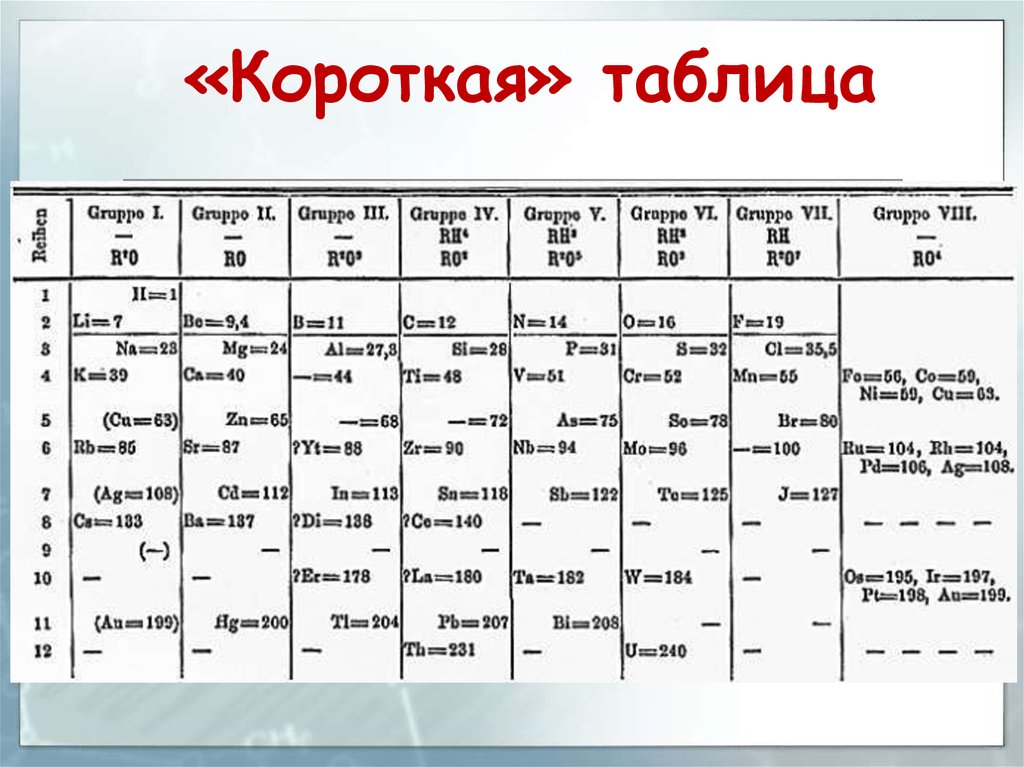
3. Структура периодической системы
Наиболее распространёнными являются3 формы таблицы Менделеева.
В «сверхдлинном» варианте каждый
период занимает ровно одну строчку.
В «длинном» варианте лантаноиды и
актиноиды вынесены из общей
таблицы.
В «короткой» форме записи, в
дополнение к этому, четвёртый и
последующие периоды занимают по 2
строчки.
4.
«Короткая» таблица5.
«Длинная» таблица6.
Короткая форматаблицы, содержащая
восемь групп элементов
была официально
отменена ИЮПАК
в 1989 году.
7.
Значение периодическойсистемы
Благодаря системе сложилось современное
понятие о химическом элементе, были
уточнены представления о простых веществах
и соединениях.
Mg (магний):
12 – номер хим. Элемента в ПСХЭ
Менделеева (соответствует числу
протонов и электронов);
2 - число электронов на первом
энергетическом уровне;
8 – на 2 энерг.уровне;
2 – число электронов на 3
энерг.уровне;
24, 312 – атомная масса
хим.элемента.
8.
В ходе исследований атомаметодами физики было
установлено, что порядковый номер
элемента в таблице Менделеева
(атомный номер) является мерой
электрического заряда атомного
ядра этого элемента, номер
горизонтального ряда (периода) в
таблице определяет число
электронных оболочек атома, а
номер вертикального ряда —
квантовую структуру верхней
оболочки, чему элементы этого ряда
и обязаны сходством химических
свойств.
9.
Появление периодической системы открылоновую, подлинно научную эру в истории
химии и ряде смежных наук — взамен
разрозненных сведений об элементах и
соединениях появилась стройная система,
на основе которой стало возможным
обобщать, делать выводы, предвидеть.
10.
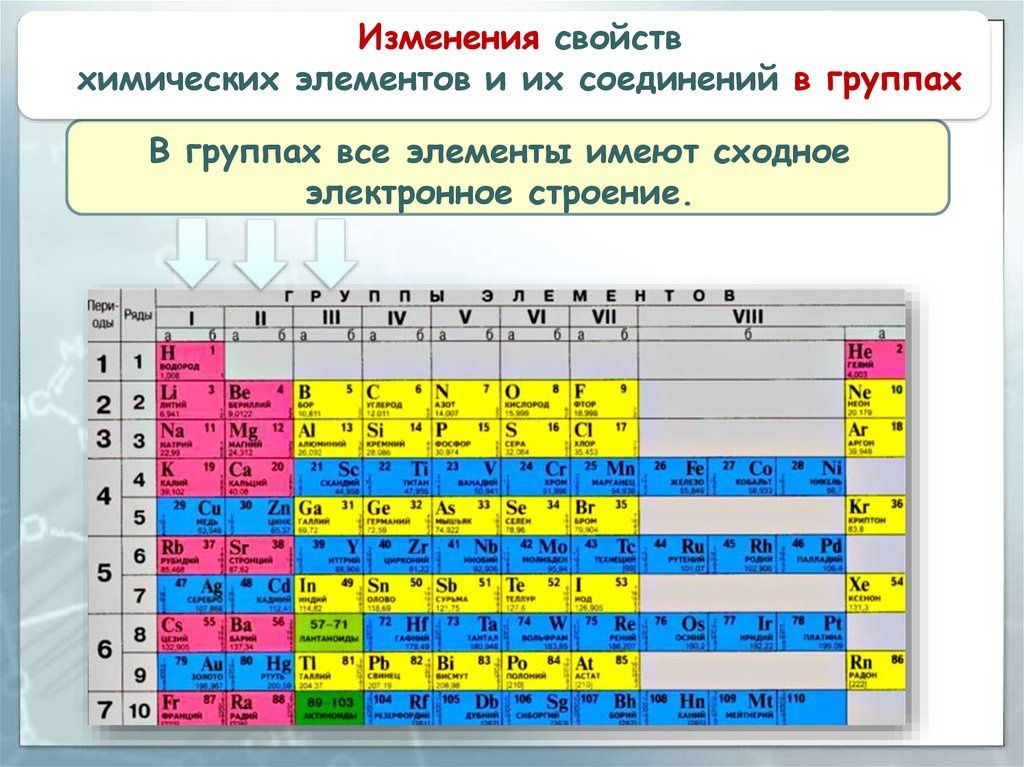
Изменения свойствхимических элементов и их соединений в группах
В группах все элементы имеют сходное
электронное строение.
11.
Различий в наполнении внешнегоэнергетического уровня электронами нет.
Номер группы периодической системы соответствует
числу электронов на внешней электронной оболочке
атомов элементов этой группы
12.
Меняется размер атома - сверху вниз вгруппе радиусы атомов увеличиваются!
Периодический закон Д. И. Менделеева:
«свойства химических элементов; а также формы и
свойства образуемых ими простых веществ и
соединений находятся в периодической зависимости от
величины зарядов ядер их атомов»
это означает:
13.
в группе сверху вниз:внешние электроны все слабее
притягиваются к ядру атома;
возрастает способность
атома отдавать электроны.
способность отдавать электроны =
металлические свойства, т.е.
закономерность изменения
химических свойств элементов и
их соединений в группах:
возрастают металлические
свойства элементов
усиливаются основные
свойства их соединений
14.
Изменения свойствхимических элементов и их соединений в периодах
15.
Номер периода (горизонтального рядапериодической таблицы) совпадает с номером
высшей занятой электронной орбитали.
16.
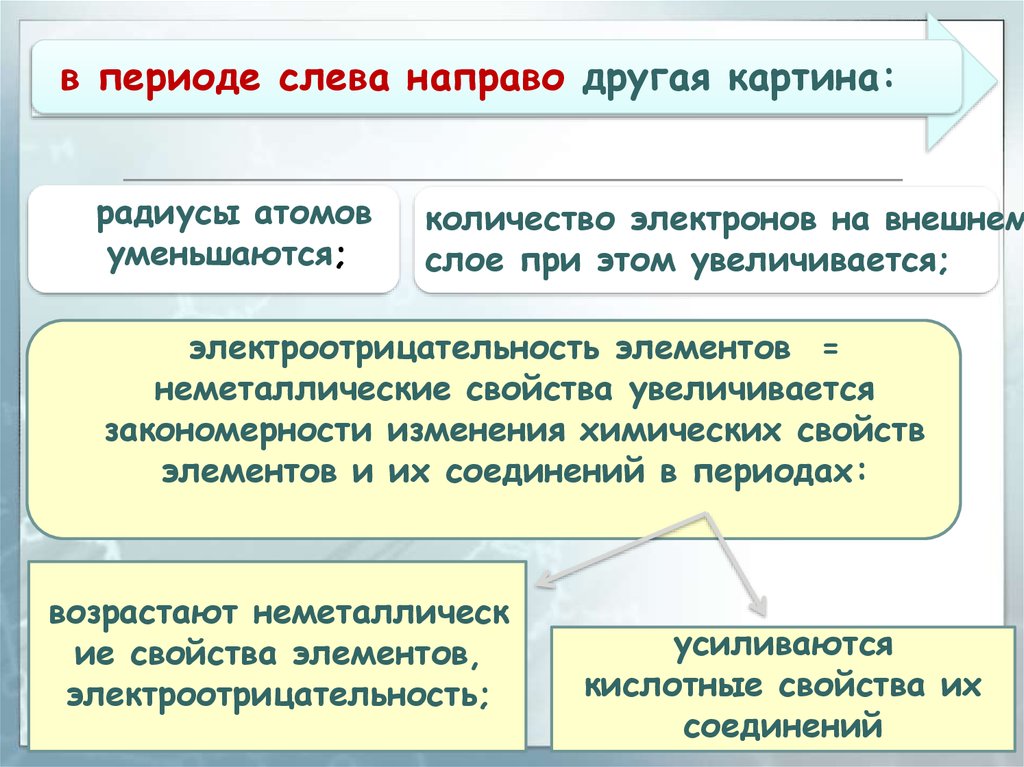
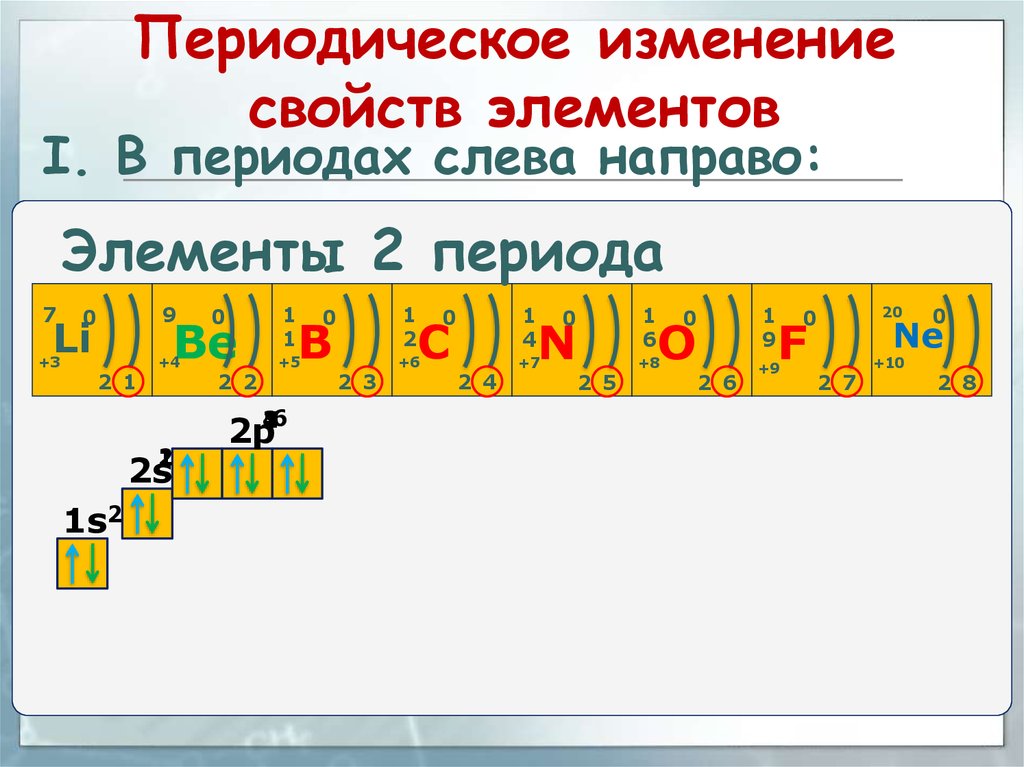
в периоде слева направо другая картина:радиусы атомов
уменьшаются;
количество электронов на внешнем
слое при этом увеличивается;
электроотрицательность элементов =
неметаллические свойства увеличивается
закономерности изменения химических свойств
элементов и их соединений в периодах:
возрастают неметаллическ
ие свойства элементов,
электроотрицательность;
усиливаются
кислотные свойства их
соединений
17.
18.
Восстановительные иметаллические свойства
В
С увеличением заряда ядра атомов
ИТОГЕ наблюдается постепенное закономерное
изменение свойств элементов и их
соединений от металлических к типично
неметаллическим,
что связано с увеличением числа электронов
на внешнем энергетическом уровне
Восстановительные и металлические свойств
Окислительные и неметаллические свойств
19.
Есть еще элементы, которые образуюттак называемые амфотерные
соединения.
Они проявляют как металлические, так
и неметаллические свойства.
Zn Cr Al Sn Pb
Mn Fe Be
20.
Атом – электронейтральнаясистема взаимодействующих
элементарных частиц,
состоящего из ядра
(образованного протонами и
нейтронами) и электронов.
21.
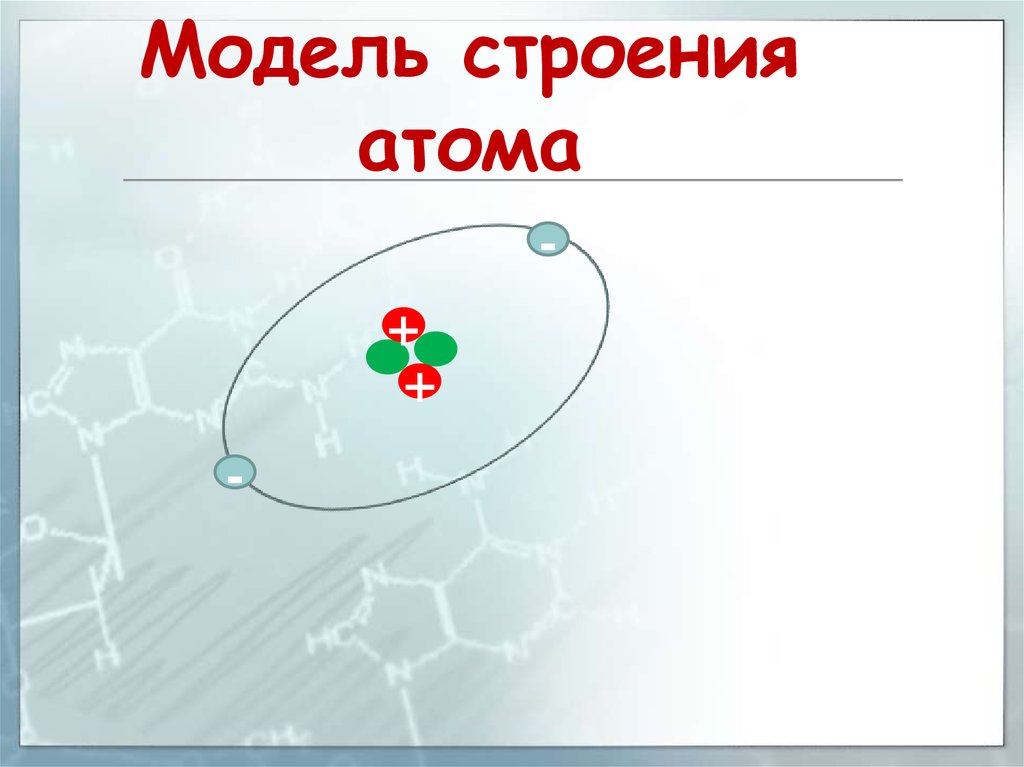
Модель строенияатома
+
+
-
22.
Изотопы – это разновидностиатомов одного и того же
хим.элемента, имеющие
одинаковое число протонов но
разное число нейтронов.
1H — протий (Н)
+
23.
-+
2H — дейтерий (D)
24.
3H — тритий(радиоактивен) (T).
25.
Химический элемент – это видатомов с одинаковым
положительным зарядом ядра.
26.
Электронное облако – пространствовокруг атомного ядра, в котором
наиболее вероятно нахождение
электрона.
27.
Электроны, обладающие близкимизначениями энергиями, образуют
единый электронный слой.
K
L
M
N
3
4
O P
Q
+Z
1
2
5 6
7
28.
В пределах одного и того же периодаметаллические свойства ослабевают,
а неметаллические усиливаются, так
как:
а) увеличиваются заряды атомных ядер
элементов;
б) увеличивается число электронов на
внешнем энергетическом уровне атомов;
в) число энергетических уровней в атомах
элементов не изменяется;
г) радиус атомов уменьшается.
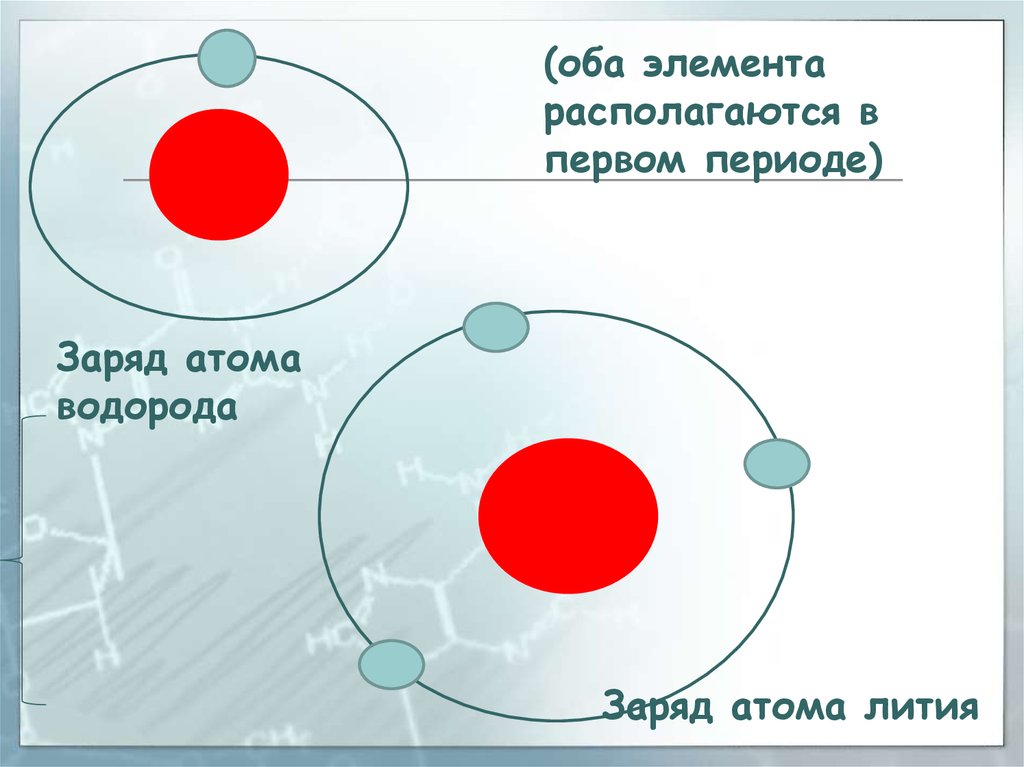
29.
(оба элементарасполагаются в
первом периоде)
Заряд атома
водорода
Заряд атома лития
30.
В пределах одной и той же группы(в главной подгруппе) металлические
свойства усиливаются, а
неметаллические ослабевают, так как:
а) увеличиваются заряды атомных ядер
элементов;
б) число электронов на внешнем
энергетическом уровне не изменяется;
в) увеличивается число энергетических
уровней в атомах;
г) увеличивается радиус атомов.
31.
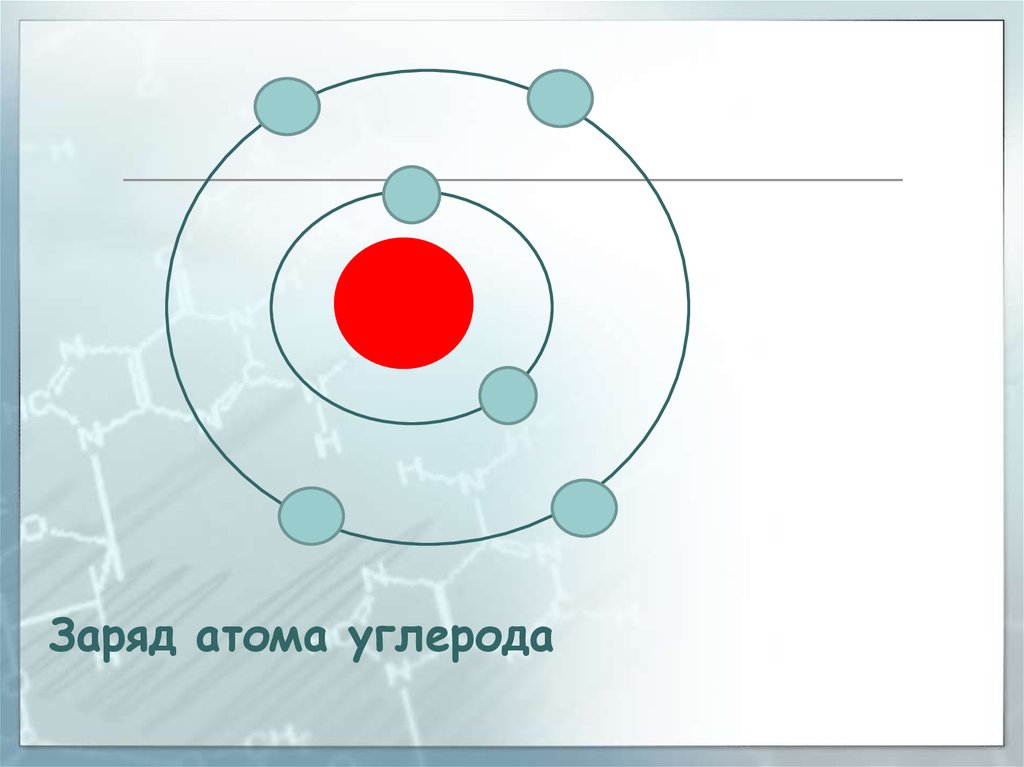
Заряд атома углерода32.
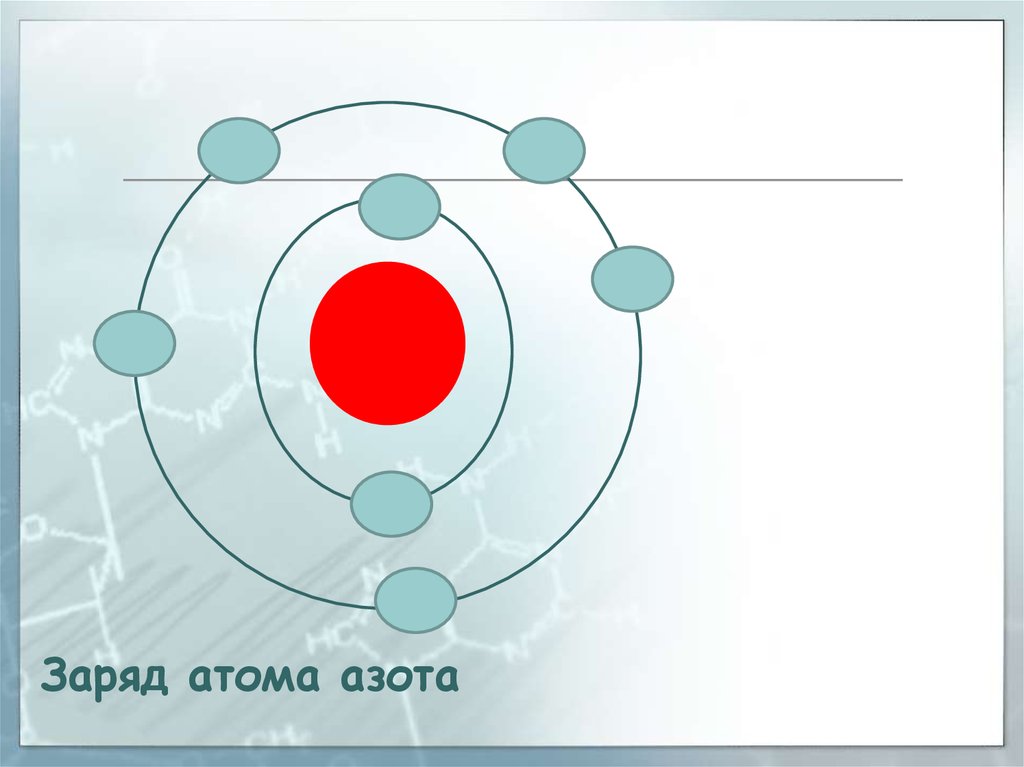
Заряд атома азота33.
Элементы неметалловНемета́ллы — химические элементы с
типично неметаллическими свойствами,
которые занимают правый верхний угол
Периодической системы.
Расположение их в главных подгруппах
соответствующих периодов следующее:
Кроме того, к неметаллам относят
также водород и гелий.
34.
Элементы неметалловХарактерной особенностью неметаллов
является большее число электронов на
внешнем энергетическом уровне
их атомов.
Неметаллы имеют высокие значения
сродства к электрону,
большую электроотрицательность и
высокий окислительновосстановительный потенциал.
35.
Периодическое изменениесвойств элементов
I. В периодах слева направо:
Элементы 2 периода
7
9
0
Be
Li
+3
0
2 1
+4
2
1
2s
1s2
2 2
1
1
B
+5
2p123456
1
2
0
2 3
1
4
0
C
+6
2 4
1
6
0
N
+7
2 5
1
9
0
O
+8
2 6
20
0
F
+9
0
Ne
2 7
+10
2 8
36.
Периодическое изменениесвойств элементов
I. В периодах слева направо:
Элементы 2 периода
7
9
0
Li
+3
0
Be
2 1
+4
2 2
1
1
1
2
0
B
+5
2 3
C
1
4
0
+6
2 4
1
6
0
N
+7
2 5
1
9
0
O
+8
2 6
F
2
0
0
+9
0
Ne
2 7
+10
2 8
Элементы 3 периода
Na
2 8 1
Mg
2 8 2
Al
2 8 3
Si
2 8 4
P
S
2 8 5
Cl
2 8 6
2 8 7
Ar
2 8 8
37.
Элементы металловПо своему электронному строению металлы
делятся на s-, p-, d- и f-металлы.
s-металлы расположены в 1 и 2 группах
Периодической системы химических
элементов, р-металлы – в 13, 14, 15, 16
группах.
В группах s- и р-металлов число
электронов на внешнем энергетическом
уровне не изменяется, радиус атома
увеличивается, электроотрицательность
уменьшается, восстановительные свойства
усиливаются, металлические свойства
усиливаются.
38.
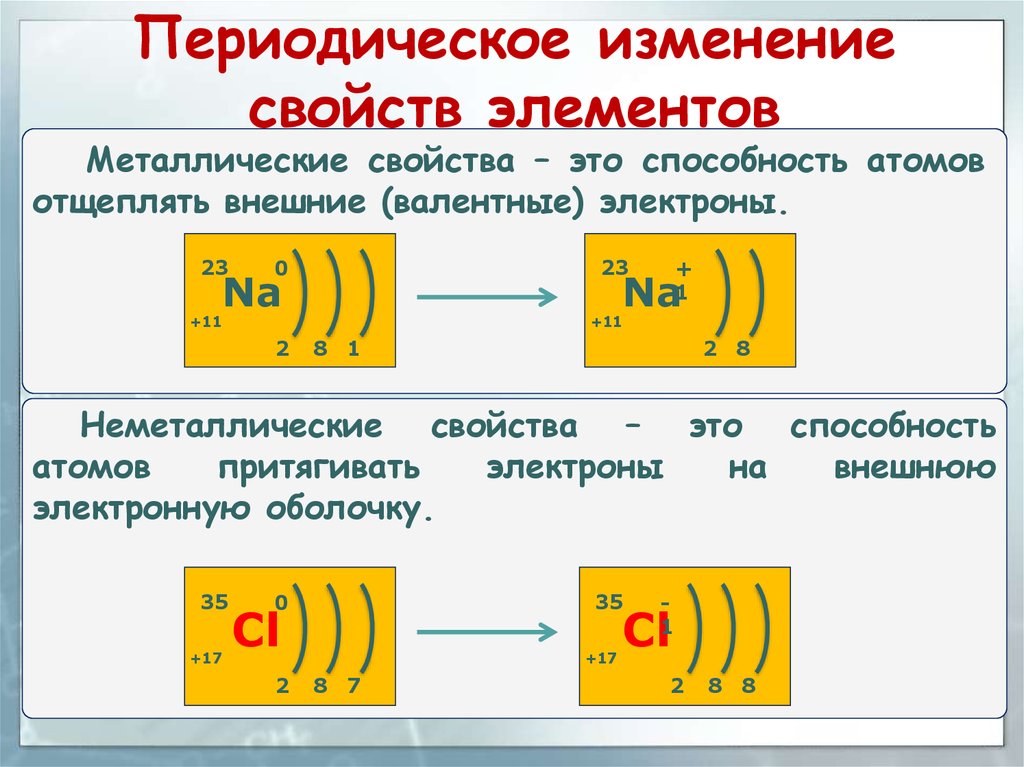
Периодическое изменениесвойств элементов
Металлические свойства – это способность атомов
отщеплять внешние (валентные) электроны.
23
23
0
Na
Na
+11
2
+
1
+11
8 1
2 8
Неметаллические свойства – это способность
атомов
притягивать
электроны
на
внешнюю
электронную оболочку.
35
+17
35
0
Сl
2
+17
8 7
1
Сl
2
8 8
39.
Периодическое изменениесвойств элементов
II. В группах сверху вниз:
Элементы III A группы
11
12
0
B
2 3
0
Al
+13
70
2 8 3
0
Ga
+31
115
2 81 3
8
0
In
+49
2 81 1 3
8 8
2 4
0
Si
+14
73
2 8 4
0
Ge
+32
119
2 81 4
8
0
Sn
+50
0
N
+6
28
Элементы V A группы
14
0
C
+5
27
Элементы IV A группы
2 81 1 4
8 8
+7
2 5
31
0
+15
75
P
2 8 5
0
As
+33
122
2 81 5
8
0
Sb
+51
2 81 1 5
8 8
40.
Типы химических реакцийКлассификационный
признак – число и состав
исходных веществ и
продуктов реакции
41. Типы химических реакций
Реакции разложенияХим.реакции когда из одного
исходного вещества образуется
несколько более простых веществ.
2НgO 2Hg + O2
2H2O 2H2 + O2
2H2O2 2H2O + O2
2KMnO4 K2MnO4 + MnO2 + O2
42. Реакции разложения
КатализаторыВещества, изменяющие скорость
химической реакции, но по
окончании их остающиеся
качественно и количественно
неизменёнными
ФЕРМЕНТЫ – биологические
катализаторы белковой природы
43. Катализаторы
Классификация химических реакций попризнаку наличие или отсутствие
катализатора
Реакции, протекающие с участием
катализатора, называются
каталитическими.
Реакции, протекающие без участия
катализатора, называются
некаталитическими
Реакции, протекающие с участием
ферментов, называются
ферментативными
44. Классификация химических реакций по признаку наличие или отсутствие катализатора
Реакции соединенияХимические реакции, в результате
которых из нескольких исходных
веществ образуется одно сложное
(продукт реакции)
Р P2O5 H3PO4
1). 4P + 5O2 2P2O5
2). P2O5 + 3H2O 2H3PO4
Реакции протекающие только в одном
направлении называются необратимыми
45. Реакции соединения
2SO2 + O22SO3
Химические реакции, которые
протекают одновременно в двух
противоположных направлениях –
прямом и обратном, называются
обратимыми.
46. Реакции соединения
Реакции замещенияZn + 2HCl ZnCl2 + H2
2Al + 6HCl 2AlCl3 + 3H2
2Al + 3H2SO4 Al2(SO4)2 + 3H2
Реакции, в результате которых
атомы простого вещества замещают
атомы из химических элементов в
сложном веществе, называются
реакциями замещения
47. Реакции замещения
Вытеснительный ряд Бекетова (рядактивности (напряжений) металлов)
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr,
Fe, Co, Sn, Pb (H2) Cu, Hg, Ag, Au, Pt.
По своей способности вытеснять
водород из растворов кислот русский
химик Н.Н.Бекетов расположил все
металлы в порядке убывания их
химической активности (слева направо)
48. Вытеснительный ряд Бекетова (ряд активности (напряжений) металлов)
Реакции обмена2NaOH + CuSO4 Cu(OH)2
+ Na2SO4
2NaI + Pb(NO3)2 PbI2 + 2NaNO3
Реакции, в результате которых два
сложных вещества обмениваются
своими составными частями
49. Реакции обмена
Протекают в растворах до конца, если впродуктах реакции образуется:
А) вещество выпадающее в осадок;
Б) газообразное вещество;
В) вода.
Na2CO3 + 2HNO3 2NaNO3 + H2O +CO2
NaOH + HNO3 NaNO3 + H2O
50. Реакции обмена
H+ - среда кислаяОН- - среда щелочная
H+ + ОН- H2O – среда нейтральная
NaOH + HNO3 NaNO3 + H2O
Реакция обмена между кислотой и
основанием называют реакцией
нейтрализации
51. Реакции обмена
Контрольная работаРасположить элементы в порядке возрастания
металлических свойств. Объяснить, как
изменяются свойства в периодах и группах.
а) Ве; О; В; С;
б) Ва; Ве; Са; Мg
Расположить элементы в порядке возрастания
неметаллических свойств. Объяснить, как
изменяются свойства в периодах и группах.
а) Аl ; Nа; Р; С ;
б) Рв; Si; С; Sn









































 chemistry
chemistry








