Similar presentations:
Фосфор
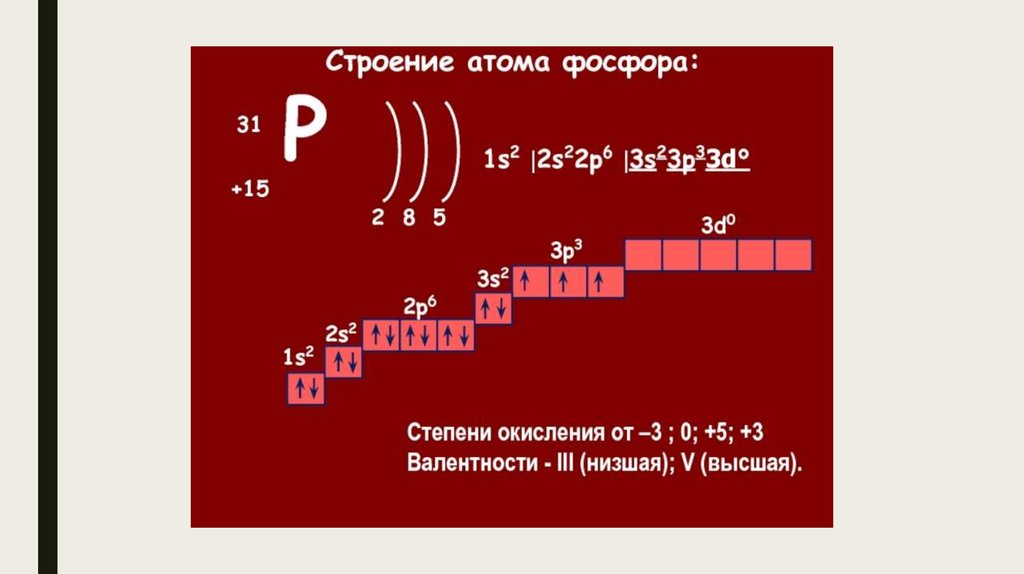
1. ФОСФОР
Выполнили студенты ХЕМО-01-18:Писарева Екатерина
Кувшинов Илья
Сергеева Надежда
Епифанов Александр
2.
3.
4.
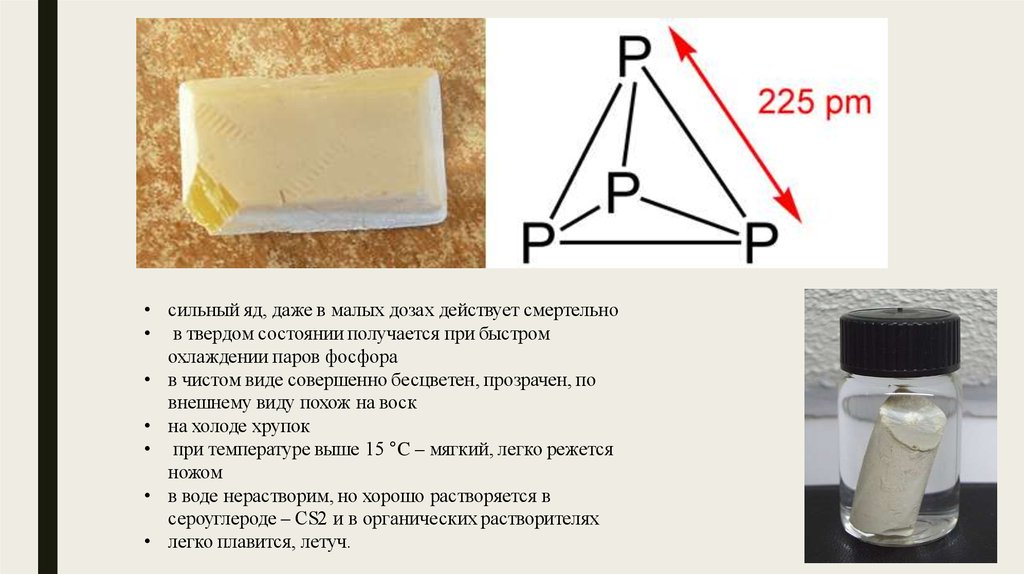
• сильный яд, даже в малых дозах действует смертельно• в твердом состоянии получается при быстром
охлаждении паров фосфора
• в чистом виде совершенно бесцветен, прозрачен, по
внешнему виду похож на воск
• на холоде хрупок
• при температуре выше 15 °C – мягкий, легко режется
ножом
• в воде нерастворим, но хорошо растворяется в
сероуглероде – СS2 и в органических растворителях
• легко плавится, летуч.
5.
• имеет формулу Рn и представляет собойполимер со сложной структурой
• порошок красно-бурого цвета
• неядовит, нелетуч
• нерастворим в воде и во многих
органических растворителях и
сероуглероде
• не воспламеняется на воздухе и не
светится в темноте
• при нагревании до 260 °C
воспламеняется
• при сильном нагревании, без доступа
воздуха, не плавясь (минуя жидкое
состояние) испаряется – сублимируется.
6.
• представляет собой чёрное вещество с металлическимблеском, жирное на ощупь и весьма похожее на графит, и
с полностью отсутствующей растворимостью в воде или
органических растворителях.
7. Органические производные трехвалентного фосфора
Органофосфины являются производными фосфинаРН3, где атомы водорода замещены на
органические радикалы. Фосфористый водород,
или фосфин, РН3, - бесцветный газ с неприятным
запахом, токсичен, при нагревании разлагается,
на воздухе самовоспламеняется, в смеси с
кислородом взрывается.
8. Способы получения органофосфинов
В случае неполного замещения образуются органохлорфосфины:PCl3
PCl3
RMgBr +
2RMgBr +
RPCl2 + RMgBrCl
R2PCl + 2MgBrCl
PCl3
3RMgBr +
R3P + 3MgBrCl
Также органофосфины можно получать по реакции гидридного присоединения фосфина к
олефинам, например:
CH3
C6H13CH
CH2
+ PH3
C6H13CH PH2
Оксиды третичных фосфинов могут быть восстановлены трихлорсиланом с получением триорганофосфинов:
HSiCl3
(C6H5)3P
O
(C6H5)3P
9.
Органохлорфосфины могут быть получены реакцией прямого синтеза из элементного фосфора (красного) игалогеналкила в присутствии катализатора – металлической меди при повышенной температуре:
P + RCl
300-360 oC
Cu
RPCl2
+
R2PCl + PCl3
Получение органохлорфосфинов с ароматическим фенильным радикалом может быть осуществлено
реакцией электрофильного замещения атома водорода бензольного кольца при взаимодействии с PCl3 в
присутствии AlCl3 по Фриделю-Крафтсу:
AlCl3
C6H6 + PCl3
C6H5PCl2
+
HCl
10. Химические свойства органофосфинов
Низшие алифатические фосфины самовоспламеняются на воздухе. В условиях регулируемого процессаокисления триорганофосфины присоединяют кислород с образованием производных пятивалентного
фосфора. На первом этапе образуются оксиды третичных фосфинов, их содержание составляет 50%, далее
атом кислорода внедряется последовательно по связям Р-С с образованием эфиров кислот пятивалентного
фосфора, причем содержание эфира диалкилфосфиновой кислоты составляет 45%, а количество эфиров
алкилфосфоновой и ортофосфорной кислот суммарно составляет 5%:
R3P
[O]
R3P
O
R
+ R P
RO
O
+
R
RO P
RO
O
RO
+ RO P
RO
O
Третичные фосфины являются основаниями. При алкилировании третичных фосфиновгалогеналкилами
образуются соли четвертичных фосфониевых оснований, от которых легко перейти к основаниям:
(CH3)3P
+ CH3I
(CH3)4P+I-
(CH3)4P+OH-
11.
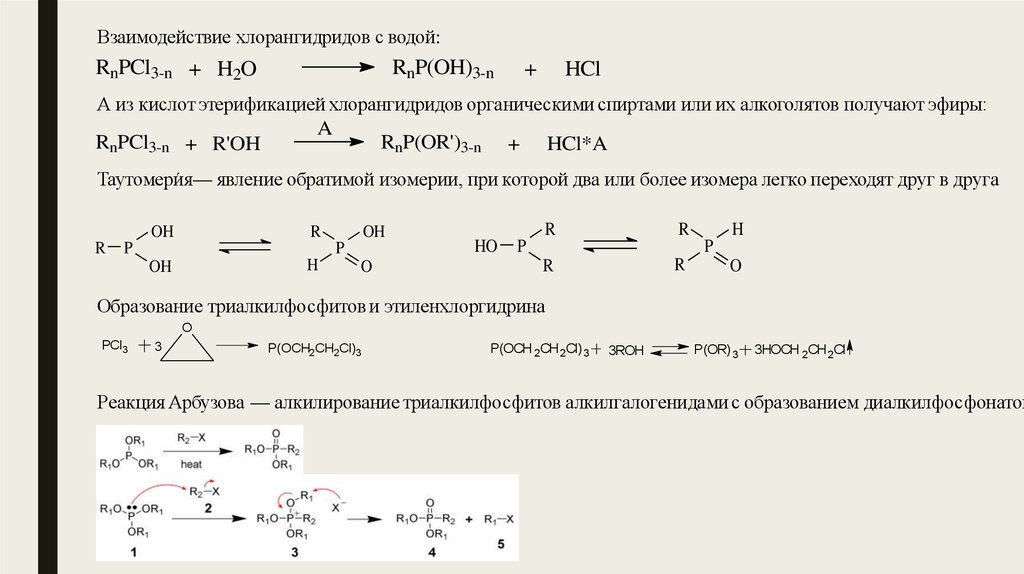
Взаимодействие хлорангидридов с водой:RnPCl3-n + H2O
RnP(OH)3-n
+
HCl
А из кислот этерификацией хлорангидридов органическими спиртами или их алкоголятов получают эфиры:
A
RnPCl3-n + R'OH
RnP(OR')3-n + HCl*A
Таутомери́я— явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга
OH
R
R
P
OH
P
H
OH
O
R
HO
R
P
H
P
R
R
O
Образование триалкилфосфитов и этиленхлоргидрина
O
PCl3
3
P(OCH2CH2Cl)3
P(OCH 2CH 2Cl) 3
3ROH
P(OR) 3
3HOCH 2CH 2Cl
Реакция Арбузова — алкилирование триалкилфосфитов алкилгалогенидами с образованием диалкилфосфонатов
12. ОРТОФОСФОРНАЯ КИСЛОТА И ФОСФАТЫ Получение
13. Свойства
H3PO4 — трёхосновная кислота средней силы. При взаимодействии с очень сильной кислотой,например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли
фосфорила, например, [Р(ОН)4]ClO4.
В водных растворах подвергается электролитической диссоциации в три
образованием катиона гидроксония. Степень диссоциации и вид зависят от pH раствора:
стадии
с
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция
с нитратом серебра, при этом образуется жёлтый осадок:
Качественной реакцией на ион H2РО4− является образование ярко-жёлтого осадка молибденофосфата
аммония:
14. ФОСФАТЫ
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- итрехзамещенные соли
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы
мало. Прокаливание солей приводит к следующим превращениям:
15. Применение фосфатов
• Авиационная промышленность• Пищевая промышленность
• Сельское хозяйство
• Стоматология
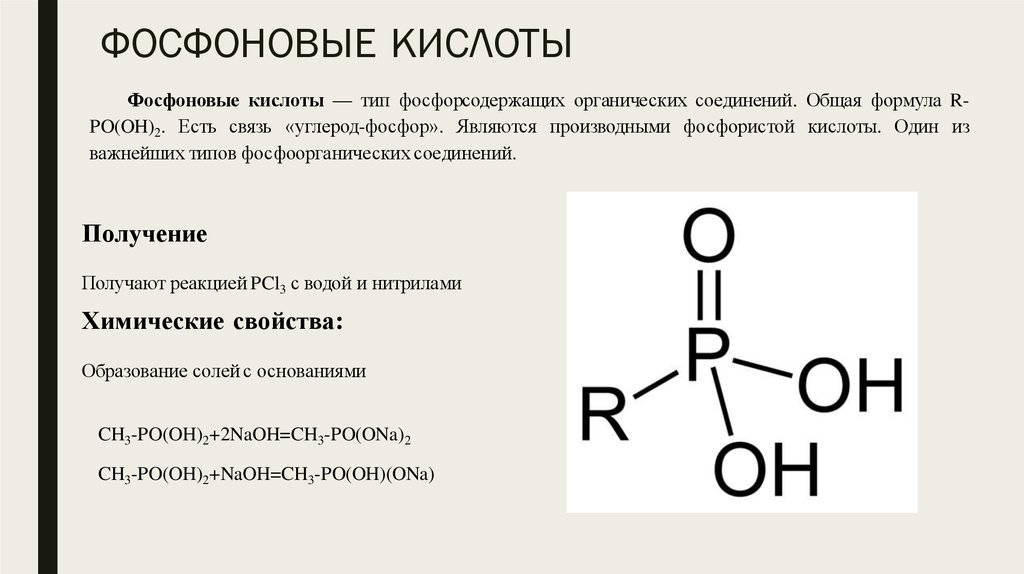
16. ФОСФОНОВЫЕ КИСЛОТЫ
Фосфоновые кислоты — тип фосфорсодержащих органических соединений. Общая формула RPO(OH)2. Есть связь «углерод-фосфор». Являются производными фосфористой кислоты. Один изважнейших типов фосфоорганических соединений.
Получение
Получают реакцией PCl3 с водой и нитрилами
Химические свойства:
Образование солей с основаниями
CH3-PO(OH)2+2NaOH=CH3-PO(ONa)2
CH3-PO(OH)2+NaOH=CH3-PO(OH)(ONa)
17. Важнейшие представители фосфоновых кислот
• Фосфонуксусная кислота HOOCCH2P(O)(OH)2• Нитрилометиленфосфоновая кислота
Получают по схеме: NH3+3CH2O+PCl3+6H20=N[CH2P(O)(OH)2]3+9НCl
• Оксиэтилидендифосфорная кислота СН3С(ОН)[Р(О)(ОН)
Применение
Используются в теплоэнергетике (их добавки ингибируют образование накипей и понижают жесткость
воды), в нефте- и газодобыче, а также нефтепереработке (предотвращает гипсовые отложения в
трубопроводах), в пищевой, парфюмерной и текстильной промышленности (добавки фосфоновых кислот
ингибируют коррозию в автоклавах, входят в состав осветляющих композиций, стабилизируют вина и т. п.),
при никелировании стали, как добавки к удобрениям), строительстве (замедлитель схватывания бетона и
гипса). Являются основой для широкого класса боевых отравляющих веществ нервно-паралитического
действия.
18. ФОСФИНОВЫЕ КИСЛОТЫ
Фосфи́новые кисло́ты — фосфорсодержащие органические соединения общей формулы R2P(=O)OH,формально являющиеся замещенными производными фосфиновой кислоты Н2P(=O)OH
Применение:
Используются в лабораторной практике и органическом синтезе.
ПРОЧИЕ СОЕДИНЕНИЯ
Соединения, содержащие связи P-Cl, P-OR, P-N классифицируются как галогенангидриды, эфиры и амиды
соответствующих кислот. Наиболее типичными реакциями соединений этого ряда являются реакции
нуклеофильного замещения у атома фосфора:
19.
Производные фосфоновых, фосфиновых, фосфорной кислот и их серосодержащих аналогов(тиофосфоновых и тиофосфиновых кислот) применяются в качестве инсектицидов (средств борьбы с
вредителями сельского хозяйства):
К типу фосфорорганических производных со смешанными функциями галогенангидридов, эфиров или
амидов относятся сильнейшие боевые отравляющие вещества нервно-паралитического действия (табун,
зарин, зоман):
20.
Соединения, содержащие пятиковалентный фосфор, — алкилиденфосфораны могут выступать в качественуклеофильных реагентов в реакциях с альдегидами и кетонами (реакция Виттига):
21. ТАУТОМЕРИЯ ФОСФОРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ (взаимные превращения)
ТАУТОМЕРИЯСОЕДИНЕНИЙ
ФОСФОРООРГАНИЧЕСКИХ
(взаимные
превращения)
Многие фосфорорганические соединения склонны к обратимым изомеризациям. Чаще всего такие
изомеризации относятся к прототропным процессам, то есть явлениям, связанным с перемещением протона.
Очень интересные результаты получены при изучении тиокислот пятивалентного фосфора:
Важное значение имеет таутомерия гирофосфорильных соединений:
22.
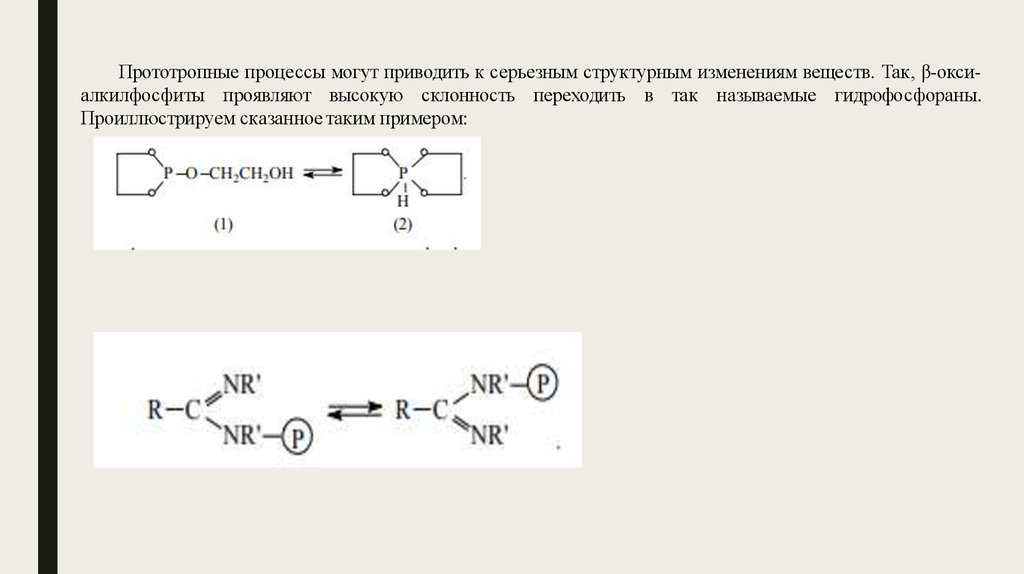
Прототропные процессы могут приводить к серьезным структурным изменениям веществ. Так, β-оксиалкилфосфиты проявляют высокую склонность переходить в так называемые гидрофосфораны.Проиллюстрируем сказанное таким примером:
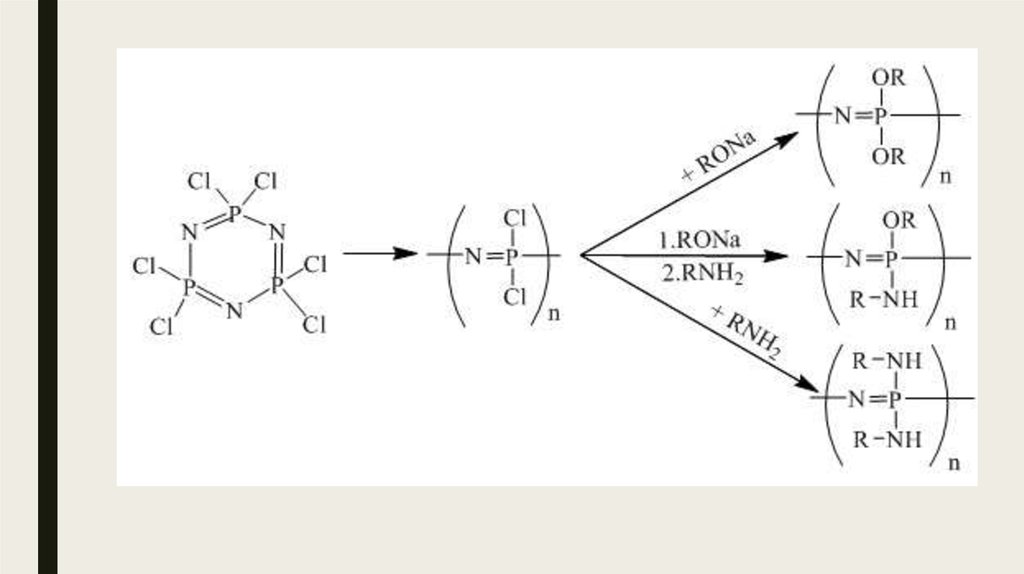
23. Фосвазены
Фосфазены - Большой интерес для полимерной химии представляют соединения фосфора с азотом,так называемые фосфазены с общей формулой (NPR2)n, где R=Hal (чаще всего Cl) или органический
радикал ( алкильный или арильный, алкокси-
или алкоксигруппа, аминогруппа и др.) Известны
соединения циклической и линейной структуры способны к реакции Полимеризации с образованием
высокомолекулярных полимеров, обладающих рядом ценных для практического Использования свойств.
Исходными
соединениями
дихлорциклофосфазены.
для
получения
Фосфазены
-
органических
бесцветные
производных,
жидкости
растворимые в органических растворителях.
Рис 1 . Структура дихлорциклофосфазена
либо
как
правило,
кристаллические
служат
вещества,
24. Получение
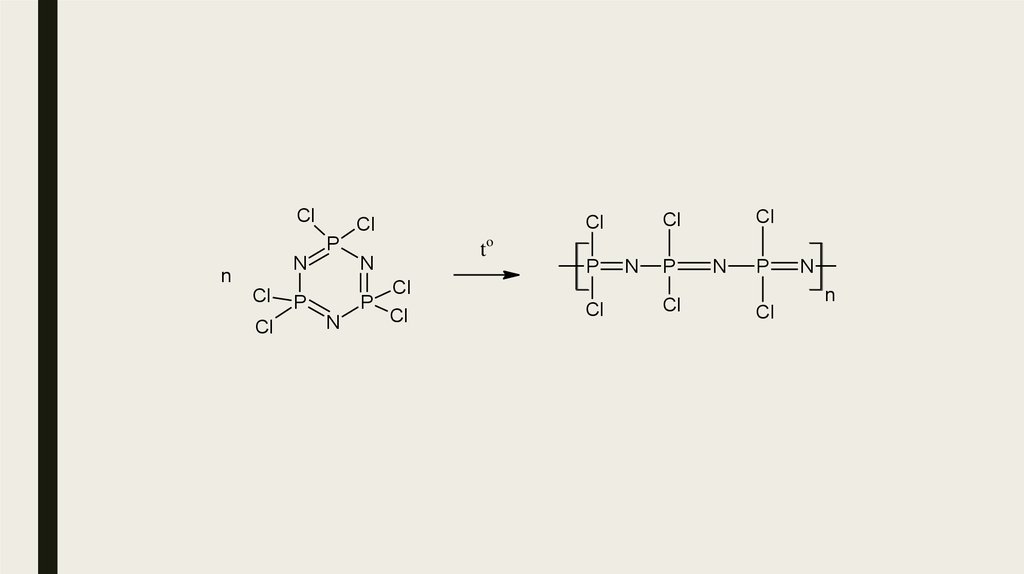
nPCl5 + nNH4Cl[NPCl2 )n + 4nHCl
Схема реакции получения дихлоциклофосфазенов
R2PCl3 + nNH4Cl
(NPR2 )n + 4nHCl
Схема реакции получения диорганоциклофосфазенов
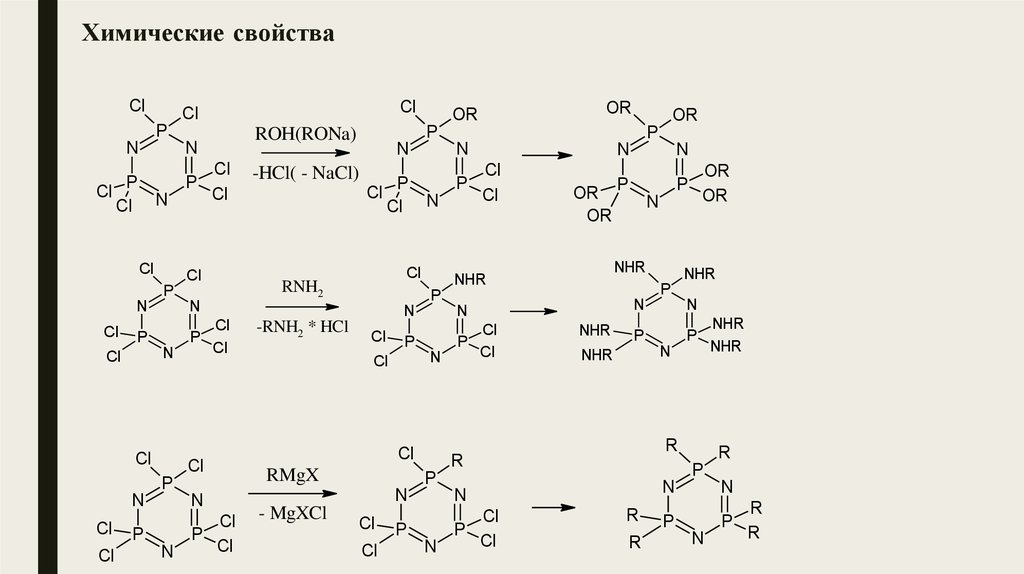
25. Химические свойства
ClCl
Cl
P
N
N
P
Cl
Cl N
P
Cl
Cl
Cl
N
P
P
N
Cl
Cl
Cl
Cl
Cl
P
Cl
Cl
N
N
P
Cl
P
Cl
N
-RNH2 * HCl
N
P
Cl
Cl N
P
Cl
Cl
Cl
OR
OR
Cl
N
N
P
Cl
P
Cl
N
Cl
RMgX
N
N
P
P
P
NHR
N
P
P
N
NHR
R
Cl
Cl
P
Cl
P
Cl
N
NHR
NHR
R
P
P
N
NHR
N
R
N
OR
OR
N
NHR
NHR
P
Cl
- MgXCl
P
N
RNH2
P
N
-HCl( - NaCl)
OR
P
ROH(RONa)
Cl
Cl
OR
OR
R
R
N
N
P
P
N
R
R
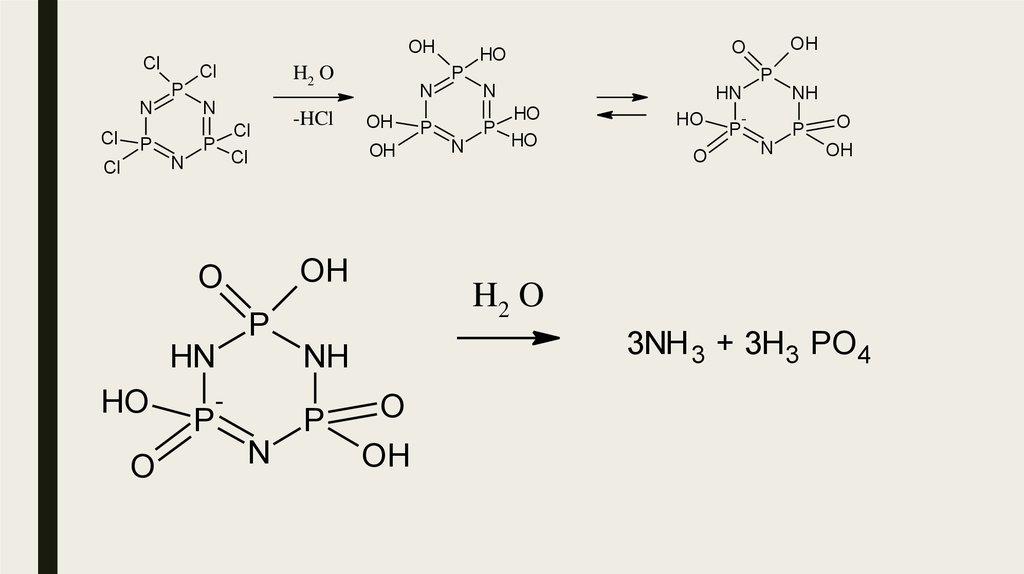
26.
OHCl
Cl
H2 O
P
N
Cl
N
P
N
Cl
Cl
P
Cl
-HCl
P
OH
OH
OH
O
HO
O
P
P
N
P
P
N
HN
HO
HO
HO
O
NH
-
P
P
N
O
OH
3NH 3 + 3H3 PO4
NH
-
N
P
H2 O
P
HN
N
OH
O
HO
O
OH
27.
ClP
n
Cl
Cl
N
N
P
P
N
to
Cl
Cl
P
Cl
Cl
Cl
Cl
Cl
N
P
Cl
N
P
Cl
N
n
28.
Полифосфазены биомедицинского назначения синтезируют путем молекулярного замещения полидихлорофосфазена, получаемого, в свою очередь, из хлорофосфазенов, в частности гексахлорциклотрифосфазена .29.
30. Синтез полифосфазенов
Синтез полифосфазеновГетерополифосфазены [—N=P(R2)—X—], получают поликонденсацией хлорфосфазенов с полифункцион.
фенолами и аминами (наиб. важны полифосфазены на основе двухатомных фенолов). Представляют собой
фосфорсодержащие аналоги фенольных и аминоаль-дегидных смол. Используют такие полифосфазены как
связующие для пластиков, обладающих повышенными огне- и термостойкостью, как пленкообразователи
для лакокрасочных материалов и клеев.





















 chemistry
chemistry








