Similar presentations:
Введение в химию. Что изучает химия?
1.
Введение вхимию
Что изучает химия?
vВещества
vМолекулы
vАтомы
2.
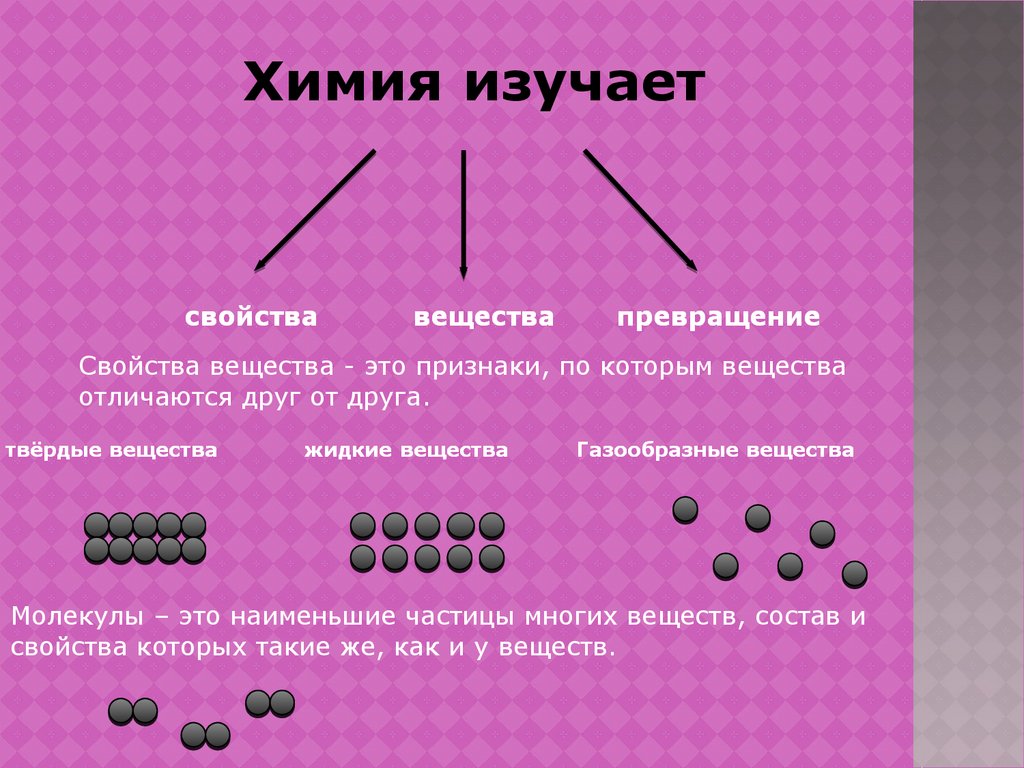
Химия изучаетСвойства вещества - это признаки, по которым вещества
отличаются друг от друга.
Молекулы – это наименьшие частицы многих веществ, состав и
свойства которых такие же, как и у веществ.
3.
Атомы – это мельчайшие химически неделимые частицы вещества.Химический элемент – это определённый вид атомов.
Простые вещества – это вещества, образованные атомами одного
химического элемента.
Сложные вещества – это вещества, образованны атомами разных
химических элементов.
4.
Символы химических элементов введены в 1814 годушведским химиком Й. Я. Берцелиусом.
5.
Лабораторная посудаХимический стакан
Колба
Большие и маленькие колбы
Мерный цилиндр
Воронка
6.
ИЗУЧЕНИЕ СТРОЕНИЯ ПЛАМЕНИ СПИРТОВКИ1.Фитиль
2.Диск с трубкой
3.Резервуар (сосуд)
4.Колпачок
7.
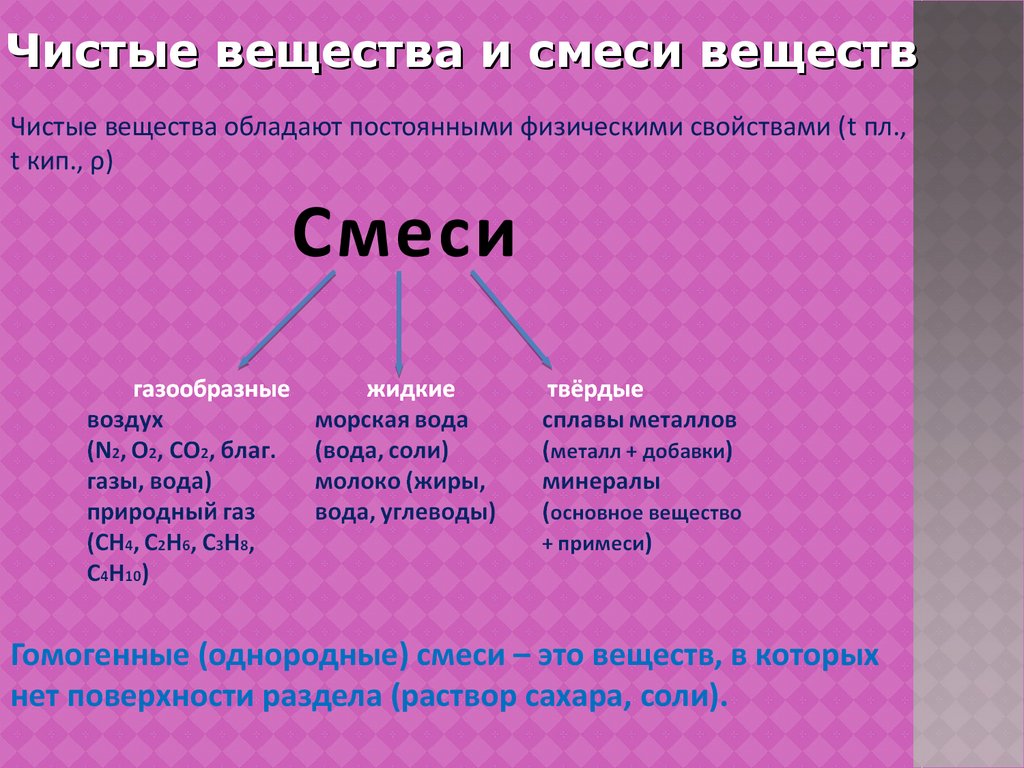
Чистые вещества и смеси веществЧистые вещества обладают постоянными физическими свойствами (t пл.,
t кип., ρ)
Смеси
Гомогенные (однородные) смеси – это веществ, в которых
нет поверхности раздела (раствор сахара, соли).
8.
-ОтстаиваниеСп
ос
об
ы
ра
зд
ел
ен
ия
см
ес
ей
Гетерогенные (не однородные) смеси – смеси веществ, в
которых есть поверхность раздела (туман, мутная вода,
пыльный воздух).
-Фильтрование
-Выпаривание
9.
Отстаивание – способ разделения смеси, которыйоснован на различной плотности веществ.
Фильтрование – способ разделения смеси, который
основан на различной пропускной способности
пористого материала – фильтра по отношению к
составляющим смесь частицам.
Выпаривание – выделение летучих твёрдых веществ
из раствора в летучем растворителе
10.
Концентрация растворовm р – ра = m р.в. + m р - ля
100% = ω р.в. + ω р- ля
ω ( амега ) – массовая доля растворённого вещества.
ω части = m части
m целого
Дано:
m cоли = 12 г
m H2O = 68 г
ω соли = ?
ω р.в. = m р.в.
m р - ра
Решение:
1) m р –ра = m c + m H2O
= 12 г + 68 г = 80 г
2) ω с = m c= 12 г= 0,15
m р – ра 80 г
11.
АТОМАтом – это электронейтральная и химически
неделимая частица, состоящая из положительно
заряженного ядра и движущихся вокруг него
отрицательно заряженных электронов.
СТРОЕНИЕ АТОМА
Ядро
Масса
частицы
Заряд
частицы
Электронная оболочка
Нуклоны
P+
n°
1 а.е.м.
протоны
+1
1 а.е.м.
нейтроны
0
Электроны
ē
0
-1
12.
Порядковый номер =элемента
Заряд ядра = Число протонов = Число электронов
13.
A=Z+NN=A-Z
A = массовое число
Z = число протонов
N = число нейтронов
7 Li 3p⁺
3
4n°
3ē
27 Al 13p⁺
13
14n°
13ē
137
Ba
56
40
K 19p⁺
19
21n°
19ē
56p⁺
81nˉ
56ē
14.
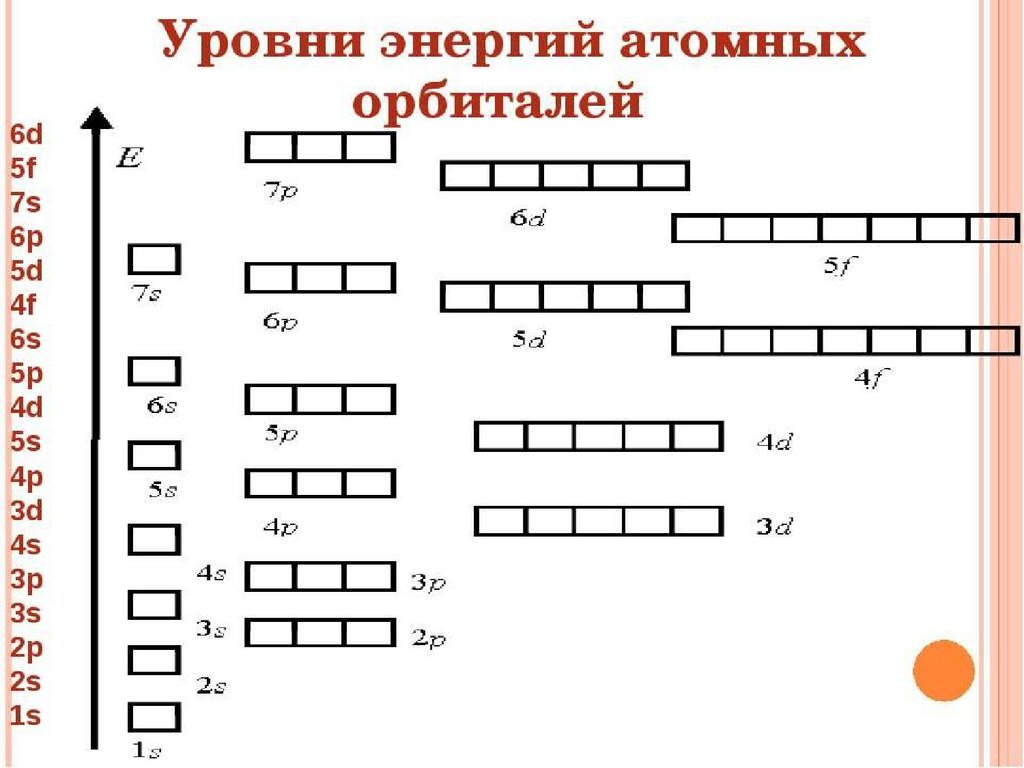
Строение электронной оболочкиСтроение электронной оболочки – это совокупность
всех электронов в атоме.
Электронный слой или энергетический уровень (ЭУ) –
совокупность электронов с близкими значениями энергии.
N – максимальное количество электронов на ЭУ.
n – номер ЭУ.
На 1 – ом ЭУ – max 2 ē
На 2 – ом ЭУ – max 8 ē
На 3 – ом ЭУ – max 18 ē
На 4 – ом ЭУ – max 32 ē
N периоде = число ЭУ
N группы = число ē на внешнем ЭУ
15.
11H
4
2 He
+1
1
- схема атома
+2
2
Атомная орбиталь
Атомная орбиталь – пространство
вокруг ядра, в котором положение
электрона наиболее вероятно.
-S орбиталь
-p орбиталь
объемная
восьмёрка
- max 2 ē
16.
y-max 6 ē
px, py, pz
x
p - подуровень
z
d и f орбитали более сложные по форме и энергии.
-max 10 ē
d - подуровень
-max 14 ē
f - подуровень
Схема строения атома
массовое
1
число
1 H
+1
порядковый номер
1
7
Li
3
+3
2
3














 chemistry
chemistry








