Similar presentations:
Что изучает наука химия
1.
Проверка остаточных знаний• Что изучает наука химия?
• Это наука о веществах
• Это наука о превращении веществ
• Это наука о свойствах веществ
• Это наука о веществах, их свойствах и
превращениях.
2.
• Что такое простое вещество?• Вещество , образованное химическими
элементами
• Вещество, образованное атомами
химических элементов
• Вещество, образованное атомами одного
химического элемента
• Вещество, образованное атомами разных
химических элементов.
3.
• В каком ряду расположены тольковещества
• поваренная соль, сахар, свеча
• вода, железо, сера
• медь, гвоздь, кислород
• кирпич, пищевая сода, керамический
стакан.
4.
• Верны ли следующие суждения?А) Вещество - это то, из чего состоит
физическое тело.
В) Химический элемент - это
определенный вид атомов.
• Верно только А
• Верно только В
• Верны оба суждения
• Оба суждения неверны.
5.
• Тело:• Графит
• Полиэтилен
• Свинец
• Пробирка
6.
• Вещество:• Медная проволока
• Медная монета
• Медная пластина
• Медь
7.
• Простое вещество:• Водород
• Углекислый газ
• Сахар
• Поваренная соль
8.
• Сложное вещество• Фосфор
• Крахмал
• Сера
• Медь
9.
• Говорят о водороде, как о простомвеществе:
• Водород – самый легкий газ
• Порядковый номер водорода в
Периодической таблице-1
• Водород входит в состав воды
• Водород входит в состав кислоты
10.
• Говорят о меди как о химическомэлементе
• Медь не реагирует с соляной кислотой
• Медь окисляется при нагревании
• Медная проволока
• Медь входит в состав медного купороса
11.
Структура ОГЭ по химии• Экзаменационная работа по химии состоит из 2 частей, включающих в
себя 24 задания:
• Часть 1 содержит 19 заданий с кратким ответом. Максимальное
количество баллов — 24.
• Часть 2 содержит 3 задания с развернутым ответом. Это задание на
расстановку коэффициентов методом электронного баланса в
заданном уравнении, цепочка превращений из трех неорганических
реакций и расчетная задача. Максимальный балл — 10.
• В Части 2 присутствуют 2 экспериментальных задания. Сначала
необходимо выполнить задание 23: записать уравнения реакций и
описать предполагаемые качественные признаки превращений.
Затем следует изучить инструкцию и сообщить организатору в
аудитории о своей готовности приступить к выполнению самого
эксперимента (задание 24). Максимальный балл — 6.
• На выполнение всей экзаменационной работы по химии отводится 3
часа (180 минут).
12.
• Разбалловка такая:• 5 выставляется при получении 31-40 баллов.
• 4 выставляется при получении 21-30 баллов.
• 3 выставляется при получении 10-20 баллов.
• Если у вас меньше 10 баллов, вы не
сдали экзамен.
13.
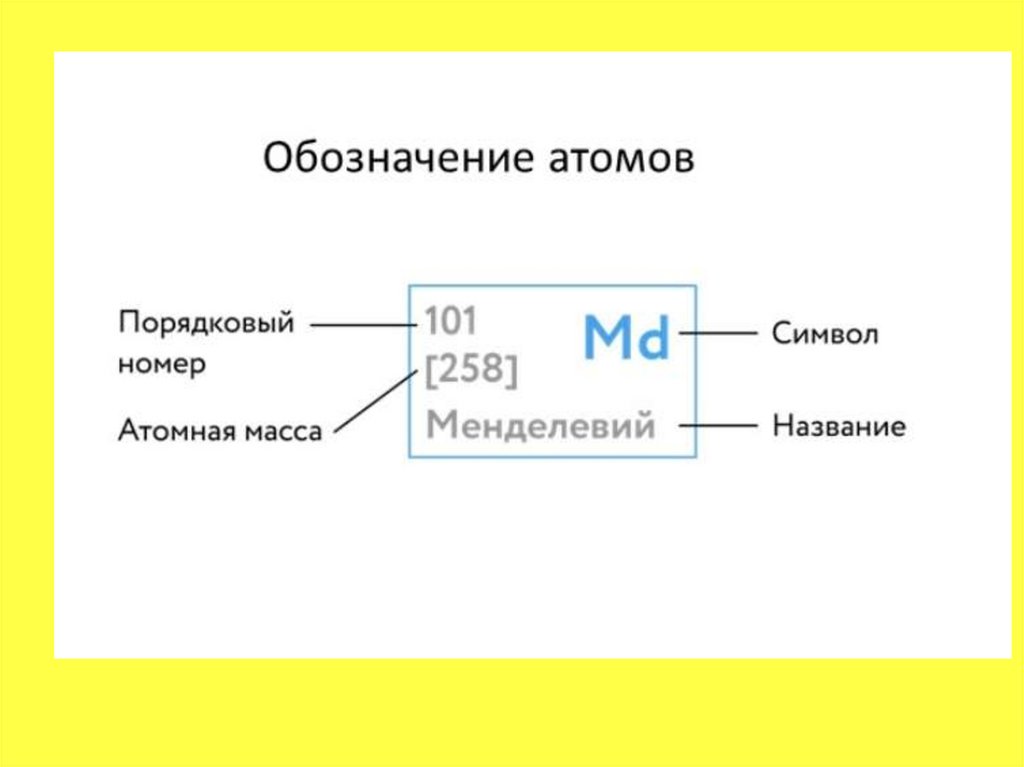
Строение атома. Строение электронныхоболочек первых 20 элементов
Периодической системы Д.И. Менделеева.
Тема 1.
14.
15.
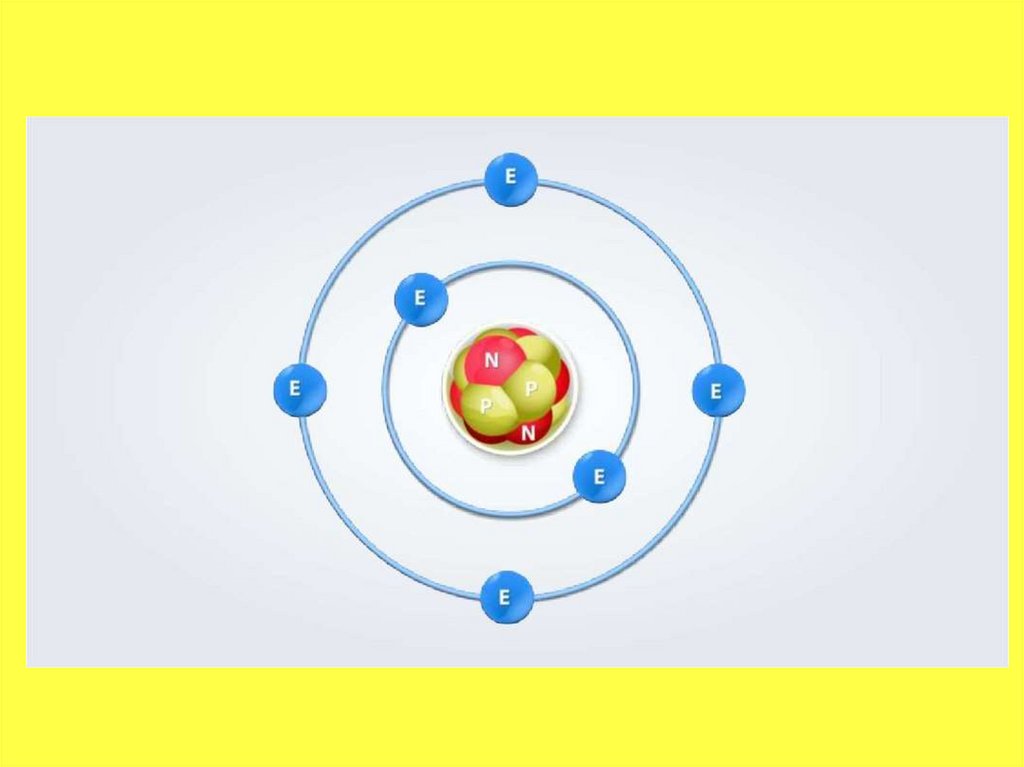
• Атом — это мельчайшая, электронейтральная,химически неделимая частица вещества,
состоящая из положительно заряженного ядра и
отрицательно заряженной электронной оболочки.
16.
• При этом электроны двигаются довольнохаотично. Совокупность электронов, которые
двигаются вокруг ядра,
называется электронной оболочкой.
• Атомное ядро — массивное и положительно
заряженное, расположено в центральной
части атома. Структура ядра довольно сложна,
и изучается в ядерной физике. Основные
частицы, из которых оно состоит —
протоны и нейтроны. Они связаны ядерными
силами (сильное взаимодействие).
17.
Рассмотрим основныехарактеристики протонов, нейтронов и электронов:
18.
• И — самое главное. Периодическая системахимических элементов, структурированная
Дмитрием Ивановичем Менделеевым,
подчиняется простой и понятной
логике: номер атома — это число протонов в
ядре этого атома.
• Следовательно, заряд ядра Z равен числу
протонов, т.е. номеру атома в Периодической
системе химических элементов.
19.
• Атом — это электронейтральная частица,следовательно, число протонов равно числу
электронов: Ne = Np = Z.
• Масса атома (массовое число A) примерно равна
суммарной массе крупных частиц, которые входят в
состав атома — протонов и нейтронов. Поскольку
масса протона и нейтрона примерно равна 1
атомной единице массы, можно использовать
формулу:
• M = Np + Nn
20.
• Массовое число указано в Периодическойсистеме химических элементов в ячейке
каждого элемента.
21.
Важно• При решении задач ЕГЭ массовое число
всех атомов, кроме хлора, округляется до
целого по правилам математики.
Массовое число атома хлора в ЕГЭ принято
считать равным 35,5.
22.
• Таким образом, рассчитать число нейтронов ватоме можно, вычтя из массового числа номер
атома: Nn = M – Z.
• В Периодической системе собраны химические
элементы — атомы с одинаковым зарядом ядра.
Однако, может ли меняться у этих атомов число
остальных частиц? Вполне. Например, атомы с
разным числом нейтронов
называют изотопами данного химического
элемента. У одного и того же элемента может быть
несколько изотопов.
23.
• У изотопов одного элемента массовоечисло одинаковое или разное?
• У изотопов одного элемента число
протонов одинаковое или разное?
24.
• Разновидности атомов одногохимического элемента, имеющие разные
атомные массы, называют изотопами.
Изотопы — разновидности атомов с
одинаковым числом протонов в ядре
(зарядом ядра), но разным числом
нейтронов. Значит, изотопы отличаются
только числом нейтронов.
25.
• Химические свойства атомов определяются строениемэлектронной оболочки и зарядом ядра. Таким образом,
химические свойства изотопов одного элемента
практически не отличаются.
• Поскольку атомы одного элемента могут существовать в
форме разных изотопов, в названии часто указывается
массовое число, например, хлор-35, и принята такая
форма записи атомов:
26.
• Определите количество нейтронов,протонов и электронов в изотопе брома-81.
• Определите число нейтронов в изотопе
хлора-37.
27.
Двухатомные молекулы• Запомнить 7 двухатомных молекул.
• H2 N2 O2 F2 Cl2 Br2 I2
28.
Строение электронной оболочки• Согласно квантовой модели строение атома
Нильса Бора, электроны в атоме могут
двигаться только
по определенным (стационарным) орбита
м, удаленным от ядра на определенное
расстояние и характеризующиеся
определенной энергией. Другое название
стационарны орбит — электронные
слои или энергетические уровни.
29.
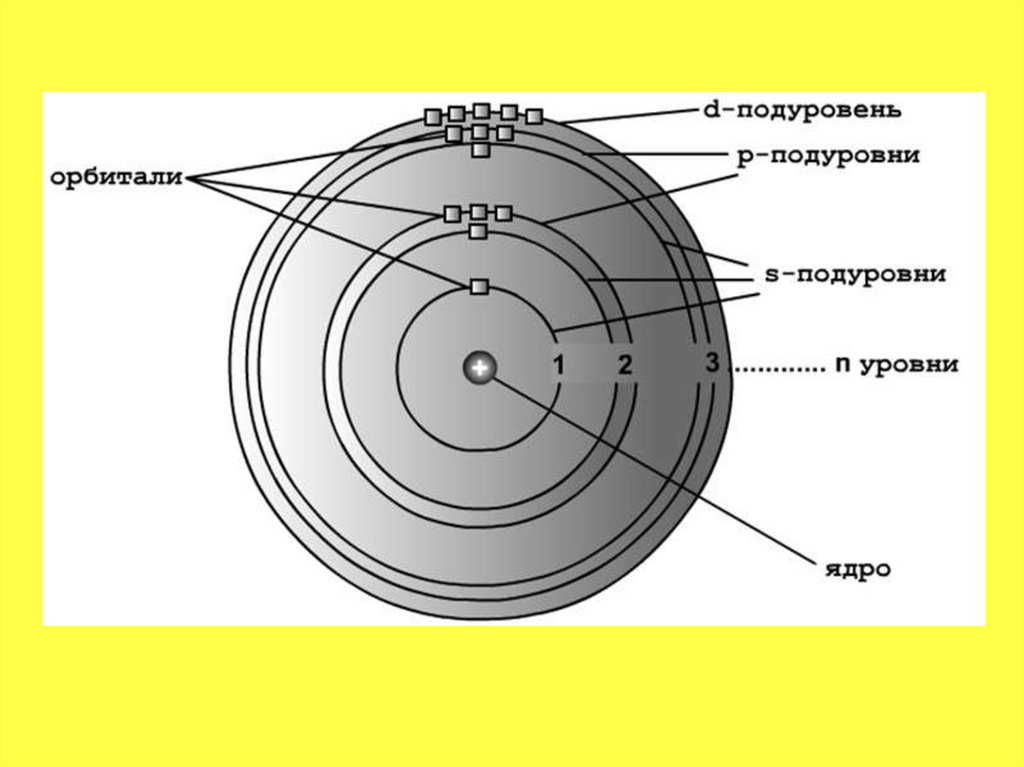
30.
• Электронные уровни можно обозначатьцифрами — 1, 2, 3, …, n. Номер слоя
увеличивается мере удаления его от ядра.
Номер уровня соответствует главному
квантовому числу n.
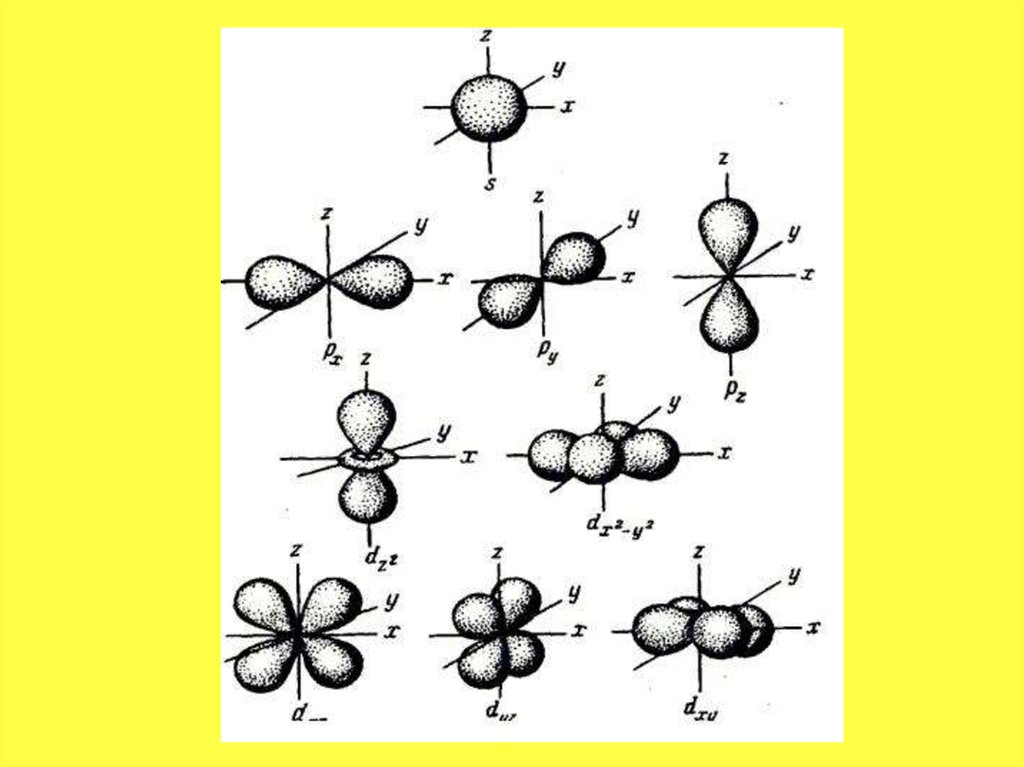
• В одном слое электроны могут двигаться по
разным траекториям. Траекторию орбиты
характеризует электронный подуровень. Тип
подуровня характеризует орбитальное
квантовое число l = 0,1, 2, 3 …, либо
соответствующие буквы — s, p, d, g и др.
31.
32.
• В рамках одного подуровня (электронныхорбиталей одного типа) возможны варианты
расположения орбиталей в пространстве. Чем
сложнее геометрия орбиталей данного
подуровня, тем больше вариантов их
расположения в пространстве. Общее число
орбиталей подуровня данного типа l можно
определить по формуле: 2l+1. На каждой
орбитали может находиться не более двух
электронов.
33.
• Электронная оболочка атома — это всеэлектроны атома. Электроны в электронной
оболочке атома расположены слоями.
Электроны в разных слоях различаются
энергией взаимодействия с ядром атома.
Чем дальше от ядра находится электрон,
тем меньше энергия его взаимодействия с
ядром.
34.
• Вместимость электронных слоев различная. В слое № 1,или в первом слое, у всех элементов, кроме водорода,
находится 2 электрона. (В атоме водорода всего 1.
электрон, и он — в первом слое.) Во втором
слое может находиться не больше восьми
электронов. В третьем слое максимально может
расположиться 18 электронов. В четвертом
слое максимально бывает 32 электрона.
• Если N — максимальное число электронов на
электронном слое с номером n, то для определения
числа N можно воспользоваться формулой
• N = 2n2 .
35.
• Завершенный электронный слой — это слой в атоме,содержащий максимально возможное для него число
электронов.
• Электронные слои заполняются так: сначала первый,
потом второй и последующие — по мере уменьшения
энергии их взаимодействия с ядром. Расположение по
слоям электронов в атомах водорода, кислорода и магния:
36.
37.
• Химические свойства атомов определяютсясвойствами их электронов. Движение
электронов в атоме описывают с
привлечением понятия орбитали. Каждый
электрон в атоме находится на своей
орбитали.
38.
39.
• Орбиталь — это часть электронного облака,создаваемого электронами при движении в
атоме. Орбиталь — это пространство около
ядра, где чаще всего находится электрон.
40.
Заполнение электронами энергетических орбиталейпроисходит согласно некоторым основным правилам.
• Принцип Паули (запрет Паули): на одной атомной
орбитали могут находиться не более двух электронов с
противоположными спинами (спин — это
квантовомеханическая характеристика движения
электрона).
• Правило Хунда. На атомных орбиталях с одинаковой
энергией электроны располагаются по одному с
параллельными спинами. Т.е. орбитали одного
подуровня заполняются так: сначала на каждую
орбиталь распределяется по одному электрону. Только
когда во всех орбиталях данного подуровня
распределено по одному электрону, занимаем
орбитали вторыми электронами, с противоположными
спинами.
41.
• Таким образом, сумма спиновыхквантовых чисел таких электронов на
одном энергетическом подуровне
(оболочке) будет максимальной.
42.
• Принцип минимума энергии. Электронызаполняют сначала орбитали с наименьшей
энергией. Энергия атомной орбитали
эквивалентна сумме главного и
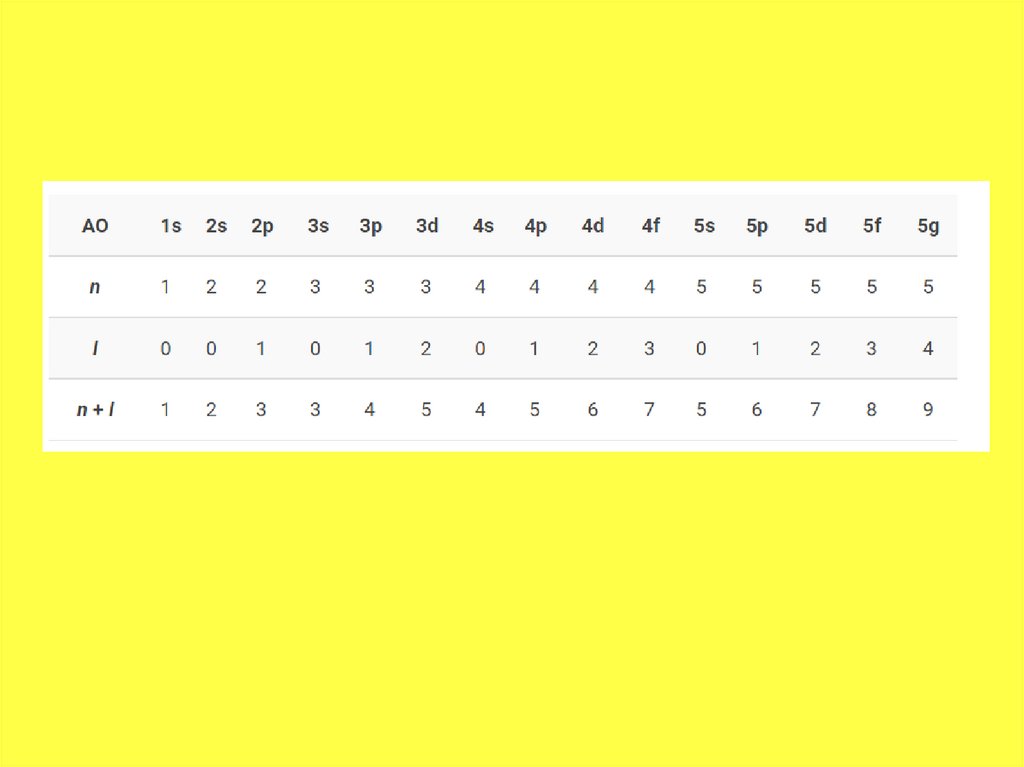
орбитального квантовых чисел: n + l. Если
сумма одинаковая, то заполняется первой
та орбиталь, у которой меньше главное
квантовое число n.
43.
44.
• Таким образом, энергетический рядорбиталей выглядит так:
• 1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s <
4d < 5p < 6s < 4f~5d < 6p < 7s <5f~6d …
45.
• Электронную структуру атома можнопредставлять в разных формах —
энергетическая диаграмма, электронная
формула и др. Разберем основные.
• Энергетическая диаграмма атома — это
схематическое изображение орбиталей с
учетом их энергии. Диаграмма показывает
расположение электронов на энергетических
уровнях и подуровнях. Заполнение орбиталей
происходит согласно квантовым принципам.
46.
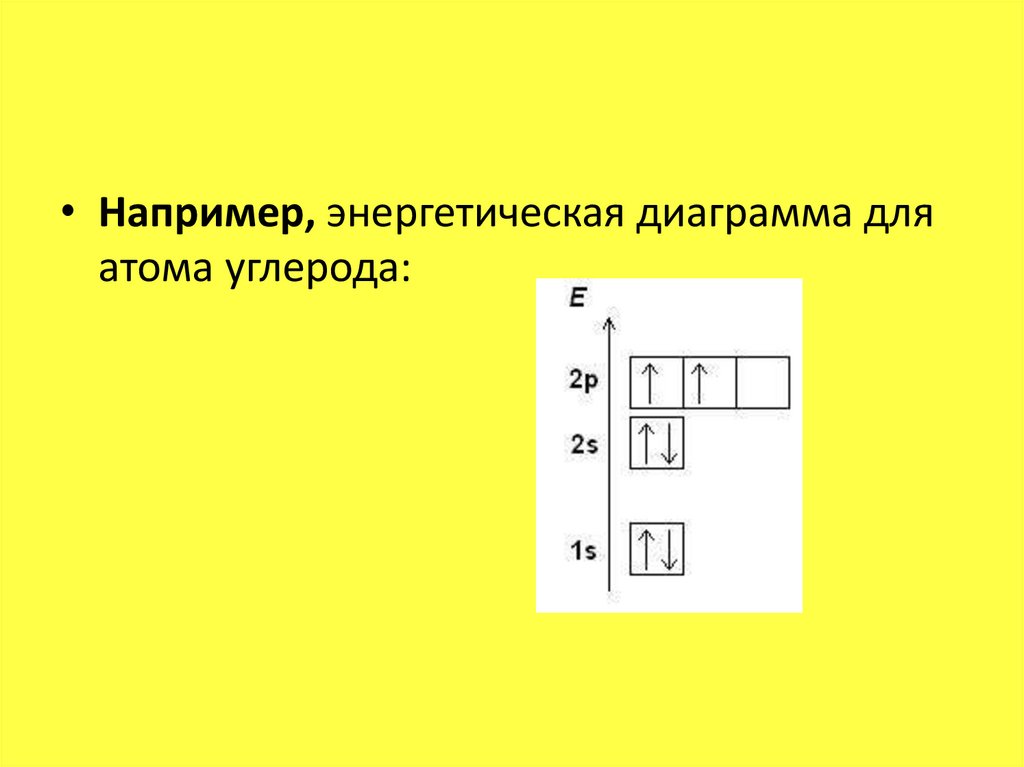
• Например, энергетическая диаграмма дляатома углерода:
47.
• Электронная формула — это записьраспределения электронов по орбиталям
атома или иона. Сначала указывается номер
уровня, затем тип орбитали. Верхний индекс
справа от буквы показывает число электронов
на орбитали. Орбитали указываются в порядке
заполнения. Запись 1s2 означает, что на 1
уровне s-подуровне расположено 2 электрона.
• Например, электронная формула углерода
выглядит так: 1s22s22p2.
48.
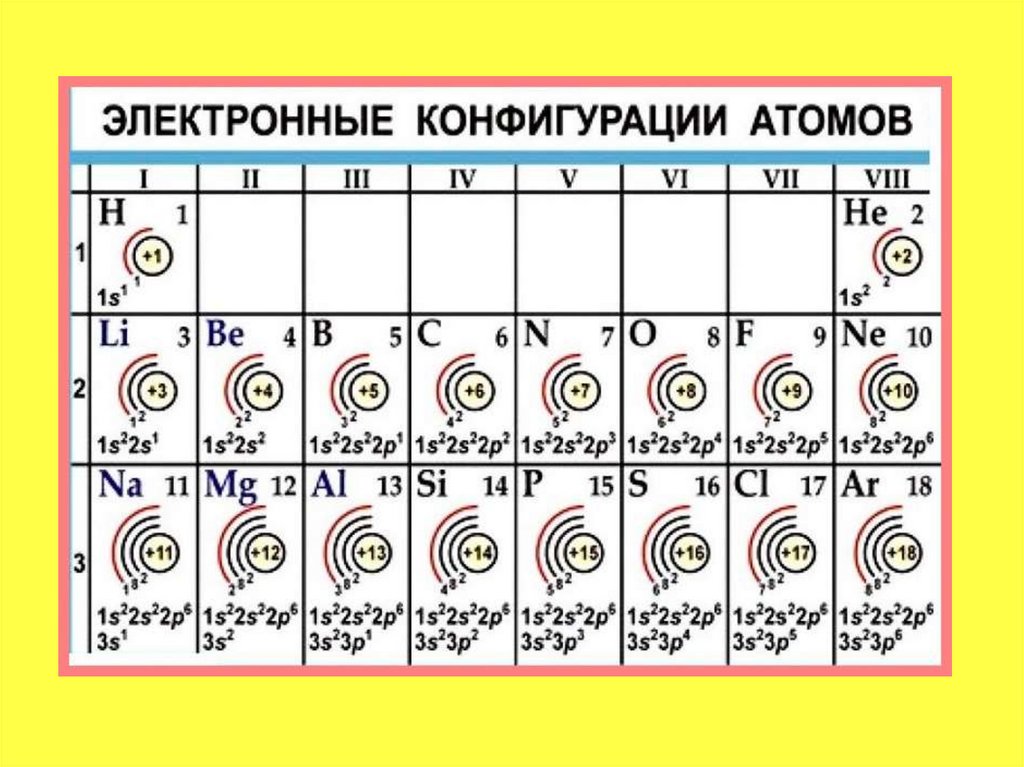
Электронные формулы элементовпервых четырех периодов
49.
50.
• Рассмотрим заполнение электронамиоболочки элементов первых четырех
периодов. У водорода заполняется самый
первый энергетический уровень, sподуровень, на нем расположен 1
электрон:
51.
• У гелия 1s-орбиталь полностью заполнена:52.
• У бериллия 2s-подуровень заполнен:53.
• У бора заполняется p-подуровень второгоуровня:
54.
• У следующего элемента, углерода,очередной электрон, согласно правилу
Хунда, заполняет вакантную орбиталь, а не
заполняет частично занятую:
55.
• Попробуйте составить электронную иэлектронно-графическую формулы для
следующих элементов.
• Азот
• Кислород
• Фтор
56.
57.
• У неона завершено заполнение второгоэнергетического уровня:
58.
• У натрия начинается заполнение третьегоэнергетического уровня:
59.
• От натрия до аргона заполнение 3-го уровня происходит втом же порядке, что и заполнение 2-го энергетического
уровня.
• А вот начиная с 19-го элемента, калия, иногда начинается
путаница — заполняется не 3d-орбиталь, а
4s. Заполнение энергетических уровней и подуровней
электронами происходит по энергетическому ряду
орбиталей, а не по порядку. Рекомендую повторить его
еще раз. Таким образом, формула калия:
60.
61.
62.
• Дальнейшее заполнение 3d-подуровняпроисходит согласно квантовым правилам,
от титана до ванадия:
63.
• Однако, у следующего элемента порядокзаполнения орбиталей нарушается.
Электронная конфигурация хрома такая:
64.
• При «традиционном» порядке заполнения орбиталей(соответственно, неверном в данном случае —
3d44s2) ровно одна ячейка в d-подуровне оставалась бы
незаполненной. Оказалось, что такое заполнение
энергетически менее выгодно. А более выгодно,
когда d-орбиталь заполнена полностью, хотя бы
единичными электронами. Этот лишний электрон
переходит с 4s-подуровня. И небольшие затраты
энергии на перескок электрона с 4s-подуровня с лихвой
покрывает энергетический эффект от заполнения
всех 3d-орбиталей. Этот эффект так и называется —
«провал» или «проскок» электрона. И наблюдается он,
когда d-орбиталь недозаполнена на 1 электрон (по
одному электрону в ячейке или по два).
65.
• У меди мы снова наблюдаем провал(проскок) электрона — электрон опять
проскакивает с 4s-подуровня на 3dподуровень:
• +29Cu [Ar]3d104s1
66.
• На цинке завершается заполнение 3dподуровня:• +30Zn [Ar]3d104s2
67.
• У следующих элементов,от галлия до криптона, происходит
заполнение 4p-подуровня по квантовым
правилам. Например, электронная
формула галлия:
• +31Ga [Ar]3d104s24p1
68.
• Некоторые важные понятия:• Внешний энергетический уровень — это
энергетический уровень в атоме
с максимальным номером, на котором
есть электроны.
• Например, у меди ([Ar]3d104s1) внешний
энергетический уровень — четвёртый.
69.
• Валентные электроны — электроны ватоме, которые могут участвовать в
образовании химической связи. Например,
у хрома (+24Cr [Ar]3d54s1) валентными
являются не только электроны внешнего
энергетического уровня (4s1), но и
неспаренные электроны на 3d-подуровне,
т.к. они могут образовывать химические
связи.
70.
Основное и возбужденноесостояние атома
71.
• Электронные формулы, которые мы составляли доэтого, соответствуют основному энергетическому
состоянию атома. Это наиболее выгодное
энергетически состояние атома.
• Однако, чтобы образовывать химические связи, атому в
большинстве ситуаций необходимо наличие
неспаренных (одиночных) электронов. А химические
связи энергетически очень для атома выгодны.
Следовательно, чем больше в атоме неспаренных
электронов — тем больше связей он может
образовать, и, как следствие, перейдёт в более
выгодное энергетическое состояние.
72.
• Поэтому при наличии свободныхэнергетических орбиталей на данном
уровне спаренные
пары электронов могут распариваться, и
один из электронов спаренной пары может
переходить на вакантную орбиталь. Таким
образом число неспаренных электронов
увеличивается, и атом может
образовать больше химических связей, что
очень выгодно с точки зрения энергии. Такое
состояние атома называют возбуждённым и
обозначают звёздочкой.
73.
• Например, в основномсостоянии бор имеет следующую
конфигурацию энергетического уровня:
74.
• На втором уровне (внешнем) одна спареннаяэлектронная пара, один одиночный электрон и
пара свободных (вакантных) орбиталей.
Следовательно, есть возможность для перехода
электрона из пары на вакантную орбиталь,
получаем возбуждённое состояние атома бора
(обозначается звёздочкой):
75.
• Попробуйте самостоятельно составитьэлектронную формулу, соответствующую
возбуждённому состоянию атомов.
Углерод
76.
77.
Электронные формулы ионов78.
• Атомы могут отдавать и приниматьэлектроны. Отдавая или принимая
электроны, они превращаются в ионы.
• Ионы — это заряженные частицы.
Избыточный заряд
обозначается индексом в правом верхнем
углу.
79.
• Если атом отдаёт электроны, то общий зарядобразовавшейся частицы
будет положительный (вспомним, что число протонов в
атоме равно числу электронов, а при отдаче электронов
число протонов будет больше числа электронов).
Положительно заряженные ионы —
это катионы. Например: катион натрия образуется так:
• +11Na 1s22s22p63s1
-1е = +11Na+ 1s22s22p63s0
80.
• Если атом принимает электроны, топриобретает отрицательный заряд.
Отрицательно заряженные частицы —
это анионы. Например, анион хлора
образуется так:
• +17Cl 1s22s22p63s23p5 +1e = +17Cl— 1s22s22p63s23p6
81.
• Таким образом, электронные формулыионов можно получить добавив или отняв
электроны у атома. Обратите внимание,
при образовании катионов электроны
уходят с внешнего энергетического уровня.
При образовании анионов электроны
приходят на внешний энергетический
уровень.
82.
• Попробуйте составить самостоятельноэлектронный формулы ионов.
• Ион Са2+
83.
• Электронная формула иона кальция Са2+:• +20Ca2+ 1s22s22p63s23p6
84.
• В некоторых случаях совершенно разныеатомы образуют ионы с одинаковой
электронной конфигурацией. Частицы с
одинаковой электронной конфигурацией и
одинаковым числом электронов
называют изоэлектронными частицами.












































































 chemistry
chemistry








