Similar presentations:
Общая химия
1.
1. Общая химия1.2. Строение атома
Периодический закон
1.2.1.Состав атома. Строение
электронных оболочек
2.
Атом – мельчайшая химически неделимаячастица, но эта частица имеет сложное строение
А. Беккерель
1853–1908 гг.
Э. Резерфорд
1871–1937 гг
Р. Милликен
1868–1953 гг.
3.
Планетарная модель атома1. В центре атома находится положительно
заряженное ядро, занимающее ничтожную часть
пространства внутри атома.
2. Вокруг ядра двигаются электроны, они образуют
т.н. электронную оболочку. Их общий заряд
равен заряду ядра атома, но с противоположным
знаком. Атом – электронейтральная частица.
3. Ядро состоит из протонов и нейтронов. Эти
частицы носят общее название – нуклоны.
4. Протоны (р) имеют заряд +1, электроны (е) имеют
заряд -1, нейтроны (n) не имеют заряда.
4.
В ядре сосредоточена почти вся масса атомамасса протона~ 1 а.е.м.
масса нейтрона ~ 1 а.е.м.
масса электрона ~ 0,0005 а.е.м.).
m (атома) = m (ядра) = число р + число n
протонное число = число р = заряд ядра = № элемента в ПС
нуклонное число = число нуклонов (т.е. всех протонов и нейтронов) =
массовое число (т.е. массе атома в а.е.м.)
Протонное и массовое число – важнейшие характеристики элемента.
Их указывают около знака химического элемента, например:
23
11Na
5.
Химический элемент. Изотопы.Совокупность атомов с одинаковым числом протонов называют
химическим элементом. Масса у этих атомов может быть
разная.
Совокупности атомов с одинаковое числом протонов, но разным
числом нейтронов, называют изотопами. Например: 126С и 136С
Изотопы — это разновидности
атомов одного и того же
химического элемента,
имеющие одинаковый заряд
атомного ядра, но разные
массовые числа.
6.
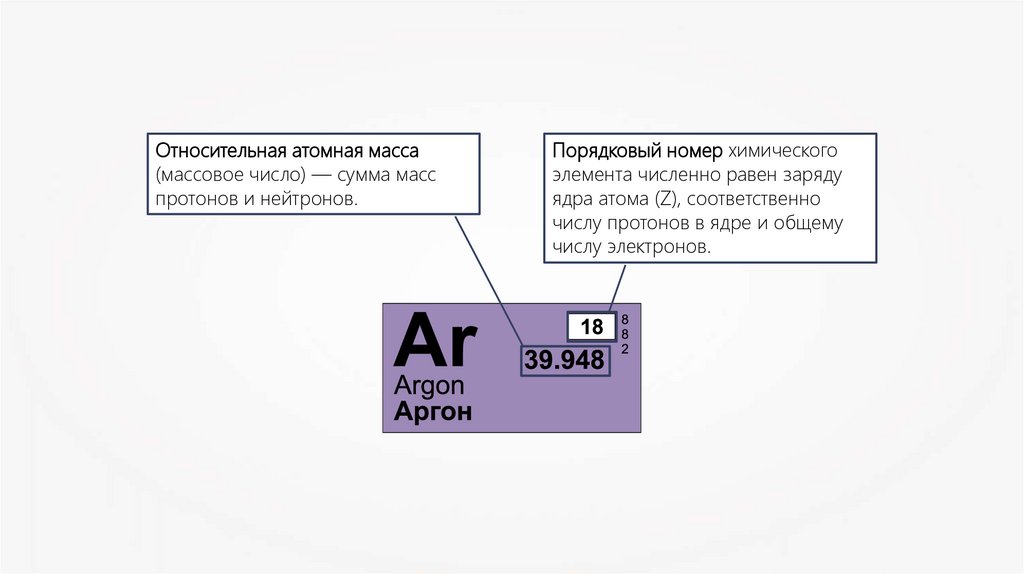
Относительная атомная масса(массовое число) — сумма масс
протонов и нейтронов.
Порядковый номер химического
элемента численно равен заряду
ядра атома (Z), соответственно
числу протонов в ядре и общему
числу электронов.
7.
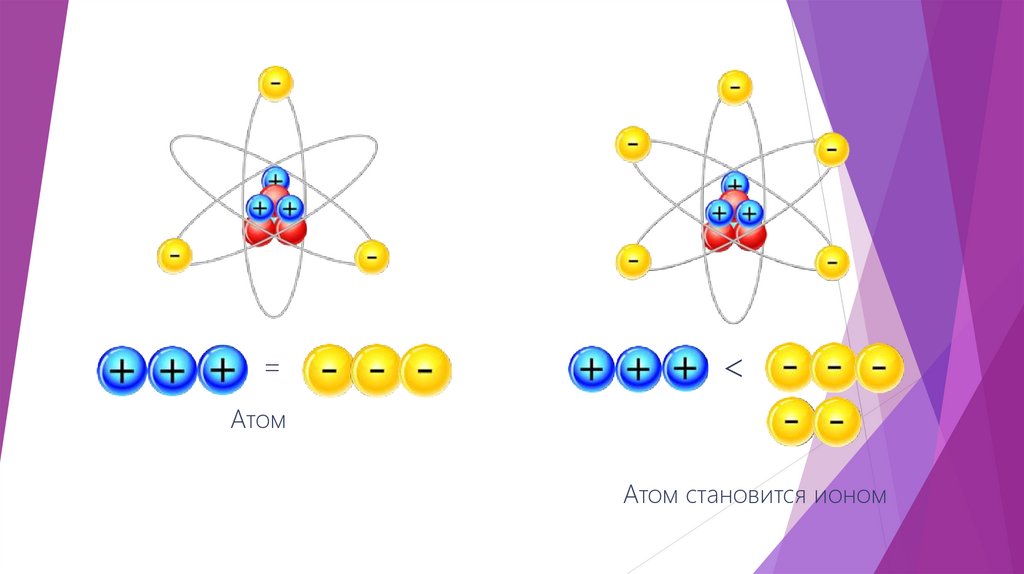
=<
Атом
Атом становится ионом
8.
Определите состав частиц27Al
Br
Na+
S2
Атом массой 14 а.е.м. имеет шесть электронов.
Ион с зарядом -3 имеет 15 протонов.
9.
Три идеи квантовой механикипринцип дискретности или
квантования
корпускулярно-волновой дуализм
вероятностный характер движения
объектов микромира
10.
Квантование энергии электрона в атомеФизические величины, относящиеся к
микрообъектам, изменяются не
непрерывно, а скачкообразно –
квантуются.
Электромагнитное излучение испускается
в виде отдельных порций (квантов)
энергии.
Кванты энергии впоследствии были названы
фотонами.
Значение одного кванта: ΔE = hν, где ΔE – энергия,
Дж; ν – частота, с–1;
h = 6,626.10–34 Дж с
(постоянная Планка).
Макс ПЛАНК
(1858 – 1947)
11.
Модель атома БораН. Бор
1885–1962 гг.
Электроны находятся на
стационарных орбитах и
двигаются с огромной скоростью.
Двигаясь по орбите электрон не
излучает и не поглощает энергии.
Это происходит только при
переходе электрона с одной
орбиты на другую. Причем чем
меньше радиус орбиты, тем
меньше энергия электрона.
Значит, переходя на более
удаленную орбиту электрон
должен поглощать энергию, а
переходя на меньшую орбиту
электрон излучает энергию.
12.
Корпускулярно-волновой дуализм(двойственность)
У электрона двойственная природа. Как частица
он имеет определенную массу (хотя и очень
маленькую даже по сравнению с протоном) и
заряд, а как волна – он имеет способность
огибать препятствие (дифракция).
Такую двойственную природу имеют и другие
микрочастицы, обладающие массой, размерами и
зарядом. Они одновременно проявляют и свойства
волны, т.е. способность к дифракции и интерференции
Кванты электромагнитного излучения (фотоны)
рассматривают как движущиеся со скоростью света
частицы, имеющие нулевую массу покоя (А. Эйнштейн).
13.
Вероятностный характер явлениймикромира
Для микрочастицы неприемлемо понятие о
траектории движения. Можно лишь говорить
о вероятности обнаружить ее каких-то
областях пространства.
Чем точнее определена скорость, тем
меньше известно о местоположении
частицы, и наоборот. (принцип
неопределенности)
Вернер ГЕЙЗЕНБЕРГ
(1901 - 1976)
14.
Современная теория строения атома (ТСА)Самым важным понятием современной ТСА стало
понятие об электронном облаке.
Электрон двигается с очень большой скоростью и
характер движения у него – вероятностный. Т.е.
он двигается не по определенной траектории, а
хаотично, в пространстве около ядра, причем
вероятность пребывания его в разных точках этого
пространства неодинакова.
Пространство около ядра, где
пребывание электрона наиболее
вероятно называют электронным облаком
или электронной орбиталью (эо).
15.
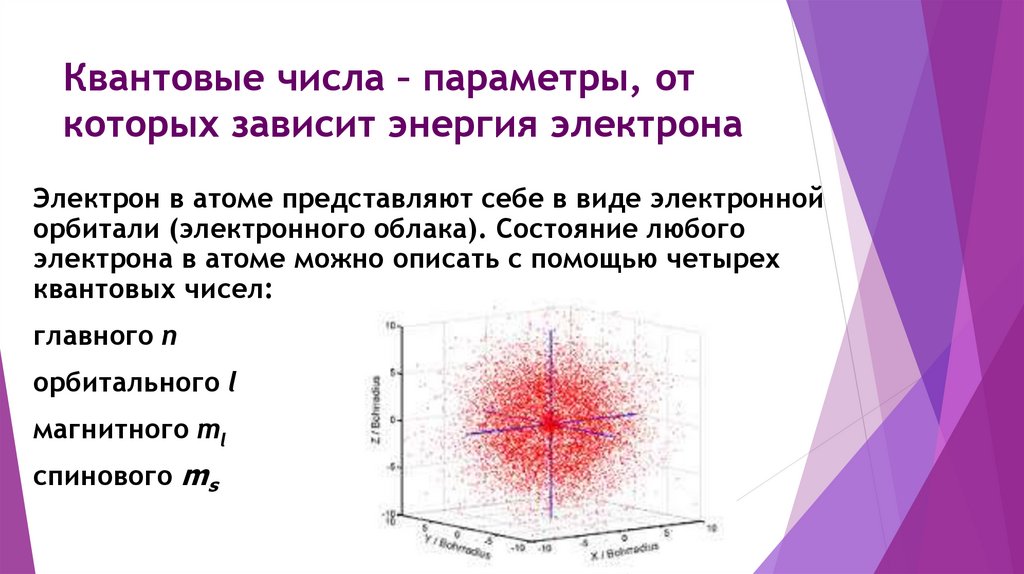
Квантовые числа – параметры, откоторых зависит энергия электрона
Электрон в атоме представляют себе в виде электронной
орбитали (электронного облака). Состояние любого
электрона в атоме можно описать с помощью четырех
квантовых чисел:
главного n
орбитального l
магнитного ml
спинового ms
16.
Главное квантовое число nn может принимать положительные
целочисленные значения (1, 2, 3, 4 и т.д.).
главное квантовое число определяет размер
электронного облака и чем больше значение
n, тем больше размер электронной орбитали
электронные орбитали, имеющие одинаковое
главное квантовое число и примерно
одинаковые по размеру образуют
электронный слой или электронный уровень
чем больше размер орбитали, тем выше
энергия электрона
17.
Орбитальное квантовое число lдля каждого значения n разрешены
целочисленные значения l от 0 до (n−1)
вместо значения l = 0, 1, 2, 3... орбитальное
число часто обозначают буквами s, p, d, f
атомные орбитали с разными орбитальными
квантовыми числами различаются формой и
энергией
орбитали с одинаковым главным и одинаковым
орбитальным квантовым числом образуют
электронный подуровень
число подуровней на уровне равно номеру
уровня
18.
Обозначение уровней и подуровнейОрбитали можно обозначать двумя символами:
цифрой и буквой. Цифра говорит о размере
орбитали (на каком уровне находится орбиталь),
а буква говорит о форме орбитали (на каком
подуровне находится орбиталь).
1 уровень – 1s
2 уровень – 2s, 2p
3 уровень – 3s,3p, 3d
4 уровень – 4s, 4p, 4d, 4f…
19.
1) 2s и 3s2) 3p и 3s
3) 2p и 1s
Ответьте на вопросы:
1) Чем похожи эти электронные орбитали?
2) Чем отличаются эти электронные
орбитали?
3) У какой орбитали больше энергия?
4) Нарисуйте эти орбитали.
5) Сколько подуровней на третьем
электронном уровне? Назовите их.
20.
Магнитное квантовое число mlМагнитное квантовое число ml отвечает за
число электронных орбиталей на подуровне
и ориентацию орбиталей в пространстве.
Для каждого значения l магнитное квантовое
число ml может принимать целочисленные
значения от −l до +l.
Например, s- орбиталь (l = 0) определенного
размера может быть только одна, а рорбитали (l = 1) могут быть ориентированы
тремя способами (ml = –1, 0, +1). Для dорбиталей возможно уже пять значений
магнитного квантового числа. Для fорбиталей – 7 значений…
21.
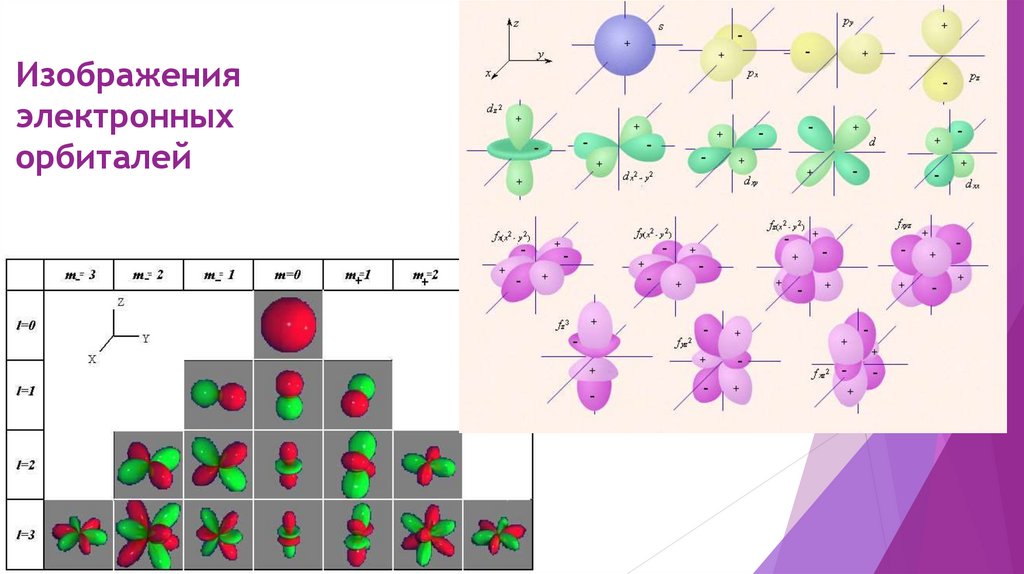
Изображенияэлектронных
орбиталей
22.
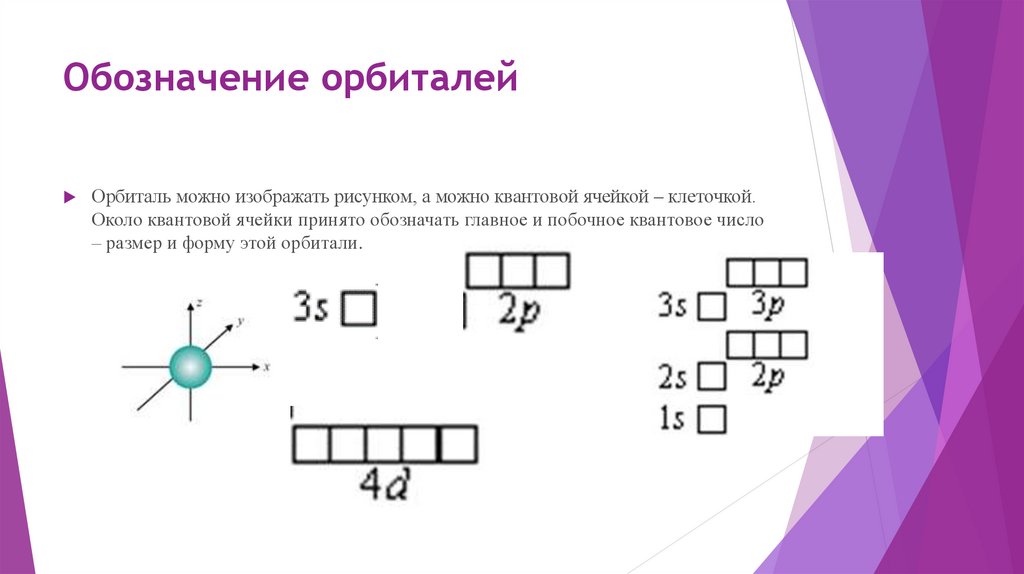
Обозначение орбиталейОрбиталь можно изображать рисунком, а можно квантовой ячейкой – клеточкой.
Около квантовой ячейки принято обозначать главное и побочное квантовое число
– размер и форму этой орбитали.
23.
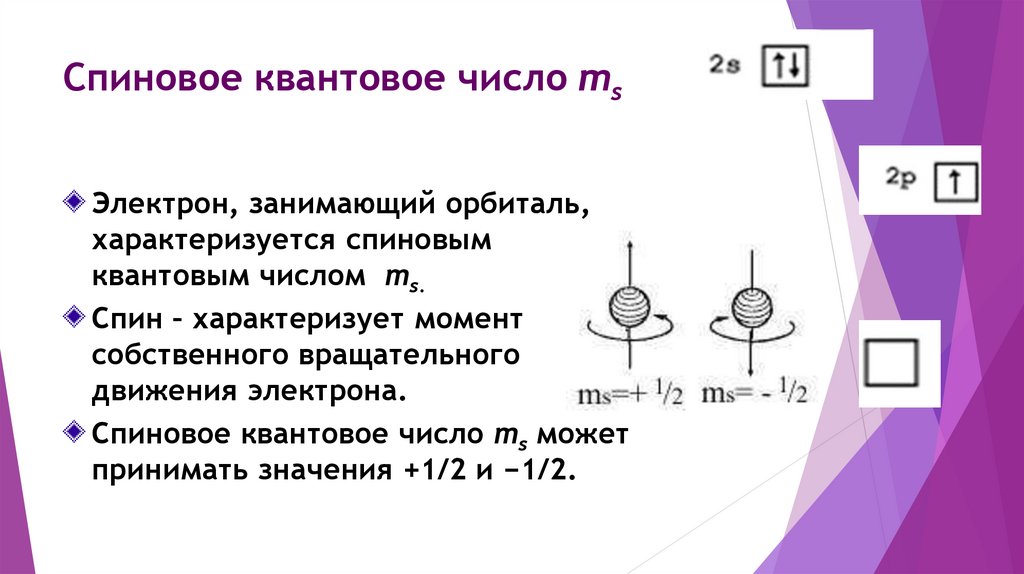
Спиновое квантовое число msЭлектрон, занимающий орбиталь,
характеризуется спиновым
квантовым числом ms.
Спин – характеризует момент
собственного вращательного
движения электрона.
Спиновое квантовое число ms может
принимать значения +1/2 и −1/2.
24.
Сформулируйте основные представления остроении электронной оболочки атомов
Число электронов в атоме равно порядковому номеру элемента.
Электроны, которые находятся в атоме размещаются на разных
расстояниях от ядра, т.к. имеют разную энергию.
Электронные слои образуются орбиталями, близкими по энергии. Эти
орбитали имеют одинаковое главное квантовое число. Электронные слои
часто называют электронными уровнями. Число электронных уровней у
химического элемента совпадает с номером периода, в котором находится
этот элемент.
На каждом уровне существует определенное число подуровней, это число
равно номеру уровня.
На каждом подуровне – определенное число орбиталей (1,3,5,7…).
Набор возможных электронных орбиталей у всех химических
элементов абсолютно одинаков!
25.
Три правила заполненияэлектронных орбиталей в атоме
Принцип запрета (принцип Паули): в атоме не
может быть двух одинаковых электронов, т. е.
электронов с одинаковым набором 4-х
квантовых чисел. Значит на одной орбитали
может быть не более двух электронов, причем,
с противоположными спинами.
И в одной клеточке (квантовой ячейке) мы
рисуем или ↓↑, или только ↓, или только↑.
Или она вообще пустая – вакантная орбиталь.
Но ↑↑ - запрещено принципом Паули.
26.
Три правила заполненияэлектронных орбиталей в атоме
Принцип минимума энергии (принцип Клечковского): т.е. в стабильном
(стационарном) состоянии электроны сначала заполняют орбитали с
меньшим уровнем энергии.
Энергия электрона зависит от суммы главного и от орбитального
квантового числа, а если сумма одинакова, то величиной главного
квантового числа. Значит подуровни по возрастанию энергии
образуют ряд:
Верхним индексом указывают число электронов на данном подуровне.
Распределение электронов в атоме по уровням и подуровням называют
электронной конфигурацией атома или электронной формулой элемента.
27.
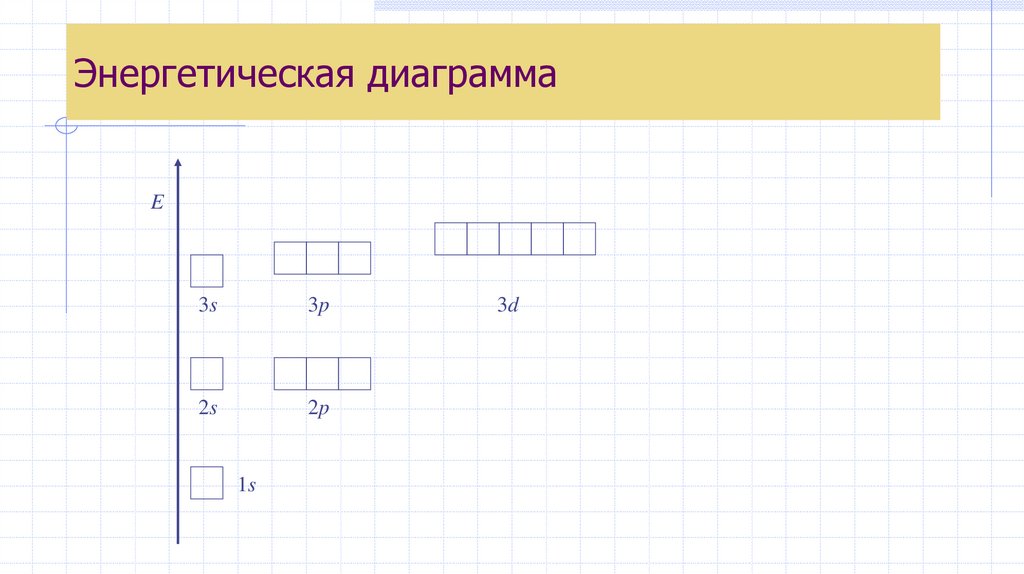
Энергетическая диаграммаE
3s
3p
2s
2p
1s
3d
28.
Три правила заполненияэлектронных орбиталей в атоме
Правило Хунда. На одном подуровне значение суммы
спинового числа электронов должно быть
максимально, а это значит, что заполнение
электронами подуровня сначала происходит по
одному, а только потом – происходит спаривание.
29.
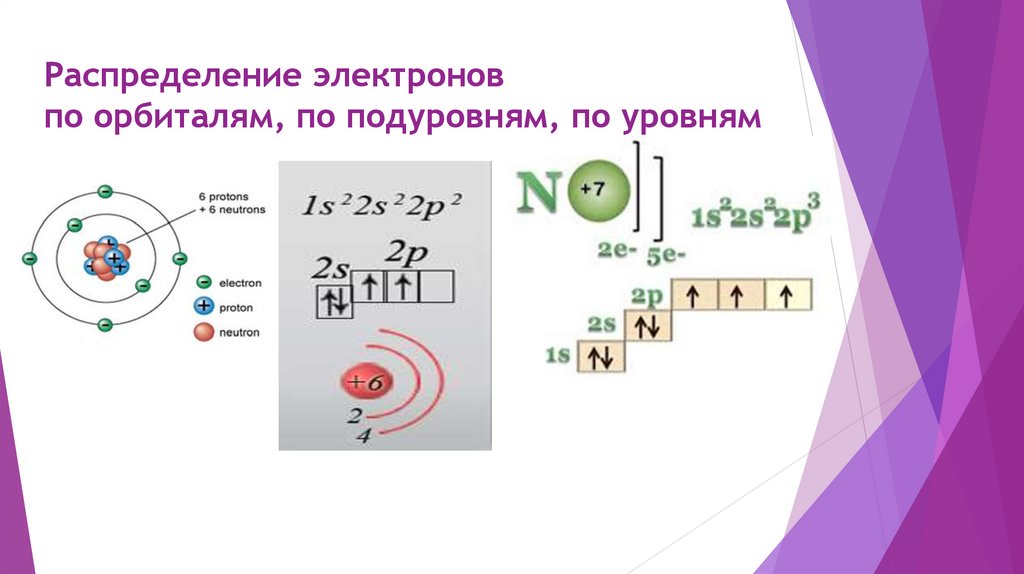
Распределение электроновпо орбиталям, по подуровням, по уровням
30.
Напишите распределение электронов поорбиталям, по подуровням и по уровням
1) магний
2) фосфор
3) гелий
4) калий
5) титан
6) бром






















 chemistry
chemistry








