Similar presentations:
Хлороводород. Соляная кислота
1. Хлороводород. Соляная кислота.
2.
3. Хлороводород HCl
HCl – это бесцветный газ с резкимнеприятным запахом, тяжелее
воздуха.
Докажем это:
М (HCl)= 1+35,5=36,5 г/моль
М (воздуха)= 29 г/моль
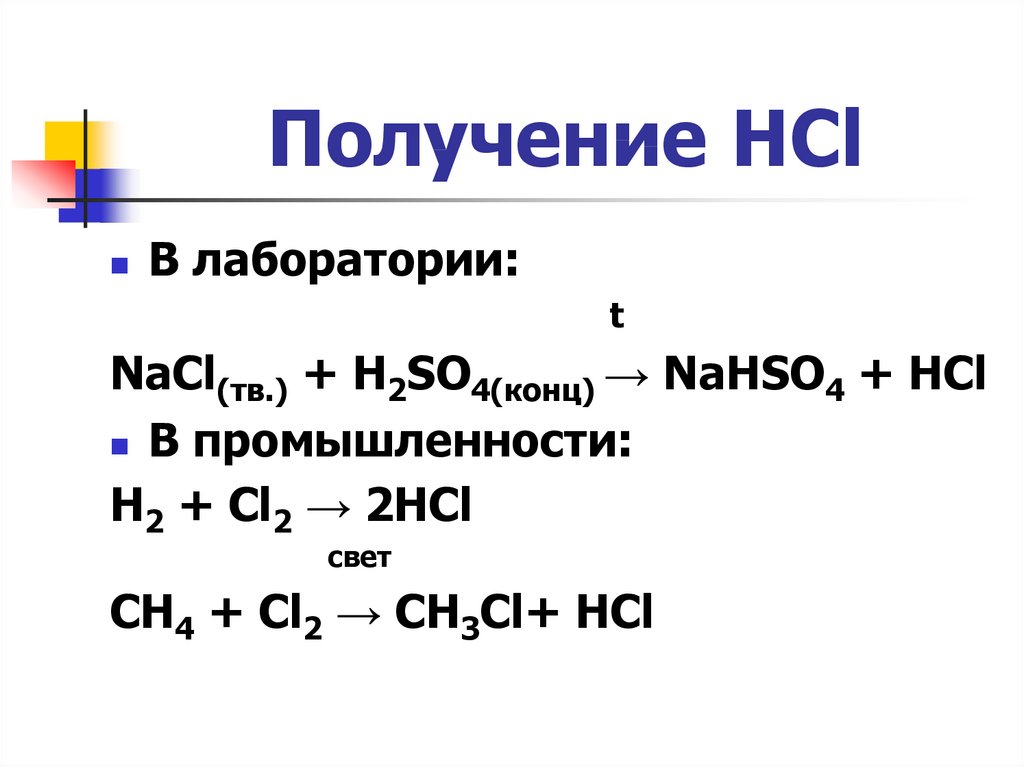
4. Получение HCl
В лаборатории:t
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl
В промышленности:
H2 + Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
5. Соляная кислота HCl
Соляная кислота сильная, т.е. вводных растворах полностью
распадается на ионы:
HCl → H+ + ClРастворы кислоты не имеют
запаха.
6.
7.
8. Химические свойства
Кислотные свойстваА. Взаимодействие с металлами,
стоящими в ряду активности до
водорода:
HCl + Zn →
2HCl + Zn → ZnCl2 + H2
Допишите:
HCl + Al →
1.
9.
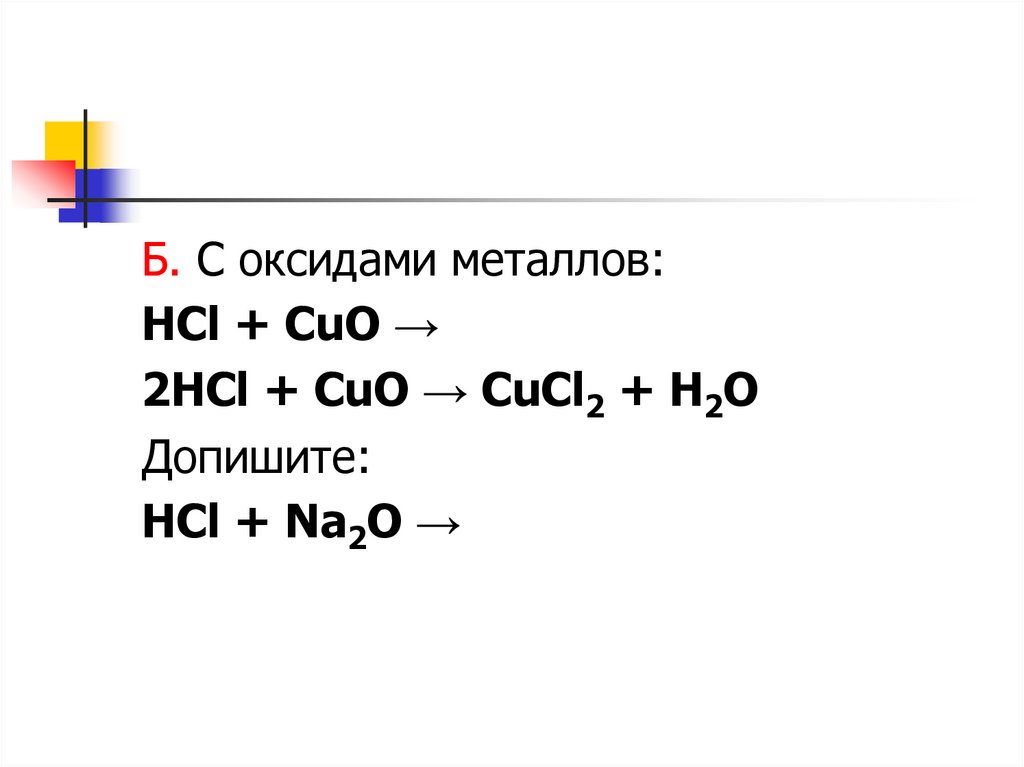
Б. С оксидами металлов:HCl + CuO →
2HCl + CuO → CuCl2 + H2O
Допишите:
HCl + Na2O →
10.
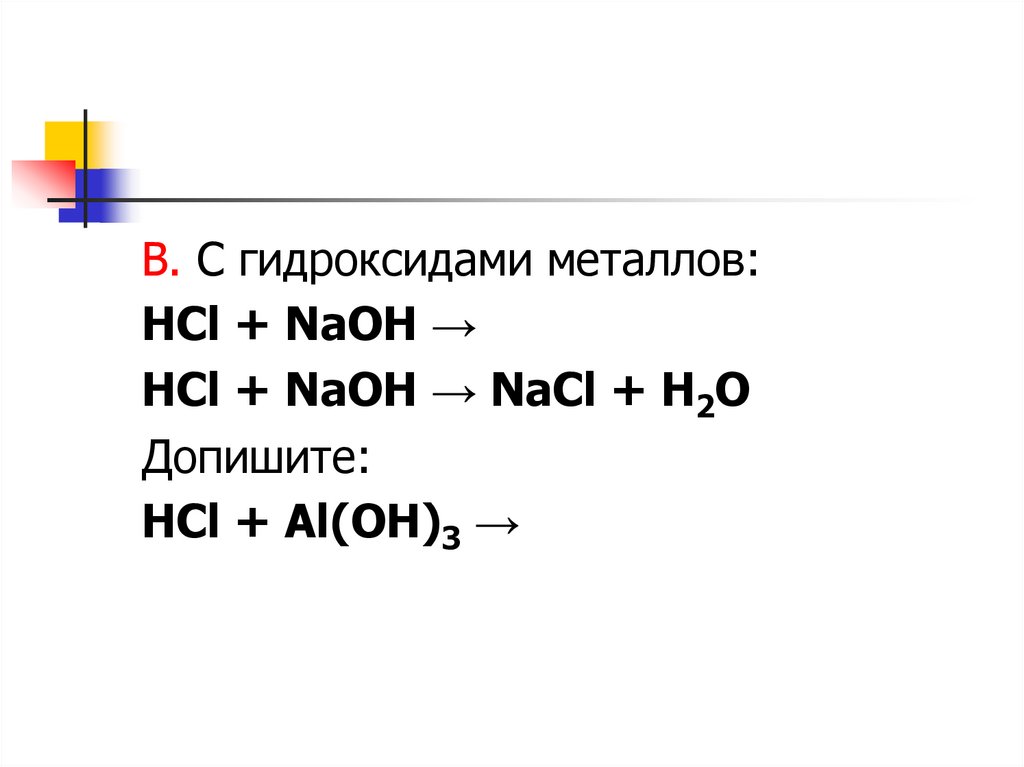
В. С гидроксидами металлов:HCl + NaOH →
HCl + NaOH → NaCl + H2O
Допишите:
HCl + Al(OH)3 →
11.
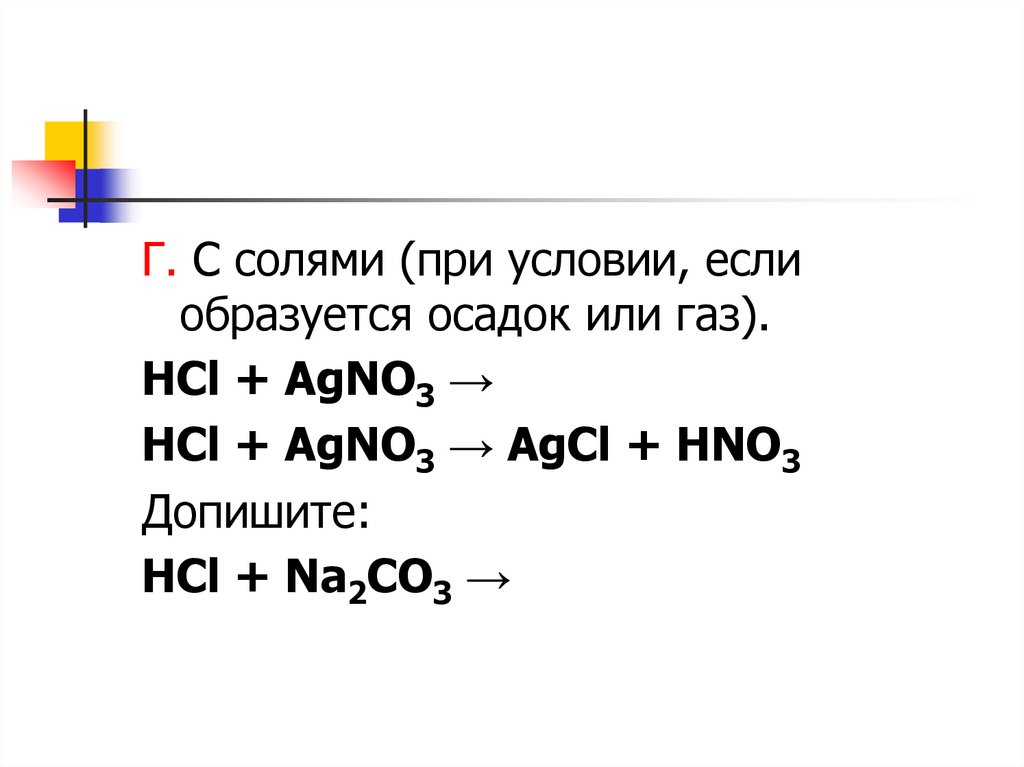
Г. С солями (при условии, еслиобразуется осадок или газ).
HCl + AgNO3 →
HCl + AgNO3 → AgCl + HNO3
Допишите:
HCl + Na2CO3 →
12. 2. Восстановительные свойства.
HCl + MnO2 → MnCl2 + Cl2 + 2H2OHCl + KMnO4 → MnCl2 + Cl2 + KCl + H2O
HCl + KClO3 → Cl2 + KCl + H2O
В данных уравнениях расставьте коэффициенты с
помощью электронного баланса, определите кто
является окислителем, а кто – восстановителем.
13. Качественная реакция на хлорид ион:
NaCl + AgNO3 → AgCl + NaNO3Составьте полное и сокращенное ионные
уравнения








 chemistry
chemistry








