Similar presentations:
9м
1. Хлороводород. Соляная кислота. Хлориды
2. Физические свойства хлороводорода
- бесцветный газ с резким запахом;- растворимость в воде по объёму (≈500:1);
- «дымит» на влажном воздухе.
3. Строение молекулы
H-ClСравнение молекулы HCl с молекулами
других галогеноводородов
H-F
H-Cl
H-Br
H-I
Визуализация выполняется с помощью
программного комплекса
HyperChem 8.0
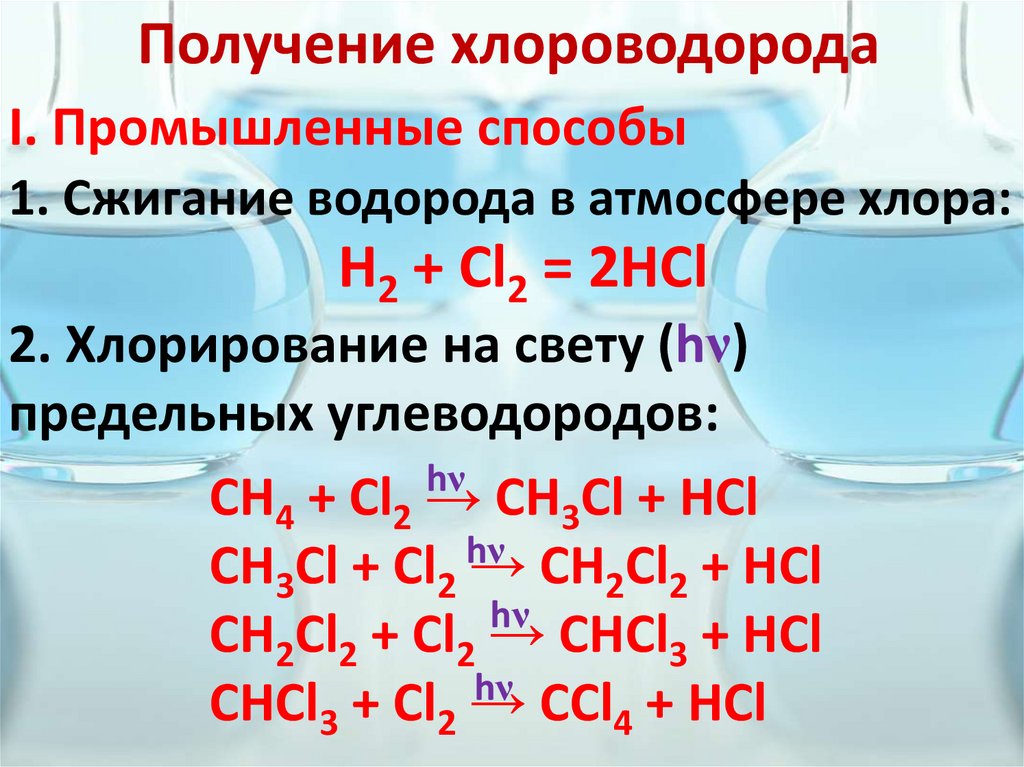
4. Получение хлороводорода
I. Промышленные способы1. Сжигание водорода в атмосфере хлора:
H2 + Cl2 = 2HCl
2. Хлорирование на свету (hν)
предельных углеводородов:
hν
СН4 + Сl2 → СН3Cl + HCl
hν
CH3Cl + Cl2 → CH2Cl2 + HCl
hν
CH2Cl2 + Cl2 → CHCl3 + HCl
hν
CHCl3 + Cl2 → CCl4 + HCl
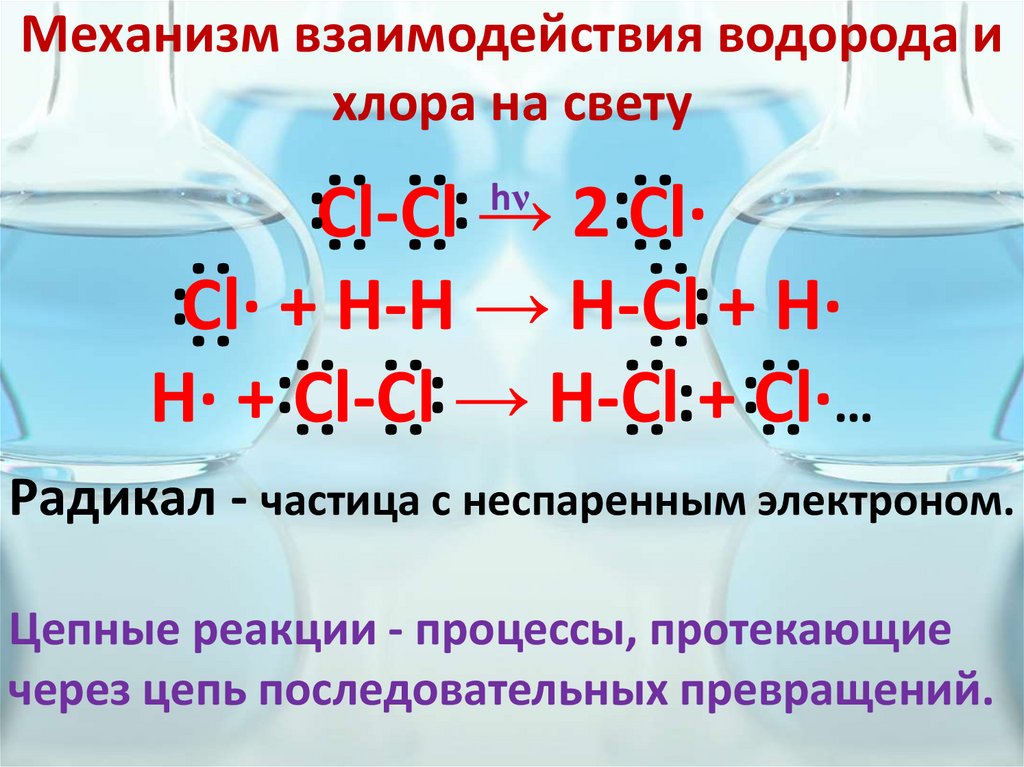
5. Механизм взаимодействия водорода и хлора на свету
: :: :
: :
: :
: :: :: :
: :
: :
hν
:Cl-Cl: →
2:Cl·
:Cl· + H-H → H-Cl: + H·
H· +:Cl-Cl: → H-Cl:+ :Cl·…
Радикал - частица с неспаренным электроном.
Цепные реакции - процессы, протекающие
через цепь последовательных превращений.
6.
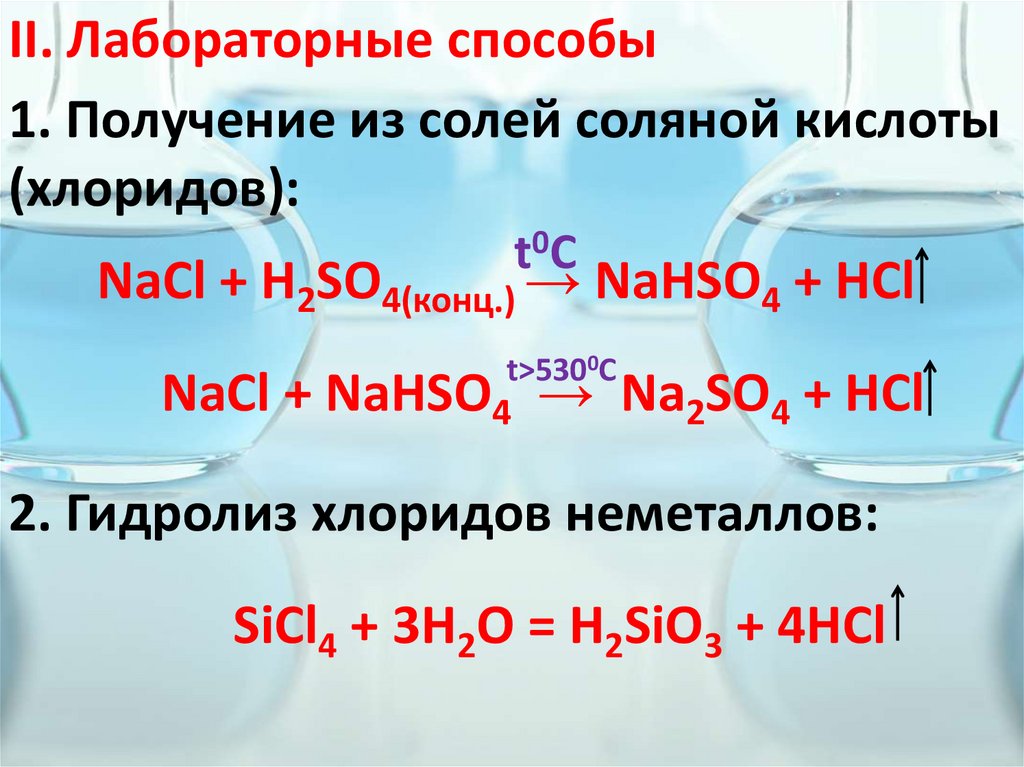
II. Лабораторные способы1. Получение из солей соляной кислоты
(хлоридов):
t0C
NaCl + H2SO4(конц.) → NaHSO4 + HCl
t>5300C
NaCl + NaHSO4 → Na2SO4 + HCl
2. Гидролиз хлоридов неметаллов:
SiCl4 + 3H2O = H2SiO3 + 4HCl
7. Соляная кислота
- раствор HCl в воде.Физические свойства
1. Бесцветная жидкость (техническая жёлто-зелёного цвета) с резким запахом;
2. Концентрированная HCl - «дымит»;
3. Максимальная концентрация ≈40% HCl.
8. Химические свойства HCl
1. Сильная кислота:HCl + H2O → H3O+ + Clупрощённо: HCl → H+ + ClКак изменяется окраска индикаторов в
растворах кислот ?
Лакмус Метиловый оранжевый Фенолфталеин -
9.
2. Взаимодействие с металлами (левее Нв ЭХРНМ):
Fe + 2HCl = FeCl2 + H2
3. Взаимодействие с основными и
амфотерными оксидами:
FeO + 2HCl = FeCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
4. Взаимодействие с основаниями:
Fe(OН)3 + 3HCl = FeCl3 + 3H2O
5. Взаимодействие с солями:
Na2S + 2HCl = 2NaCl + H2S
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
10. Хлориды металлов
- соли соляной кислоты.NaCl, CuCl2, FeCl3, AlCl3 и др.
1. HCl и хлориды окисляются сильными
окислителями:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
5KCl + KClO3 + 3H2SO4 = 3K2SO4 + Cl2 + 3H2O
11. 2. Качественная реакция на HCl и хлориды:
HCl + AgNO3 = AgCl + HNO3NaCl + AgNO3 = AgCl + NaNO3
AgCl - белый творожистый осадок
Ag+ + Cl- = AgCl
12. Применение соляной кислоты
Используя рисунок 20(стр. 69),выпишите в тетрадь применение
соляной кислоты.
13. Домашнее задание
• §11, 12, ответить на вопрос 7письменно ,стр. 71;
• подготовиться к п/р стр.72;
• повторить т/б.











 chemistry
chemistry








