Similar presentations:
Соляная кислота. Хлориды
1. Соляная кислота. Хлориды
Презентацию подготовила ученица 9А классаБушуева Екатерина
2. Соляная кислота
- раствор HCl в воде.Физические свойства
1. Бесцветная жидкость (техническая жёлто-зелёного цвета) с резким запахом;
2. Концентрированная HCl - «дымит»;
3. Максимальная концентрация ≈40% HCl.
3. Химические свойства HCl
1. Сильная кислота:HCl + H2O → H3O+ + Clупрощённо: HCl → H+ + ClКак изменяется окраска индикаторов в
растворах кислот ?
Лакмус Метиловый оранжевый Фенолфталеин -
4.
2. Взаимодействие с металлами:Fe + 2HCl = FeCl2 + H2
3. Взаимодействие с основными и
амфотерными оксидами:
FeO + 2HCl = FeCl2 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
4. Взаимодействие с основаниями:
Fe(OН)3 + 3HCl = FeCl3 + 3H2O
5. Взаимодействие с солями:
Na2S + 2HCl = 2NaCl + H2S
Pb(NO3)2 + 2HCl = PbCl2 + 2HNO3
5. Хлориды металлов
- соли соляной кислоты.NaCl, CuCl2, FeCl3, AlCl3 и др.
1. HCl и хлориды окисляются сильными
окислителями:
16HCl + 2KMnO4 = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
5KCl + KClO3 + 3H2SO4 = 3K2SO4 + Cl2 + 3H2O
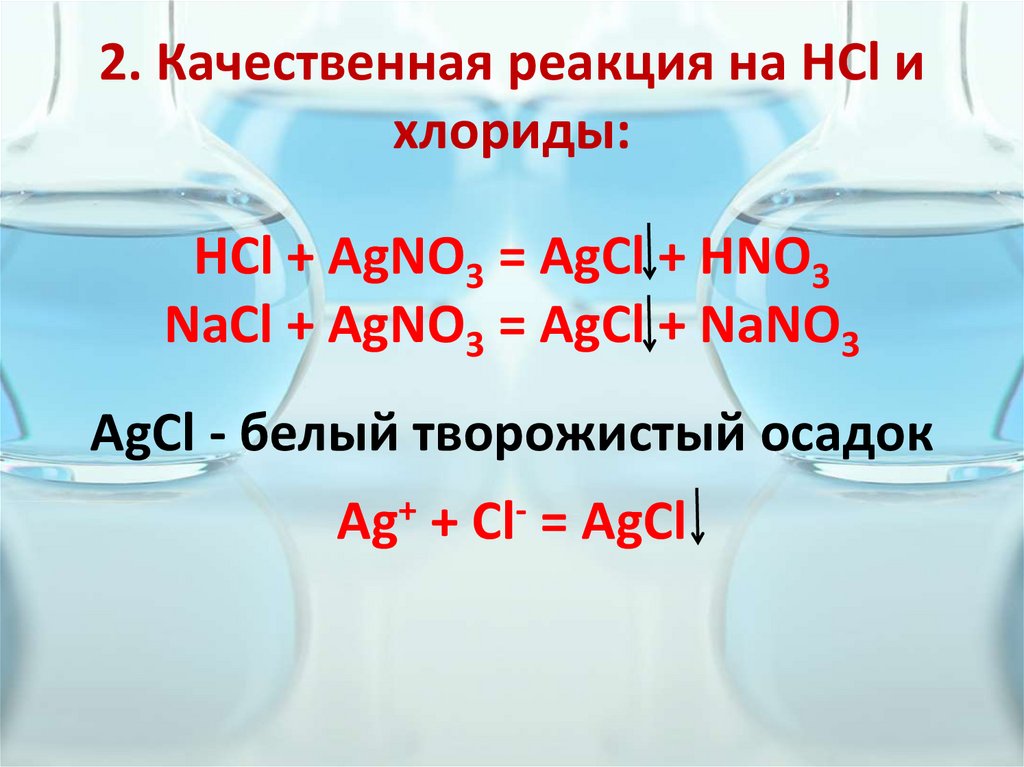
6. 2. Качественная реакция на HCl и хлориды:
HCl + AgNO3 = AgCl + HNO3NaCl + AgNO3 = AgCl + NaNO3
AgCl - белый творожистый осадок
Ag+ + Cl- = AgCl






 chemistry
chemistry








