Similar presentations:
Основные положения теории растворов электролитов, используемых в аналитической химии
1.
Основные положения теории растворовэлектролитов, используемых в
аналитической химии
1
2.
Майкл Фарадей1791 – 1867
2
3.
Электролиты – вещества, водные растворыкоторых проводят электрический ток
Неэлектролиты – вещества, водные растворы которых не проводят электрический
ток
3
4.
В 1887 году Аррениус предложил теориюэлектролитической диссоциации
4
5.
Сванте Аррениус1859 – 1927
5
6.
Суть теории: все электролиты при растворении в воде распадаются на ионы,создавая электропроводящую среду
NaCl Na+ + Cl–
Al2(SO4)3 2Al3+ + 3SO42–
6
7.
Количественно диссоциация электролита врастворе характеризуется степенью
диссоцииации
Nдисс
Cдисс
= ———— = ————
Nобщ
Cобщ
Выражается в долях единицы или
процентах
Nдисс = 95, Nобщ = 100
= 0,95 или 95%
7
8.
Классификация электролитов< 3% – слабые электролиты
3% < < 30% – электролиты средней силы
> 30% – сильные электролиты
8
9.
Сильные электролиты1. Неорганические кислоты: HNO3, HBr, HI, HCl,
H2SO4(по первой ступени) и др.
2. Гидроксиды щелочных и щелочно-земельных металлов: NaOH, KOH, Ca(OH)2, Ba(OH)2,
Sr(OH)2
3. Большинство солей: CaCl2, NH4Cl, Na3PO4,
CH3COONa и т.д.
9
10.
Слабые электролиты1. Неорганические кислоты: H2S, H3PO4,
H2SO4(по второй ступени), H2CO3 и др.
2. Большинство органических кислот:
янтарная, уксусная, щавелевая и др.
3. Аммиак и большинство органических
оснований: пиридин, N2H4, NH2OH,
(CH3)2NH и др.
10
11.
Общая (истинная) и активнаяконцентрация ионов в растворе
11
12.
Общая концентрация ионов в раствореопределяется молярной концентрацией
растворенного электролита
Na2SO4 2Na+ + SO42–
0,02 м/л
0,04 м/л 0,02 м/л
K4[Fe(CN)6] 4K+ + [Fe(CN)6]4–
0,005 м/л
0,02 м/л 0,005 м/л
12
13. Активная концентрация (активность)– это концентрация свободных, не связанных в ассоциаты ионов
Ca2+
Cl
Cl
Cl
2+
Ca Cl 2+
Cl Ca
Cl
Cl
Cl
Ca
2+
Cl
Ca
2+
Cl
13
14.
aA = fA·[A]aA – активная концентрация вещества A
fA – коэффициент активности
A – общая концентрация вещества A
14
15.
Коэффициент активности зависит от ионнойсилы раствора и заряда иона
I = ½ Сi · zi2
При вычислении ионной силы раствора
учитываются концентрации и заряды всех
ионов, находящихся в растворе (ионами
слабых электролитов пренебрегают)
15
16.
Задача 1. Рассчитайте ионную силу раствора,содержащего 0,01 М CaCl2, 0,02 M HCl и
0,025 M уксусной кислоты.
Решение:
1. Какие электролиты сильные, какие электролиты слабые.
2. Проверить концентрацию сильных электролитов.
3. Найти концентрацию каждого иона и ионную силу раствора.
16
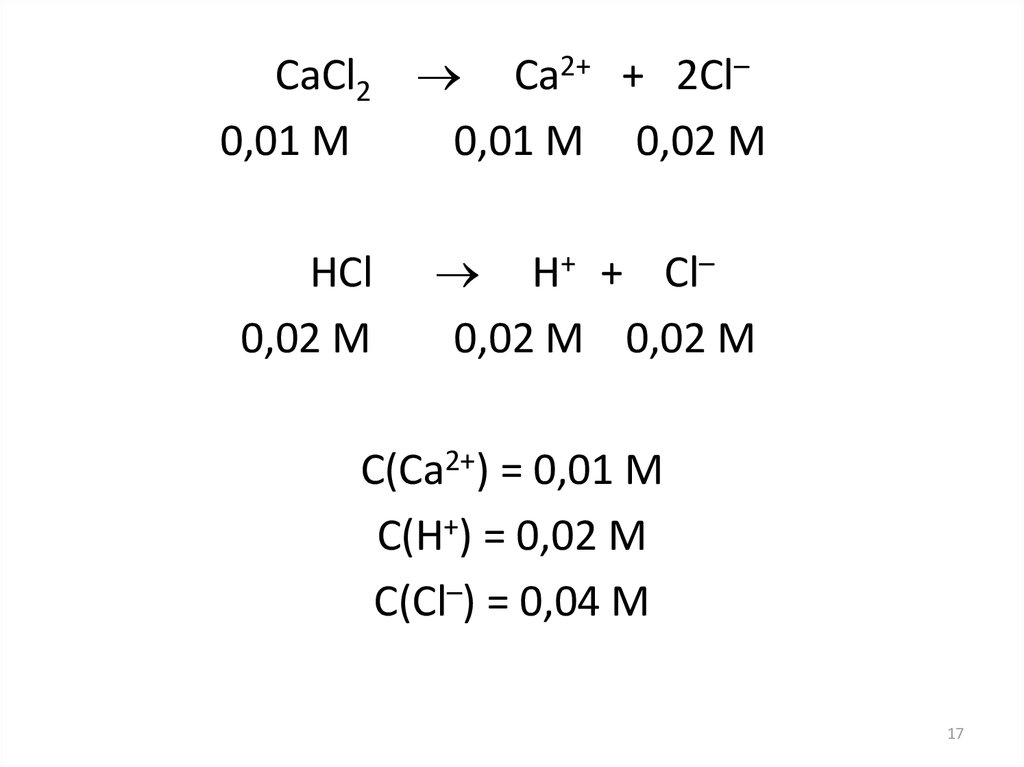
17.
CaCl2 Ca2+ + 2Cl–0,01 M
0,01 M 0,02 M
HCl
0,02 M
H+ + Cl–
0,02 M 0,02 M
C(Ca2+) = 0,01 M
C(H+) = 0,02 M
C(Cl–) = 0,04 M
17
18.
I = ½ Сi · zi2I = ½ (0,01 · 22 + 0,02 · 12 + 0,04 · 12 ) =
= 0,05 (моль/л)
Ответ: 0,05 моль/л
18
19.
Задача 2. Смешали равные объемы 0,02 Мраствора серной кислоты и 0,01 М
раствора щавелевой кислоты.
Рассчитайте ионную силу полученного
раствора.
19
20.
C1 · V1 = C2 · V2C1 · V1
C2 = –––––––––
V2
0,02 · X
C2 = –––––––– = 0,01 (M)
2X
20
21.
H2SO4 H+ + HSO4–0,01 M
0,01 M 0,01 M
I = ½ Сi · zi2
I = ½(0,01 · 12 + 0,01 · 12) = 0,01 (M)
Ионная сила растворов сильных электролитов, состоящих только из однозарядных ионов, равна их общей молярной
концентрации
21
22.
Расчет коэффициента активности1. Расчетный путь
2. Используя справочные данные
22
23.
Водные растворыt = 25 оС
I = 0,01 0,2 М
Уравнение Дебая Хюккеля:
I
lg fi = 0,509 · zi2 · –––––––––––
1+ I
23
24.
I < 0,01 Mlg fi = 0,509 · zi2 · I
24
25.
Правило ионной силы(выведено эмпирически Льюисом и Рендаллом)
В разбавленном растворе с данной ионной
силой все ионы с одинаковым зарядом по
абсолют-ной величине имеют один и тот же
коэффи-циент активности
25
26.
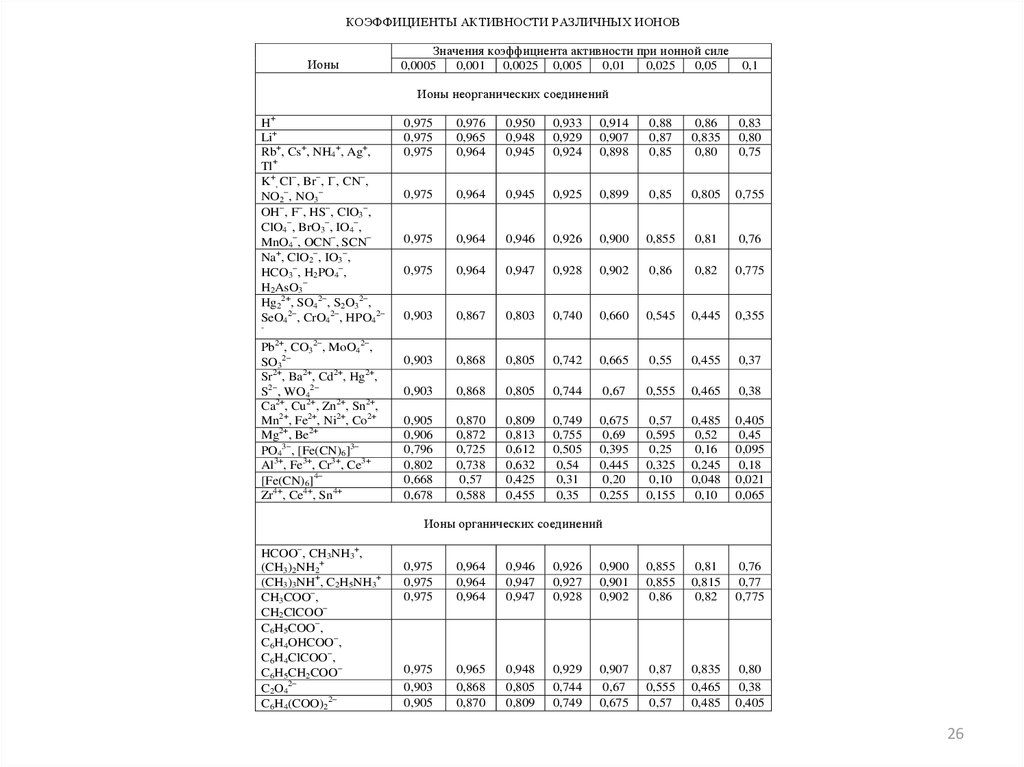
КОЭФФИЦИЕНТЫ АКТИВНОСТИ РАЗЛИЧНЫХ ИОНОВИоны
Значения коэффициента активности при ионной силе
0,0005
0,001 0,0025 0,005
0,01
0,025
0,05
0,1
Ионы неорганических соединений
H+
Li+
Rb+, Cs+, NH4+, Ag+,
Tl+
K+, Cl , Br , I , CN ,
NO2 , NO3
OH , F , HS , ClO3 ,
ClO4 , BrO3 , IO4 ,
MnO4 , OCN , SCN
Na+, ClO2 , IO3 ,
HCO3 , H2PO4 ,
H2AsO3
Hg22+, SO42 , S2O32 ,
SeO42 , CrO42 , HPO42
0,975
0,975
0,975
0,976
0,965
0,964
0,950
0,948
0,945
0,933
0,929
0,924
0,914
0,907
0,898
0,88
0,87
0,85
0,86
0,835
0,80
0,83
0,80
0,75
0,975
0,964
0,945
0,925
0,899
0,85
0,805
0,755
0,975
0,964
0,946
0,926
0,900
0,855
0,81
0,76
0,975
0,964
0,947
0,928
0,902
0,86
0,82
0,775
0,903
0,867
0,803
0,740
0,660
0,545
0,445
0,355
0,903
0,868
0,805
0,742
0,665
0,55
0,455
0,37
0,903
0,868
0,805
0,744
0,67
0,555
0,465
0,38
0,905
0,906
0,796
0,802
0,668
0,678
0,870
0,872
0,725
0,738
0,57
0,588
0,809
0,813
0,612
0,632
0,425
0,455
0,749
0,755
0,505
0,54
0,31
0,35
0,675
0,69
0,395
0,445
0,20
0,255
0,57
0,595
0,25
0,325
0,10
0,155
0,485
0,52
0,16
0,245
0,048
0,10
0,405
0,45
0,095
0,18
0,021
0,065
-
Pb2+, CO32 , MoO42 ,
SO32
Sr2+, Ba2+, Cd2+, Hg2+,
S2 , WO42
Ca2+, Cu2+, Zn2+, Sn2+,
Mn2+, Fe2+, Ni2+, Co2+
Mg2+, Be2+
PO43 , [Fe(CN)6]3
Al3+, Fe3+, Cr3+, Ce3+
[Fe(CN)6]4
Zr4+, Ce4+, Sn4+
Ионы органических соединений
HCOO , CH3NH3+,
(CH3)2NH2+
(CH3)3NH+, C2H5NH3+
CH3COO ,
CH2ClCOO
C6H5COO ,
C6H4OHCOO ,
C6H4ClCOO ,
C6H5CH2COO
C2O42
C6H4(COO)22
0,975
0,975
0,975
0,964
0,964
0,964
0,946
0,947
0,947
0,926
0,927
0,928
0,900
0,901
0,902
0,855
0,855
0,86
0,81
0,815
0,82
0,76
0,77
0,775
0,975
0,903
0,905
0,965
0,868
0,870
0,948
0,805
0,809
0,929
0,744
0,749
0,907
0,67
0,675
0,87
0,555
0,57
0,835
0,465
0,485
0,80
0,38
0,405
26
27.
Задача 3.Рассчитать (по справочнику)
коэффициент активности иона калия для
ионной силы 0,015 моль/л.
27
28.
КОЭФФИЦИЕНТЫ АКТИВНОСТИ РАЗЛИЧНЫХ ИОНОВИоны
Значения коэффициента активности при ионной силе
0,05
0,025
0,01
0,001 0,0025 0,005
0,0005
0,1
Ионы неорганических соединений
H+
Li+
Rb+, Cs+, NH4+, Ag+,
Tl+
K+, Cl , Br , I , CN ,
NO2 , NO3
OH , F , HS , ClO3 ,
ClO4 , BrO3 , IO4 ,
MnO4 , OCN , SCN
0,975
0,975
0,975
0,976
0,965
0,964
0,950
0,948
0,945
0,933
0,929
0,924
0,914
0,907
0,898
0,88
0,87
0,85
0,86
0,835
0,80
0,83
0,80
0,75
0,975
0,964
0,945
0,925
0,899
0,85
0,805
0,755
0,975
0,964
0,946
0,926
0,900
0,855
0,81
0,76
28
29.
I0,01
–
0,025
–
———
I ' = - 0,015
0,01
–
0,015
———
I " = - 0,005
–
f
0,899
0,850
———
f ' = 0,049
0,899
x
———
f " = 0,899 –x
29
30.
I 'f '
——— = ———
I "
f "
- 0,015
0,049
——— = ———
- 0,005
0,899 –x
30
31.
(- 0,005) · 0,049X = 0,899 — —————— = 0,883
(- 0,015)
I = 0,015 моль/л
f (K+) = 0,883
Ответ: f (K+) = 0,883
31
32.
Чем меньше ионная сила раствора,тем больше коэффициент активности
Для сильно разбавленных растворов
(I < 0,0001 M)
Тогда
f 1
aA = [A]
32
33.
Задача 4.0,3264 г хлорида цинка растворили в
300 мл воды. Рассчитайте активность
ионов в растворе.
m
0,3264
С(ZnCl2) = ———— = ———— = 0,008 M
M · V(л)
136 · 0,3
33
34.
ZnCl2 Zn2+0,008
0,008
+ 2Cl–
0,016
I = ½(0,008 · 22 + 0,016 · 12) = 0,024 (M)
0,024
lg f(Zn2+) = 0,509 · 22 · ––––––––––– =
1+ 0,024
= 0,2731
f(Zn2+) = 0,533
34
35.
0,024lg f(Cl–) = 0,509 · 12 · ––––––––––– =
1+ 0,024
= 0,0683
f(Cl–) = 0,854
a(Zn2+) = 0,533 · 0,008 = 0,004 (моль/л)
a(Cl–) = 0,854 · 0,016 = 0,014 (моль/л)
Ответ: 0,004 моль/л; 0,014 моль/л.
35
36.
СПАСИБО ЗА ВНИМАНИЕ!36
















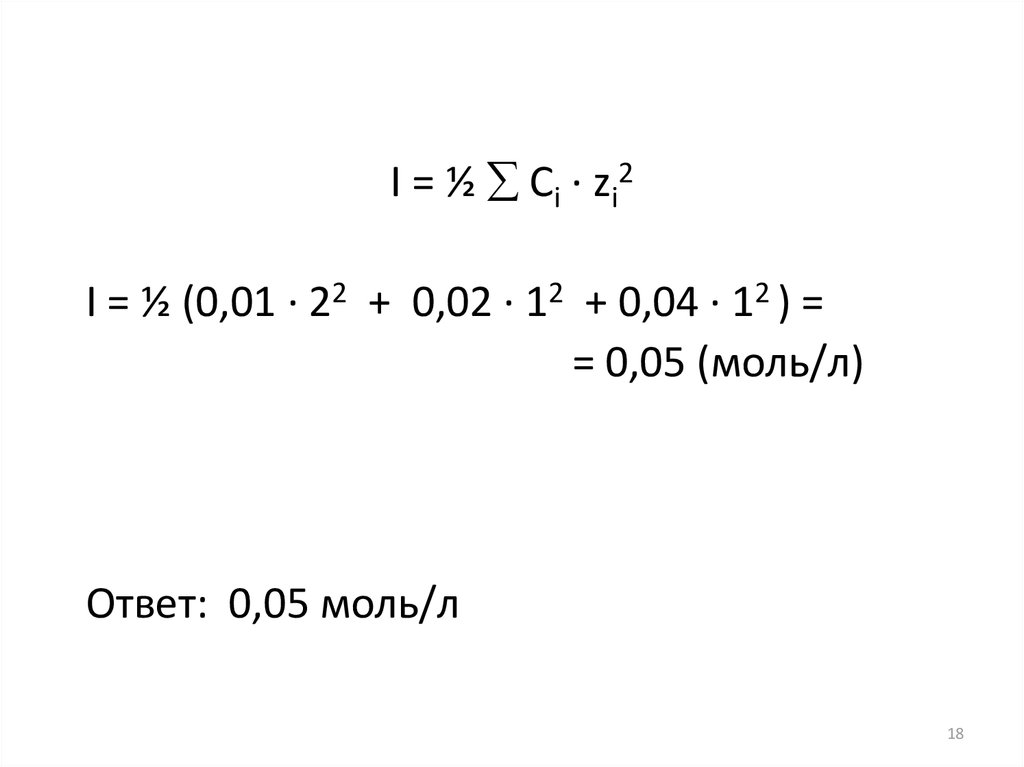

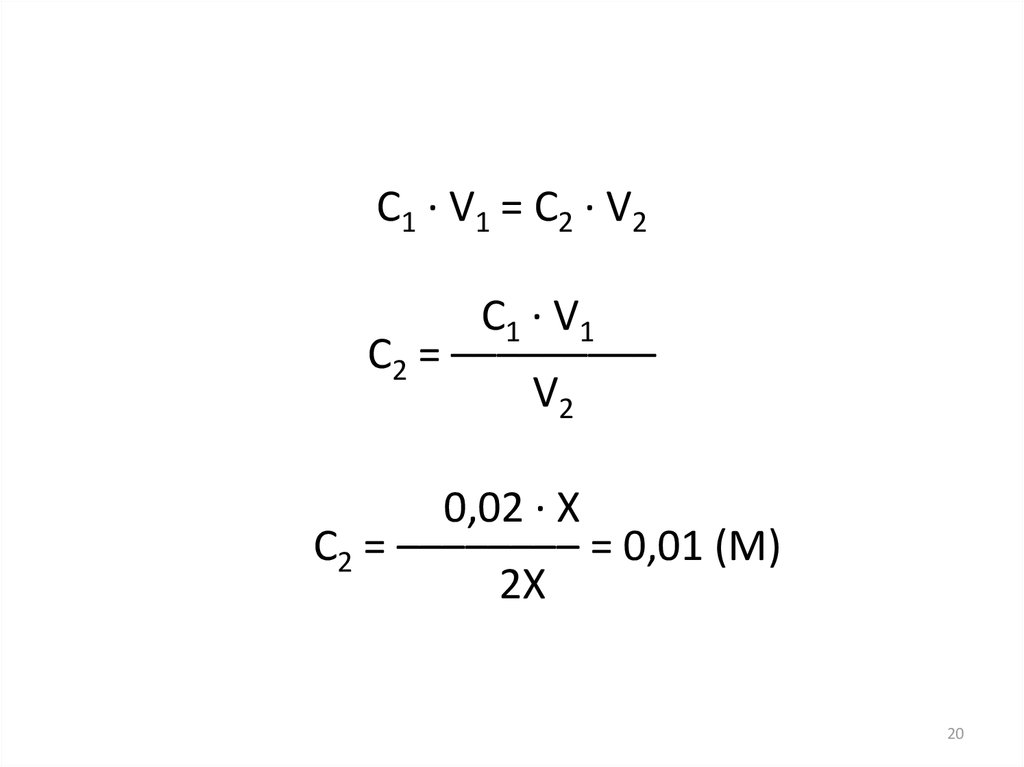



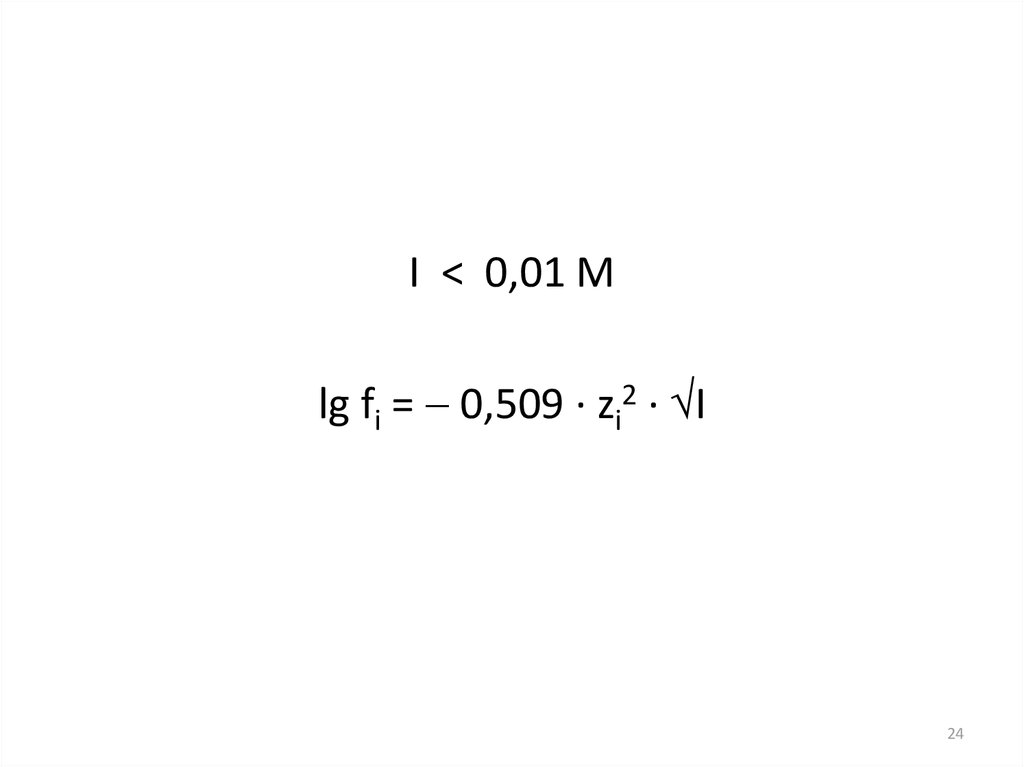



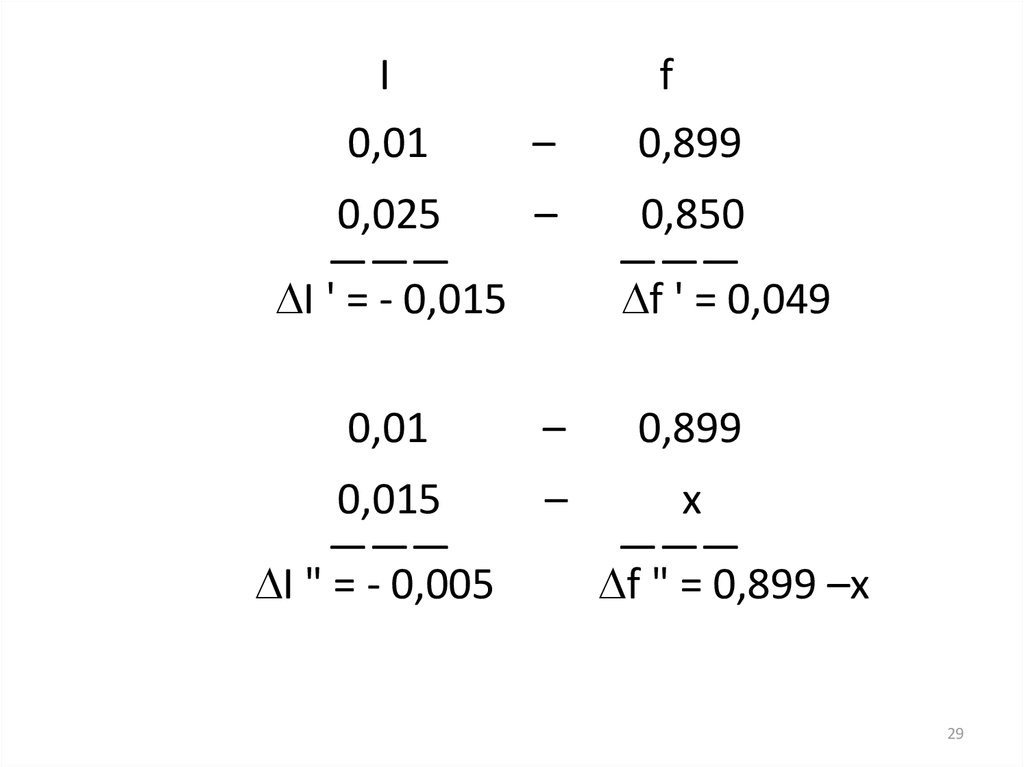
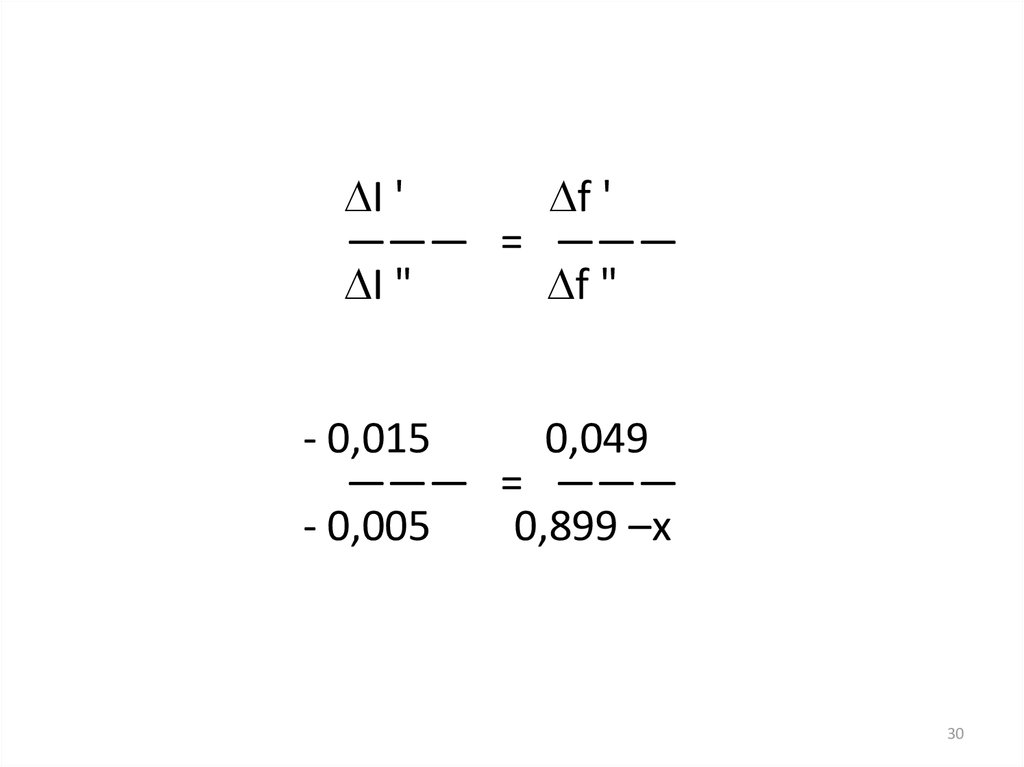






 chemistry
chemistry








