Similar presentations:
Метангидратное ружье. Задача 3. Команда: Когнитивная машина
1. Метангидратное ружье Задача 3
Команда: Когнитивнаямашина
2. Условия задачи
• На дне океана находится значительное количествометана в виде гидратов. Если температура на
планете продолжит повышаться, то этот метан будет
высвобождаться из гидратов и выходить в виде газа
в атмосферу.
• Существует теория, что это приведет к постоянному
ускорению глобального потепления, так как метан
сам по себе является парниковым газом.
• Предположив, что эта теория верна, предложите
способ безопасно разрядить это “метангидратное
ружье”.
1
3.
ЦелиЧто такое метангидртное ружье и
метангидраты?
Что такое метан гидраты
Устойчивость метангидратов
Объем метангидратов
Добыча метангидратов
Что делать с метаном?
Химические свойства метана
Превращение метана в более сложные вещества
Свойства продукта
Технология
2
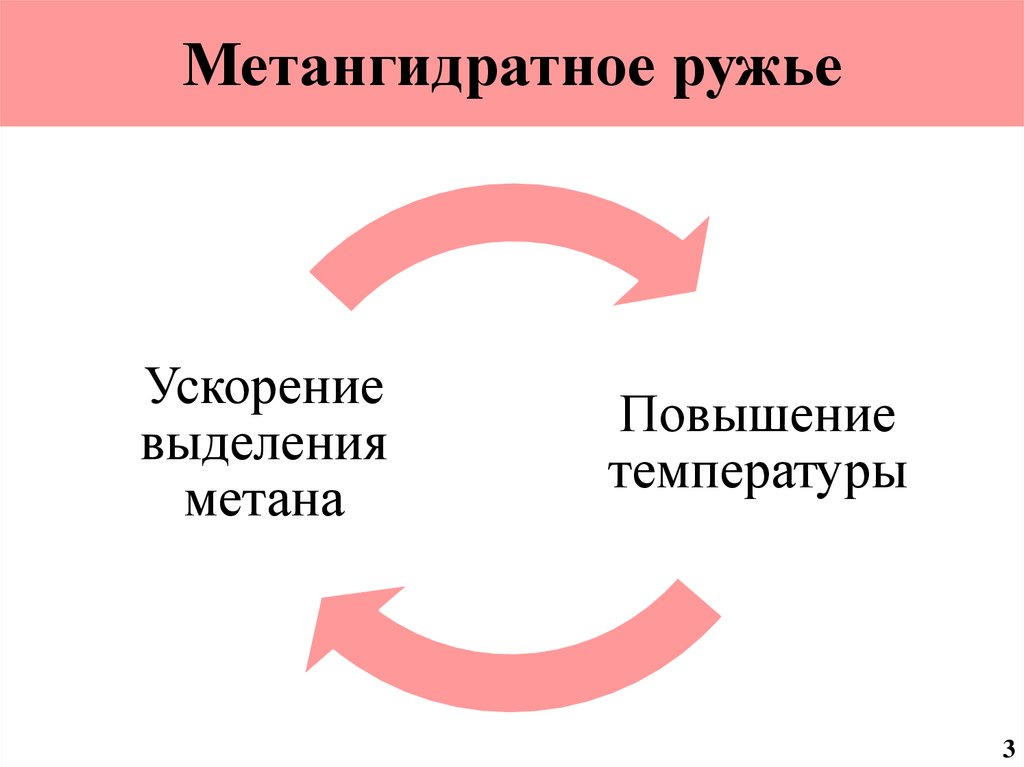
4. Метангидратное ружье
Ускорениевыделения
метана
Повышение
температуры
3
5. Что такое метангидрат?
(CH4 )4 (H2O)234
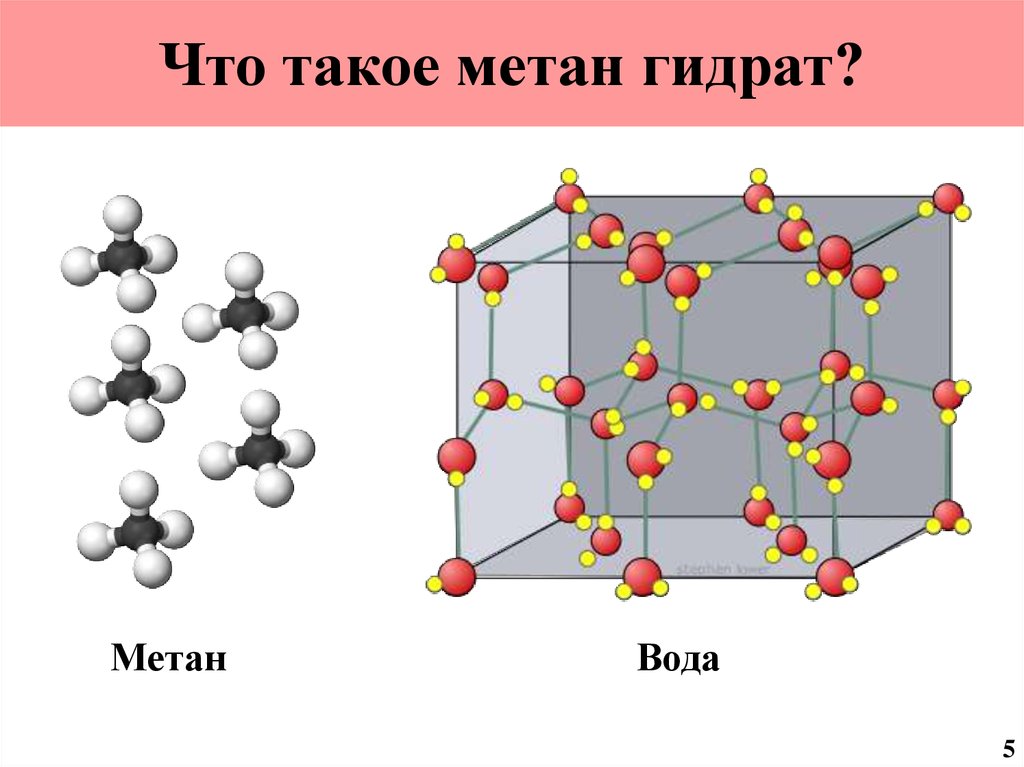
6. Что такое метан гидрат?
МетанВода
5
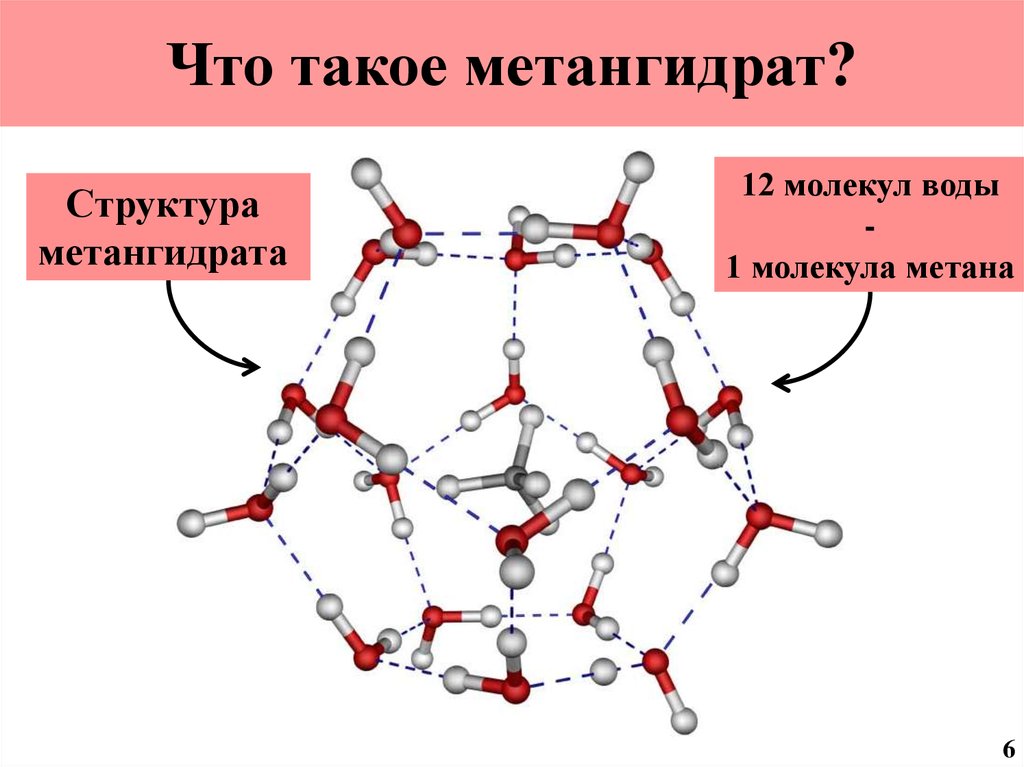
7. Что такое метангидрат?
Структураметангидрата
12 молекул воды
1 молекула метана
6
8. Что такое метангидрат?
Метангидрат1 м3
Метан
164 м3
7
9.
Классификация метангидратов8
10. Объем метангидратов
Общее количество метана720 триллионов кубических метров
472.32·1012 кг
9
11.
Объем добываемых метангидратов10
12.
Добыча метана из подземныхметангидратов
11
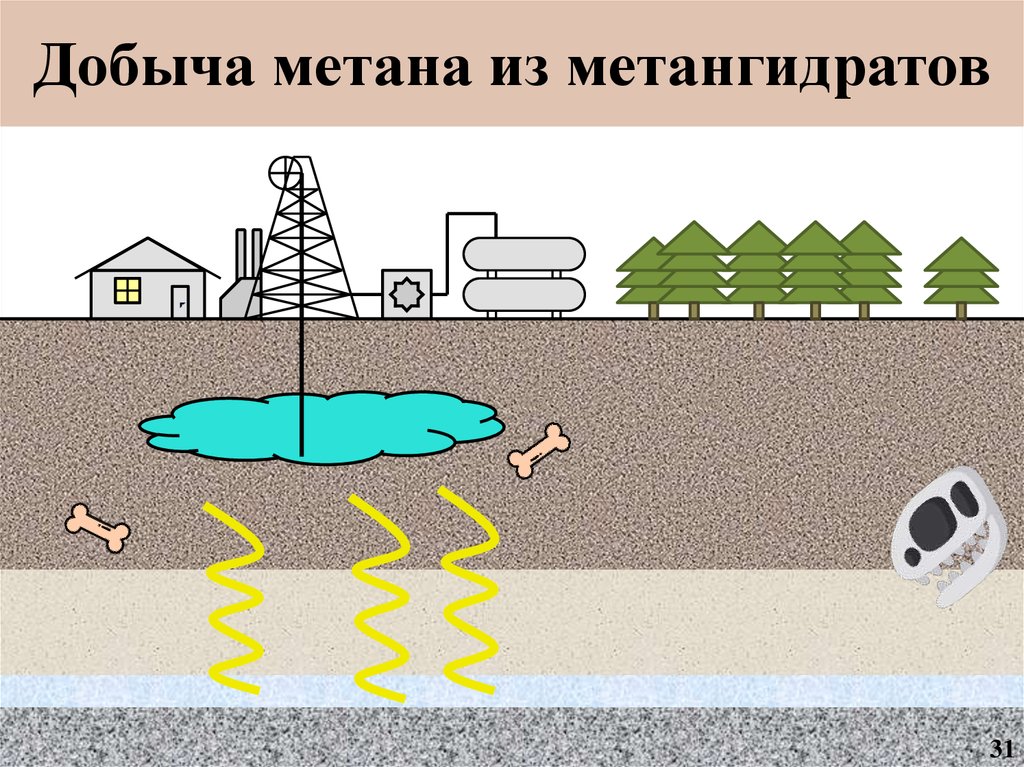
13.
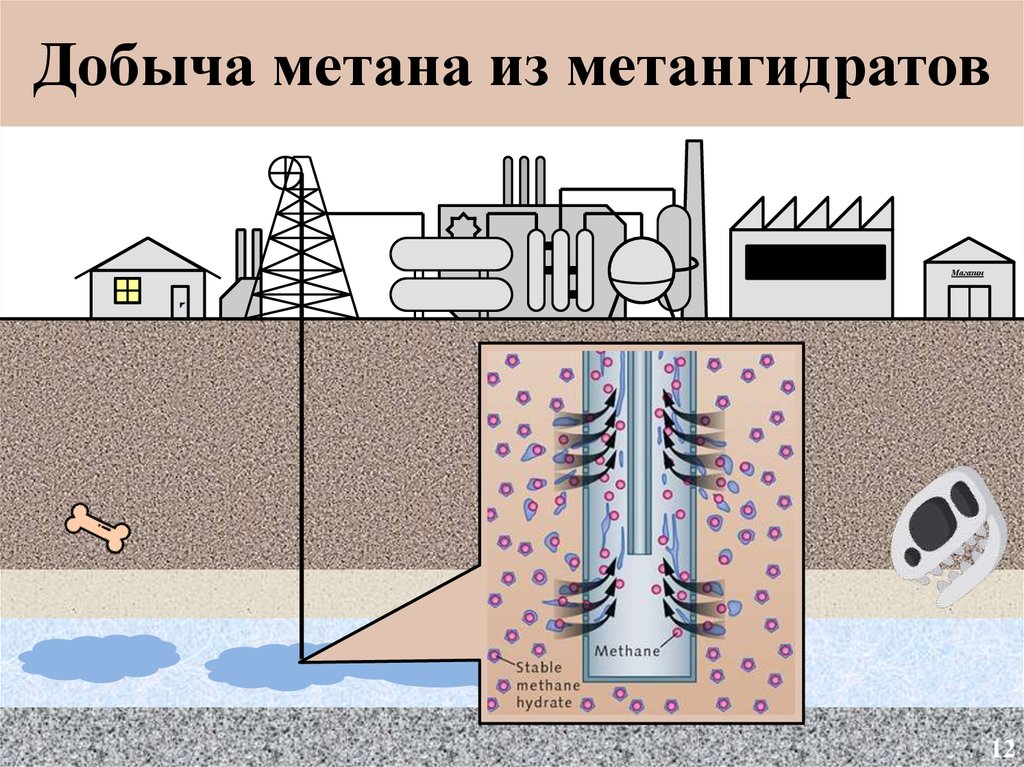
Добыча метана из метангидратовМагазин
12
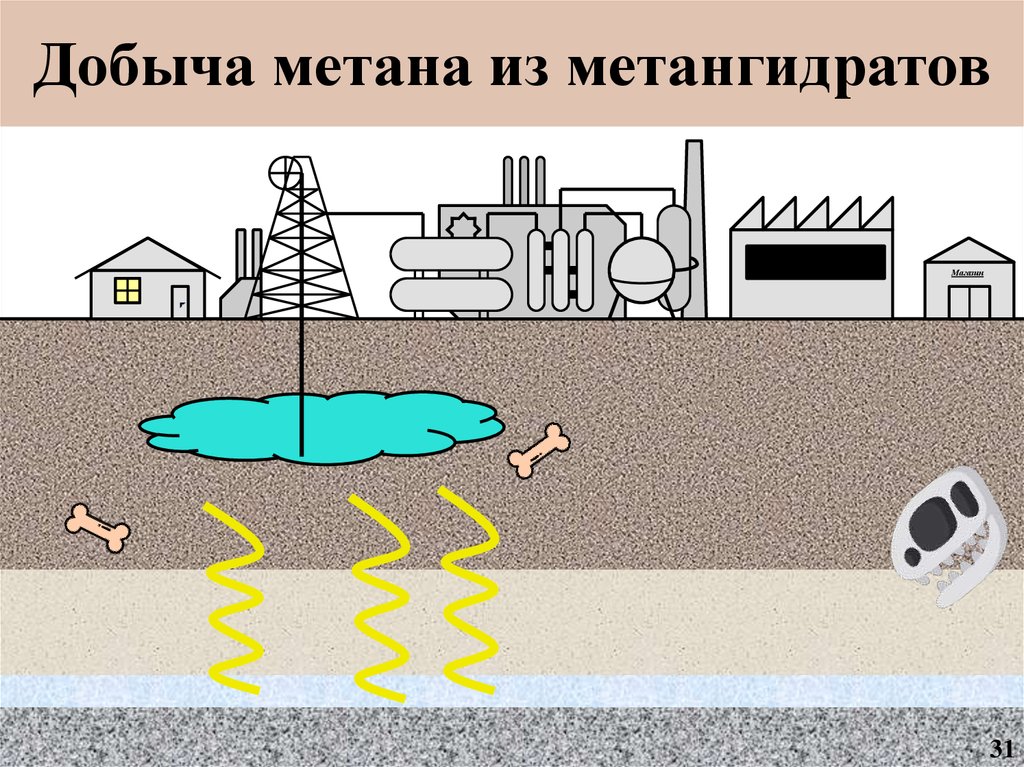
14.
Добыча метана из метангидратов13
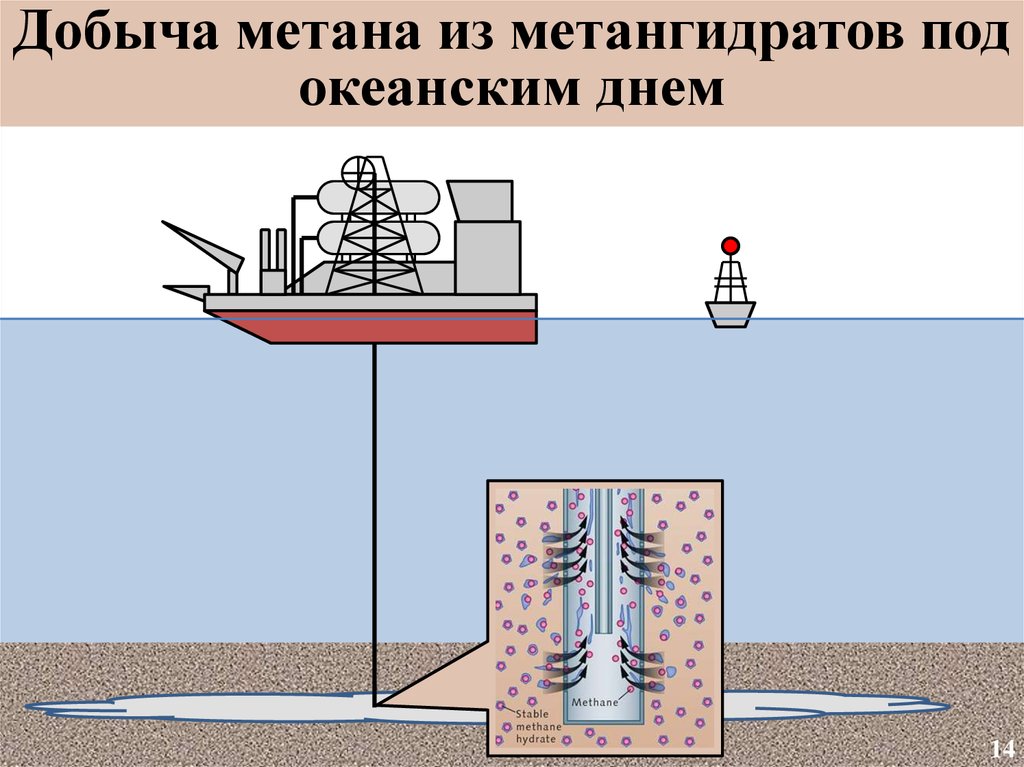
15.
Добыча метана из метангидратов подокеанским днем
14
16.
Добыча метана из метангидратов подокеанским днем
15
17.
Добыча метана из метангидратов наморском дне
16
18.
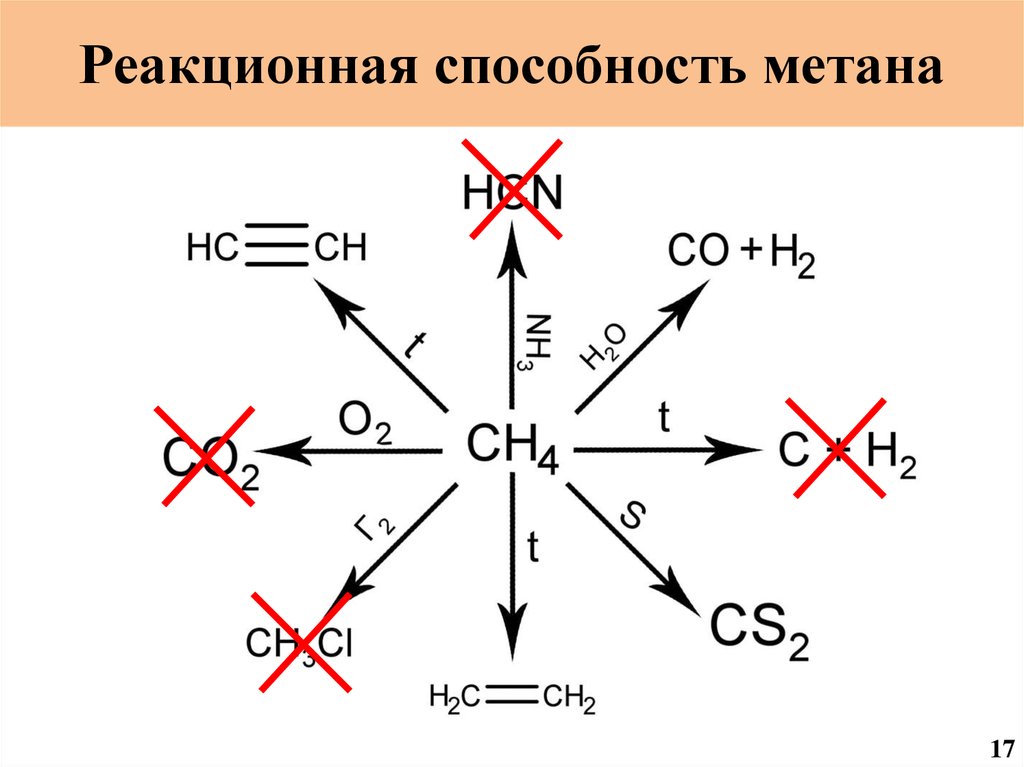
Реакционная способность метанаCH2O
H2O C
H2C
C CO
CO2C
ПВС
CO
CH3OH
N2
O2
NH3
CO2
C
CH4
C
NaCl
C
C
CH2
C2H2
C
CH C
2
NaOH
C
CH3COOH
C2H2
CH2O
CH2=CHC ≡CH
HCl
C2H4
C3H6
CH3COOH=CH2
NH3
HNO3
NH2CONH2
ПВА
NH4NO3
МФС
CH2=CHCCl=CH2
CH2=CHCl
ClCH2CH2Cl
CH2=CHClCH2Cl
ПВХ
NH3
H2O, NaOH, Cl2
NH2CH2CH2NH2
ЭХГ
Глицерин
17
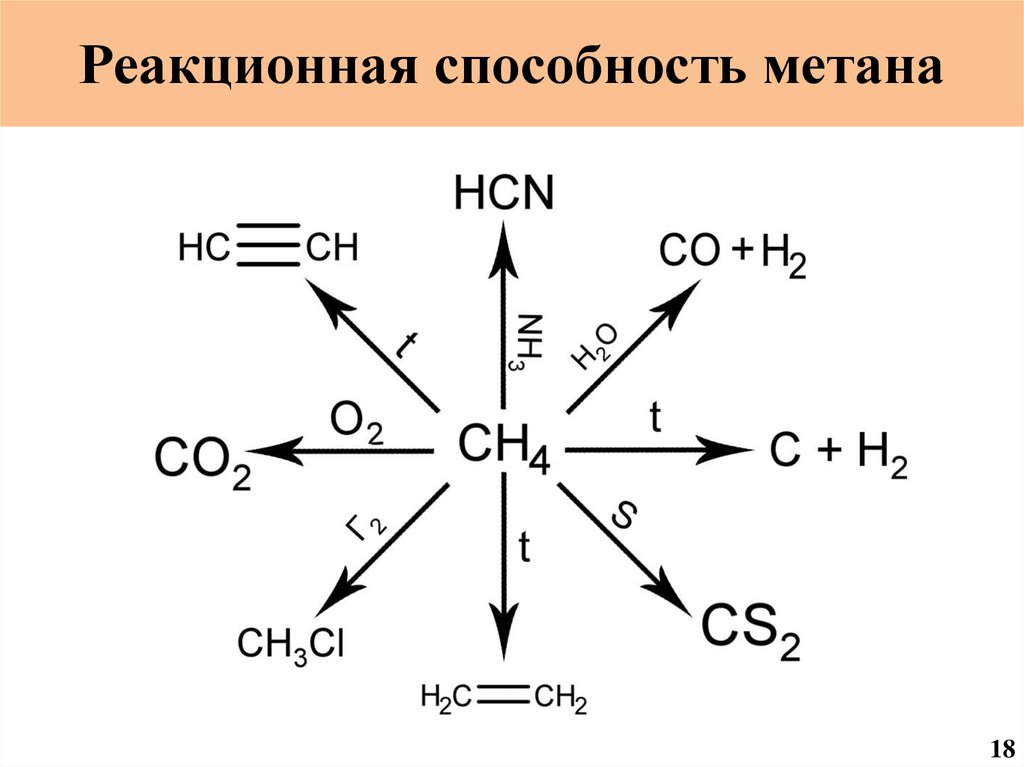
19.
Реакционная способность метана18
20.
Реакционная способность метана19
21. Конверсия метана
CH4 + H2O = CO + 3 H2• 720·1012 м3 1,44·1015 м3 720·1012 м3
1,44·1015 м3
2 CH4 = H2C=CH2 + 2 H2
• 720·1012 м3 360·1012 м3 720·1012 м3
2 CH4 = HC≡CH + 3 H2
• 720·1012 м3 360·1012 м3 1080·1012 м3
20
22. Полимеры полученные из метана
ПолиэтиленПВС
Поликетон
Ситетический
каучук
Полистирол
Полиацетилен
Полиактриловая
кислота
Полиформальдегид
21
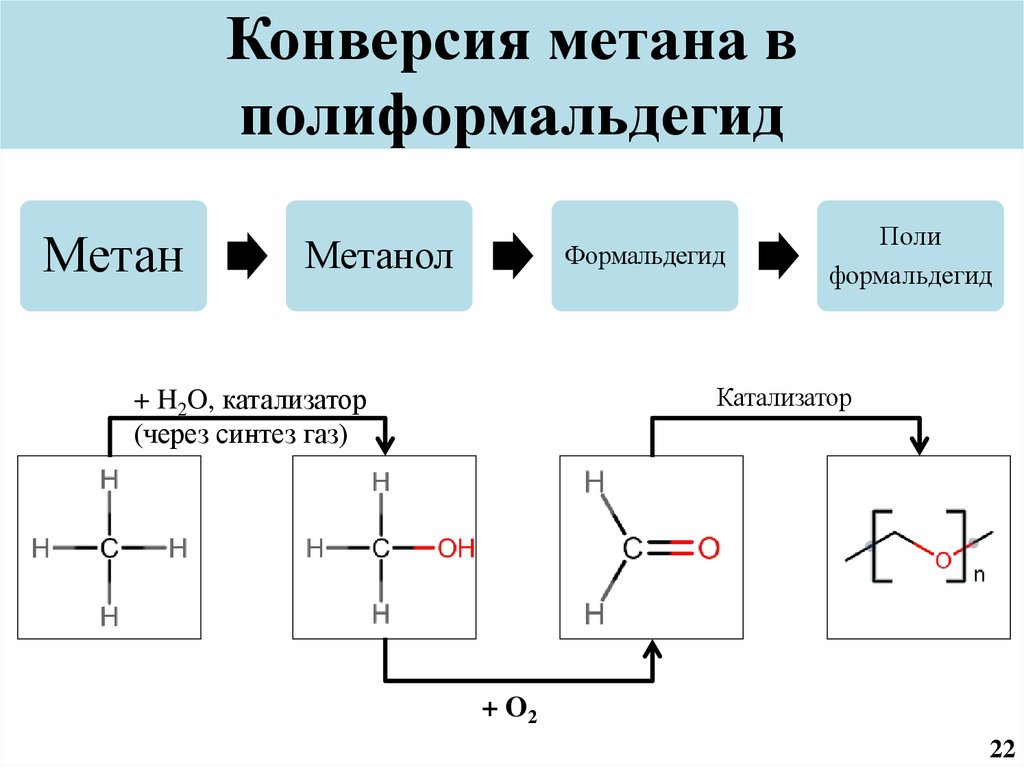
23. Конверсия метана в полиформальдегид
МетанМетанол
Формальдегид
Поли
формальдегид
Катализатор
+ H2O, катализатор
(через синтез газ)
+ O2
22
24. Характеристики конверсии
CH4 + H2O(пар) = CO + 3 H2• 720·1012 м3 720·1012 м3 720·1012 м3 2160·1012 м3
CO + 2H2 = H3COH(пар)
• 720·1012 м3 1440·1012 м3 720·1012 м3
2 H3COH(пар) + O2 = 2H2CO + 2H2O(пар)
• 720·1012 м3
360·1012 м3 720·1012 м3
720·1012 м3
nH2CO = -[-CH2-O-]n• 720·1012 м3
586.8·1012 м3
23
25. Применение полиформальдегида
МузыкаЭлектротехника
Механика
Транспорт
Одежда
Полиормальдегид
Хобби
Спорт
Упаковка
Мебель
Питание
Медицина
24
26. Производство полиформальдегида
Отчистка метанаОкисление метана до метанола
Получение формальдегида
Получение полиформальдегида
Обработка полиформальдегида
25
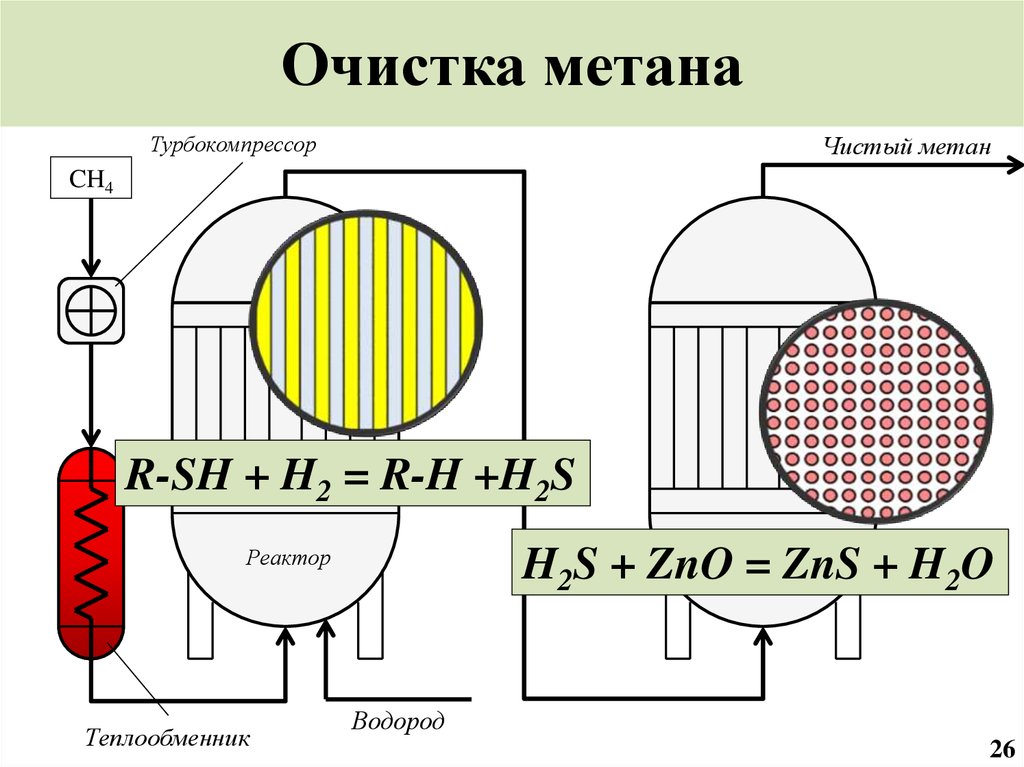
27. Очистка метана
ТурбокомпрессорЧистый метан
CH4
R-SH + H2 = R-H +H2S
Реактор
Теплообменник
H2S + ZnOРеактор
= ZnS + H2O
Водород
26
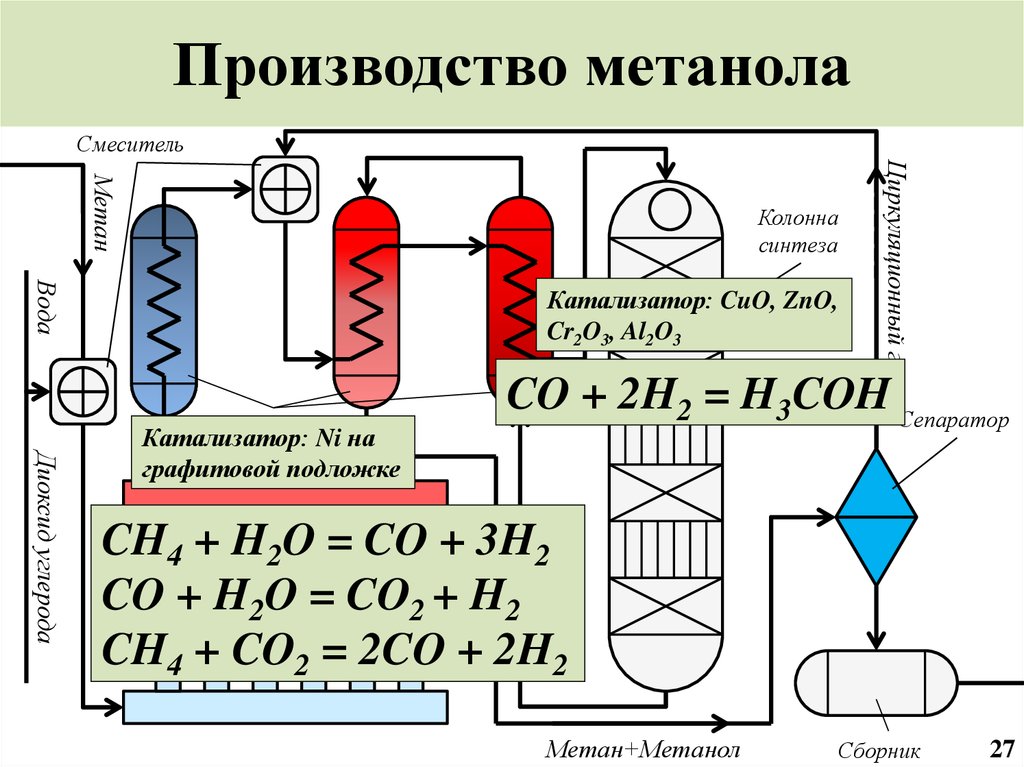
28. Производство метанола
СмесительВода
Катализатор: CuO, ZnO,
Cr2O3, Al2O3
Диоксид углерода
Теплообменник
Катализатор:
Ni на
Синтез-газ
графитовой подложке
Циркуляционный газ
Метан
Колонна
синтеза
CO + 2H2 = H3COH Сепаратор
CH4 + H2O = CO + 3H2
CO + H2O = CO2 + H2
CH4 + CO2 = 2CO + 2H2
Метан+Метанол
Сборник
27
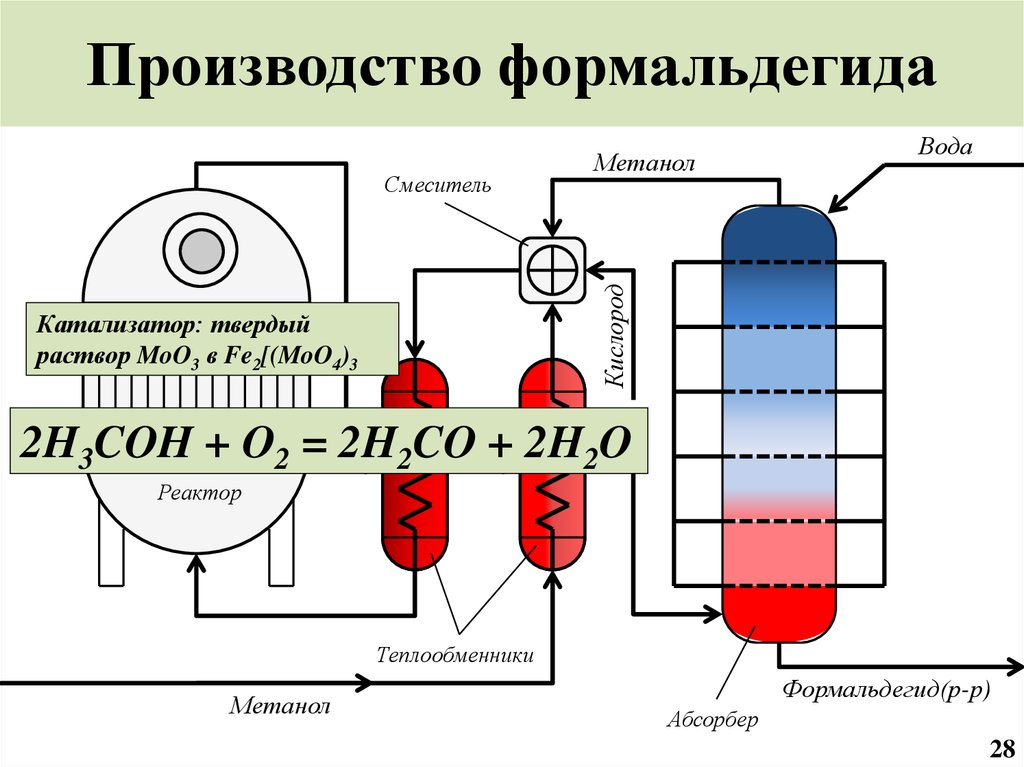
29. Производство формальдегида
ВодаКислород
Смеситель
Метанол
Катализатор: твердый
раствор MoO3 в Fe2[(MoO4)3
2H3COH + O2 = 2H2CO + 2H2O
Реактор
Теплообменники
Метанол
Формальдегид(р-р)
Абсорбер
28
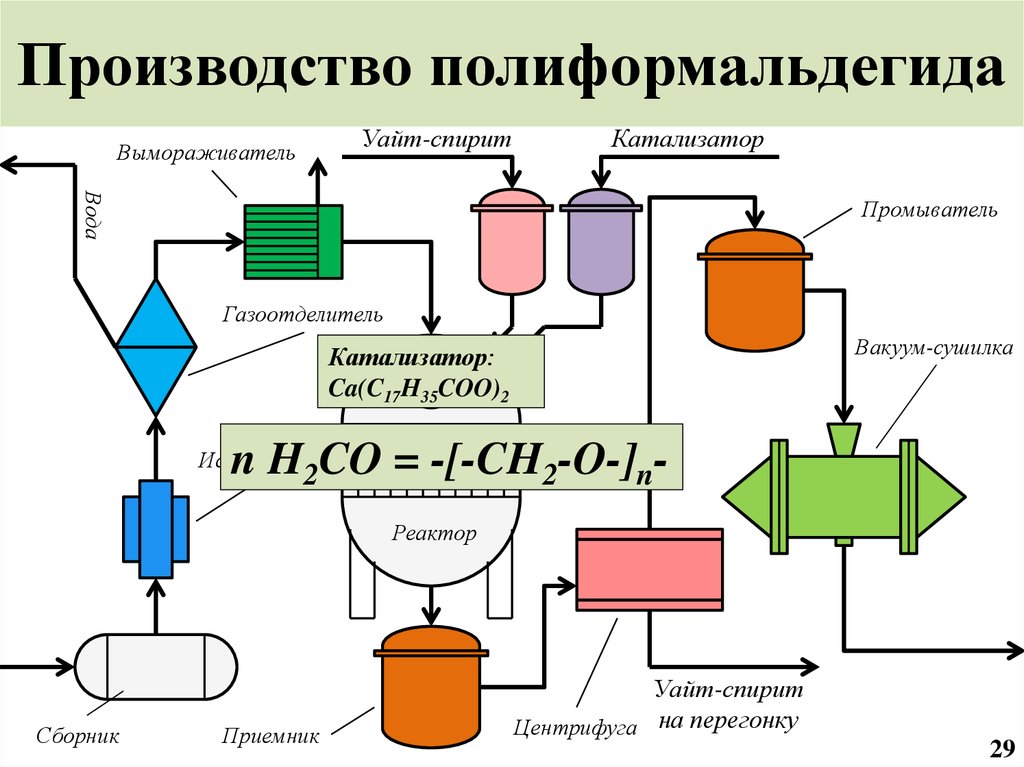
30. Производство полиформальдегида
ВымораживательУайт-спирит
Катализатор
Вода
Промыватель
Газоотделитель
Вакуум-сушилка
Катализатор:
Ca(C17H35COO)2
n H2CO = -[-CH2-O-]n-
Испаритель
Реактор
Сборник
Приемник
Уайт-спирит
Центрифуга на перегонку
29
31. Обработка полиформальдегида
Гранулированныйполиформальдегид
Присадки
Красители
Печь
30
32. Применение полиформальдегида
МузыкаЭлектротехника
Механика
Транспорт
Одежда
Полиормальдегид
Хобби
Спорт
Упаковка
Мебель
Питание
Медицина
31
33.
Плюсы• Высокий выход
• Экономичность
• Продукты
переработки
очень
востребованы
• Безопасность
Минусы
• Требуется
добыча газа
• Дорогой завод
32
34.
ЗаключениеПредложили безопасные способы добычи метана
из метангидратов
• Разобрали возможные варианты
• Выявили перспективные способы
• Разобрали способ переработки метана в полиформальдегид
Предложили технологию процесса
• Технология добычи метана из метангидратов
• Технология переработки метана в полиформальдегид
• Технология обработки полиформальдегида в готовый
продукт
33
35. Список литературы
Химия и технология основного органического и нефтехимического синтеза /
Лебедев Н. Н. – 3-е изд., перераб. – М.: Химия, 1981 г.
Основы химической технологии: Учебник для студентов вузов / Мухленов
И.П., Горштейн А. Е., Тумаркина Е. С., Тамбовцева В. Д. Под ред. Мухленова
И. П. – 3-е изд., перераб. И доп. – М.: Высш. Школа, 1983 г.
Курс технологии связанного азота. Атрощенко В. И. и др. Под ред. чл.-корр.
АН УССР Атрощенко В. И. 2-е изд, пер. и доп.
Производство метанола. Караваев М. М., Мастеров А. П. «Химия», М., 1973 г.
Промышленная адсорбция газов и паров. Серпионова Е. Н. Изд. 2-епереработ.
и доп. Учеб. Пособие для студентов химико-технологических специальностей
вузов. М., «Высш. школа», 1969 г.
Органическая химия. В 4 ч. Реутов О.А., Курц А.Л., Бутин К.П.
Дж. Кэрролл. Гидраты природного газа. — Технопресс, 2007.
34
36. Список литературы
Resources to Reserves 2013 — Oil, Gas and Coal Technologies for the Energy
Markets of the Future / IEA, 2013.
BP Statistical Review of World Energy 2013.
Макогон Ю.Ф. Природные газовые гидраты: распространение, модели
образования, ресурсы // Российский химический журнал, т. XLVTI, № 3, 2003.
Energy Resource Potential of Methane Hydrate / US DOE Report, 2011.
Paul C. Painter; Michael M. Coleman (2008). Essentials of Polymer Science and
Engineering. DEStech Publications, Inc. pp. 313–. ISBN 978-1-932078-75-6.
Christopher C. Ibeh (25 April 2011). Thermoplastic Materials: Properties,
Manufacturing Methods, and Applications. CRC Press. pp. 473–. ISBN 978-14200-9384-1.
Неорганическая химия. Химия элементов. Ю.Д. Третьяков, Л. И. Мартыненко,
А. Н. Григорьев, А. Ю. Цивадзе. В двух томах. 2007. ISBN: 978-5-94628-297-0.
35
37.
Спасибо за внимание38.
Выделение метана в небольшихколичествах
CH4
31
39.
Добыча метана из метангидратовCH4
31
40.
Добыча метана из метангидратов31
41.
Добыча метана из метангидратовМагазин
31
42. Полиэтилен из метана
Полиацетилен из метана21
43. Полиформальдегид из метана
Поликетоны из метана22
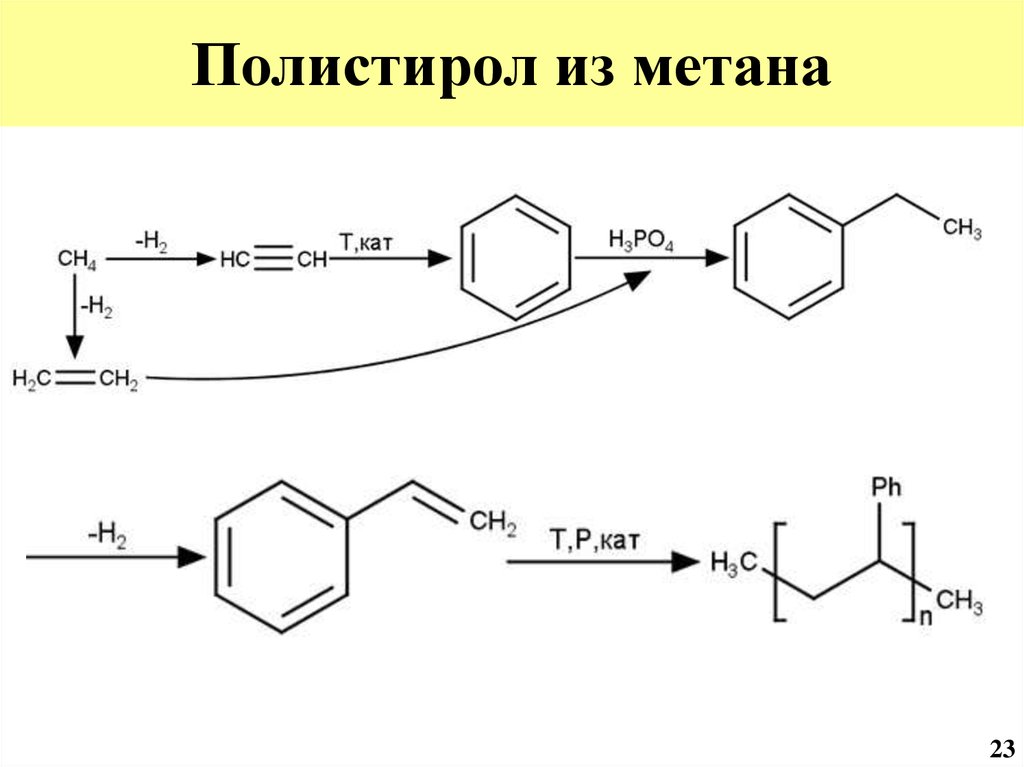
44. Полистирол из метана
2345. Полиакриловая кислота из метана
Синтетический каучук из метана24
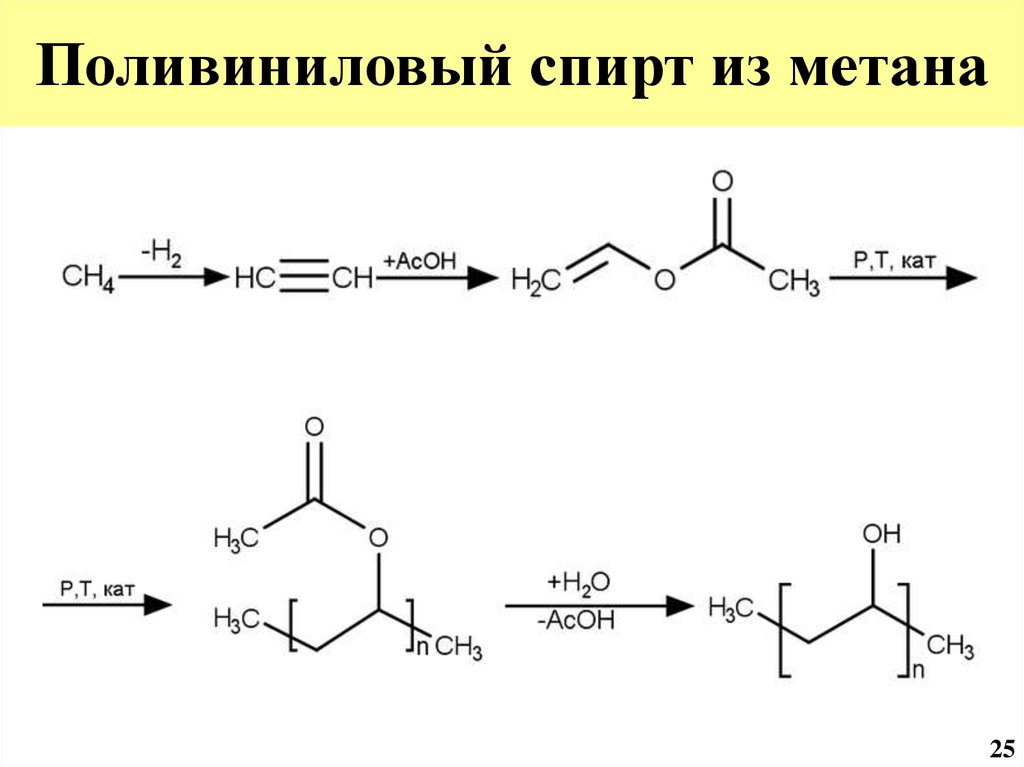
46. Поливиниловый спирт из метана
2547.
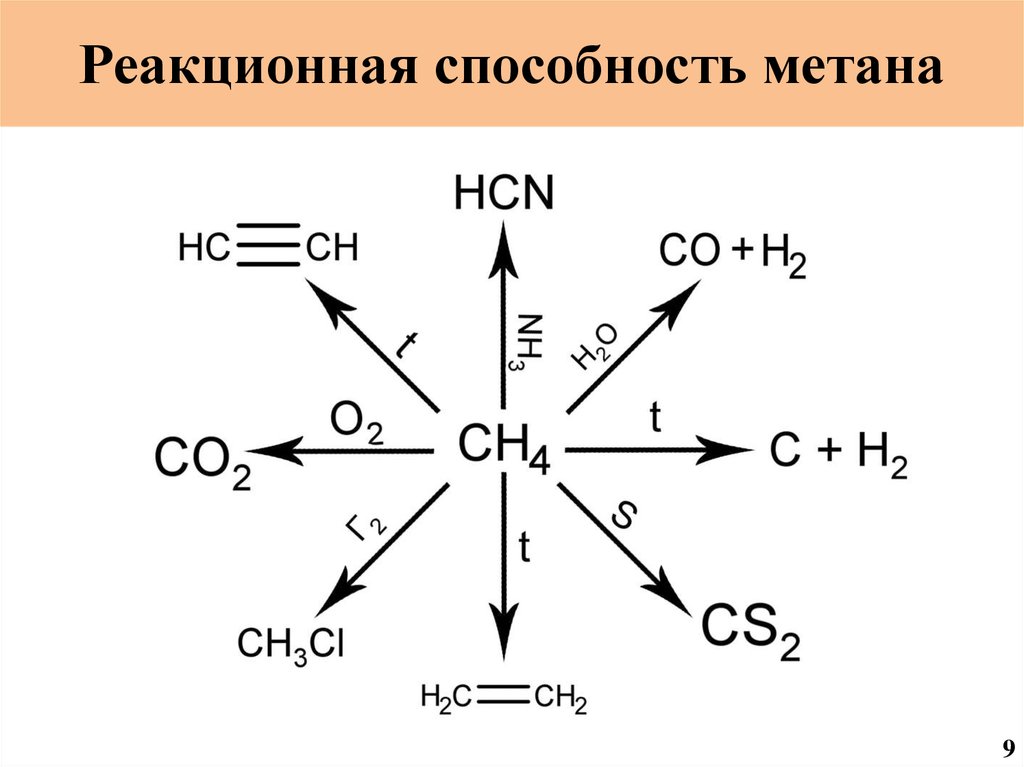
Реакционная способность метана9
48. Горение метана
CH4 + 2 O2 = CO2 + 2 H2O720·1012 м3 1,44·1015 м3 720·1012 м3 1,44·1015 м3
CH4 + 2 O2 = CO2 + 2 H2O + 892 кДж
Сжигание 720·1012 м3 CH4
=
28671,4 Квинтиллионов Джоулей
Парниковый газ
CO2
Метан взрывоопасен
10
49.
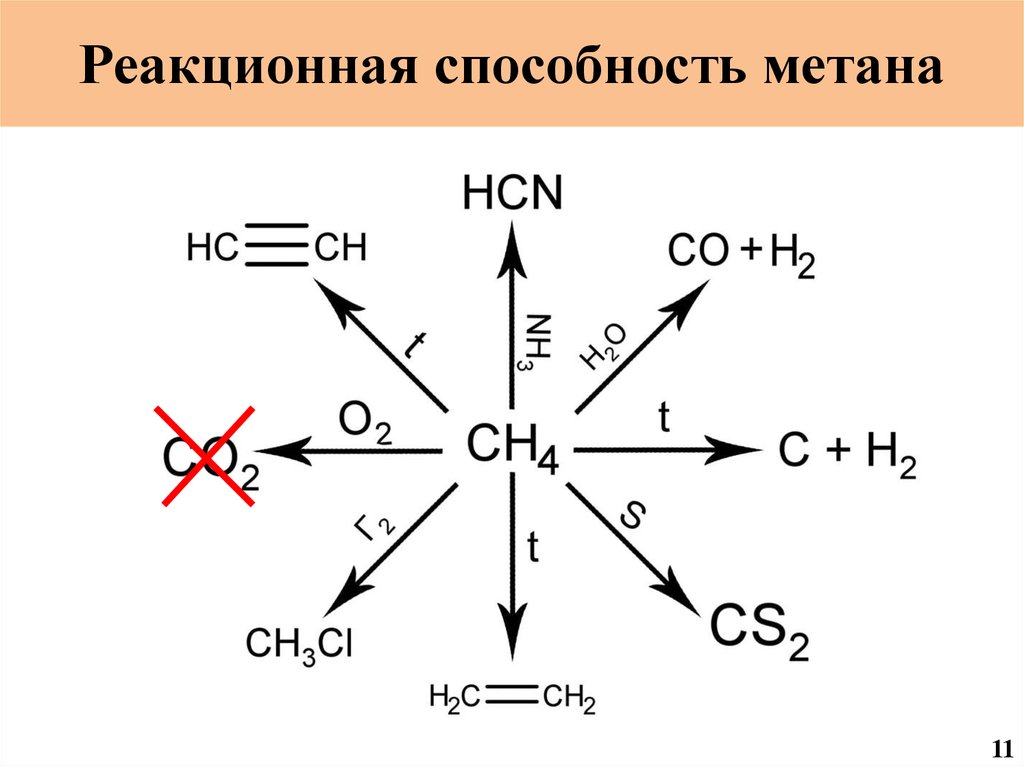
Реакционная способность метана11
50.
Разложение метанаCH4 = C + 2 H2
Требуется много энергии
• 2404.28 Квинтиллионов Джоулей
Труднореализуемо и затратно в промышленности
• Износ футеровки в печах
• Работа с высокими температурами
Продукты реакции горючи
• 2H2 + O2 = 2H2O + Q
• Q = 18386·1018 Дж
12
51.
Реакционная способность метана13
52. Взаимодействие с аммиаком
CH4 + NH3 = HCN + 3 H2720·1012 м3 1,44·1015 м3 720·1012 м3 1,44·1015 м3
HCN
Синильная кислота очень ядовита
Реакция с низким выходом
4
4
1
ЛД50 3,7 мг/кг
Активная синильная кислота реагирует с
многими соединениями, легко гидролизуется в
HCOOH, которая преобразуется в CO2
14
53.
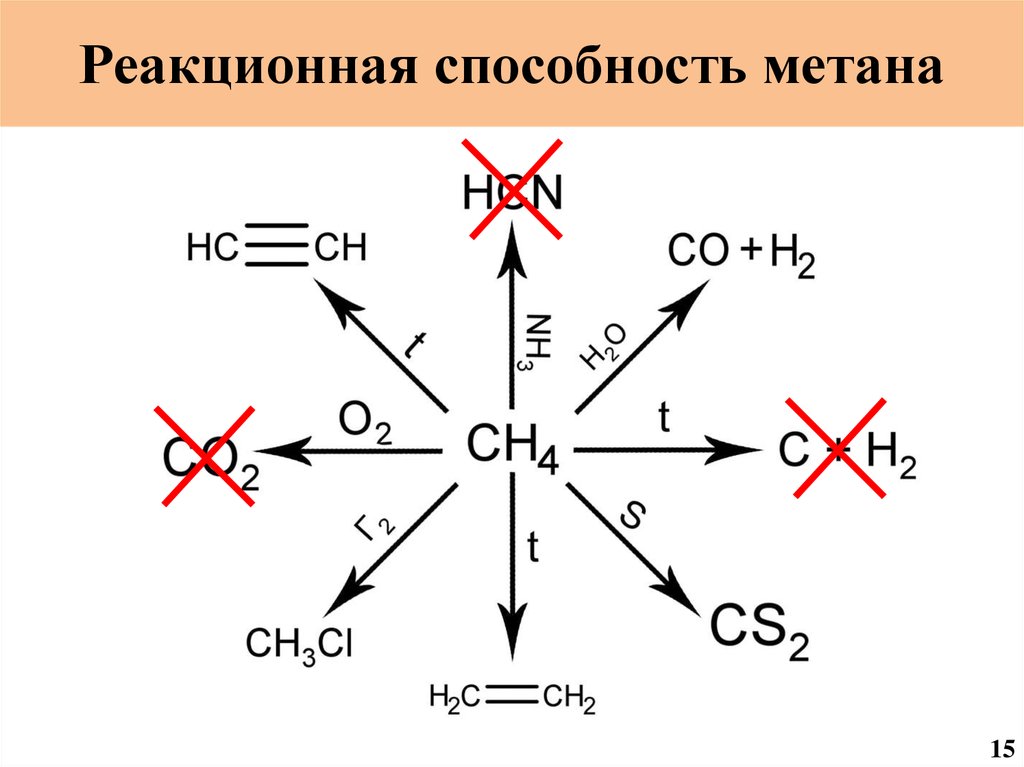
Реакционная способность метана15
54.
Галогенирование метанаCH4 + xГ2 = CH(4-X)ГX + XHГ
Г = F2; Cl2; Br2; J2
Фтор
CH3F
CH2F2
CHF3
CF4
Хлор
CH3Cl
CH2Cl2
CHCl3
CCl4
Бром
CH3Br
CH2Br2
CHBr3
CBr4
Йод
CH3J
CH2J2
CHJ3
CJ4
На земле недостаточно галогенов чтобы связать весь метан
Низкие выходы, получается смесь продуктов
Продукты не используются для промышленного синтеза
16
55.
Реакционная способность метана17
56. Сероуглерод из метана
CH4 + 2 S8 = CS2 + H2S472.32·1012 3776.21·1012 2242.72·1012 2006.80·1012
Столько серы нет
на планете Земля
H2S
4
4
0
ЛД50 600 ppm
Крайне ядовитые
продукты
CS2
3
4
1
ЛД50 3188 мг/кг
18
57.
Реакционная способность метана19





































 chemistry
chemistry