Similar presentations:
Химическая переработка углеводородного сырья. Лекция 1. Часть 2
1.
Кафедра технологии химических веществдля нефтяной и газовой промышленности
Часть 2 – Химическая переработка
углеводородного сырья
2.
Лекция 12
3. Содержание курса
Лекции – 3 ч/нед. Вторник 8.40 – 10.15 (ауд.541)Вторник, в.н., 10.25 – 12.00 (ауд.541)
доц. Толстых Л.И.
Лабораторные работы - Четверг, 14.20 – 17.40
(ауд 536)
доц. Толстых Л.И.
Семинарские занятия – Четверг, н.н., 10.25 – 12.00 (ауд. 541)
ст. преп. Ефанова О. Ю.
3
4. Рейтинговая система оценки
Рейтинговые баллы (max - 100 баллов, min –50 баллов) распределяются следующим образом:семестровые: max - 50 баллов, min –25 баллов;
экзаменационные: max - 50 баллов, min –25 баллов.
Итоговый балл: (100 – 85) => (5- отлично)
(84 – 71) => (4- хорошо)
(70 – 50) => (3- удовлетворительно)
(49 и < ) => (2- неудовлетворительно)
Промежуточные семестровые баллы выставляются по итогам контрольных недель:
1-я контрольная неделя - 16 – 22 марта 2009 г.;
2-я контрольная неделя - 20 – 26 апреля 2009 г.
Срок введения в систему «Сессия» семестрового рейтинга – 01 июня 2009 г.
Семестровый рейтинговый балл включает в себя следующие составляющие:
1. Бонус за выполнение графика работы в семестре (своевременная сдача коллоквиумов, оформление и защита
лабораторных работ, выполнение контрольной работы (в часы учебного расписания) – 15 баллов (по 5 баллов
к результатам каждой контрольной недели и к зачету), а именно:
1-я к.н. – выполнены 3 лабораторные работы , из них защищены 2 лабораторные работы – + 5 баллов;
2-я к.н. – выполнены и защищены 5 лабораторные работы, сдан 1 коллоквиум – +5 баллов;
Зачет – выполнены и защищены 6 лабораторных работ, выполнена контрольная работа, сданы 2
коллоквиума - + 5 баллов.
2. Лабораторный практикум
Цена лабораторной работы - 3 балла (1 балл – подготовка к работе, 1 балл – выполнение работы, 1 балл –
защита лабораторной работы)
В течение осеннего семестра выполняется 6 лабораторных работ. Общая максимальная сумма баллов в
семестре по результатам выполнения лабораторного практикума составляет (3 балла · 6) = 18 баллов.
3. Семинарские занятия – оценивается результат контрольной работы - максимальная оценка - 7 баллов.
4. Коллоквиум по теоретической части курса
Максимальный балл за сдачу коллоквиума -5 баллов.
Общая максимальная сумма баллов по результатам сдачи коллоквиумов –
(5 баллов · 2) = 10 баллов.
5. Экзаменационные рейтинговые баллы начисляются по 2-м вопросам экзаменационного билета:
Максимальная цена вопроса – 20 баллов (без технологической или поточной схемы) и 30 баллов (с 4
технологической или поточной схемой)
5. Основная литература
1. Адельсон С.В., Вишнякова Т.П., Паушкин Я.М.Технология нефтехимического синтеза. - М.: Химия, 1985 - 607 с.
2. Белов П.С., Вишнякова Т.П., Паушкин Я.М.
Практикум по нефтехимическому синтезу. - М.: Химия, 1987. - 239 с.
3. Адельсон С.В., Белов П.С.
Примеры и задачи по технологии нефтехимического синтеза. -М.: Химия,
1987.- 192 с.
4. Тимофеев В.С., Серафимов Л.А.
Принципы технологии основного органического и нефтехимического
синтеза.- М.: Высшая школа, 2003.- 536 с.
5. Платэ Н.А., Сливинский Е.В.
Основы химии и технологии мономеров.- М.: Наука, 2002. – 696 с.
5
6.
ОКИСЛЕНИЕ АРОМАТИЧЕСКИХСОЕДИНЕНИЙ
Кумольный метод производства фенола и ацетона – СССР, 1949 г.
1. ОКИСЛЕНИЕ ИПБ
К=18-25%
CH3 CH
CH3
+
С=91-95%
O2
CH3
Реакция
экзотермическая!
OH
OOH
C CH3
CH3 C CH3
110-1300C
pH=7-8
+
0,5 O2
Инициатор – ГПИПБ;
Катализатор – нафтенаты и
резинаты Со и Мn
CH3 C O
+
CH3 OH
H C
H
O
HCOOH
6
7.
Механизм жидкофазного окисления – радикально-цеп- инициирование
RH
+
R*
O2
+
* OOH
или
2 RH
+
O2
2R*
+
H2O2
- продолжение цепи
+
O2
ROO*
+
R*
ROO*
RH
ROOH
+
R* и т.д.
- вырожденное разветвление
ROOH
RO*
RO*
+
RH
+
*OH
ROH
+
R*
- обрыв цепи (примеси, ингибиторы, «кислые соединения») –
соответственно необходима тщательная очистка воздуха от
кислых примесей и ИПБ от примесей олефинов
7
8.
Инициирование*
CH3 C CH3
CH3 CH CH3
+
2
2
O2
+
H2 O2
Продолжение цепи
O O*
*
CH3 C CH3
O OH
CH3 C CH3
+
CH3 C CH3
O2
O O*
O OH
CH3 C CH3
CH3 CH CH3
+
*
CH3 C CH3
CH3 C CH3
+
8
9.
Вырожденное разветвлениеO O*
CH3 C CH3
CH3 C
O
+
CH3O *
*
CH3 C CH3
CH3 CH CH3
CH3O *
+
(CH3OH
CH3OH
O2
CH2O
O2
+
HCOOH)
(
9
10.
O OHO*
CH3 C CH3
CH3 C CH3
+
O*
*O H
OH
CH3 C CH3
CH3 CH CH3
+
+
O OH
*
CH3 C CH3
CH3 C CH3
+
*
CH3 C CH3
CH3 C CH3
OH
O*
CH3 C CH3
CH3 C CH3
+
10
11.
Скорость накопления ГП ИПБ:- в лабораторных условиях 10-13% /ч
-в промышленных условиях 5-7 % /ч
Содержание в оксидате на выходе из реактора:
- ГП ИПБ 18-25%
- продуктов распада (ДМФК, АФ) 1-2%
%
ГП
%
ПР
ГП ИПБ
24
15
ПР
16
10
8
5
0
1
2
3
Время,
час
11
12.
2. РАЗЛОЖЕНИЕ ГП ИПБCH3
OOH
C CH3
Реакция
экзотермическая!
OH
40-600C
H2SO4
+
CH3 C CH3
O
Побочные реакции на стадии разложения ГП ИПБ
1)
OH
CH3 C CH3
H2SO4
+
2)
CH3
OH
- H2O
Кумилфенол
C
CH3
OH
OH
CH3 C CH3
CH3
OH
+
C
- H2O
Кумилфениловый эфир
O
CH3
12
13.
OHCH3 C CH3
3)
H2SO4
CH3 C CH2
α-Метилстирол
- H2O
4)
CH3 C CH2
CH3
OH
5) CH3 C
CH2
CH3
CH3
C
2
Кумилфенол
C
+
OH
CH3
CH
Димер α-метилстирола
C
CH3
OH
6)
2
CH3
+
CH3 C CH3
O
Дифенилолпропан
(бисфенол-А)
C
HO
CH3
OH
13
14.
Суммарное количество побочных продуктов 0,1 ÷ 0,23 т/тфенола
Фенольная смола, в т.ч.:
Димер α-метилстирола + смола
Кумилфенол
α-Метилстирол
Ацетофенон
Диметилфенилкарбинол
– 43,1 %
- 33,1 %
- 15,7 %
- 7,0 %
- 0,8 %
Для более селективного разложения необходимы:
- малая концентрация ГП ИПБ (до 1%) (большой избыток ацетона);
- концентрация H2SO4 0,8 – 5,0 %;
- низкие температуры ( <400С );
- быстрый отвод тепла (испарение ацетона).
В перспективе возможна замена жидкой Н2SO4 , требующей после разложения
ГП ИПБ нейтрализации реакционной массы, приводящей к образованию
минерализованных фенолсодержащих сточных вод, на твердые органические
(КУ-2) и неорганические (каолин, алюмосиликаты, кремнийциркониевые и
цирконийфосфатные катализаторы) кислоты.
14
15.
Лекция 215
16.
Отработанныйвоздух
Отработанный
воздух
Отработанный
воздух
ИПБ
1300С
Отработанный
воздух
1200С
ИПБ
1100С
1300С
25% ГП ИПБ
Воздух
1100С
25% ГП ИПБ
Воздух
Окислительная
колонна
Каскад окислительных
колонн
16
17.
III4
5
1
1
2
I
IV
3
3
6
IX
8
9
VII
4
VI
V
II
7
10
18-25%
ГП ИПБ
70%
ГП ИПБ
95-98%
ГП ИПБ
VIII
Окисление изопропилбензола в реакторе каскадного типа
1,2,3 - реакторы; 4 – холодильники; 5 – сепаратор; 6 – колонна-нейтрализатор; 7 – емкость
приготовления окислительной шихты; 8,9 – вакуумные колонны; 10 – реактор разложения ГП ИПБ.
17
I – окислительная шихта; II – свежий воздух; III – отработанный воздух; IV – р-р NaOH;
V – свежий ИПБ; VI – ГП ИПБ; VII – H2SO4; VIII – ацетон; IX – фенол и ацетон на разделение.
13
18. Фенол и ацетон
Мировое производство фенола (без СНГ)~ 8 млн т/год (2000 г).
Производство фенола в России
~ 240 тыс.т/год (2004 г).
Потребление фенола:
- Дифенилолпропан (бисфенол-А)
(эпоксидные смолы и поликарбонаты) - 37%.
- Фенолформальдегидные смолы - 34%.
- Синтетич. волокна (капрон, нейлон) - 15%.
- Гербициды, красители, лекарственные
препараты (5%-ный водный раствор
фенола – карболка, аспирин, в
молекулярной биологии и генной
инженерии для очистки ДНК), ПАВы,
присадки к топливам и маслам,
селективные растворители – 14%
Из-за высокой токсичности в настоящее
время использование сильно
ограничено
Мировые мощности по производству
ацетона ~ 5,4 млн т/год (2000 г.)
Мировое потребление ацетона
~ 3,7 млн т/год (2000 г.)
В России:
- Производственные мощности
~ 500 тыс.т/год (2000 г.)
-Производство ~ 100 тыс.т /год (2000 г.)
Основное направление потребления
ацетона – растворитель.
Для ликвидации разрыва между
производством
и
потреблением
ацетона в Японии в схеме кумольного
производства фенола предусмотрено
гидрирование
ацетона
до
изопропилового спирта (Ni, 700С) с
последующей
дегидратацией
до
0
пропилена
(Al2O3, ,
320 С)
и
возвращением пропилена на стадию
алкилирования бензола.
18
14
19.
Производство фенола и ацетона («Саратоворгсинтез»)19
20.
«Саратоворгсинтез»НАИМЕНОВАНИЕ
ПРОДУКТА
ОБЛАСТЬ ПРИМЕНЕНИЯ
УПАКОВКА И ТРАНСПОРТИРОВАНИЕ
Фенол синтетический
технический . ГОСТ
23519-93, марки А, Б, В.
В производстве капролактама, дифенилолпропана,
медицинских препаратов, фенолформальдегидных
смол, орто-крезола, присадок к маслам, для
селективной очистки масел и др.
В железнодорожных цистернах из
нержавеющей хромоникелевой
стали, углеродистой стали с
цинковым покрытием, снабженных
устройством для обогрева.
Ацетон технический
ГОСТ 2768-84 с изм. 1-2,
высший и 1 сорт
В производстве уксусного
ангидрида,ацетонциан-гидрина,
дифенилолпропана и других органических
соединений и в качестве растворителя в
различных областях промышленности.
В железнодорожных и
автоцистернах, в герметичных
алюминиевых, стальных или
оцинкованных бочках вместимостью
от 100 до 275 куб.дм.
Побочные продукты производства фенола и ацетона:
Альфаметилстирол ТУ
2414-018-47773778-2006,
первый и второй сорт
В производстве синтетических каучуков и
латексов, пластических масс и др.
В железнодорожных цистернах
Бутилбензольная
фракция . ТУ 2411-03405757601-94 с изм. 1,
марки: "компонент для
автомобильного бензина"
и "для переработки"
Как компонент автомобильного бензина, а
также сланцеперерабатывающими заводами для
переработки
В железнодорожных цистернах,
имеющих нижний слив
Этилбензольная
фракция. ТУ 2414-01505757601-98 с изм. 1,2
На сланцехимических производствах, для
получения этилбензола, в производствах
лакокрасочных материалов.
В железнодорожных и
автоцистернах
Смола
полиалкилбензольная.
ТУ 2453-011-477737782004, марка "Б"
Для выделения из нее целевых продуктов,
входящих в ее состав, в качестве реагентасобирателя для флотации углей, компонента
смазочных добавок к буровым растворам и
котельного топлива.
В железнодорожных цистернах
Смола фенольная. ТУ
2424-020-057575601-98 с
изм. 1
Как компонент котельного топлива. Расчетная
теплота сгорания смолы составляет от 40 до 50
тыс.Дж/кг.
В железнодорожных и
автоцистернах
Алюмохлорид. ТУ 2152005-47773778-2002 марка
"Б"
В качестве коагулянта для очистки
промышленных сточных вод.
20 с
В железнодорожных цистернах
универсальным сливным прибором,
автоцистернах
21. Технико-экономические показатели производства фенола (США)
ПоказателиКумольный
метод
Сульфурационный метод
Хлорбензольный метод
Метод Рашига
-
0,903-0,977
-
0,977-1,18
0,94-0,97
-
-
-
-
-
1,22-1,33
-
1,558
-
-
-
0,465
0,172
1,542
1,243
-
1,361
-
-
2,177
110-130
300-400
340-400
200-300 (1 ст.)
350-360 (2 ст.)
3. Конверсия за проход, %
25-30
6-7
35-45
8-15 (1 ст.)
10-15 (2 ст.)
4. Выход, % от теор.
90-95
85-92
90-98
70-85
5. Заводская
себестоимость,%
100
100,2
101,2
101,1
6. Капитальные затраты
(на 1 т продукции в год)
100
96,5
143
150
1. Расход сырья , т/т
фенола
Бензол
ИПБ
хлорбензол
H2SO4
HCl
-
NaOH
Воздух
2. Температура, 0С
21
15
22. ПРОИЗВОДСТВО ТЕРЕФТАЛЕВОЙ КИСЛОТЫ
ТолуолОкисление
Бензойная
к-та
Σ ксилолов
Бензол
Диспропорционирование К-соли
ЭБ
Ароматические
у/в
Гидрирование
П-кс.
Окисление
Терефталевая
к-та
М-кс.
Окисление
Изофталевая
к-та
Изомеризация
О-кс.
Окисление
Ортофталевая
к-та
Разделение
Нафталин
Окисление
Смесь
фталевых к-т
(К-солей)
22
23.
Мощности по производству ТФК (2005 г.): в мире - 34 млн.т/год
в РФ - 230 тыс. т/год
Мировое производство и потребление ТФК – 29,7 млн.т/год
( До 2005 г. в РФ не производилась ТФК,
а производство ПЭТФ осуществлялось только на
импортном сырье )
1.
O2
CH3
COOCH3
COOH
CH3
120-2000C
1-2 МПа
нафтенат Со, Mn
HNO3
COOH
O2
CH3 OH
Выход
80%
160-1800C
CH3
O2
Выход
80-90%
CH3
1-2 МПа
ацетат Со, Mn
стеарат Со, Mn
COOH
CH3OH
260-2800C
COOH
Выход
90%
COOCH3
COOH
COOCH3
COOH
COOCH3
Выход
40-60%
Трудности очистки ТФК от нитросоединений и
других побочных продуктов!
23
24.
2.COOCH3
CH3
+
CH3
CH3
Расход на 1 т ДМТФ:
п-ксилол - 0,63 т
метанол - 0,38 т
O2
нафтенат Со,
0C
160-180
стеарат Со
0,4-0,6 МПа
COOH
COOCH3
+
CH3
COOH
CH3OH
250-2800C
2 МПа
COOCH3
COOCH3
+
CH3
COOCH3
24
25.
Одностадийный метод производства терефталевойкислоты
CH3
+
[
O2
CH3
CH3
Температура: 125 – 2750С
Давление: 3 – 4 МПа
Растворитель:
COOH
уксусная к-та : п-ксилол (1 : 1)
NaBr + CH3 COOH
H Br
+
CH3COONa
+
H Br
Катализатор: ацетат Со + NaBr
Расход п-ксилола: 0,66 т/т ТФК
HOO *
O2
+
Br *
Выход: 96%
*
CH2
CH3
+
Br *
COOH
COOH
*
CH2
COOH
+
COOH
O2
]
COOH
25
26.
Полиэтилентерефталат (ПЭТФ) (лавсан, дакрон)HO CH2 CH2OH
ТФК
+
HOOC
COOH
ПЭТФ
H2O
OCH2 CH2
OC
C
O
O
n
Полиэфирное волокно,
пленки, радиодетали,
химическое оборудование,
пищевая упаковка
26
27.
2728.
Лекция 328
29.
ПРОИЗВОДСТВО СИНТЕТИЧЕСКИХ ЖИРНЫХКИСЛОТ
1. Гидролиз природных жиров
CH2
OOCR'
CH
OOCR"
CH2
OOCR'''
CH2 OH
H 2О
CH OH
+ R' COOH + R COOH + R'''COOH
CH2 OH
2. Окисление твердых парафинов С20 – С40
RH
+
R' C OOH
H
O2
3. Карбонилирование спиртов
R CH2 OH
+ CO
Rh-кат
R CH2 C OOH
4.Окисление альдегидов
RCH
CH2
+
O
CO+ H2
Co2(CO)8
R CH2 CH2C
O2
H Co2(CO)8
R CH2 CH2 C OOH
30-500C
5.Гидрокарбоксилирование высших олефинов
RCH
CH2
+ C O + H2O
Co2(CO)8
120-2500C
20-30МПа
R CH2 CH2 C OOH
29
30.
CH3CH2(CH2)nCH2CH3Окисление
CH3OH
+
+ O2
OH C (CH2) nCH2 CH3
+ O2
- 0,5 О2
OOH
+ O2
+
+ O2
CH3C (CH2) nCH2 CH3
O
+ O2
C O2
OH
- Н2О
HOOC C (CH2) nCH2 CH3
H COOH
CH3 CH (CH2) CH2 CH3
CH3 CH (CH2) nCH2 CH3
+ O2
H2O
CH3C CH (CH2) n-1 CH2 CH3
CH3C (CH2)
O OOH
CH3 COOH
+
- 0,5 О2
- Н2О
CH3 C (CH2) n-1 CH CH2CH3
+ O2
O
CH3CH2 (CH2) n-1 COOH
+
OOH
O
CH3CH2 (CH2) n-1 C HO
CH3 COOH
CH CH2CH3
n-1
CH3 C (CH2) n-1C CH2CH3
OH
O
O
+ O2
+ O2
CH3 CH2 CH (CH2) n-2COOH
CH3 C (CH2)
COOH
n-2
+
CH3CH2 COOH
O
OH
+ O2
H2O
CH3 CH2 CH (CH2) n-2 C O
O
HOOC (CH2) n-3COOH
+
CH3 COOH
30
31.
Состав оксидата:1) катализаторный шлам
2) нейтральные продукты
• н-парафины С20 – С40
• спирты С1 – С25
3) кислые продукты С1 – С25
• монокарбоновые к-ты
• сложные эфиры
• кетоны
• кетокислоты
• оксикислоты
• лактоны
• дикарбоновые к-ты
Расходные показатели
(на 1 т к-т С10 – С20 )
Н-парафины – 1,2 ÷ 1,3 т
Сода - 0,42 т
Щелочь – 0,315 т
Серная к-та – 0,87 т
Отходы (сульфат натрия) – 1,2 т
31
32.
ОмылениеR COOH
+
R COOR '
+
Na2CO3
R COOH
+
NaHCO3
R COOR '
+
H2O
+
+
R COONa
NaOH
+
H2O
+
R COONa
R COONa
NaOH
NaOH
R CH2 C CH2
NaHCO3
+
R COONa
Na2CO3
2 NaHCO3
R COOH
+
R COONa
Na2CO3
R CH2
+
+
H2O
NaHCO3
CO2
90-1100С, 25%-ный
р-р Na2CO3
CO2
+
+
R'OH
H2O
+
90-1100C, 25%-ный р-р
R' OH NaOH, 1,5 – 2,5 ч
+
CH3 CH3
O
R CH2CH CH2C
O
O
R CH2 C CH2 COOH
NaOH
R CH2CH CH2 COONa
OH
NaOH
R
COONa
+
CH3 COONa
O
R CH2CH CH2 COONa
CH CH2 COONa
R CH
+
H2O
340-3800С, 2-2,5 МПа
OH
2 R CH2 COONa
R CH2 C CH2 R
O
+
Na2CO3
32
33.
KMnO4С20 – С40
Воздух
К=70%
Отделение
катализаторного
шлама
Окисление
120-
1100С,
Na2CO3
Н2О
Na2SO4
24 ч.
Кат.
шлам
Отделение
низкомолекулярных к-т
CO2
Омыление
К-ты С1-С4
0-е неомыляемые
NaOH
1-е неомыляемые
2-е неомыляемые
Автоклав
230-2500С,
2 – 2,5 МПа
Доомыление
Отстаивание
Термообработка
Отстаивание
340-3800С 130-2000С
RCOONa
H2O
Приготовление
мыльного
клея
CO2,
к-ты С1 – С4
H2SO4
Н2О
2 RCOONa + CO2
H2SO4
Разложение
мыльного
клея
R COOH + Na2 SO4
+
[R COOH + R COONa] + NaHCO3
"кислое мыло"
Ректификация
С5 – С6
С7 – С9
С10 – С20
С21 – С25 и >
33 24
Поточная схема производства СЖК окислением твердых парафинов С20 – С40
34.
ПРОИЗВОДСТВО УКСУСНОЙ КИСЛОТЫМировое производство уксусной кислоты: 2005 г. – более 9 млн. т/год
2010 г. (прогноз) – 11,2 млн. т/год
Производство уксусной кислоты в России (2005 г.) – 175 тыс.т/год
Структура мирового
потребления уксусной кислоты
(2000 г.)
Винилацетат
–
40%
Уксусный ангидрид
–
13%
Ацетали
–
14%
Терефталевая кислота –
19%
Прочее
14%
–
34
35.
1. Окисление н-бутанаУсловия процесса:
температура - 140-1700С;
Достоинства: одностадийность,
непрерывность, доступность и дешевизна сырья.
Недостатки: высокая коррозионость среды,
образование побочных продуктов
давление - 5,0 МПа;
массовое соотношение св. н-бутан : возвр. н-бутан : воздух = 1 : (1,5 ÷ 2,0) : (10 ÷ 12);
содержание продуктов окисления в возвратном бутане – 10% масс.от Σн-бутанов.
Тепловой эффект реакции – 20900 кДж/кг
+ O2
CH3 CH2 CH2 CH3
CH3 CH CH2CH3
OOH
+ O2
CH3 C
CH CH3
O
МЭК
–
– 43%
10%
Этилацетат и др. - 9%
Н-бутан – 28%
CH3 C CH2 CH3
O
CH3COOH
+
CH3 CHO
OOH
Состав оксидата:
Уксусная к-та
H2O
На 1 т н-бутана образуется до 1,6 т
полезных кислородсодержащих
продуктов (кислот, спиртов, эфиров,
кетонов), в т.ч. 872 кг уксусной
кислоты и 190 кг метилэтилкетона
35
36.
2. Окисление н-бутеновCH2
CHCH2CH3
CH3CH
CHCH3
+ CH3COOH
1100С;
1,5-2 МПа
10% КУ-2
CH3 CH2 CHCH3
O C OCH3
+ 2 O2
2000С
;6
МПа
3 CH3COOH
Вна проп. = 44%
Высокоселективный процесс фирмы Bayer
Селективность окисления достигается путем ослабления центральной связи бутеновой
цепочки при превращении смеси н-бутенов (~ 80% н-бутенов и ~ 20% н-бутана) во
втор-бутилацетат.
При окислительном крекинге втор-бутилацетата образуется три молекулы уксусной
кислоты, одна из которых возвращается в цикл для образования ацетата.
При непосредственном окислении фракции н-бутенов получается сложная смесь
продуктов, содержащая много смолистых веществ.
Превращение н-бутенов во втор-бутилацетат создает условия для преимущественного
образования уксусной кислоты.
Бутен-1 реагирует с уксусной кислотой быстрее, чем бутен-2, поэтому последний
составляет основную массу н-бутенов, возвращаемых в цикл.
Для ускорения процесса присоединения к олефину уксусной кислоты ее берут в
полуторном избытке.
Товарная уксусная кислота содержит 99,7% основного продукта
На 1 т уксусной кислоты расходуется 1,260 т бутеновой фракции
36
37.
3. Окисление легких фракций прямогонного бензина С5 – С8Условия процесса:
•температура – 160 – 1950С;
•давление – 5,0 МПа;
Состав оксидата:
Уксусная к-та
– 80 - 81%
Муравьиная к-та – 12 – 15%
Пропионовая к-та – 5 – 8%
Янтарная к-та – 3 – 10%
Кислородсодержащие
примеси (спирты, кетоны,
эфиры)
Содержание насыщенных парафиновых
углеводородов С5 – С8 нормального
строения в сырье 78,5 – 85,0%
Разделение оксидата
Нейтральные кислородсодержащие
соединения образуют с водой азеотропные
смеси, кипящие ниже 1000С; после отгонки они
возвращаются на окисление.
Азеотропной перегонкой с изопропиловым спиртом и последующей ректификацией
получают смесь безводных кислот С1 – С3,
направляемую на разделение.
Муравьиная к-та (98%) выделяется
азеотропной дистилляцией с толуолом.
Уксусная (99,5%) и пропионовая (99,5%)
37
кислоты выделяются ректификацией в вакууме.
38.
4. Жидкофазное окисление ацетальдегида+ O2
CH3 CHO
CH3COOH
Побочные продукты:
формальдегид, муравьиная к-та,
метилацетат, ацетон, диацетил,
этилидендиацетат, СО2, Н2О
Условия процесса:
•температура – 50 – 700С;
•давление – 0,7 МПа
На производство 1 т 98,5-99,5%-ной уксусной
к-ты расходуется 0,81 т ацетальдегида и 215 м3
технического (98%-ного) кислорода
5. Жидкофазное карбонилирование метанола
CH3 OH
+
CO
Условия процесса:
•температура – 2500 С;
•давление – 6-7 МПа;
•катализатор – карбонил и
иодид кобальта
CH3COOH
Побочные продукты:
пропионовая к-та и более
высококипящие продукты,
СО, СО2, Н2О
На производство 1 т уксусной
кислоты расходуется 0,6 т метанола
и 620 м3 оксида углерода
38
39.
Производство адипиновой кислотыOH
+ O2
+ H2
OH
OOH
O
+ O2
+ H2
O
+ O2
OOH
OHC (CH2)4COOH
+ O2
HOOC (CH2)4 COOH
Одностадийный процесс
• температура 130 – 1600С;
• давление 1 -2 МПа;
• растворитель – уксусная к-та;
•катализатор – ацетат кобальта
В = 50%
(практически не применяется)
39
40.
Двухстадийный процесс1-я стадия:
• температура 135 – 1400С;
К = 80%
• давление 1,8 – 2.МПа;
• катализатор - стеарат или нафтенат Со.
2-я стадия:
• температура 80 – 850С;
В = 82 -86%
• окислитель – О2;
• катализатор – ацетат Со и Сu;
или
• температура 80 – 1100С;
B = 90-95%
• окислитель – HNO3 (60%- ная); (Коррозия!!!)
• катализатор – (NH4)3VO4 + CuO
40
41.
ONOH
+ NH2OH
O
H2SO4 + SO3
Оксим
циклогексанона
[ NH(CH2)5 C ]
NH
ε- капролактам
Капролактам
n
O
капрон
HOOC (CH2)4 COOH
+
2 NH3
n HOOC (CH2)4 COOH
+
n H2N (CH2)6 NH2
N
2 H2O
C (CH2)4 C
[
2 n H2O
Гексаметилендиамин + адипиновая к-та
N
+ H2
C (CH2)4 C
O
H2N (CH2)6 NH2
NH(CH2)6 NH
]
n
O
найлон – 6,6
41
42.
Лекция 442
43.
ГАЗОФАЗНОЕ ОКИСЛЕНИЕ АРОМАТИЧЕСКИХУГЛЕВОДОРОДОВ
Мировое производство малеинового ангидрида ~ 1 млн т/год
Мировое производство фталевого ангидрида ~ 4 млн т/год
C
C
O
C
O
O
O
C
C
C
O
t пл=
52,850
C
t кип= 2020 C
O
t пл = 130,80 C
t = 284,50 C
кип
Структура потребления малеинового
ангидрида
Ненасыщенные полиэфирные волокна > 50%
Алкидные смолы
Сополимеры со стиролом, метакриловыми
эфирами
Бутандиол
Пластификаторы
Ядохимикаты
Смазочные масла
Присадки
t пл = 80,30C
t кип= 2170 C
Структура потребления фталевого
ангидрида
Ненасыщенные полиэфиры - 20%
Алкидные и глифталевые смолы – 15%
Пластификаторы – 60%
Лакокрасочные материалы
Высокопрочные пластики
43
44.
Me+
Me
+ O2
O
O*
+
Me
+
Me
O
O*
+
Me
+
O
O
OO *
+
Me
O
+ O2
O
*
O
O
O
O*
O
CH
+ 2 O2
CO2 ;
H2O
C
O
CH
C
O
Механизм включает в себя сорбцию кислорода на поверхности контакта по иону
переходного металла катализатора и сорбцию углеводорода на окисленной поверхности
катализатора.
Металл поставляет электроны, окисляясь при этом до высшего валентного состояния и
переводит сорбированный кислород в ион-радикал.
44
45.
C+
C
O
+
O
O2
C
CO2 + H2O
Выход = 72-78%
C
O
C
CH3 CH
CH CH3
CH3 CH2 CH2 CH3
+
C
+
O
O2
CO2
+ H2O
Выход = 50-54%
C
C
O
O
C
+
O
O
O2
C
+
CO2
+
H2O
Выход = 89-94%
O
CH3
CH3
C
+
O
O
O2
Выход = 75-82%
+
CO2 + H2O
C
O
45
46.
УСЛОВИЯ ПРОЦЕССАКатализатор – V2O5 / Al2O3 (Mo, Ti, Co, Ni, P, Na, W, S)
Температура = 350 – 450 – 5000С
Масс. соотношение у/в : воздух = (1 : 30÷50 )
К = 100%
Отвод тепла – нитрит-нитратная смесь ( NaNO2 – NaNO3 – KNO3 ;
tпл = 1400С, tкип = 6500С)
Побочные реакции:
а) полное окисление ( СО2 + Н2О )
б) низкомолекулярные кислоты ( НСООН, СН3СООН )
в) при получении фталевого ангидрида – 5-8% малеинового
ангидрида
(выделение экономически нецелесообразно!)
46
47.
Отработанныйвоздух
2
Вода
5
МА
2
1
6
3
Малеиновая
к-та
Воздух
2
В.п.
7
МА
сырой
Бензол
4
2
Смолы
Принципиальная технологическая схема производства малеинового ангидрида газофазным
окислением бензола
1- реактор; 2 – теплообменники; 3 – сепаратор; 4 – емкость; 5 – скруббер; 6 – испаритель-дегидрататор;
47
7 – ректификационная колонна
48.
Вода2
5
ФА
2
1
3
6
3
О-фталевая
к-та
Вода
(В.п.)
Воздух
В.п.
7
Вода
(В.п.)
2
4
О-ксилол
2
Принципиальная технологическая схема производства фталевого ангидрида газофазным
окислением о-ксилола
1- реактор; 2 – теплообменники; 3 –конденсатор; 4 – емкость; 5 – скруббер; 6 – испаритель-дегидрататор;
7 – ректификационная колонна
48
49.
Лекция 549
50.
Производство оксида этиленаМощности по производству оксида этилена:
в мире ~ 15 млн т/год (степень загрузки - 90 - 92%) (2001 г.)
Потребление:
в России («Капролактам» - Дзержинск, «Нижнекамскнефтеоргсинтез»,
«Салаватнефтеоргсинтез» - 600 тыс.т/год
(производство – 231 тыс.т/год) (2001 г.)
I. Хлоргидринный способ
1)
Cl2
CH2
2)
+
H2O
CH2
CH2
CH2
Cl
OH
+
HOCl
+
HOCl
+
30-400C
1000C
0,5 Ca(OH)2
МЭГ, ДЭГ, ТЭГ;
НПАВ;
МЭА, ДЭА, ТЭА;
гликолевые эфиры,
гидравлические
жидкости.
HCl
CH2
CH2
Cl
OH
CH2
CH2
+
0,5 Ca Cl2
+
H2O
O
Побочная реакция: 200 кг дихлорэтана на 1 т оксида этилена
CH2
CH2
+
Cl2
CH2
CH2
Cl
Cl
Достоинства: возможность использования более дешевой фракции С2, простота
аппаратурного оформления
Недостатки: коррозия, токсичность хлора, большой расход хлора и щелочи, большое
количество сточных вод, содержащих хлорорганику, большое количество шлама (СаСl2)
50
51.
II. Прямое окисление этиленаCH2
CH2
+
CH2
0,5 O2
CH2
+
121,5 КДж/моль
O
CH2
CH2
+
3 O2
2 CO2
+
2 H2O
+
1383 КДж/моль
CH2
CH2
+
0,5 O2
2 CO2
+
2 H2O
+
1257 КДж/моль
O
Катализатор:
Оптимальные условия:
Окислитель - технический кислород
12-15% Ag на α-Al2O3 с промотирующими и
структурирующими добавками (Cl, Se, S, Rb, Cs, K)
Температура – 230 – 2500С
Селективность катализатора без добавок – 45 – 50%
Конверсия этилена - 15 – 25% (20 – 30%)
Селективность катализатора с добавками – 80 – 82%
Концентрация этиленоксида в реакционной
массе (для минимизации реакции полного
окисления) - 1,0 – 1,5%
Хлор отчасти подавляет реакцию полного окисления,
поэтому в поток этилена подается постоянная
микроподпитка в виде дихлорэтана
Срок службы катализатора - 2-5 (9) лет
(через 4-5 лет селективность снижается на 7-8%)
Давление – 0,3 – 3,5 МПа
Суммарный выход этиленоксида – 75 – 80%
(При использовании в качестве окислителя
воздуха суммарный выход этиленоксида не
превышает 65% при двух- или
51
трехступенчатой схеме окисления)
41
52.
Реактор:Трубчатый, Øтр = 32 мм, Lтр = 6,5 – 8 м.
Неподвижный слой катализатора
Отвод тепла – дифенил или кипящая вода под давлением
5,5 МПа
С,%
100
75
Сырье:
Чистота этилена – 98,0 – 99,9%
(ацетилен < 0,001% об.; сернистые соединения < 0,0001% об.;
высшие олефины < 0,1% об.)
50
25
Сырьевая смесь:
200
250
300 T,0C
С,%
100
Этилен – 20 – 30% об.
Кислород – 7 – 8% об.
Диоксид углерода – 4 – 5% об.
Инерты (азот, аргон) – 57 – 69% об.
75
Реакционная смесь:
50
25
25
50
75
100
К,%
Этилен – 13 – 19,5% об.
Кислород – 3,5 – 5% об.
Этиленоксид – 1,0 – 1,5% об.
Диоксид углерода – 10 – 12% об.
Инерты (азот, аргон) – 62 – 72% об.
52
42
53.
Свежийэтилен
Возвратный этилен
Сдувка
СО2
К2СО3 , Н2О
Кислород
2
5
4
3
2
1
2
2
2
КНСО3
Вода
2
6
1 – реактор
2 – теплообменники
3 – абсорбер оксида этилена
4 – абсорбер СО2
5 – десорбер
6 – отпарная колонна
7,9 – ректификационные колонны
8 – дополнительный абсорбер
оксида этилена
Оксид
этилена
Фузельная вода
7
8
9
Фузельная
вода + смолы
Технологическая схема окисления этилена в этиленоксид
техническим кислородом
53
54.
5455.
Установка производства оксида этилена (ПО «Нижнекамскнефтеоргсинтез»)55
56.
Лекция 656
57. Производство оксида пропилена
Потребление: пропиленгликоль – 21% (ненасыщенные полиэфирные смолы,антиобледенители для самолетов, парфюмерная промышленность, лакокрасочные материалы)
полиэфирполиолы – 65 % (полиуретановые каучуки, смолы, стеклопластики и др.)
Мировые мощности по производству оксида пропилена > 7 млн т/год (2006 г)
Степень загрузки ~ 95%
Производство оксида пропилена в России (ОАО «Нижнекамскнефтехим) ~130 тыс.т/год
I. Хлоргидринный способ
1) Cl2
+
H2O
HOCl
+
HCl
CH3CH
CH3CH
CH2
+ HOCl
Cl
30-400C
OH
CH3CH
OH
2) CH3CH
Cl
CH3CH
OH
CH2
В = 87- 90%
CH2
Cl
CH2
OH
CH2
+
Ca(OH)2
1000C
CH3CH
CH2
+
Ca Cl2
+ 2 H2O
O
Cl
В = 95%
57
58.
Побочные реакции:1) CH3CH
CH2
2) CH3CH
CH2
+
+
CH3 CH
Cl2
H2O
O
3) 2 CH3CH
Cl
CH2
OH
H2O
CH2
Cl
Cl
CH3 CH
CH2
OH
OH
CH3CH
CH2
O
CH3CH
В = 6 - 9%
(110÷270 кг/т ПО)
Cl
CH2
Cl
Расход С3Н6 (0,85÷1,0) т/т ПО
Достоинства: возможность использования более дешевой фракции С3, простота аппаратурного
оформления
Недостатки: коррозия, токсичность хлора, большой расход хлора и щелочи, большое количество
сточных вод, содержащих хлоррганику, большое количество шлама (СаСl2) – 40 т/т ПО.
58
59.
II. Электрохимический способ (разновидность хлоргидринного)В одном аппарате проводят электролиз поваренной соли, гипохлорирование пропилена и
омыление образующегося пропиленхлоргидрина раствором NaOH, полученным в катодном
пространстве электролизера
NaCl
CH2
CH
H2O
+ Cl -
CH3 2
H2O
анод
Na +
+
CH2
CH
OH
Cl
Cl
CH3
К = 20 – 25%
-
С = 80 – 98%
Na+
+
-
катод
OH
CH2
CH
CH3
+
H2
+ Na+ + Cl -
O
Достоинства: отсутствие сточных вод, незначительный выход побочных продуктов
Недостатки: необходимость сложной очистки электролита от хлорорганических соединений;
очень разбавленный раствор ПО ( < 1%) и соответственно трудность выделения ПО;
гидратация части ПО в пропиленгликоль в процессе выделения
59
60.
III. Эпоксидирование надуксусной кислотойO
CH3COOH
CH3 CHO
+
CH3 C
H2 O2
+ O2
30-500C
OOH
+
H2O
O
CH3 C
OOH
2 -4 МПа
Р-ль: этилацетат
Кат-р: соли мет. перем. валентности
O
CH3 C
CH2
CH
К = 97-98%
В = 90-92%
CH3
OOH
Р-ль: этилацетат
50-800C
1-1,3 МПа
без катализатора
CH2
CH
CH3
+
CH3 COOH
O
Расход С3Н6 0,96 т/т ПО
Коррозия!!!
60
61.
IV. Сопряженное окисление(катализатор – растворимые соли
металлов переменной валентности или без катализатора)
CH2
CH
CH3
+
CH3 CHO
+ O2
70-850C
5-6 МПа
CH2
CH
CH3
+
CH3 COOH
O
Из 1 т ацетальдегида и 360 кг пропилена получается 450 кг ПО и 1060 кг уксусной кислоты
CH2
CH
CH3
+
CH3 C CH2 CH3
O
+ O2
150-1600C
5 МПа
CH2
CH
CH3
+
2 CH3 COOH
O
Из 1 т МЭК и 880 кг пропилена получается 1160 кг ПО и 1210 кг уксусной кислоты
Недостатки: сложность выделения ПО и коррозионность среды
V. Окисление пропилена молекулярным кислородом – не имеет в
настоящее время промышленного значения вследствие низкой (< 50%) селективности
как в жидкой, так и в газовой фазе.
61
62.
VI.Эпоксидирование пропилена гидропероксидами (этилбензола,изопропилбензола, трет-бутила)(Халкон-процесс)
1)
2)
CH2 CH3
O2
OOH
OH
O
CH CH3
CH CH3
C CH3
;
OOH
OH
CH CH3
C3H6
CH CH3
CH2
CH
CH3
+
O
3)
OH
CH
CH CH3
CH2
На 1 т пропиленоксида
образуется 2,6 т стирола
-H O
2
4)
На 1 т пропиленоксида
расходуется 0,8 т пропилена
и 3,6 т этилбензола
O
OH
C CH3
CH CH3
+ H2
5)
CH
CH2
+ H2
CH2 CH3
62
63.
1.Условия окисления этилбензола:Окисление в жидкой фазе; 1400С; 0,25 МПа; 4-6 ч ; реакционная
масса содержит 10-13% ГП и 2-3% ПР (метилфенилкарбинол- МФК и
ацетофенон - АФ).
ГП концентрируется вакуумной отгонкой этилбензола до 90-92%.
2. Условия эпоксидирования пропилена гидропероксидом:
Эпоксидирование в жидкой фазе; 80 – 1100С; 2 – 7 МПа; 0,5 – 2 ч; КГП ~
100%;
Соотношение С3Н6 : ГП = (2 ÷ 6) : 1; катализатор – растворимые
в реакционной массе нафтенаты Мо (или других металлов переменной
валентности)
Последовательность стадий процесса:
- Активация (окисление) Мо(V) в Мо(VI);
- Комплексообразование катализатора с ГП;
- Эпоксидирование;
- Выделение активной формы катализатора;
- Комплексообразование с продуктами реакции;
- Разложение ГП.
63
64.
3. Условия дегидратации МФК:Дегидратация в паровой фазе; 200 – 2500С; Кат-р – TiO2;
Дегидратация в парожидкостной фазе – в реакционноректификационном аппарате, нижняя часть которого заполнена
катионитом и работает как дегидрататор, а верхняя часть работает как
колонна азеотропной перегонки – отгоняется гетероазеотроп
стирол/вода при температуре < 1000С, что исключает термическую
полимеризацию стирола.
4. Условия селективного гидрирования АФ
1500С; 1,6 – 2,5 МПа; Кат-р - (CU – Fe – Cr) или (Ba – Cr- Cu – Zn)
64
65.
Возвратный ЭБКатализатор
ЭБ
ГП
10-12%
Окисление
Разделение
Кислород
ГП
90-92%
ПР
Эпоксидирование
С3Н6
Возвр.
С3Н6
Н2
Катализаторный р-р
Разделение
ПО
Гидрирование
МФК; АФ
МФК
Н2
Селективное
гидрирование
АФ
Дегидратация
Разделение
Стирол
Поточная схема получения пропиленоксида (Халкон-процесс)65
66.
NaOH3
Возвр.
ЭБ
ПО
2
2
3
С3Н6
5
6
1
4
7
8
9
10
Сточные
воды
ЭБ
С3Н6
О2
Катализатор
ГП 90%
1 – Колонна окисления
2 – Холодильник
Стирол
3 – Сепаратор
4 – Вакуумная ректификационная колонна
5 – Колонна нейтрализации
6 – Реактор эпоксидирования
7 – 10 – Ректификационные колонны
11 – Реакционно-ректификационный
реактор -дегидрататор
12 – Реактор селективного гидрирования
13 – Флорентийский сосуд
МФК,
АФ
11
11
12
13
Н2О
Н2
АФ
Принципиальная технологическая схема получения оксида пропилена
эпоксидированием пропилена гидропероксидами
66
67.
Vll. Эпоксидирование гидроперекисью водорода (НРРО – процесс)CH2
CH
CH3
+
H2O2
CH3OH
CH2
CH
CH3
+
H2O
O
Пропилен
Н2О2
Метанол
Реакторный блок
Разделение реакционной
смеси
Очистка
ПО
ПО
Разделение
метанола и
воды
Вода
Новый безопасный
одностадийный способ
получения Н2О2 из
водорода и кислорода в
растворе метанола на
нанокатализаторе!
(Концерн Evonik и ам.
компания Headwaters
Inc.)
67
68.
Лекция 768
69.
Производство ацетальдегидаПотребление: уксусная кислота, уксусный ангидрид, этилацетат, бутанол,
2-этилгексанол
I. Из ацетилена по реакции Кучерова (60 лет!)
а) катализатор 10-20%-ный р-р H2SO4, содержащий 0,5
т-ра - 75-1000С;
CH
CH
+
С2Н2 : Н2О = 2,5 : 1; К = 30 – 50%;
H2O
CH3 CH O
+
CH3 CH
CHCHO
С = 92 – 93%
150 КДж/моль
Побочные реакции:
2 CH3 CH O
– 0,6% Hg в виде HgSO4
+
H2O
Для уменьшения
количества
побочных
продуктов берется
избыток ацетилена!
смолы
Кротоновый альдегид
Ацетальдегид ( а также H2S, PH3, NH3, AsH3) является сильным восстановителем и
переводит Hg+2 в Hg0 – в результате образуется ртутный шлам. Т.к. металлическая
ртуть имеет высокое давление насыщенных паров, часть ее уносится с реакционными
газами. Для предотвращения восстановления ртути в катализаторный р-р добавляют
соли Fe+3 , что и поддерживает максимальную степень окисления Hg+2 . В присутствии
Fe+3 катализатор может работать достаточно долго, но т.к. ионы Fe+2 накапливаются,
часть его необходимо непрерывно отводить для регенерации (окисление HNO3 !!!).
Потери ртути составляют 1,0 – 1,5 кг на 1 т ацетальдегида
69
55
70.
Ацетальдегид,C2H2 на
улавливание
ацетальдегида
в скрубберах
Насадка для
улавливания
кат. р-ра
Кат. р-р на
регенерацию
Возвр.С2Н2
Hg
В.п.
C2H2
Кат. р-р после
регенерации
Недостатки: токсичность, агрессивная среда в реакторе, потери
ртути, загрязнение окружающей среды, образование смол
70
71.
б) катализатор CdHPO4 * Ca3 (PO4)2 , активен при 350 – 4000С в течение ~ 3 мес.;регенерируется воздухом и водяным паром при 400 – 4500С.
Н2О : С2Н2 = (7 ÷ 10) :
С2Н2
К = 45 - 50%
Выход:
В.п.
- Ацетальдегида - 89 - 90%
- Кротонового альдегида – 6 – 7%
- Уксусной кислоты – 0,5 – 1,0%
- Ацетона – 0,3%
Недостатки:
Н2О
-Малый срок службы катализатора без регенерации
-Высокая температура реакции
Продукты
реакции
-Низкая механическая прочность катализатора
(разрушение, спекание)
-Токсичность кадмия
Не получил распространения!
71
72.
II. Двухстадийный способ производства ацетальдегида изацетилена
1) Получение винилбутилового эфира
CH
CH
+
CH3 CH2 CH2CH2 OH
КОН
CH2
400-4200C
К = 90%
CH
O
CH2CH2 CH2CH3
Выделение ВБЭ экстрактивной
ректификацией с ДЭГ. Необходимая
чистота ВБЭ - 99,5%
2) Гидролиз винилбутилового эфира
CH2
CH
O
CH2CH2 CH2CH3 + H2O
КУ-2ФПП
80-950C
CH3 CH O
К = 100%
III. Окислительное дегидрирование этанола
CH3 CH2OH
+
0,5 O2
290-3000C
CH3CHO
Катализатор –
медный или меднощелочной
+
+
CH3 CH2 CH2CH2 OH
Н-бутанол
циркулирует в
системе,
восполняются
только его
потери.
H2O
В = 33-50%
72
73.
IV. Окисление этиленаРеакция окисления этилена в присутствии хлористого палладия известна с
1894 г. Промышленный процесс (Я.К.Сыркин, И.И.Моисеев, М.Н.Варгафтик)
реализован в 1959 г.
1.
CH2
2.
Pd
3.
4.
Pd
CH2
+
2 HCl
+
Cu2Cl2
+
PdCl2
+
0,5 O2
2 CuCl2
+
+
2 HCl
H2O
v2
v3
+ 0,5 O2
v1
CH3C HO + Pd
PdCl2
PdCl2
v4
+
+
+ HCl
H2O
v2
Реакция
экзотермическая,
суммарный
тепловой эффект
221,5 кДж/моль
Cu2Cl2
2 CuCl2
v1 >>
+ H2O
v1 =~ v3 =~ v4
73
74.
Побочные реакции:O2
CH3C HO
CH3COOH
CH3CH
2 CH3CH O
CH3C HO
+
CH2
CH2
CH2
CH2
HCl
+
+
+
H COOH
CH CHO
+
CH3 Cl
O2
+ CO2 +
смолы
H2O
+
H2O
H2O
+
CO2
CH3 CH2 Cl
HCl
HCl
O2
+
O2
ClCH2 CH O
+
H2O
74
75.
На скорость реакции, селективность процесса и выход ацетальдегидасущественно влияет состав катализаторного раствора ( сод. PdCl2, CuCl2
), рН среды, давление, температура, соотношение этилена и
окисляющего агента:
- Cu : Pd = (25 : 1) ÷ (50 : 1)
- рН = (0,8 ÷ 3) – кислая среда; или (6,0 ÷ 7,5) – нейтральная среда.
При повышении рН из катализаторного раствора выпадает Cu2Cl2, что
приводит к снижению выхода ацетальдегида и забивке отверстий
газораспределительного устройства.
Растворимость Cu (I) можно повысить, добавляя в незначительных
количествах муравьиную, уксусную или трихлоруксусную кислоты.
Превышение их оптимального содержания приводит к образованию
малоактивных солей меди и карбоновых к-т, а также увеличивает
растворимость в них (особенно в уксусной к-те) продуктов реакции.
75
76.
-растворимость солей в воде ограничена, поэтому образуются оченьразбавленные растворы катализатора, что приводит к его низкой
удельной производительности.
- Выгоднее работать с катализатором, находящимся в воде или
разбавленной уксусной
к-те в виде суспензии ( т.н. шламовый
катализатор). Применение шламового катализатора позволяет сочетать
высокую концентрацию катализатора с хорошим отводом тепла; при этом
образуется стабильная пена, способствующая хорошему
диспергированию газа.
- в качестве сырья можно использовать как концентрированный
этилен, так и этан-этиленовую фракцию; строго ограничивается
содержание ацетилена (< 0,005%), высших олефинов (<0,03%) и серы
(< 0,001%) во избежание дезактивации катализатора и образования
побочных продуктов.
76
77.
- при 200С скорость реакции очень низкая, обычный интервал температур90 – 1300 С.
-давление может изменяться в интервале 0,3 – 1,3 МПа для поддержания
реакционной массы в жидкой фазе и улучшения растворимости газов;
кроме того для повышения растворимости олефина и кислорода в водных
растворах применяют специальные устройства для турбулизации
жидкости, что обеспечивает максимальную поверхность контакта фаз.
-для снижения доли побочных реакций (конденсация, хлорирование)
предусматривается непрерывный отвод ацетальдегида из зоны реакции.
-при использовании гомогенного катализатора газовые потоки (олефин,
кислород, воздух) барботируют через слой жидкости.
- гетерогенный катализатор может использоваться в псевдоожиженном и
неподвижном виде: трубчатый р-р ( отвод и утилизация тепла за счет
циркуляции воды в межтрубном пространстве) или реактор колонного
типа с катализатором, размещенным на полках (отвод тепла за счет
испарения водного конденсата, подаваемого между слоями катализатора)
77
78.
Возвратный этиленАзеотроп
вода/кротоновый
альдегид
Отраб.
воздух
Вода
6
Вода
7
8
10
9
2
5
1
В.п.
В.п.
Воздух
3
4
Кат. р-р
11
С2Н4
АА
Кат. р-р на
окисление
Фузельная
вода
Принципиальная технологическая схема двухстадийного окисления
этилена в ацетальдегид на хлористом палладии
1 – реактор; 2 – регенератор; 3,4 – сепараторы; 5 – холодильник; 6,9 – скрубберы;
7,10 – отпарные колонны; 8 – ректификационная колонна; 11 - емкость
78
79.
а) Двухстадийный процесс – реакции (1), (3) идут в одном аппарате,реакции (2), (4) – в другом.
Катализатор – гомогенный: водный р-р 0,3-0,5% PdCl2, 12-33% CuCl2 * H2O,
CH3COOH.
Жидкофазный процесс.
К ~ 100%.
100-1200C, 0,8 – 1,3 МПа, окислитель – кислород воздуха (т.к. подача
этилена и воздуха разделены)
Достоинства: можно брать менее концентрированный этилен;
окислитель – кислород воздуха; малый рецикл этилена; хороший отвод
тепла за счет испарения воды и продуктов реакции; более безопасный
процесс
Недостатки: коррозия (р-р футерован титаном); большие капитальные
затраты.
79
80.
Лекция 880
81.
Возвратный этилен и кислородАА
Азеотроп
вода/кротоновый
альдегид
Вода
2
3
4
Вода
6
7
8
Кат. на рег.
1
В.п.
О2
Кат. с рег.
С2Н4
В.п.
В.п.
5
Катализаторный
р-р
Принципиальная технологическая схема одностадийного окисления
этилена в ацетальдегид на хлористом палладии
1 – реактор; 2 - холодильник; 3 – сепаратор; 4 – скруббер; 5 –емкость;
6,7,8 – отпарные колонны
81
82.
б) Одностадийный процесс – реакции (1), (3) и (4) идут в одномаппарате.
– гомогенный катализатор : водный р-р солей палладия и меди.
Жидкофазный процесс.
- гетерогенный катализатор : смесь PdCl2 (2%) и CuCl2 (10%) на
носителе (оксид алюминия, силикагель, пемза, активированный уголь).
Газофазный процесс.
90-1000C; 1,0 МПа; окислитель – технический кислород (для
безопасности работают с недостатком кислорода ); этилен : кислород =
(2,5 : 1) ÷ (4 : 1)
К = 30 – 50%
Достоинства: меньшие капитальные затраты; в случае гетерогенного
катализатора – отсутствие коррозии
Недостатки: высокая концентрация этилена, использование технического
кислорода, повышенные требования безопасности;
в случае гетерогенного катализатора – сложности отвода тепла и точного
дозирования этилена и кислорода
82
83.
Оба процесса конкурентно способны!Выход ацетальдегида в зависимости от условий 84 -98%
Побочные продукты; муравьиная к-та, уксусная к-та, хлористый метил,
хлористый этил, хлоруксусный альдегид, кротоновый альдегид, диоксид
углерода и др.
Разработан и предложен новый катализаторный раствор, в котором по
сравнению со стандартными катализаторными растворами уменьшено
содержание палладия и меди в 2-3 раза, а ионов хлора в 4 раза. Это
обусловливает их значительно более низкую стоимость. Кроме того, при
этом процессы хлорирования сильно замедляются и повышается
селективность процесса.
Конверсия этилена не ниже 98 %, кислорода 99%.
Поскольку конверсия реагентов достаточно высока, рециркуляция не
предусмотрена.
Т.к. конверсия этилена и кислорода высокие, содержание взрывоопасных
газов в сепараторе минимально, и не возникают проблемы, связанные с
вопросами безопасного ведения процесса.
83
84. Технико-экономические показатели производства ацетальдегида
Технико-экономическиепоказатели
Парофазная
гидратация
ацетилена
(Cd- кат.)
Окислительное
дегидрирование
этанола
Прямое
этилена
окисление
1стадийное
2стадийное
Капитальные затраты на
основное производство
ацетальдегида
100
65
120
150
То же с учетом сырья
100
115
85
90
Себестоимость (цеховая)
100
90
55
60
84
85.
Сравнение показателей производств ацетальдегида прямымокислением этилена на гомогенных катализаторах
Показатели процесса
Двухстадийный
процесс
Одностадийный
новый
Производительность установки
100
267
Удельные кап. вложения
100
50
Себестоимость 1 т ацетальдегида
100
82
Приведенные затраты на 1 т
100
78
Производительность труда
100
178
этилен
100
100
реагенты, катализаторы
100
71
водяной пар
100
34
электроэнергия
100
26
вода
100
64
100
12
Расход на 1 т ацетальдегида
Энергетические средства
Сточные воды на 1т ацетальдегида
85
86.
Из пропилена - ацетонCH3 CH
CH2
+
PdCl2
+
H2O
O2
50-1000С
9,8 МПа
CH3C CH3
O
+
Pd
+
HCl
В = 99%
Из бутенов - метилэтилкетон
CH3CH2CH
CH2
+
PdCl2
+
H2O
O2
1000С
4,5 МПа
CH3C CH2 CH3
O
+
Pd
+
HCl
В = 80%
86
87.
Лекция 987
88.
Производство винилацетатаМировое производство винилацетата (ВА) (2005 г.) ~ 5 млн.т/год
Единичные мощности установок 30 – 300 тыс.т/год
Направления использования ВА:
- Поливинилацетатная эмульсия – 41%
( CH2 CH )
n
O C CH3
O
( CH2
- Поливиниловый спирт,
CH )
O
поливинилацетали – 42%
( CH2 CH
OH
CH2 CH )
OH
n
n
C CH3
ROH
NaOH
CH )
( CH2
n
OH
O
+
R CHO
( CH2 CH
O
CH2 CH )
CH
n
O
R
Использование в производстве лакокрасочных материалов (22%), клеев
(23%), химических волокон, текстиля, искусственной кожи (18%),
пластиков (18%), бумаги, картона (10%), эмульгаторов, загустителей,
уплотнителей ( в т.ч. самовосстанавливающихся), безосколочных стекол,
сополимеров с различными ненасыщенными соединениями.
88
89.
Методы получения винилацетата1) Из ацетилена и уксусной кислоты (жидкофазный метод)
(Впервые получен в СССР в 1938 г.)
CH CH
+
CH3COOH
600C
H2SO4 + HgSO4
CH2
CH OCOCH3
В = 3 - 5% !!!
2) Из ацетальдегида и уксусного ангидрида (СССР, 1953 г.)
OCOCH3
CH3C HO
+
(CH3CO)2O
CH3CH
CH3COOH
+
CH2
CH
OCOCH3
OCOCH3
Не получил распространения вследствие
своей многостадийности и коррозионности!
89
90.
3) Из ацетилена и уксусной кислоты (газофазный процесс)CH
CH
+
CH3COOH
Катализатор
2300C
CH3 COO CH
CH2
0,13-0,14 МПа
+
98кДж/моль
Zn(CH3COO)2 ,Cd(CH3COO)2 или их смесь на носителе
( оксид алюминия
, , силикагель, пемза, акт.уголь )
Мольное соотношение ацетилен : уксусная к-та = (3,5 ÷ 5) : 1
Побочные реакции
CH3 C CH3
+
H2O
+
CO2
+
CH3 CHO
H2O
CH
+
CH3 COOH
+
2 CH
Спо ац. = 92 – 95%
Присутствие воды в исходных
реагентах приводит к
увеличению выхода побочных
продуктов и гидролизу ВА!
O
CH
Спо у.к. = 95 – 99%
(при избытке кислоты и недостатке ацетилена)
2 CH3 COOH
CH
Ку.к. = 60 – 70%
CH3 CH
H2O
CH3 COO CH
Необходима тщательная осушка
исходных реагентов!
CHCHO
CH3 CH (OOCCH3)2
CH2
Этилидендиацетат
CH3 COO CH
CH2
CH3COO CH
+
CH2
H2O
CH3 COOH
( CH-CH2 )
CH3COO
+
CH3 CHO
n
90
91.
Свежеприготовленный катализатор содержит до 30% ацетата цинка.Активен начиная с температуры 1600С. При снижении активности
катализатора повышают температуру до 220 – 2300С, затем направляют на
регенерацию.
Дезактивация катализатора происходит вследствие уноса ацетата цинка и
его разложения по реакции:
Zn(CH3COO)2
ZnO
+
CO2
+
CH3 C CH3
O
Частичная регенерация катализатора имеет место и в ходе основной реакции
получения винилацетата
ZnO
+
2 CH3COOH
Zn(CH3COO)2
+
H2O
91
92.
В промышленности чаще всего применяется трубчатый реактор. Дляотвода тепла используется циркуляция в межтрубном пространстве и
через выносной холодильник бифенила или водного конденсата
(генерируется водяной пар!)
Применение реактора с псевдоожиженным слоем возможно в случае
использования в качестве носителя вместо дорогого и механически
непрочного активированного угля механически более прочного
носителя (оксид алюминия, силикагель) и замены ацетата цинка на
менее летучий ацетат кадмия. Для отвода тепла имеется встроенный
теплообменник, в трубки которого подается или бифенил, или водный
конденсат.
Вследствие способности винилацетата к терполимеризации необходимо
быстрое выведение его из зоны высоких температур.
Наличие кротонового альдегида (КА) в продуктах реакции дезактивирует
катализатор (образуя полимеры на его поверхности) и загрязняет конечный
продукт (0,005% КА замедляет скорость полимеризации ВА на 15%, а
0,2% КА – на 40%).
Выделение винилацетата осуществляется методом ступенчатой конденсации
или абсорбцией.
92
93.
3’Свежая
уксусная к-та
3
8
6
2
1
4
5
Ингибитор
Возвратная
уксусная к-та
13
9
7
12
Катализаторная
пыль
11
Свежий ацетилен
Тяжелокипящая фр-я
(этилидендиацетат,
полимеры, ингибитор)
Винилацетат
Кротоновая фр-я
17
Легкая фр-я
15
16
18
10
Полимеры и
ингибитор
14
Принципиальная технологическая схема
получения винилацетата из ацетилена и
уксусной кислоты парофазным методом
1- колонна-испаритель-смеситель;
2 – сепаратор;
3,5 – теплообменники; 3’ – подогреватель; 4 – реактор;
6,11 – водяные холодильники; 7 –труба Вентури;
8 –расширитель; 9 – скруббер; 10,18 – сборники;
12,13 – рассольные холодильники;
14,15,17 – 93
ректификационные колонны; 16 – дистилляционный куб
94.
Достоинства:- достаточно прост, протекает в одну стадию;
- исходные реагенты в газовой фазе легко перемешиваются;
- парогазовая реакционная смесь загрязняется, главным образом,
твердыми частицами катализатора, которые достаточно легко
отделяются пылеулавливающими устройствами;
- характеризуется незначительными затратами тепла на синтез, на
испарение уксусной кислоты и подогрев реакционной смеси;
- основное оборудование (за исключением испарителя) может быть
изготовлено из углеродистой стали, так как исходные вещества
находятся в виде перегретой парогазовой смеси и коррозия
практически отсутствует.
94
73
95.
Недостатки:- наличие больших объемов циркулирующего газа (объясняется особенностями
кинетики процесса на катализаторе для протекания которого необходим избыток
ацетилена по сравнению с его стехиометрическим количеством);
- наличие больших объемов циркулирующего газа требует больших объемов
реакционной и вспомогательной аппаратуры; кроме того, увеличение объемов
нежелательно также ввиду особой взрывоопасности ацетилена при повышенной
температуре;
- необходимость создания большой поверхности теплообмена вследствие мало
интенсивной теплопередачи к перегретой парогазовой смеси;
- требуется выделение конденсацией винилацетата-сырца из избытка газообразного
ацетилена, т.е. из разбавленных газовых смесей;
- необходимо выделять и возвращать в процесс значительные количества уксусной
кислоты из-за неполной ее конверсии;
- при повышенных температурах ( 200 °С) образуются побочные продукты, от
которых необходимо отделять винилацетат;
- образуются побочные смолообразные продукты, отравляющие катализатор;
- для отвода тепла необходимо встраивать теплообменные устройства, тогда как в
жидкофазных процессах тепло отводится, главным образом, за счет испарения95
продуктов реакции или исходных реагентов.
96.
4) Из этилена и уксусной кислотыLiCL
CH2 CH2
Pd
+ CH3COOH + PdCl2
+ O2 +
HCl
Pd
+ 2 CuCl2
2 CuCl
+ O2 +
v3
HCl
v1
PdCl2
v2
,
(NaCL,KCl)
PdCl2
v4
а) Жидкофазный процесс
+
+
CH2 CH OCOCH3 + Pd + 2 HCl
H2O
v2 << v1
2 CuCl
v1 ~
= v3~= v4
CuCl2 + H2O
Ку.к. = 20-30%;
Условия процесса:
t = 100-1300С; Р = 3-4 МПа;
[PdCl2] = 30 – 50 мг/л
[О2] = 5,5 -7% (взрывоопасность!)
С ростом температуры, содержания воды и
времени реакции усиливается гидролиз ВА и
соответственно увеличивается выход
ацетальдегида и других побочных продуктов
Кэт. = 2-3%
(за проход)
Недостатки:
- коррозионная
среда;
- низкая конверсия этилена и
уксусной к-ты;
- очень разбавленный раствор
катализатора и целевого продукта
(большие затраты на выделение);
- образование нерастворимых
оксалатов и дезактивация
катализатора
96
97.
Побочные продуктыOCOCH3
O
CH3C
CH3CH
H
1) CH2
этилидендиацетат
CH O
C
CH3
+
C
C O2
диоксид
C
HO
OCOCH3
ацетальдегид
углерода
O
O
OH
щавелевая к-та
H2O
CH3C HO
+
CH3COOH
O
OCOCH3
2) CH2
CH O
C
CH3
+
CH3COOH
CH3CH
OCOCH3
O
3)
4)
CH3COOH
O
HO
+ O2
O
C
C
OH
+
+ O2
HOOC COOH
CuCl2
O
O
O
C
C
C O2
+
H2O
оксалат меди (и палладия)
O
Cu
97
98.
б) Газофазный процесс (технология Bayer AG и Hoechst)Катализатор – хлорид палладия или металлически палладий на носителе
(содержание Pd в свежем катализаторе 1-5% (
до 0,1 - 2%).
Носитель – оксид алюминия, силикагель, активированный уголь.
Промотор – ацетат натрия.
Срок службы катализатора – 2,5 года.
Неподвижный слой катализатора ( псевдоожиженный слой нецелесообразен из-за уноса Pd).
Потери Pd не должны превышать 2,2 г на 1 т винилацетата.
Кожухотрубчатый реактор.
t = 175 – 2000C ( По мере падения активности катализатора температура повышается)
Р = 0,6 МПа
Основная побочная реакция – полное окисление этилена до диоксида углерода и воды.
Ккисл. = 60 – 70%; Ку.к. = 15 – 30%; Кэт. = 10 – 15%
Достоинства:
Спо эт. = 91 – 94%; Спо у.к. = 95 – 100%
- Простота оформления;
ВВА = 91%;
- Снижение коррозии;
ВСО2 = 8%;
Впр. = 1%
- Повышение конверсии этилена;
Недостатки:
- Повышение селективности
процесса
- Взрывоопасность
- Невысокая конверсия
98
99.
Возвратный этиленCO2
Na2CO3
О2
2
8
3
9
10
11
Свежая
уксусная к-та
2
1
Уксусная к-та
Возвратная
уксусная к-та
NaHCO3
ВА-сырец
Н2О
Свежий
этилен
2
7
5
6
4
H2O
Тяж. прод.
CH3COONa
Тяж.фр.
Технологическая схема газофазного процесса получения винилацетата
этилена и уксусной к-ты на гетерогенном палладиевом катализаторе
из
1- колонна-испаритель- смеситель; 2 – теплообменник; 3- реактор; 4 – сепаратор; 5,7,9
– ректификационные колонны; 6 – емкость; 8- скруббер; 10 – абсорбер; 11 - десорбер
99
100.
Ректификационныеколонны для
выделения
винилацетата
100
101.
Лекция 10101
102.
ПОЛУЧЕНИЕ АКРИЛОВОЙ КИСЛОТЫ И ЕЕПРОИЗВОДНЫХ
I.
Акриловая кислота
Мировые мощности по производству акриловой кислоты ~ 4 млн т/год
Основные направления потребления:
- Акриловые эфиры (1,4 млн т/год) (производство красок, лаков, покрытий и пр.)
- Полимеры (в т.ч. водорастворимые) и сополимеры (связующие материалы,
диспергаторы, аппретирующие материалы, средства для получения мелованной
бумаги и картона, клеев, эластомеров)
Методы получения акриловой кислоты
1) Гидролиз акрилонитрила
N
CH2 CH C
Акрилонитрил
+
800C
H2O
O
CH2 CH C
к-ты, щелочи
NH2
Много побочных реакций!
Акриламид
+ H2O
O
CH2
CH C
OH
Акриловая к-та
102
103.
2) Гидроксикарбоксилирование ацетиленаO
CH
CH + 4 H2O
+
Ni(CO)4
+
4 CH2
2 HCl
CH C
OH
+
NiCl2
+ H2
Кат.
O
CH
CH + 4 ROH + Ni(CO)4
+
4 CH2
2 HCl
+
CH C
400С; 0,1 МПа;
NiCl2
+ H2
OR
Ni(CO)4
С2Н2 : СО = 1 :
1
Недостаток: взрывоопасность!!!
3) Окислительное карбонилирование этилена
CH2
CH2
Pd
+
Cu2Cl2
+
PdCl2
+
H2O
2 CuCl2
+
2 HCl
+
1500C , 7,5 МПа
CO
CH2
LiCL , NaCL
Cu2Cl2
+ 0,5 O2
+
CH
COOH
+
Pd
+
2 HCl
PdCl2
2 CuCl2
+
H2O
103
104.
1-я стадия:4) Окисление пропилена в паровой фазе
CH CH3
1. CH2
2. CH2
CH CHO
Акролеин
+
CH2
O2
+
O2
CH CHO
CH2
+
Кат. – оксиды Bi, Co, Ni,
Fe, Sn в присутствии
водяного пара;
320 кДж/моль
+
COOH
CH
300-3500С; 0,1 – 0,3 МПа;
260 кДж/моль
Н2О : С3Н6 = (4÷5) : 1;
О2 : С3Н6 = 2 : 1
Кпроп = 90 - 95%
Вакр.= 80 – 90%
Механизм окисления – радикально-цепной
2 O*
O2
CH
CH3
CH2
CH
*
CH
2
CH2
+
2-я стадия:
O*
CH2
*
CH CH
2
*
CH
*
+
O*
НО*
CH2
CH
CH2
CH
*
CH
*
+
O*
CH2
CH CHO
CH2
CH CHO
+
HO*
CH2
CH
*
CO
НО*
H2O
+
*
Н
H2OО
+
250–2800С; 0,1 – 0,2 МПа;
Кат. – МоО3 и другие оксиды
в присутствии водяного пара;
В.п. : акролеин = 2 : 1;
+
HO*
*
CO
Какр..= 95 – 97%;
+
CH2
CH
CH2
CH COOH
H2O
Ва.к. > 90%
104
105.
Водяной пар уменьшает возможность перегрева и снижает взрывоопасность,способствует повышению активности катализатора, облегчает десорбцию
продуктов реакции и увеличивает продолжительность стабильной работы
катализатора (1 ст. – до 1 года; 2 ст. – до 4 лет).
В промышленности процесс в две стадии идет без разделения и очистки
продуктов 1-й стадии.
Для предотвращения полимеризации акриловой кислоты в процессе
ректификационной очистки добавляют ингибиторы (гидрохинон, фенол,
дифениламин, хлористый аммоний)
105
106.
Отх.газы
Акр.
к-та
Уксусная
к-та
Вода
С3Н6
В.п.
4
1
5
6
7
8
2
3
3
Воздух
Полимеры
9
Сточные
воды
Принципиальная технологическая схема газофазного окисления пропилена в
акриловую кислоту
1, 2 – контактные аппараты; 3 – холодильники; 4 – скруббер; 5 – колонна экстрактивной
дистилляции; 6 – 8 – ректификационные колонны; 9 – колонна регенерации растворителя
106
107.
II. Нитрил акриловой кислоты (НАК) (акрилонитрил)Впервые получен в 1893 г., практическое применение ~ с 1930 г. (каучук БН)
Мировые мощности по производству НАК ~ 5 млн т/год (Степень загрузки 90 – 93%)
Восточная Европа (включая Россию) ~ 250 тыс.т/год
Структура потребления НАК
- Полиакрилонитрильные волокна – 68%
- Смолы АБС и САН – 20%
- Бутадиеннитрильный каучук – 5%
- Адипонитрил – 4%
- Прочее – 3%
7 промышленных способов производства НАК
107
108.
1. Из этилена через этиленоксид и этиленциангидринCH2
CH2
+ O2
CH2
CH2
+ HCN
O
CH2 CH2 C
700C
0,2МПа OH
ТЭА
N
H2O
CH2
200-2200C
MgO, Al2O3
CH C
N
CH C
N
Многостадийность. Много побочных реакций! HCN!!!
2. Из этилена через ацетальдегид и гидроксинитрил
CH2
CH2
+ O2
CH3CH O
+ HCN
200C
CH3 CH C
N
H2O
600-7000C
OH
CH2
В = 90%
В = 97-98%
Многостадийность. Много побочных реакций! HCN!!!
3. Прямое взаимодействие этилена, синильной кислоты и кислорода
(«Асахи» и «Дюпон»)
CH2
CH2
+
HCN
+
0,5 O2
Побочные реакции! HCN!!!
330-3600C
Ni,Pd/Al2O3
CH2
CH
C
N
+
H2O
В = 90%
108
109.
4. Из ацетилена и синильной кислотыCH
CH
+
850C
HCN
CH2
Кислый водный р-р
Cu2Cl2 + NH4Cl +KCl
CH
C
N
Очень много побочных реакций! HCN!!!
5. Из пропилена и оксида азота («Дюпон»)
4 CH2
CH
CH3
+
6 NO
450-5500C
4 CH2
Ag/SiO2
CH C
N
+
6 H2O
+
N2
В = 79%
6. Окислительный аммонолиз пропана («Монсанто»)
CH3CH2 CH3 + NH3
+
2 O2
480-5200C
CH2
Sb,W,V
CH
C
N
+
4 H2O
109
110.
7. Окислительный аммонолиз пропиленаCH2
CH
CH3
+
NH3 + 1,5 O2
CH2
CH C
N
+
3 H2O + 14700 кДж/кг
Условия реакции:
Катализатор – Bi2Mo2O9, Bi2Mo3O12 + Fe, W, Ni, Co, Mg, Sn, Sb, P, U и др.;
Катализатор - формованный или нанесенный на носитель; неподвижный
(выше селективность) или псевдоожиженный (лучше теплоотвод);
450 – 5000С;
0,4 МПа;
02 : NH3 : C3H6 = (1,5 ÷3) : (0,9 ÷ 1,05) : 1
Отвод тепла – циркулирующая нитрит-нитратная смесь (при неподвижном
слое катализатора) или вмонтированные в реактор охлаждающие змеевики
(псевдоожиженный слой катализатора)
Побочные продукты: акролеин, ацетальдегид, формальдегид, ацетон, оксид и
диоксид углерода, вода, ацетонитрил, синильная кислота, метан, цианэтиленамин,
формальдимин.
110
111.
Побочные реакции1) CH2
CH
CH3
+
O2
CH2
2) CH2
CH
CH3
+
O2
CH3CH O
3) CH2
CH
CH3
+
O2
CH3 C CH3
CH CHO
+
+
H2O
HCHO
O
+
4) CH2
CH
5) CH
2
CH CH3
+
2 O2
6) CH2
CH CH3
+
O2
7) CH2
CH C
CH3
N
+
CO2
O2
+
+
NH3
2 NH3
NH3
+
H2O
CO
CH3 C
HC
H2N CH2 CH2 C
цианэтиленамин
N
N
N
+
+
CH4
HC
N
+
CO2
CH3 C
N
+ 4 H2O
+
H2O
+ CH2
NH
ацетонитрил формальдимин
111
112.
ПропиленАммиак
3
1
5
На разделение
2
А)
Кислород
4
Газы
Син. к-та
НАК
Вода
Б)
6
Пропилен
Аммиак
Ацетонитрил
7
9
8
10
2
1
Кислород
Вода
Т.фр.
Принципиальные технологические схемы производства акрилонитрила:
А) неподвижный катализатор; Б) псевдоожиженный катализатор
112
1 –смеситель; 2 – реактор; 3, 4, 5 – теплообменники; 6 – скруббер; 7 -10 – ректификационные колонны
113.
III. АкролеинCH2
CH
CH3 + O2
CH2
CH CHO
+
H2O
Условия реакции:
Катализатор – Bi2Mo2O9, Bi2Mo3O12 + Fe, W, Ni, Co, Mg, Sn, Sb, P, U и др.;
400 – 5000С; 0,1 – 1,0 МПа; время контакта – 1,2 с.
Или
Cu2O; 370 – 4000С; время контакта -0,2 с.
02 : C3H6 = (3 ÷ 4) : 1
Разбавление сырья водяным паром в 2-3 раза для снижения взрывоопасности.
Трубчатый реактор. Отвод тепла – циркулирующая нитрит-нитратная смесь
А) Одностадийный процесс: катализатор – молибдат висмута
К = 5-8%; С = 73 – 77%; В = 60 – 63%
Б) Двухстадийный процесс: 1-й р-р – катализатор – оксид меди
2-й р-р – катализатор фосфоромолибдат висмута
К = 95%; С = 66 – 67%; В = 69 – 70%
113
114.
IV. АкриламидБолее 50% акриламида идет на получение полиакриламида (нефтедобыча,
горнодобывающая, пищевая промышленность - загуститель, буферная жидкость,
гелеобразующий материал, флокулянт, ингибитор и т д.)
Препаративные методы получения акриламида – весьма многочисленны и разноообразны.
O
CH CH + CO + NH3
CH C
CH2
NH2
Промышленные методы получения акриламида
- До 1970 г. – омыление акрилонитрила моногидратом 80-85%-ной серной кислоты
при температуре 1000С
O
CH2
CH C
N
+
H2O
+
H2SO4
CH2
CH C
NH2* H2SO4
Ca(OH)2
O
CH2
+
CH C
CaSO4
+
H2O
NH2
- В настоящее время – каталитическая гидратация акрилонитрила в присутствии
твердого катализатора Cu/Al2O3
114
115.
ПОЛУЧЕНИЕ МЕТАКРИЛОВОЙ КИСЛОТЫ И ЕЕПРОИЗВОДНЫХ
I. Газофазное окисление изобутена
CH2
C
CH3
+ O2
CH2
CH3
C
CH3
CHO
+ O2
CH2
C
COOH
CH3
I стадия: 160 – 4500С;
II стадия: 350 – 4000С;
Оксиды Mo, Co, Bi, Ni, Fe, P, Te;
Оксиды Мо или фосфоромолибденовая
к-та с добавкой промоторов;
разбавление водяным паром;
i-С4Н8 : О2 : N2 = 1 : 3 : 27;
К = 90-99%; С = 75-90%; В = 80-88%
К = 80–95%; С = 75–97%; В = 85-90%;
115
116.
II.Получение метакролеина окислением трет.-бутилового спиртаOH
CH2
C
CH3
+ O2
CH2
CH3
C
CHO
CH3
300 – 3500С; 0,3 – 0,4 МПа; 2-3 с;
Оксиды Мо или фосфоромолибденовая
добавкой промоторов;
к-та с
Разбавление водяным паром;
t-С4Н8ОН : О2 : Н2О = 1 : (10÷15) : (6÷ 12);
К = 100%; С > 80%
На основе акриловой и метакриловой к-т получают (этерификацией,
переэтерификацией и др. способами) эфиры – акрилаты и метакрилаты, затем –
полимерные и сополимерные продукты
Мировое производство метилметакрилата ~ 1,7 млн т/год
116
117.
Лекция 11117
118.
Производствоспиртов
118
119.
ПРОИЗВОДСТВО МЕТАНОЛАРастворитель, экстрагент,
отдушка в пафюм. изд.
Лаки, краски, клеи, хим.
волокна, текстиль,
искусственная кожа,
пластики, бумага,
картон, эмульгаторы,
загустители, уплотнители
ПВА
Этилацетат
Винилацетат
Ацетилцеллюлоза
Уксусный
ангидрид
Муравьиная к-та
Метилформиат
Растворитель
МТБЭ
Консерванты, коагулянт
латексов, дубильный
реагент
Полиуретаны
Уксусная
к-та
Высококтановая
добавка к
бензинам
Упаковка,
диализные
мембраны,
волокна,
фильтры
Диметилтерефталат
МЕТАНОЛ
Метилметакрилат
ДМФА
Диметилкарбонат
Пенополиуретаны,
СК
Полиэфиры
Синт.волокна,
смолы
Полиэфиры
Поликонденсационные смолы,
пластмассы, СВ
Формальдегид
Орг.стекло, тара, клеи,
контактные линзы,
самоотверждающиеся
пластмассы
Полиметилметакрилат
Растворитель
ПолиПолиацетали
Упаковка, краски,
изоляция
ФФС
Связующее для разл.
констр. и термоизоляц.
материалов, лаки, клеи
Поликар
бонаты.
Антикоррозионные и конструкционные
материалы, диэлектрики, физиологич.
инертные фильтры крови и костные
протезы, оболочки для лекарств
пролонгированного действия
119
120.
Мировые мощности по производству метанола ~ 40 млн.т/годОбъем производства ~ 30 млн.т/год
Крупнейшие производители метанола: США (~ 5,6 млн.т/год); Канада, Саудовская Аравия (~ 4 млн.т/год);
Тринидад и Тобаго (~ 3 млн.т/год); Новая Зеландия (~ 2,5 млн.т/год); Германия (~ 1,9 млн.т/год);
Россия (~ 2,2 млн.т/год при мощностях ~ 3 млн.т/год).
Основные потребители ( и импортеры) метанола – США, Западная Европа, Япония.
Основное производство метанола в России:
-ОАО «Метафракс» (г.Губаха) – 41,4% (750 тыс.т/год)
-ОАО «Томский нефтехимический комбинат» - 39,7%(750
тыс.т/год)
Проекты Газпром: совместное производства с Германией
(«Метапром», Архангельск); Тобольск, Эстония (КохтлаЯрве- сланцеперерабатывающий комплекс)
Потребление метанола в России:
- Экспорт (США, Зап.Европа, Китай, Индия) > 50%
- Формальдегид – 20%
- Газовая промышленность – 20%
Мировое потребление метанола
(2001 г):
- Формальдегид – 35%
- МТБЭ - 28%
- Уксусная кислота – 7%
- Диметилтерефталат – 3%
- Метилметакрилат – 3%
- Растворители – 3%
- Прочее – 21%
- Прочее – 10%
Рост внутреннего спроса в России за счет МТБЭ!
120
121.
Метанол может быть получен из любогоуглеродсодержащего источника!
Гидрирование СО
Тяжелые фракции нефти
Газификация древесины
Газификация каменного угля
Газификация
бытового мусора
Газификация торфа
Природный
газ!!!
МЕТАНОЛ
В настоящее время функционируют установки по производству метанола суммарной
мощностью от 60 до 900 тыс.т/год.
Планируемые, проектируемые и строящиеся мощности можно условно разделить на
категории:
1. Установки суммарной мощностью до 1,3 млн.т/год, находящиеся в стадии пуска или
строительства.
2. Установки суммарной мощностью до 1,7 млн.т/год, находящиеся в стадии
инжиниринга (завершающей стадии проектирования), но с нерешенными
финансовыми вопросами.
3. Установки суммарной мощностью до 1,8 млн.т/год, находящиеся в стадии
предварительного проектирования
121
3
122.
Окисление метанаCH4
+
CH3OH
CH2O
0,5O2
CH3OH
+
CH2O
+
HCOOH
+
0,5O2
0,5O2
0,5O2
HCOOH
283 кДж/моль
+
+
295 кДж/моль
+
CO2 + H2O
550 кДж/моль
+
483 кДж/моль
Некаталитическое окисление метана
3400С, 10 МПа, СН4 : О2 + 9 : 1
К = 22%, С = 17% (по метанолу)
Каталитическое окисление метана
Катализаторы – оксиды азота, Сu-Sn, Pt, Pd
400 – 6000С, оксиды азота, основной продукт
– формальдегид – В = 11%
122
123.
Конверсия метана сводяным паром
CH4
CO
+ 2 H2
+
H2O
CO2
CO2
+
3 H2
CH3OH
+
H2
2 CH3 OH
n CO
+
H2O
CO
+
CH3OH + 90 кДж/моль
CO
CH3 OH
+
2n H2
+
H2
_
206 кДж/моль
H2
+
CH4
CH3 O
H2O + 50 кДж/моль
+
H2O
CH3
C n H 2n+1OH
+
H2O
+ (n-1) H2O
К = 15 - 50%
и зависит от
равновесия реакции и
выбранных условий
Ni/Al2O3, 800 – 9000С, 4 МПа
Более 80% метанола
производится при низком
и среднем давлении.
В > 95%
Степень чистоты
получаемого метанола -
99,85%
123
124.
Давление,МПа
Содержание метанола в паровой фазе (%
об.) при т-ре, 0С
240
280
300
340
380
400
5
26,0
13,9
8,7
2,9
0,9
0,6
10
31,7
25,7
20,4
9,9
3,9
2,4
15
32,8
30,1
27,0
17,3
8,8
5,6
20
33,1
31,8
30,1
23,0
13,3
9,9
30
33,3
32,8
32,1
28,6
21,4
17,0
Фирма
Катализатор
Т-ра, 0С
Давление, МПа
Nissui-Topsol
(CuO+ZnO)/Cr2O3
230 -260
10 - 15
Vulkan
ZnO/Cr2O3
270 - 330
15 - 25
Pritchard
CuO
200 - 330
10 - 25
BASF
(CuO+ZnO)/Cr2O3
200 - 350
5 - 25
ICI
(CuO+ZnO)/Cr2O3
240 - 260
<5
Lurgi
(CuO+ZnO)/Cr2O3,
CuO+ZnO
230 - 250
4-5
В стадии разработки:
- Гомогенные катализаторы на основе Со(СО)4 – 2000С,
30 МПа;
- Гетерогенные катализаторы на основе карбонилов Rh, Pt, Pd, Ir ,
нанесенных на MgO и CaO – 150 – 2200С, 0,1 – 2,0 МПа.
124
125.
125126.
126127.
127128.
(СН3)2ОА)
СН4
Конверсия
с водяным
паром
Очистка
природного газа
Очистка
синтез-газа
Синтез
метанола
Разделение
СН3ОН
Н2О
Б)
Возвр. синтез-газ
Диметиловый
эфир
Метанолсырец
Вода
4
1
6
2
7
8
5
3
Высш. сп
Св. синтез-газ
Поточная (А) и принципиальная технологическая (Б) схемы производства метанола
1 – скруббер (отмывка синтез-газа от СО2); 2 – адсорбер с акт.углем (очистка от Fe(CO)5 – кат-ра побочных процессов!); 3
– теплообменник; 4 – реактор (полочный или кожухотрубчатый); 5 – холодильник; 6 – сепаратор;
7,8
128
– ректификационные колонны
129.
Производствометанола
129
130.
130131.
Лекция 12131
132.
ПРОИЗВОДСТВО МТБЭМировое производство МТБЭ (2001 г) ~ 30 млн.т/год
(снижение к 2010 г. до 14,7 млн.т/год за счет исключения потребления МТБЭ в США.)
Европа,
Россия, Ср. и Бл. Восток не планируют сокращения производства и потребления МТБЭ
1990 г. – «Закон о чистом
воздухе» (США)
Применение экологически
чистого бензина с содержанием
2% масс. кислорода (введение
оксигенатов)
? МТБЭ ? Метанол ?
Этанол ?
Количество установок по
производству МТБЭ (2001 г)
США – 47
Европа – 47
Азия – 45
Лат. Америка – 23
Ближний и Средний Восток -11
Канада - 1
Производство МТБЭ в США,
млн.т/год
1985- 1,45
1990 – 3,8
1995 – 7,5
2001 – 9,3 (max!!!) + 4 млн т
импорт!!! (самый крупный
потребитель МТБЭ в мире!)
В 2000 г. –
запрет на
применение
МТБЭ в
США
Впервые промышленное производство МТБЭ
организовано в Италии в 1973 г.
(100 тыс. т/год)
Сырье для МТБЭ
1.Метанол
2.Изобутилен:
-газ пиролиза бензина – до 50% изобутилена,
-газы кат. крекинга – 15-17% изобутилена,
-изомеризация н-бутана,
132
-дегидрирование изобутана
133.
Основная реакцияCH3
CH3 C
+
CH2
CH3 C
CH3 OH
CH3
O CH3
CH3
Побочные реакции
CH3
CH3 C
CH2
+
CH3 C
H2O
CH3
OH
CH3
CH3
2 CH3 C
CH2
CH3
2 CH3 OH
CH3 C
CH2 C
CH3
(CH3)2O
CH2
CH3
+
H2O
Выход побочных продуктов растет с повышением температуры и времени
контакта, т. е. при снижении скорости подачи сырья.
При правильно подобранном режиме побочные процессы можно подавить
практически полностью и обеспечить селективность более 98%.
133
134.
Условия процесса:1). Гомогенные катализаторы – 10-50%-ные водные растворы
кислот (H2SO4, H3PO4, HCl, H3BO3), органические сульфокислоты,
гетерополикислоты, катализаторы Фриделя-Крафтса.
50 – 1500С; 1-2 МПа; К = 93 - 98%
Недостатки: коррозия, сложность отделения от продуктов
реакции, низкая селективность.
2). Гетерогенные катализаторы -оксиды Mg, Al, Fe, Ni,V;
синтетические цеолиты ZSM-5, ZSM-11; сульфоугли; ионообменные
смолы.
Наиболее эффективны и удобны в применении – гранулированные
сульфокатиониты, имеющие высокую механическую прочность –
макропористые (КУ-23, КУ-2ФПП) и микропористые (Пьюролайт Ст175)
– модифицированные на 10-30% катионами Ni, Fe, Cr, Cu, Co, Zn c
целью подавления димеризации изобутилена
70-800С; 0,8 – 1,0 МПа;
К = 98 – 99%; С = 98 - 99%
134
135.
Продуктыкрекинга
Н-бутан
Изомеризация
н-бутана
Разделение
Смесь н- и изо-бутана
из других источников
Изобутан
Метан
Синтез
метанола
Метанол
Дегидрирование
изобутана
Разделение
Изобутеновая фр-я из
других источников
Синтез
МТБЭ
МТБЭ
Поточная схема производства МТБЭ («Devy MacKy)
Мощность установок – до 500 тыс.т/год МТБЭ
Реализованные на практике технологии производства МТБЭ отличаются друг от
друга в основном типом реактора (изотермический, адиабатический,
«каталитической перегонки» или их комбинация) и необходимостью (или ее
отсутствием рециркуляции отработанной изобутеновой фракции
135
136.
Возвр. метанол5
6
Отраб.у/в
t1
1
4
3
ΣС4
t2
2
Метанол
7
8
t2 < t1
А
Б
В
Технологическая схема синтеза МТБЭ (“Chemische Werke Hüls”) в жидкой фазе
1- подогреватель; 2 – реактор; 3,4 – ректификационные колонны; 5,6 –холодильники; 7,8 – кипятильники
Практически неограниченная гибкость по сырью, конверсии и качеству целевого
продукта (побочные продукты – следы диизобутена и трет-бутилового спирта)
А - смесь углеводородов с высоким содержанием МТБЭ для смешения с бензином; Б – МТБЭ (+ метанол)
после реакции метанола с фракцией ΣС4 с низким содержанием изобутена; В – чистый МТБЭ
136
137.
54
Отраб. у/в
Н2О
1
2
3
Метанол
ΣС4
(сод. изобутена
10-65%)
К = 99% и >
7
МТБЭ
(97-99%)
6
Технологическая схема производства МТБЭ в реакционно-ректификационном аппарате (НИИМСК)
1 – реакционно-ректификационный аппарат; 2 – абсорбер; 3 –ректификационная колонна;
4,5 – холодильники; 6,7 - кипятильники
При небольшом избытке метанола достигается практически полное превращение
изобутена.
При недостатке метанола достигается практически полная его конверсия, в результате
чего отпадает необходимость использования блока промывки отработанной бутанбутеновой фракции и регенерации метанола
137
«Каталитическую перегонку» рационально применять в случае равновесных реакций
для смещения равновесия в сторону образования целевого продукта
138.
Сравнительные показатели производства МТБЭПОКАЗАТЕЛИ
Процесс на сульфокатионитном
катализаторе
формованном
НИИМСК
мелкозернистом
Chemische Werke Hüls
99,0
97,5
98 – 99,5
98,0
Колонна
«каталитической
перегонки»
Трубчатый +
шахтный
0,38
0,40
Эл. энергии, квт-ч
20
8
Охлаждающей воды, м3
18
26
Конверсия изобутена, % масс.
Содержание МТБЭ в
товарном продукте, % масс.
Тип реактора
Расход на 1 т МТБЭ
Пара, т
138
139.
ПРОИЗВОДСТВО МТАЭВсего несколько установок в мире
Исходная фракция С5 подвергается очистке каталитическим гидрированием для
удаления диеновых, ацетиленовых и серосодержащих соединений (Pd/катионит)
в предварительном реакторе, который может быть использован как перед
обычным реактором со стационарным слоем катализатора, так и перед
реактором «каталитической перегонки».
При гидрировании происходит изомеризация неактивного при получении
МТАЭ
3-метил бутена -1 в активные 2-метилбутен-1 и 2-метилбутен-2
CH2
CH
C
CH3
CH3
CH3 CH2 C
CH3 CH
CH2
CH3
C
CH3
CH3
CH3
CH3 CH2 C
CH2
+
CH3 OH
CH3 C
O
CH3
CH2
CH3
К = 95%
CH3
139
140.
ПРОИЗВОДСТВО ФОРМАЛЬДЕГИДАМировое производство – несколько млн.т в год.
Потребление – полиформальдегид (полиокиметилен, полиметиленоксид) конструкционные пластмассы, волокна, фильтры и пр.; фенолформальдегидные,
меламиноформальдгидные, мочевиноформальдегидные смолы; изопрен (через
диметилдиоксан) – СКИ; лекарственные препараты и др.
Основной метод получения – окислительное дегидрирование метанола
CH3 OH
+
0,5 O2
Основная реакция
k1
CH2O + H2O
+
147,4 кДж/моль
Побочные реакции
k2
CH3 OH
+
CH3 OH
CH2O
+
H COOH
H COOH
CH2O
1,5 O2
94,4 кДж/моль
H2
CO2
+
2 H2O
H COOH
0,5 O2
+
+
CO2
0,5 O2
CO
+
k1 << k2
H2O
+
+
+
575 кДж/моль
270,4 кДж/моль
H2O
+
14,5 кДж/моль
53,7 кДж/моль
140
141.
Катализаторы процесса – гетерогенные:1) Ag/пемза или Ag-металл (проволока, сетка, губчатое серебро) (раньше – Cu)
Пемза – нейтральный носитель, устойчивый при высоких температурах (до 10000С
со сравнительно небольшой удельной поверхностью (важно для уменьшения
доли побочных реакций!!!).
Активными центрами катализатора являются поверхностные оксиды серебра,
на которых сорбируется метанол и кислород (фактически идет окислительновосстановительная реакция).
Скорость превращения метанола в формальдегид при температурах < 3000С
лимитируется подводом реагентов к поверхности зерен катализатора (кинетическая
область).
К = 4,6 % мольн; В = 3,6 % мольн.
При температурах > 4000С процесс переходит в область внешней диффузии,
обеспечивая значительную разность концентраций реагентов и продуктов реакции
на поверхности катализатора и в потоке.
Химическое взаимодействие между реагентами происходит очень быстро, а
разогрев катализатора настолько велик, что оказывается достаточным для
поддержания высокой температуры реакции ( ~ 600 - 7000С)
Регулирование температуры осуществляется изменением соотношения
СН3ОН:О2=1: (0,3 ÷ 0,33). Для снижения взрывоопасности смесь разбавляется
инертным газом (азот, аргон) в 3 – 5 раз.
Процесс ведут в адиабатическом реакторе, на выходе продукты сразу
охлаждают.
141
142.
Кмет.= 77-97%; Ккисл.= 97-98%; С = 87-92%; В =~80%Достоинства: простота конструкции реактора; высокая
производительность; низкая металлоемкость и энергоемкость
Недостатки: высокий расходный коэффициент по сырью; присутствие
в формальдегиде до 8-11% метанола и повышенное содержание
муравьиной кислоты; дорогой катализатор
142
143.
1100СОтр.газ
Воздух
1
Метанол
+ 20-25%
воды
2
Вода
3
5
8
600-7000С
Охл.вода
7
4
6
Метанольный
формалин
Принципиальная технологическая схема синтеза формальдегида
1,2 – теплообменники; 3 – реактор; 4 – подреакторный холодильник;
5 - трехсекционный скруббер; 6 – холодильник (метанольный формалин);
7 – холодильник (15-20% формальдегида); 8 – холодильник (вода)
143
144.
2) Оксиды Co, Cu, Mn, Ca, Ba и др. [250 - 4000С; Кмет.= 98-99%]Достоинства: низкий расходный коэффициент по сырью; низкое содержание в
товарном формалине метанола (0,6-1,0%) и муравьиной кислоты (0,02%); более
дешевый катализатор.
Недостатки: Ограничение единичной мощности установок; сложность
эксплуатации и ремонта; повышенный расход энергии и воздуха;
повышенная металлоемкость
Суммарная себестоимость в обоих процесса примерно
одинакова!
144
145.
Лекция 13145
146.
ПРОИЗВОДСТВО СПИРТОВ ГИДРАТАЦИЕЙОЛЕФИНОВ
I. СЕРНОКИСЛОТНАЯ ГИДРАТАЦИЯ ОЛЕФИНОВ
Сырье – низшие олефины (этилен, пропилен, изобутилен)
RCH
+H2SO4
CH2
+
R CH CH3
3
H2O
R CH CH3
H2SO4
3
OSO2OH
3
OH
Процесс экзотермический!
Серная кислота – и катализатор и реагент!
H+
H2SO4
RCH
+
CH2
+
OSO2OH
+
H+
RCH CH3
Механизм –
3
3
+
RCH CH3
+
R CH CH3
H2SO4
+
H+
3
3
OSO2OH
В присутствии воды:
H2O
RCH
CH2 +
3
+
RCH CH3
3
+
H+
+
+
H3O
+
+
HO
RCH CH3
3
H2O
+
H2O
3
R CH CH3
3
H2O
+
H+
В процессе гидролиза
алкилсульфатов происходит
разбавление серной кислоты.
Для возвращения ее на стадию
абсорбции олефина необходимо
предварительное
концентрирование
R CH CH3
3
OH
карбоний-ионный
Присоединение протона идет по правилу
Марковникова, поэтому образуются
вторичные и третичные спирты (за
исключением этанола)!
Для абсорбции олефина серной
кислотой используется тарельчатый
абсорбер, на каждой тарелке
которого установлен охлаждающий
146
змеевик
147.
С повышением температуры иконцентрации кислоты
увеличивается количество
побочных продуктов, особенно
олигомеров, которые смешиваются с
CH3
RCH O SO2 кислотой и затрудняют ее
2
концентрирование.
3
Побочные реакции
1) Образование диалкилсульфатов
R CH
CH2
+
3
]
[
R CH CH3
3
OSO2OH
2) Образование простых эфиров
R CH CH3
+
CH3
+
RCH CH3
3
RCH O
3
OH
3
CH3
CH R
3
3) Образование карбонильных соединений
R CH CH3
3
H2
R C CH3
4) Димеризация олефинов
CH3
2 R CH
3
CH2
Концентрирование серной кислоты
осуществляется или упариванием в
вакууме или продувкой горячими (80010000С) топочными газами.
При этом полимеры окисляются до
СО2 и Н2О за счет частичного
разложения серной кислоты и
выделения кислорода.
O
H
OH
Удаление основной массы
олигомеров осуществляется
экстракцией их из серной кислоты
«зеленым маслом». Экстракт
направляется на сжигание.
RCH
3
CH
2
CHR
Повышение концентрации серной
кислоты до 98% требует
дополнительного введения олеума, т.к
147
топочные газы содержат Н2О.
148.
Условия поглощения олефинов серной кислотойОлефин
Концентрация
H2SO4, %
Температура,
0С
Парциальное
давление
олефина, МПа
96-98
80-90
1,01-1,52
Пропилен
85
25-35
0,61-0,81
Пропилен
75-80
50-60
0,61-0,81
Н-бутены
75-80
20-30
0,30-0,40
Изобутены
55-65
10-20
0,20-0,30
Этилен
Целесообразно совмещать производство соответствующих спиртов с сернокислотной
гидратацией этилена, используя для абсорбции пропилена и изобутена, которая
происходит при более мягких условиях, разбавленную серную кислоту после
гидролиза этилсульфатов.
Достоинства: высокая конверсия ( практически 100%); дешевое сырье (фракции
с любой концентрацией олефина); невысокие температуры и давления
Недостатки: коррозия!!!; трудности концентрирования и потери серной
кислоты; образование побочных продуктов; громоздкая схема разделения
148
149.
II. ПРЯМАЯ ГИДРАТАЦИЯ ОЛЕФИНОВR CH
CH2
+
H2O
R CH CH3
+Q
3
3
OH
Основной катализатор - Н3РО4 на крупнопористом силикагеле
Реакции благоприятствуют пониженные температуры и повышенные
давления, однако!!!
1)катализатор активен при температуре 260 – 3000С;
2) соотношение Н2О : С2Н4 = (0,6÷0,7) : 1, т.к. оптимальная
концентрация фосфорной кислоты в пленке на поверхности
катализатора составляет 83-85% и достигается при таком
соотношении;
3) давление составляет 7 – 8 МПа (при дальнейшем повышении
давления конденсируется Н2О, разбавляется и интенсивно уносится
кислота с поверхности носителя, увеличивается образование
полимеров )
К = 4,2 – 4,5%; С = 95%
149
150.
Особенности процесса:- высокий рецикл этилена;
- концентрация этилена не ниже 98%;
- нет необходимости отвода тепла (адиабатический реактор,
температура смеси повышается на 10-200С)
- унос фосфорной кислоты с носителя (необходима подпитка!) (срок
службы катализатора ~ 1000 час)
- нейтрализация продуктов на выходе из реактора (можно обойтись
без нее за счет коррозионностойкого теплообменника и более полно
утилизировать тепло);
- защита от коррозии (футеровка реактора медью или реактор из
биметалла)
- смешение водяного пара и этилена в паровом инжекторе или в
теплообменнике-сатураторе
150
151.
Отдувка в.д.Н3РО4
8
3
4
5
Отдувка н.д.
9
1
6
2
7
10
Этанолсырец
Этилен
Фузельная
вода из
колонны
ректификации
этанола
Принципиальная технологическая схема прямой гидратации этилена
1,2 – компрессоры; 3 – теплообменник-сатуратор; 4 – печь; 5 – реактор; 6,7 – холодильники;
8 – сепаратор высокого давления; 9 – сепаратор низкого давления; 10 – емкость.
151
152.
Установкапроизводства
этилового
спирта прямой
гидратацией
этилена
152
153.
Нейтральные катализаторы:SiO2/12WO3/7H2O + B2O3 ; (250 – 3000С, 30 МПа) или (200 – 2400С, 1,5 – 2,5 МПа)
К = 5,5 – 8,5%
TiO/ZnO , 2200С, 5 МПа
К = 10%
Для пропилена
1) Н3РО4 /силикагель; 170 – 2000С, 2-3 МПа (газофазный процесс)
= 10 – 12%
К
2) W2O3 (22%) + ZnO (5%); 240 – 2700С, 15 – 20 МПа (жидкофазный процесс)
К = 60 – 70%, С = 98%
3) Сульфокатиониты (срок службы катализаторы – 8 мес.); 130 – 1500С,
6 – 10 МПа, Н2О : С3Н6 = (12,5 ÷ 15) : 1 (жидкофазный процесс)
К = 75 – 80%, В = 94%
153
154.
154155.
Лекция 14155
156.
ПРОИЗВОДСТВО ВЫСШИХ ПЕРВИЧНЫХ СПИРТОВГидрирование природных жиров (кокосовое, пальмовое масло, животные жиры) – дает
высококачественные ВЖС с четным числом углеродных атомов (С6 – С20) нормального
строения ( можно разделить на узкие фракции и даже на индивидуальные компоненты),
пригодные для получения биоразлагаемых ПАВ.
Однако при гидрировании природных жиров ценный глицерин превращается в малоценный
изопропиловый спирт, поэтому предпочтительнее проводить сначала гидролиз или
переэтерификацию низшими спиртами, и лишь затем гидрирование.
I. ГИДРИРОВАНИЕ СЖК И ИХ ЭФИРОВ
R COOH
+
H2
R COO R'
+
H2
R CH2 OH
R CH2 OH
+
R'OH
Катализатор:
(для гидрирования эфиров) – Zn-Cr (стационарный)
(устойчив к ядам, достаточно дешевый, меньше
расход, но не гидрирует побочные продукты –
непредельные и карбонильные соединения - что
приводит к необходимости дополнительной очистки;
К = 90% ( к-ты); К = 94% (бут эф.); К = 97% (мет.эф.)
(для гидрирования кислот) - Cu-Cr (стационарный и
суспендированный)
К = 99,9%; С = 97-98% (но спирты худшего качества!)
Условия этерификации (отгон
азеотропа спирта с водой):
Бутиловым спиртом –
2-кратный избыток н-бутанола;
2000С, 0,6 МПа, 24 часа;
Метиловым спиртом 5-кратный избыток метанола ;
1300С + Н2SO4
или 3200С, 30 МПа
Условия гидрирования:
Температура - 300 – 3200С
Давление – 30 МПа
156
157.
Метанол3
4
Реактор со
стационарным
слоем
катализатора
2
9
Н2
1
Эфиры
5
(Zn-Cr)
7
8
6
Н2
Н2
ВЖС
ВЖС
Н2
Принципиальная технологическая схема
гидрирования СЖК и их эфиров
1,2 – реакторы; 3 - печь; 4,5 – теплообменники; 6 – холодильник;
7,8 – сепараторы; 9 – ректификационная колонна
Сусп.
кат-ра
СЖК
Реактор с суспендированным катализатором (Cu-Cr)
– сложность отделения катализатора
(центрифуги, пресс-фильтры), большой расход,
эрозия оборудования.
157
158.
II. Al - органический синтез1. Прямой синтез высших Al –алкилов из Al, Н2 и соответствующих α-олефинов
2. Переалкилирование Al(i-С4Н9)3 высшими α-олефинами
3. Олигомеризация этилена на Al(С2Н5)3 →
Al + H2 + R CH
Al(i-C4H9)3
Al(C2H5)3
+
+
R CH
n CH2
смесь от С4 до С30
CH2
CH2
AlR3
O2
Al(OR)3
H2O
ROH
+
Al(OH)3
CH2
158
159.
Альфоль-процесс (“Continental Oil” ,США – 1962 г.)80 -1290С (не выше, т.к возрастает выход
олефинов) 8,5 → 2 - 3 МПа; 4 - 5 часов;
Кат. 5 -10%
КAl = 81 -98%
1) Синтез триэтилалюминия
Al + H2
+
CH2
Al(C2H5)3
CH2
Al(C2H5)3
Р-тель
2) Олигомеризация
(C2H4 )x C2H5
Al(C2H5)3
+
n CH2
CH2
Al
(C2H4 )y C2H5
70 → 1600C; 5 – 12 МПа;
Змеевиковый реактор. Отвод тепла –
впрыскиванием этилена в 10 – 12 точек.
К = 85%; В = 77 -80%
(C2H4 )z C2H5
Конц. 25 – 50%,
иначе повышается
взрывоопасность,
осложняется теплосъем
Примеси α-олефинов; при попадании влаги образуются парафины, вплоть до ПЭ на
стенках реактора (необходимо периодическое удаление горячим растворителем).
3) Окисление триалкилалюминия
OR
Al R3
+
O2
Al
R
R
OR
Al
OR
Al
OR
OR
OR
R
20 - 250С → 50 – 600С ;
2 ч.
К = 85 – 90%
4) Гидролиз алкоголятов алюминия
OR
Al
OR
OR
R
+
3 H2O
Al(OH)3
+
3 ROH
20 – 600С; 1 час
К = 100%
159
160.
Легкиепрод.
Этилен
Водород
Алюминий
Приготовление кат-ра
Р-ль
(керосин)
Центрифугирование
Al
Спирты
С6 – С8
Спирты
С10– С20
Вакуумная
перегонка
Поб. прод.,
р-ль
Олигомеризация (змеевик)
Р-тель
Ректификация
Спирты
С22 – С30
Спирты
С2 – С4
Н2О (Н2SО4)
Разделение
(отстой)
Гидролиз
Вак.
ректификация
Поб. прод.,
р-ль
Вак.ректификация
Отраб.
воздух на
очистку
Окисление
(барботажная
колонна)
Воздух
Экстр.
спиртов,выделение оксида
алюминия
Al2O3
Al2 (SO4)3
Поточная схема Альфоль-процесса
160
161.
Лекция 15161
162.
III. ОКСОСИНТЕЗR CH
CH2
+
CO
+
R CH2CH2CHO
R CH2CH2CH2OH
RCHCH3
RCHCH3
H2
Реакция экзотермическая!
CH2OH
CHO
Для гем-замещенных олефинов гидроформилирование идет только по незамещенному
атому углерода:
CH3 C
CH2
+
CO
+
H2
CH3
CH3 CH CH2 CHO
CH3
Основные побочные реакции на стадии гидроформилирования : гидрирование
олефинов до насыщенных соединений, гидрирование альдегидов до спиртов, реакции
уплотнения альдегидов и др. соединений
Условия гидроформилирования
( в зависимости от катализатора):
Т-ра = 100 – 2000С
Давление = 1- 30 МПа
Время реакции ~ 1 час
Н2 : СО = (1÷2) : 1
К = 65 – 80% С ~ 95% (для низших
олефинов)
Условия гидрирования:
Т-ра = 170 -2600С
Давление = 10 – 15 МПа
Катализатор – Co, Zn-Cr, Ni-Cr и др.
162
163.
Мировое производство оксопродуктов ~ 7 млн т/год (более 50наименований) – растворители, ПАВ’ы, стабилизаторы, пластификаторы,
синтетические смазочные масла и присадки, фармацевтические товары,
лакокрасочная продукция и пр.
Производство оксопродуктов в России ~ 400 тыс. т/год
Производство бутиловых спиртов в мире ~ 2 млн т/год
Производство бутиловых спиртов в России ~ 260 тыс. т/год
(«Сибур-Химпром» - Пермь; ОАО «Невинномысский азот»; Ангарский
НХК; ОАО «Салаватнефтеоргсинтез»)
Мировое производство алифатических первичных спиртов С10 - С20
Структура потребления
бутанолов (США)
Растворители – 20%
Бутилацетат и бутилакрилат – 29%
Гликолевые эфиры – 15%
Сложноэфирные пластификаторы
(на основе фталевых кислот) – 15%
Прочее – 21%
> 1 млн т/год
Структура потребления спиртов
С10 –С20 (США)
СМС – 58%
Парфюмерия – 7%
Эмульгаторы – 4%
Присадки к маслам -7,5%
Прочее – 23,5%
163
164.
Структура мирового производства высшихалифатических спиртов (2001 г)
Метод
производства
США
Япония
Англия
Франция
Германия
Италия
Оксосинтез
37,5
30,7
84,4
100
35,9
100
Алюминийорганический синтез
40,2
15,9
-
-
33,3
-
Окисление
парафинов
4,9
23,9
-
-
-
-
Гидрирование
жиров
17,4
29,5
15,6
-
30,8
-
Высшие спирты производятся:
Европа – 375 тыс. т/год
Америка - 320 тыс. т/год
Азия – 115 тыс. т/год
Россия – 52 тыс. т/год ( > 60% гидрированием СЖК и их эфиров)
Первичные спирты С7 – С9 – для
производства пластификаторов
на основе фталевых кислот!
164
165.
Катализаторы процесса – карбонилы металлов- по каталитическойактивности располагаются в следующем ряду:
Ni, Ce, Mo, W < Fe <
~0
Mn <
10-6 – 10-4
Ru
10-2
<
Co
1
<
Rh
102 - 103
Более 50% процессов
гидроформилирования
осуществляется на
карбонилах Со!
Типы катализаторов:
1) Классический комплекс – гидрокарбонил кобальта - HCo(CO)4
2) Гидрокарбонил кобальта, модифицированный третичным фосфином
(трибутилфосфин, трифенилфосфин) - HCo(CO)3PPh3 или пиридином -
HCo(CO)(C5H5N)3
3) Гидрокарбонильные комплексы родия, модифицированные третичным
фосфином (трибутилфосфин, трифенилфосфин) – HRh(CO)(PPh3)3
165
166.
Сырье для процесса - α-олефины С2 – С20 (как индивидуальные, так ифракции, и синтез-газ)
Необходимо удаление примесей, т.к.:
- Кислород окисляет карбонилы кобальта в оксид и замедляет процесс.
- Диеновые и ацетиленовые соединения образуют нежелательные комплексы
с карбонилами кобальта и ингибируют процесс
- Аммиак дезактивирует гидрокарбонил кобальта, переводя его в
аммонийкарбонил
- Сернистые соединения (сероводород, сероуглерод) тормозят процесс,
связывая кобальт в сульфиды
166
167.
Условия и характеристика процессов гидроформилированияпропилена на различных каталитических системах
Лигандно-модифицированные
HCo(CO)4
HCo(CO)3PPh3
HRh(CO)(PPh3)3
Температура, 0С
140 - 180
160 - 200
80 - 120
Давление, МПа
25 - 30
5 - 10
1,5 – 2,5
Концентрация металла
катализатора ( в расчете на
олефин), %
0,1 – 1,0
0,5 – 1,0
0,01 – 0,001
Соотношение продуктов реакции
н- и изо-строения
(3÷4) : 1
(6÷8) : 1
(15÷25) : 1
80
10
1
9
10 – 20
80
15
15 -20
96
–
2
2
Состав продуктов,%
альдегиды
алканы
спирты
прочее
167
168.
Механизм реакции гидроформилирования на кобальтовомкатализаторе
1) Образование карбонила и гидрокарбонила кобальта
2 Co
+
8 CO
Co2(CO)8
+
Карбонил и гидрокарбонил
кобальта разлагаются:
Co2(CO)8
КК – при 510С;
ГКК < 00С
2 HCo(CO)4
H2
2) Гидрокарбонил кобальта теряет молекулу СО
*
HCo(CO)
3
HCo(CO)4
+
Стабильность
катализатора при
повышенных температурах
обеспечивается только
повышением парциального
давления СО!
CO
3) Образование π- комплекса с олефином
CH2
CH2
+
*
HCo(CO)
3
CH2
CH2
Карбонил и гидрокарбонил
кобальта растворимы в
реакционной массе –
гомогенный катализ!
HCo(CO)3
4) Образование алкилкобальткарбонилов
CH2
CH2
*
CH3CH2 Co(CO)
3
+ CO
CH3CH2 Co(CO)4
CO
HCo(CO)3
5) Изомеризация алкилкобальткарбонила в ацилкобальткарбонил
CH3CH2 Co(CO)4
*
CH3CH2 C Co(CO)
3
O
+ CO
CO
CH3CH2 C Co(CO)4
O
168
169.
6) Образование альдегидовH2
CH3CH2 CHO
*
HCo(CO)
3
+
*
CH3CH2 C Co(CO)
3
O
HCo(CO)4
H2
CH3CH2 CHO
CH3CH2 CHO
+
+
Co* 2(CO)7
HCo(CO)4
CH3CH2 C Co(CO)4
O
HCo(CO)4
CH3CH2 CHO
+
Co2(CO)8
Скорость реакции пропорциональна концентрации олефина и катализатора.
Скорость реакции возрастает с повышением парциального давления водорода и
температуры; при этом возрастает выход альдегидов изо-строения.
Скорость реакции снижается с повышением парциального давления оксида
углерода и понижением температуры; при этом возрастает выход альдегидов
нормального строения
Синтез-газ берется в избытке по отношению к олефину (в 2 – 3 раза); предусматривается
рециркуляция синтез-газа с периодической очисткой его от примесей.
При гидроформилировании низших олефинов используется инертный углеводородный
169
растворитель
170.
Прод р-цииОхл.
конденсат
Прод р-ции
Охл.
конденсат
З-2
Охл.
прод
р-ции
Охл.
синтез-газ
Охл.
прод
р-ции
З-1
Олефин
Олефин
СО + Н2
СО + Н2
Кат-р
Внутренний теплосъем
(позонное впрыскивание
охлажденных продуктов
реакции и циркулирующего
синтез-газа)
Достоинство - простота
конструкции.
Недостаток –
повышенный выход
побочных продуктов
Горячий
конденсат
Кат-р
Горячий
конденсат
Внешний теплосъем
Комбинированный реактор
(Трубки Фильда)
З-1 – зона внутреннего
теплосъема (идеальное
перемешивание; К = 50-70%)
Достоинство – близость к
аппаратам идеального
вытеснения, снижение
образования побочных
продуктов
Недостаток – повышенная
металлоемкость
З-2 – зона внешнего теплосъема
(идеальное вытеснение; min
образования побочных
продуктов)
170
171.
Классический промышленный процесс оксосинтеза включает следующие стадии:1. Карбонилообразование (кобальтизация) – образование карбонилов Со из синтез-газа,
металлического Со или его солей (нафтенаты, ацетат и др.)
2 Co
+
Co2(CO)8
8 CO
+
H2
H2
2 HCo(CO)4
2. Гидроформилирование
R CH2CH2 CHO
R CH
CH2
+
CO
+
H2
CHO
R CH CH3
3. Декобальтизация (перевод карбонилов кобальта в металлический кобальт или его соли
для отделения от продуктов реакции)
Co2(CO)8
2 HCo(CO)4
+
H2
2 Co
+
8 CO
+
H2
4. Гидрирование альдегидов до спиртов (гомогенно-каталитическое или гетерогеннокаталитическое)
R CH2CH2 CHO
+
H2
R CH2CH2 CH2OH
5. Ректификация - выделение товарных альдегидов и спиртов
В общий комплекс может входить и стадия получения синтез-газа
171
172.
Стадия декобальтизации определяет технологическуюсхему!!!
Схемы с термической декобальтизацией
2 HCo(CO)4
Co2(CO)8
+
H2
2 Co
+
8 CO
+
H2
1. Кизельгурная
Со осаждается при разложении карбонилов при понижении парциального давления
СО повышенных температурах на движущемся носителе – кизельгуре,
возвращаемом из аппарата – декобальтизера на стадию кобальтизации
2. Порошковая
Металлический Со выделяется в виде суспензии порошка в жидких продуктах, после
отделения которых суспензия Со возвращается на стадию кобальтизации.
3. Триадная
Содержит два аппарата, заполненных стационарным носителем – пемзой, на которой
осаждается металлический Со и которые работают поочередно как кобальтизер и
декобальтизер, и третий пустотелый аппарат – собственно реактор
гидроформилирования
172
173.
Отходящие газы2
3
1
150-1700С,
25 – 30 МПа
160-1850С,
25 – 30 МПа
5
4
120-1300С,
2,5 – 3,0 МПа
Горячий Н2
СО+Н2
Олефин
6
Продукты
реакции
Суспензия катализатора Со/кизельгур
Принципиальная кизельгурная схема декобальтизациии
1 – реактор кобальтизации и гидроформилирования; 2 – реактор гидроформилирования;
3, 4 – сепараторы; 5 – реактор декобальтизации; 6 – магнитный сепаратор
Недостатки: эрозия, отложение Со на стенках реактора, сложность
отделения суспензии катализатора в магнитном сепараторе
173
174.
СО+Н23
Отходящие газы
Олефин
(р-ль)
2
1
150-1700С,
25 – 30 МПа
170-1800С,
25 – 30 МПа
4
100-1300С,
2,5 – 3,0 МПа
Горячий Н2
СО+Н2
Продукты
реакции
Олефин
Раствор катализатора
Триадная схема декобальтизации
1 – кобальтизер (декобальтизер) (стационарный носитель – пемза);
2 – реактор гидроформилирования; 3 – сепаратор;
4 – декобальтизер (кобальтизер) (стационарный носитель – пемза).
Недостатки: большие капитальные затраты, необходимость переключения потоков174
(цикл работы аппарата < 24 часов), неравномерное осаждение Со на пемзе
175.
Схемы с солевой декобальтизациейНа стадии декобальтизации карбонилы кобальта разрушаются окислителями в
присутствии соответствующих кислот с образованием исходной соли.
2(RCOO)2Co
+
8 CO
+
R COOH
+
NaOH
Co2(CO)8
+
2 H2SO4
CoSO4
+
2 RCOONa
RCOONa
+
+
4 R COOH
2 H2
H2O2
+
Co2(CO)8
H2O
2 CoSO4
(RCOO)2Co
+
+
8 CO
+
4 H2O
Na2SO4
или
Co2(CO)8
+
4 R COOH
+
O2
2 (RCOO)2Co
+
8 CO
+
2 H2O
175
176.
Продуктыреакции
2
4
1
130 – 1700С,
25 - 30 МПа
Нафтенат Со
130 – 1700С,
25 - 30 МПа
3
5
140 – 1500С,
0,1 МПа
Раствор
кат-ра
Олефин
О2
СО+Н2
Испарительно-солевая схема декобальтизации
1 – кобальтизер 2 – реактор гидроформилирования; 3 – сепаратор;
4 – декобальтизер; 5 – ректификационная колонна
Недостаток - введение дополнительных реагентов ( кислоты, окислители)
Достоинство – снижение количества аппаратов высокого давления
176
177.
Продуктыр-ции
- значительно
более высокая каталитическая
активность, позволяющая снизить
концентрацию Rh до 0,0005 – 0,001% масс.;
2
3
- высокая селективность при высокой (~ 95%)
конверсии (выход целевых продуктов
почти количественный);
-Низкие концентрации катализатора и
высокий выход целевых продуктов упрощают
дальнейшую переработку;
1
СО+Н2
Олефин
Основные преимущества
Rh-катализаторов:
Катализатор
- низкие температуры (90 – 1000С) и давления
(1 – 3 МПа)
1 – реактор; 2 – сепаратор; 3 – ректификационная колонна
Для катализаторов, устойчивых к термическому разложению (фосфиновые
комплексы Со и Rh), после снижения давления продукты оксосинтеза просто
отгоняются от раствора катализатора.
В перспективе – создание Rh-катализаторов, закрепленных
(иммобилизованных) на полистироле – исключается стадия отделения
продуктов реакции от катализатора
177
178.
Лекция 16178
179.
ПРОИЗВОДСТВО МНОГОАТОМНЫХ СПИРТОВI. ГЛИКОЛИ
Мировые мощности по производству этиленгликолей ~ 14 млн.т/год
Степень загрузки – 88,% (2001 г.)
В России ~ 260 тыс.т/год («Сибурнефтехим» - г.Дзержинск; ОАО
«Салаватнефтеоргсинтез»; «Казаньоргсинтез»; ОАО «Нижнекамский НХК»)
Производство пропиленгликоля – в меньших объемах (в Европе – 819 тыс.т в
2001 г.)
Основные направления использования – антифризы, абсорбенты, растворители,
гидравлические тормозные жидкости, полиэфиры (волокна, пластмассы),
пластификаторы, поверхностно-активные вещества
HOCH2 CH2 OH
Моноэтиленгликоль (МЭГ)
HOCH2 CH2 OCH2 CH2OCH2 CH2OH
Триэтиленгликоль (ТЭГ)
HOCH2 CH2 OCH2 CH2OH
Диэтиленгликоль (ДЭГ)
HOCH2CH OH
CH3
Пропиленгликоль (ПГ)
179
180.
Основные методы производства этиленгликоля1. Гидролиз галогенпроизводных
+
ClCH2CH2Cl
HOCH2CH2Cl
Na2CO3
+
+
2000C
1-2 МПа
H2O
800C
NaHCO3
HO CH2CH2 OH
+
2 NaCl
+
CO2
NaCl
+
CO2
+
HO CH2CH2 OH
20-е годы XX века
В настоящее
время не
применяется
2. Окисление этилена в уксусной кислоте (Япония)
CH2+
CH2
1000C
Pd++, Rh++
( Li+, Na+ )
O2 + CH3COOH
HOCH2CH2 OCO CH3
+
100-1500C
H2SO4 , H3PO4
H2O
В = 99%
HOCH2CH2 O CO CH3
HO CH2CH2OH
+
CH3COOH
Коррозионность,
трудность отделения
катализатора,
необходимость его
регенерации
3. Из синтез газа или формальдегида (США – Du Pont, Chevron)
CO
+
H2
CH3 OH
2000C
CO
+
H2O
HOCH2COOH
+
CH3 OH
CH2 O
+
HOCH2 COOCH3
+
H2
70 МПа
(H2SO4 )
CH2 O
В = 90%
HOCH2COOH
В настоящее время
не используется.
HOCH2 COOCH3
2000C
3 МПа
(Cu-Cr)
HO CH2CH2 OH
+
CH3 OH
Жесткие условия, коррозия,
многостадийность, но при
дешевом синтез-газе может
иметь перспективу. 180
181.
4. Из формальдегида на цеолитах (США)1000C
цеолиты
2 CH2 O
+
HOCH2CHO
Ni
HOCH2CHO
+
CH2 O
NaOH
+
HOCH2CH2O H
H2
1250C
OH
HOCH
2CH
НОСН
2СН
2ОН
2
Na(HCOO)
К = 100%
С = 75%
Перспективен!
2
5. Прямое гидроксилирование этилена
CH2
CH2
+
O2
+
H2O
80-1000С 25 МПа
NaCl,LiCl
HO CH2CH2 OH
В > 95%
6. Гидратация оксида этилена
CH2
CH2
+
H2O
CH2
+
HO CH2CH2 OH
Катализаторы –
неорганические
кислоты, щелочи
HO CH2CH2 OH
O
CH2
HO (CH2CH2O)2 H
O
CH2
CH2
+
HO (CH2CH2O)2 H
HO(CH2CH2O)3 H
Некаталитическая
гидратация в жидкой
фазе
2000С, 1 – 2 МПа, 0,5 ч
Н2О : ОЭ = 20 : 1
К = 100%
O
Получается 15%-ный раствор ЭГ и других продуктов – требуется упаривание!
Для получения ДЭГ и ТЭГ берут смесь ЭГ : Н2О : ОЭ = 3 : 3 : 1
ВДЭГ = 85%
ВЭГ= 82-86%,
ВДЭГ= 12-14%,
ВТЭГ= 2-3%181
182.
Производство пропиленгликоляКаталитическая и некаталитическая гидратация оксида пропилена – условия
аналогичны условиям производства этиленоксида
CH3
CH
CH2
CH3
+
H2O
O
CH2
CH
OH
OH
Перспективные направления:
- Использование гетерогенных катализаторов ( например, частично нейтрализованная
амином сульфокислотная ионообменная смола)
100 – 1250С, 1,5 - 2,5 МПа, Н2О : ОП = (2÷2,5) : 1
- Разработка высокоселективного способа гидратации при низком соотношении вода : оксид
пропилена – проведение гидратации оксида пропилена в присутствии диоксида углерода
1500С; 3 – 4 МПа; СО2 : ОП = (0,1÷0,5) : 1;
К = 100%, С = 95-97%
CH3
CH
CH2
+
H2O
+
CO2
O
Пропиленкарбонат
CH2
CH CH3
OH
OH
CH2
CH
O
O
C
O
CH3
182
183.
Вода с примесью ЭГМЭГ
ОЭ
Вода
(ЭГ)
7
1
ДЭГ
2
ОЭ
3
8
9
10
11
4
ПЭГ
5
6
Принципиальная технологическая схема производства этилен- и
пропиленгликолей некаталитической гидратацией соответствующих оксидов
1,2,3 – мерники-дозаторы; 4 – смеситель; 5 – теплообменник; 6 –подогреватель; 7 – реактор;
– сепаратор; 9,10,11 – ректификационные колонны
8
183
184.
II. ГЛИЦЕРИННаправления использования: производство ВВ, алкидных смол, полиуретанов,
акролеина; компонент антифризов, эмульгаторов, смазок, клеев, косметической,
парфюмерной и пищевой продукции.
1. Получение глицерина омылением пищевых жиров
CH2 O H
CH2 OOCR
CH
H2O
OOCR
CH
CH2 OOCR
OH
+
3 RCOOH
CH2 O H
2. Хлоргидринные способы
А)
CH2
CH2
CH
CH3
CH CH2 Cl
CH2
CH CH2 Cl
Cl
OH
CH2
CH CH2 Cl
OH
Cl
2 CH2
O
CH CH2 Cl
+
Cl2
+
CH2
5000С
Cl2
+
Са(ОН)2
H Cl
Хлористый аллил
H2O
CH2
30-400С
Na2CO3
+
+
H Cl
CH2
CH CH2 Cl
Cl
OH
CH2
CH CH2 Cl
OH
Cl
1,3 – дихлорпропиленгидрин-2
1,2 – дихлорпропиленгидрин-3
CH CH2 Cl
O
+
CH CH2 Cl
3 H2O
Эпихлоргидрин
2 CH2
CH CH2
OH
OH OH
+
2 NaCl
+
CO2
184
185.
Б) CH2CH2
CH
CH
CH2
CH
OH
Cl
CH2
CH
OH
OH
CH2 Cl
CH2 O H
CH2Cl
CH2Cl
H2O
NaOH
150-1600C
+
Cl2
+ NaOH
CH2
+
CH
CH2 O H
H2O
CH2
CH
OH
Cl
CH2
CH
OH
OH
CH2
CH
CH2
OH
OH
ОН
O
+
CH2Cl
CH2Cl
NaCl
Недостатки:
Многостадийность;
Расход СI2 составляет 2,5 т/т глицерина
Много побочных неиспользуемых продуктов и отходов
Большое количество загрязненных (соли, хлор, органика) сточных вод
185
186.
3. Бесхлорные способыА)
Б)
+
CH2
CH
CH3
CH2
CH
CHO
(CH3)CHOH
2
Zn-Mg 350-4500C
CH2
CH
CH2O H
+
CH
CH2
CH3
O
CH2
В) CH2
CH
CH
O2
CH2
H2O2
CH2O H
+
+
CHO
CH2
2700C
H2O2
CH2
CH
+
H2O
CH2O H
CH CH2
OH OH
CH2O H
50-1000C CH
2
H3WO4
OH
H2O2
CHO
CH
50-1000C CH
2
H3WO4
OH
Li3PO4
230 -
CH
CH CH2
OH OH
CH2
CH
CHO
O
CH2
CH
CHO
+
H2O
O
CH2
CH
OH
OH
CHO
+
H2
CH2
CH
OH
OH
CH2
CH
OH
OH OH
CHO
CH2
186
187.
Лекция 17187
188.
III. НЕОПЕНТИЛОВЫЕ СПИРТЫНаправления использования: заменители глицерина, производство
алкидных смол, полимеров, пластификаторов,синтетических смазочных масел
Пентаэритрит (тетраметилолметан) (tпл =260,50С)
CH3CHO
+ CH2 O
Ca(OH)2
HOCH2CH2CHO
+ CH2 O
2-метилолэтаналь
Ca(OH)2
HOCH2 CH
CHO
+ CH2 O
Ca(OH)2
HOCH2
2,2-диметилолэтаналь
HOCH2
HOCH2
C
HOCH2
CHO
HOCH2
+ CH2 O
2,2,2- триметилолэтаналь
CH2O H
C
HOCH2
+ 0,5Ca(OH)2
+
30- 500С (водный р-р),
СН2О : СН3СНО = 5 : 1
время р-ции 0,5 -1,5 ч
В = 50 – 70%
0,5 Ca(HCOO)2
HOCH2
тетраметилолметан
Метриол (1,1,1 – триметилолэтан) (tпл = 2000С)
HOCH2
CH3
CH3CH2CHO
+
2 CH2 O
NaOH
HOCH2 C
HOCH2
CHO
+ CH2 O
NaOH
2,2-бис-(гидрокси-метил) пропаналь
HOCH2 C
CH3
+ Na(HCOO)
HOCH2
1,1,1 – триметилол-этан,
1,1,1 – тригидроксиметил- этан
188
189.
Этриол (1,1,1 – триметилолпропан) (tпл = 57-590С)CH2CH3
CH3 CH2 CH2CHO
+
2 CH2 O
NaOH
HOCH2 C
CHO
HOCH2
HOCH2
+ CH2 O
NaOH
HOCH2 C CH2CH3 + Na(HCOO)
HOCH2
Неопентиловый спирт (2,2 – диметил-пропандиол-1,3) (tпл = 120 – 1300С)
CHO
CH3 CHCHO
CH3
+
CH2 O
NaOH
CH3 C
CH3
HOCH2
2-гидроксиметил-2,2-диметилэтаналь
+ CH2 O
NaOH
HOCH2
CH3
C
CH3
+
Na(HCOO)
HOCH2
2,2- диметилол-пропан,
2,2 – диметил-пропандиол-1,3
189
190.
Водный р-р формиата Na + р-льР-ль
этилацетат
+ ИПС
Формальдегид
2
5
Пропионовый
альдегид
NaOH +
вода
6
7
Воздух
30-500С
17-200С
1
3
4
Метриол
Куб.
ост
Водный
р-р
формиата
Na
Принципиальная технологическая схема производства неопентиловых спиртов
1 – реактор; 2 – экстракционная колонна; 3 – кристаллизатор; 4 – фильтрующая центрифуга;
5 – сушилка; 6,7 – ректификационные колонны
190
191.
ПРОИЗВОДСТВО ЭТАНОЛАМИНОВНаправления использования: производство ПАВ, ингибиторов коррозии, абсорбенты,
растворители
NH3
+
CH2
CH2
H2O
O
HOCH2 CH2 NH2
+
CH2
CH2
HOCH2 CH2 NH2
МЭА
NH(CH2CH2OH)2
)
ДЭА
O
NH(CH2CH2OH)2
)
+
CH2
CH2
O
N (CH2CH2O H) 3
)
ТЭА
100 – 1300С; 7 – 10 МПа; катализатор – Н2О
NH3 : ОЭ = 15 : 1
МЭА – 78 – 79%
ДЭА – 16 – 17%
ТЭА – 4 – 5%
191
192.
Н2О рец.МЭА
1
2
3
4
ДЭА
5
ТЭА
6
Н2О
NH3
ОЭ
Принципиальная технологическая схема производства этаноламинов
1 – колонна – реактор; 2,3,4,5,6 – ректификационные колонны
192
193.
Алкиламины1. Гидроамидирование СЖК
Алкилгалогениды
1.
Радикальное галогенирование
2.
ВЖС + галогеноводород
193
194.
Производные пиридина1)
2-метил-5-этил пиридин
Паральдегид (тример ацетальдегида) + аммиак + ацетат аммония
194





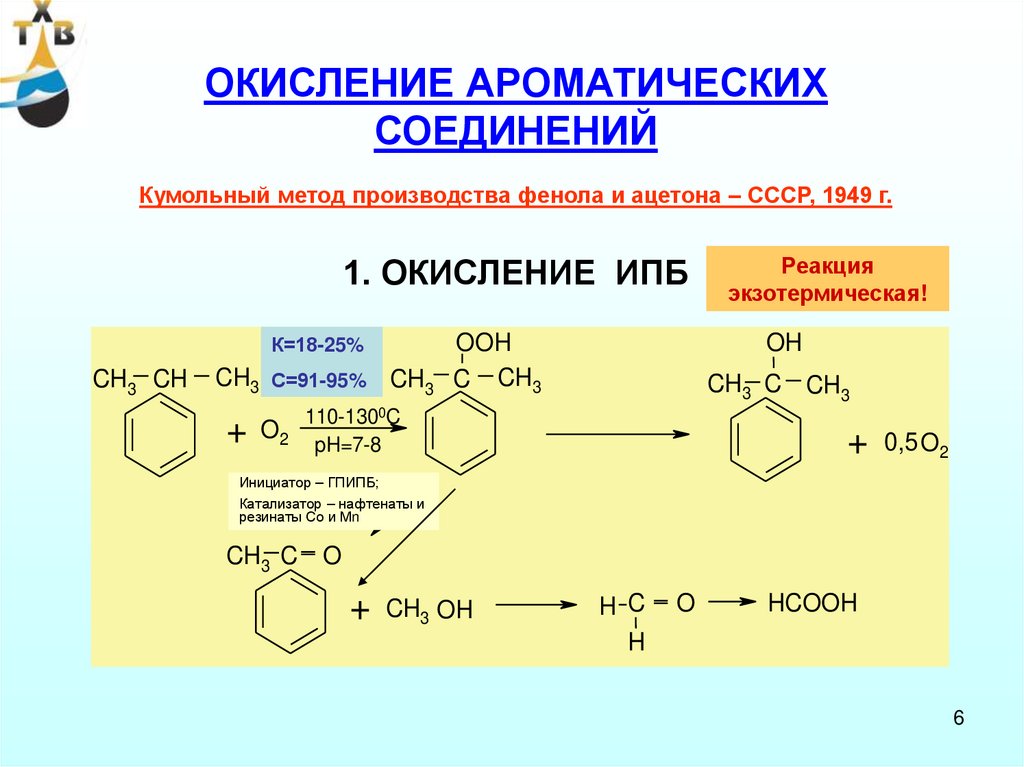



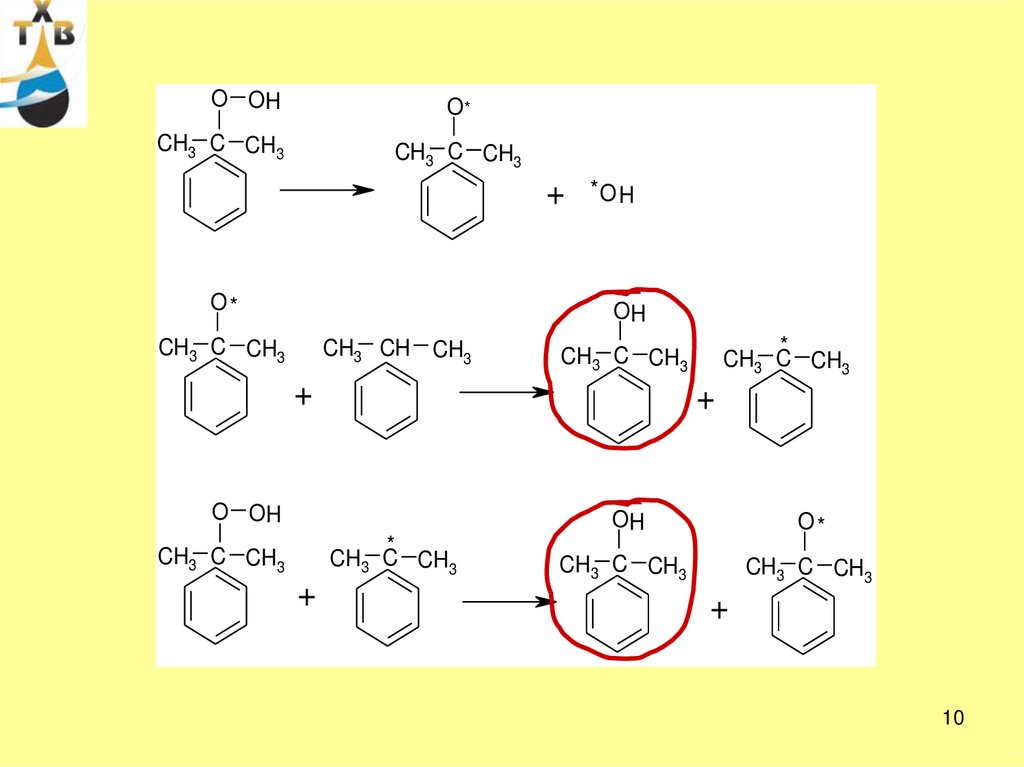
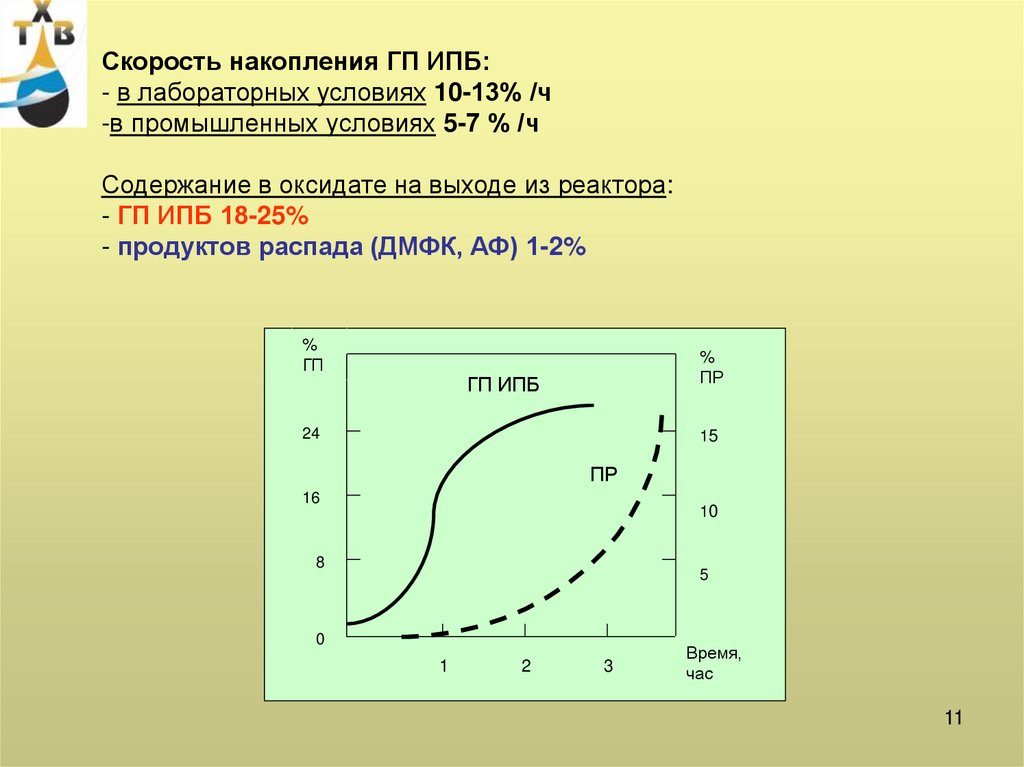
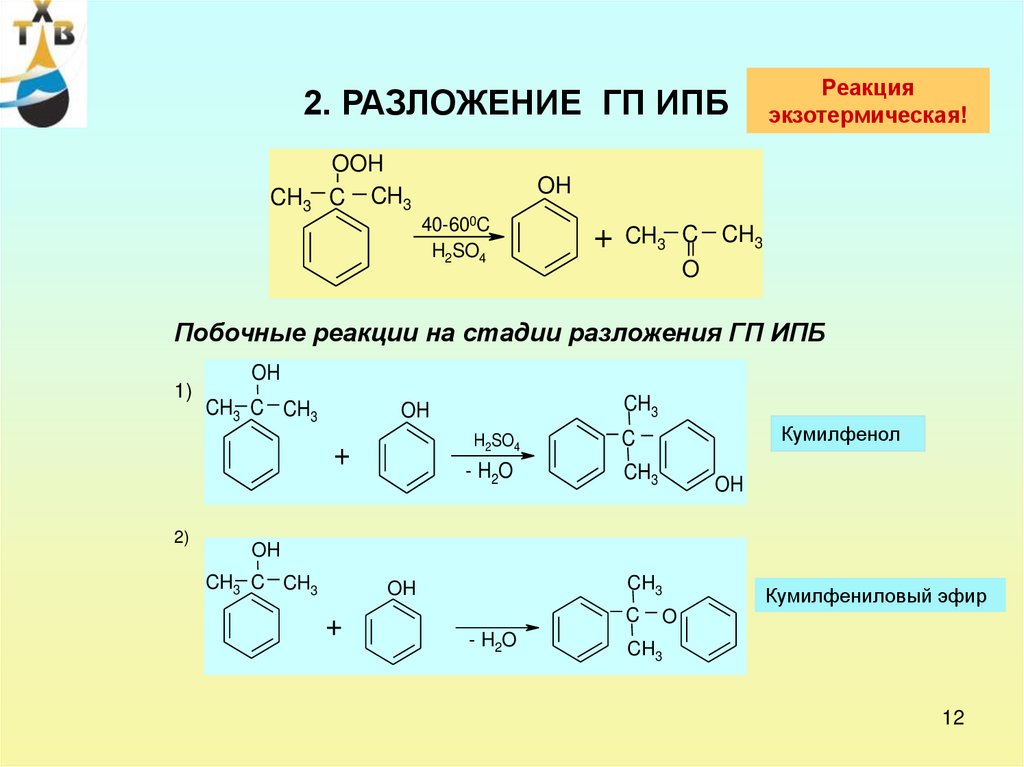
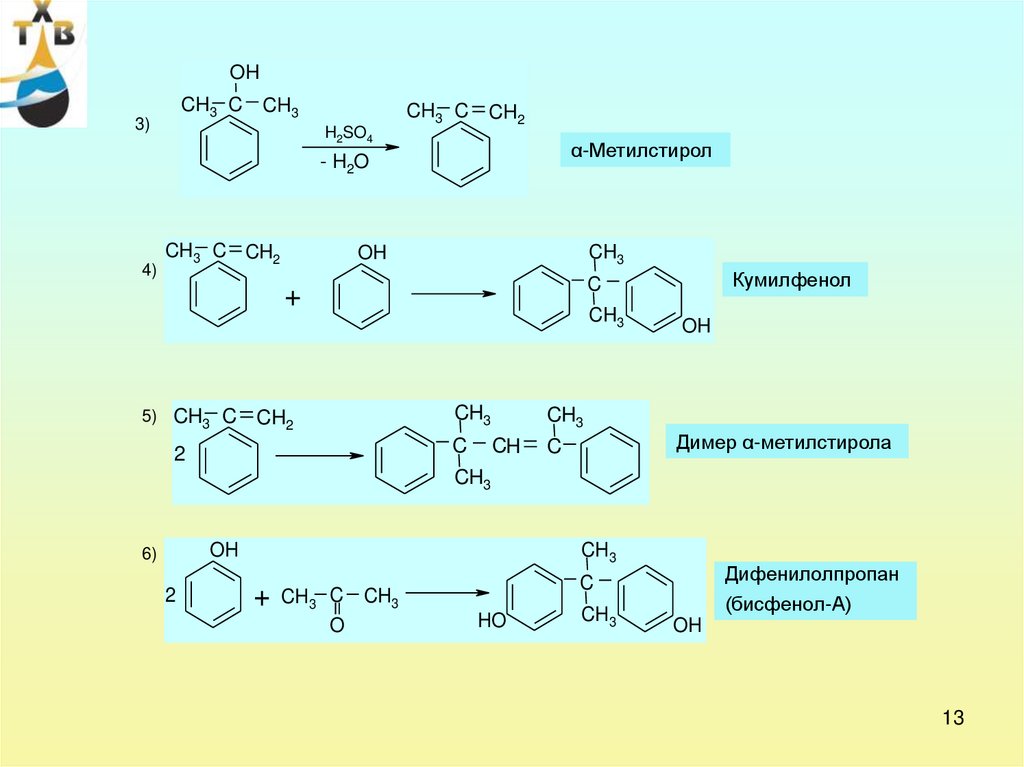


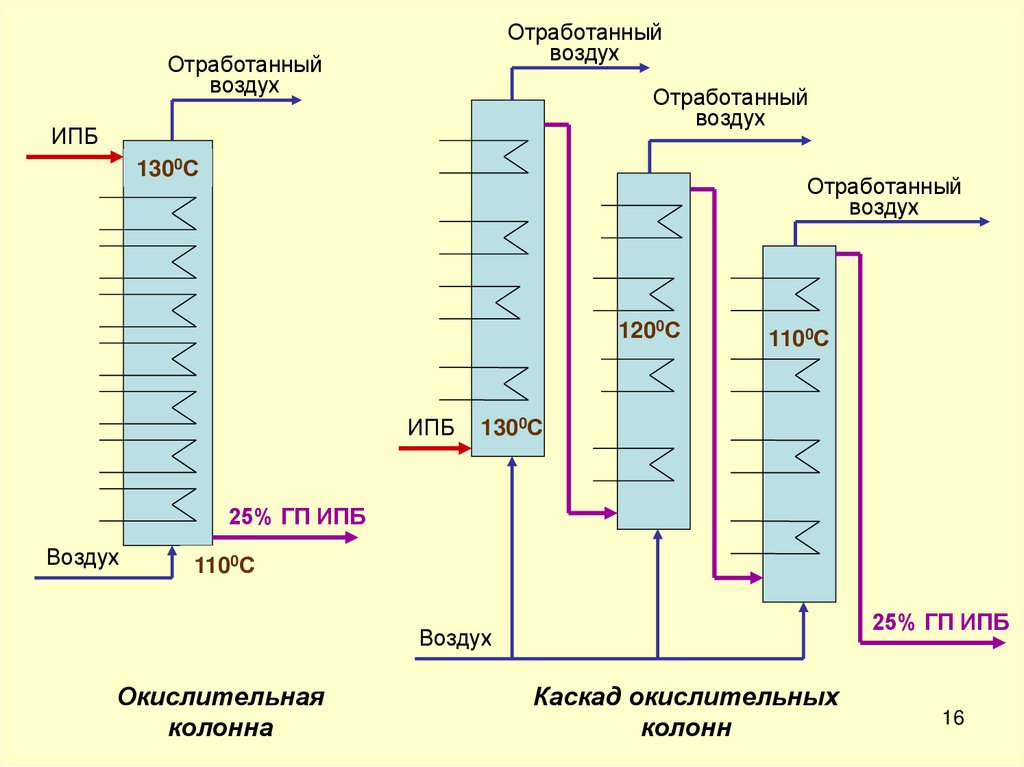
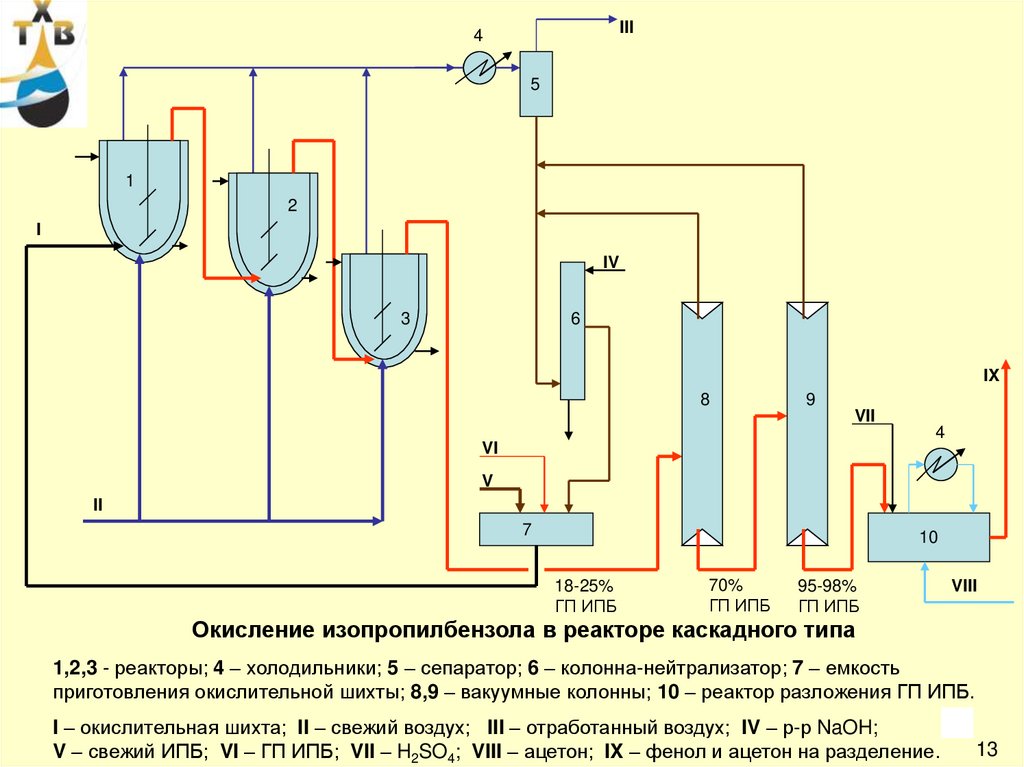






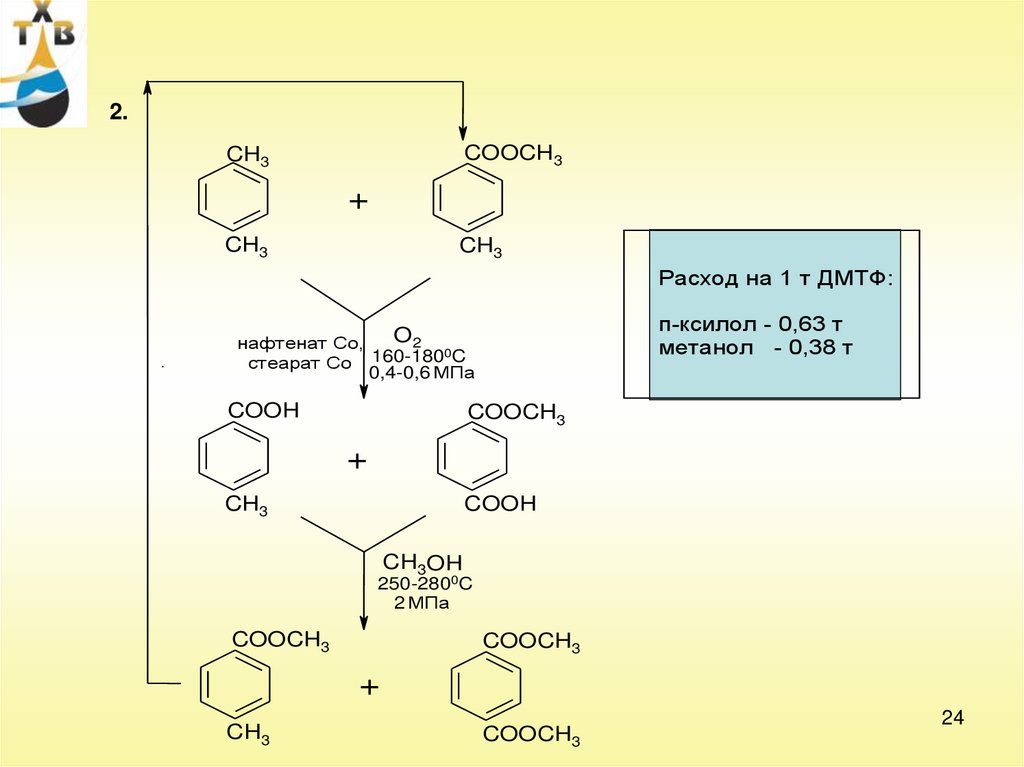
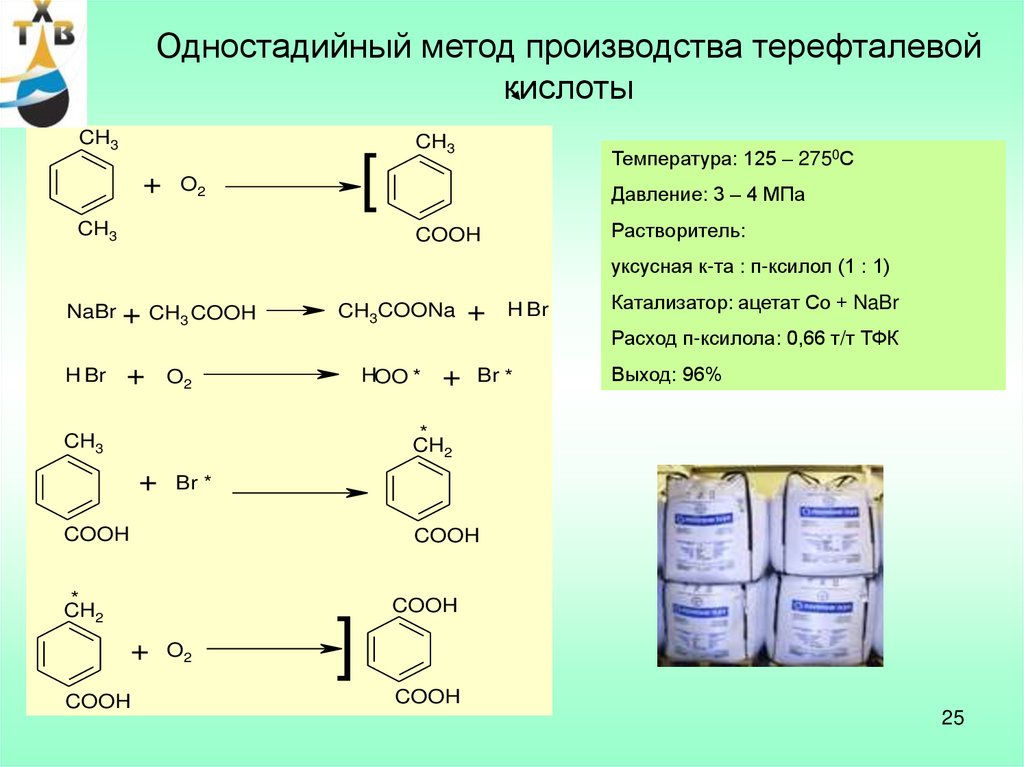
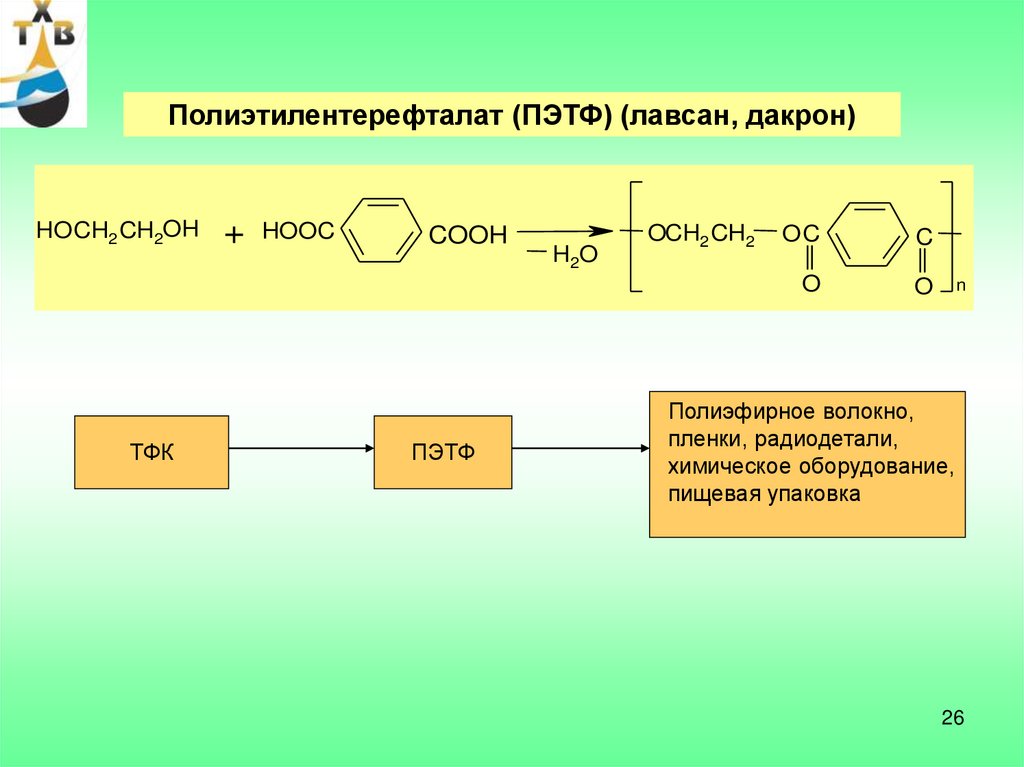








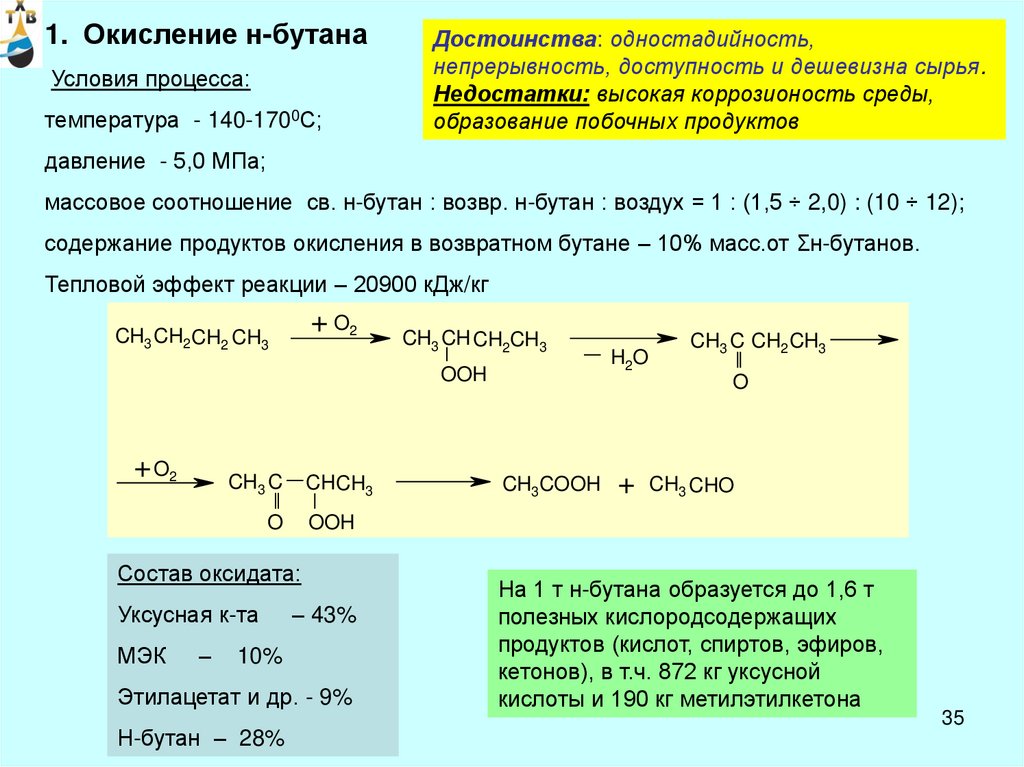


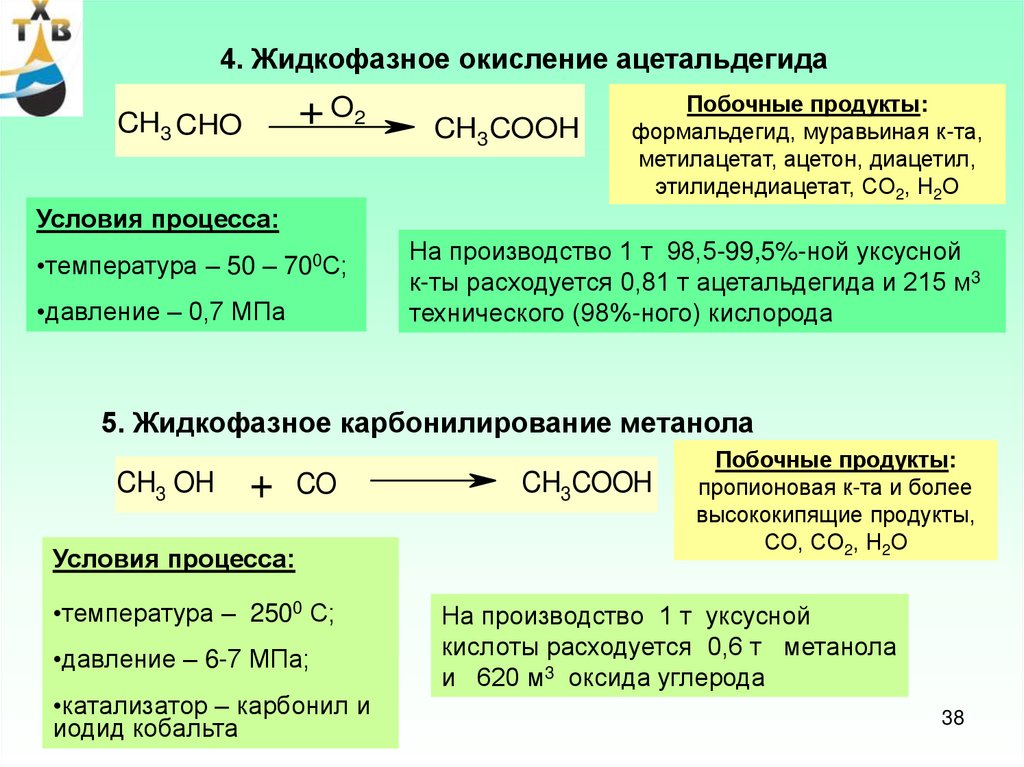
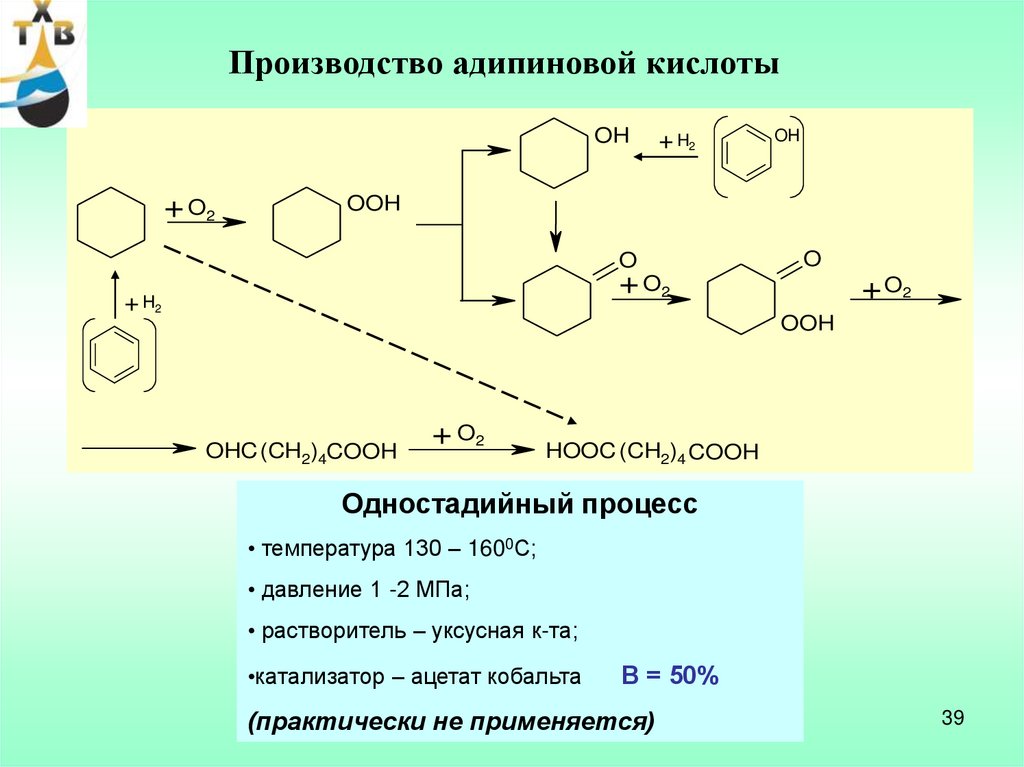



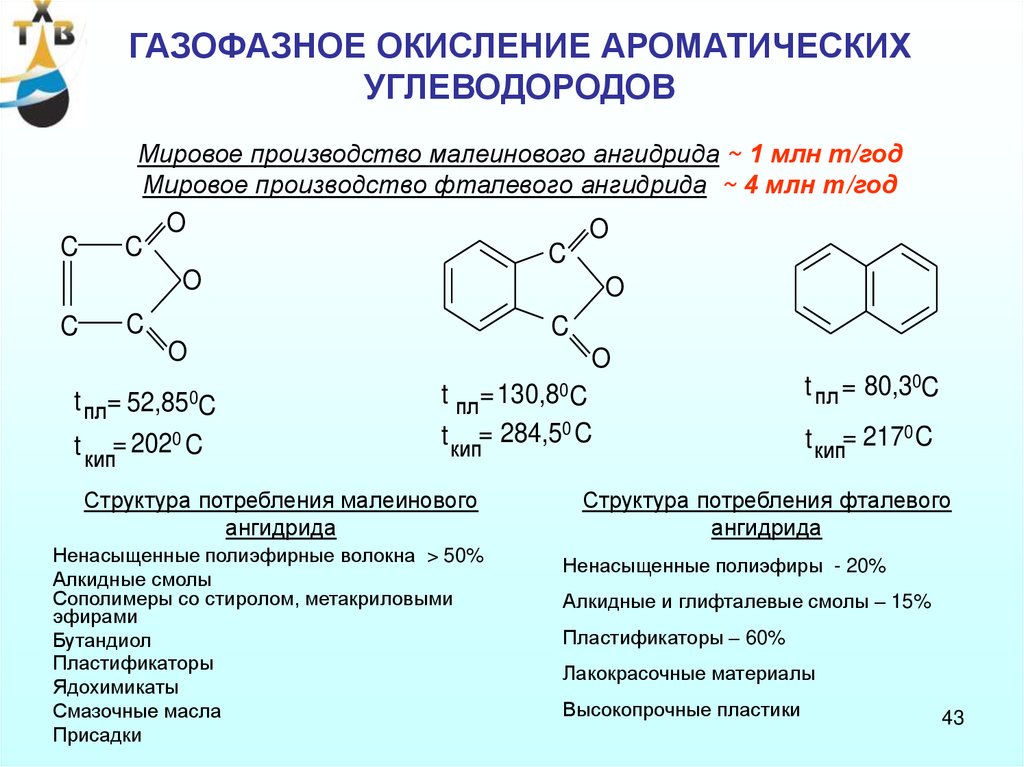
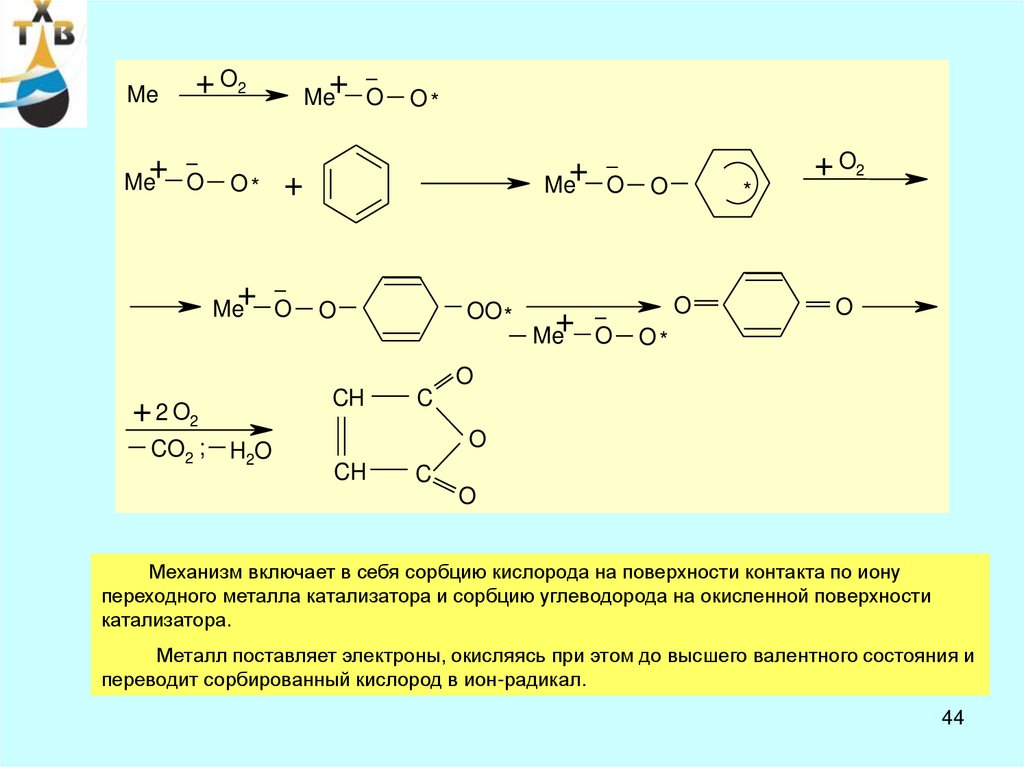


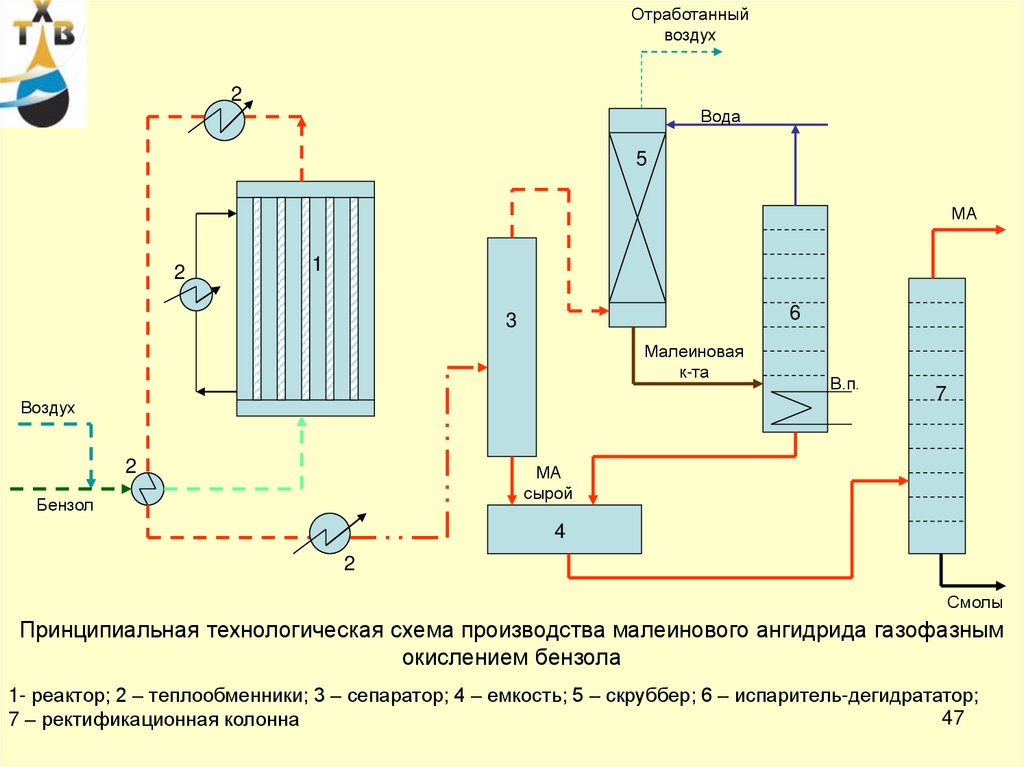
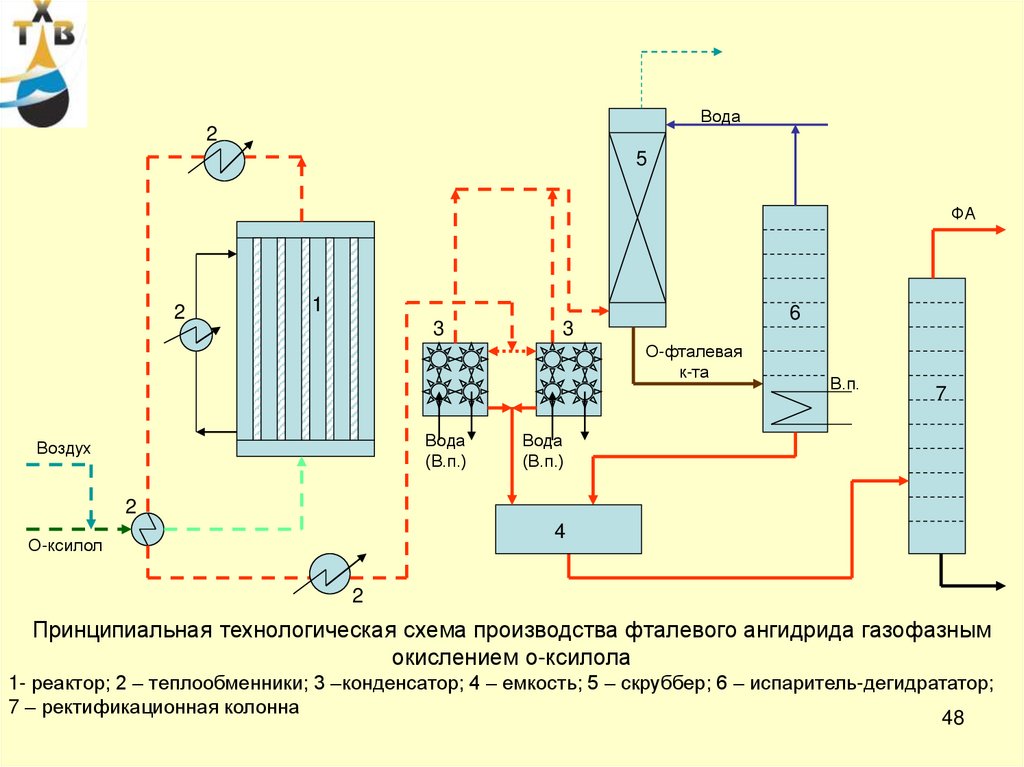



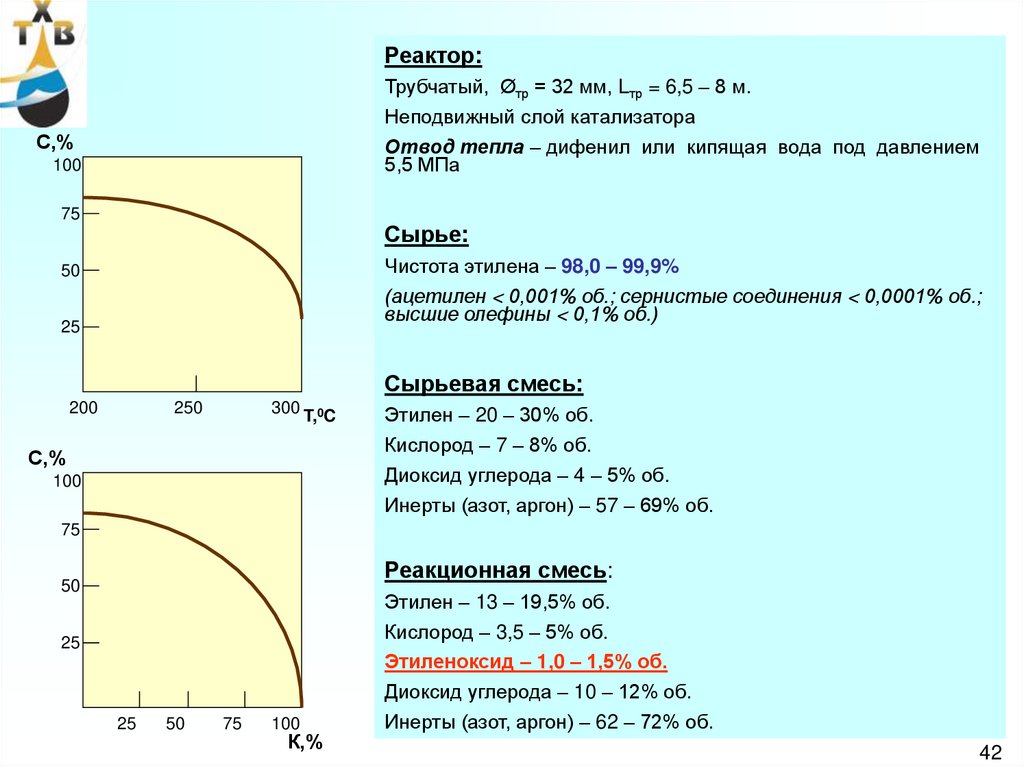




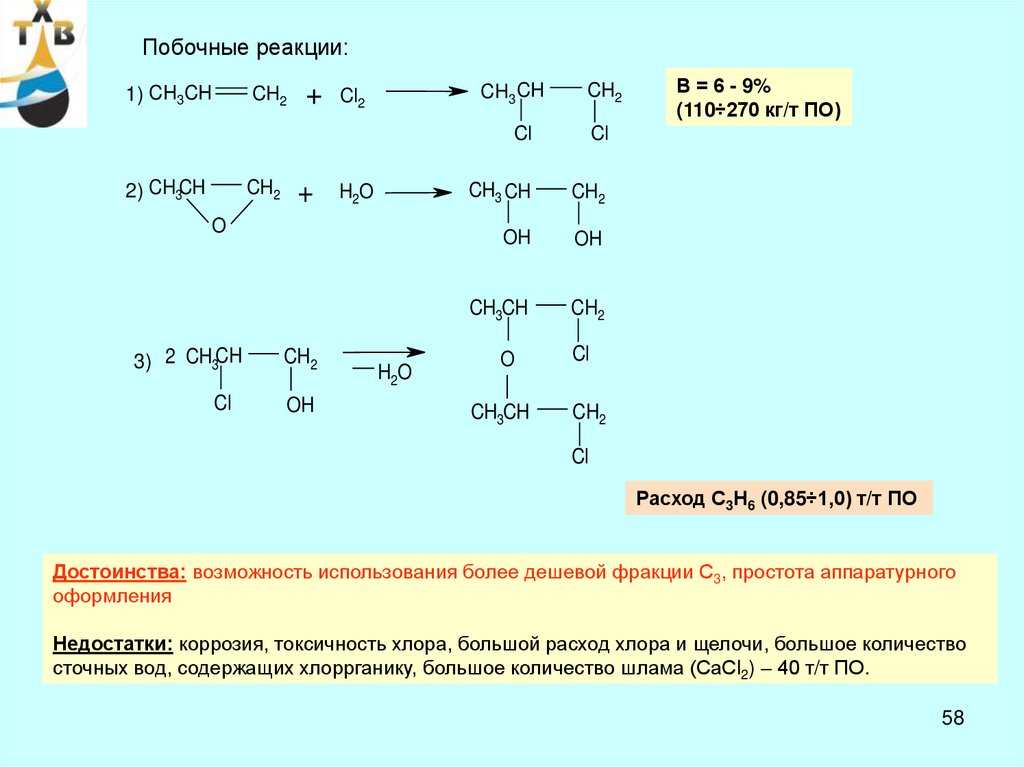

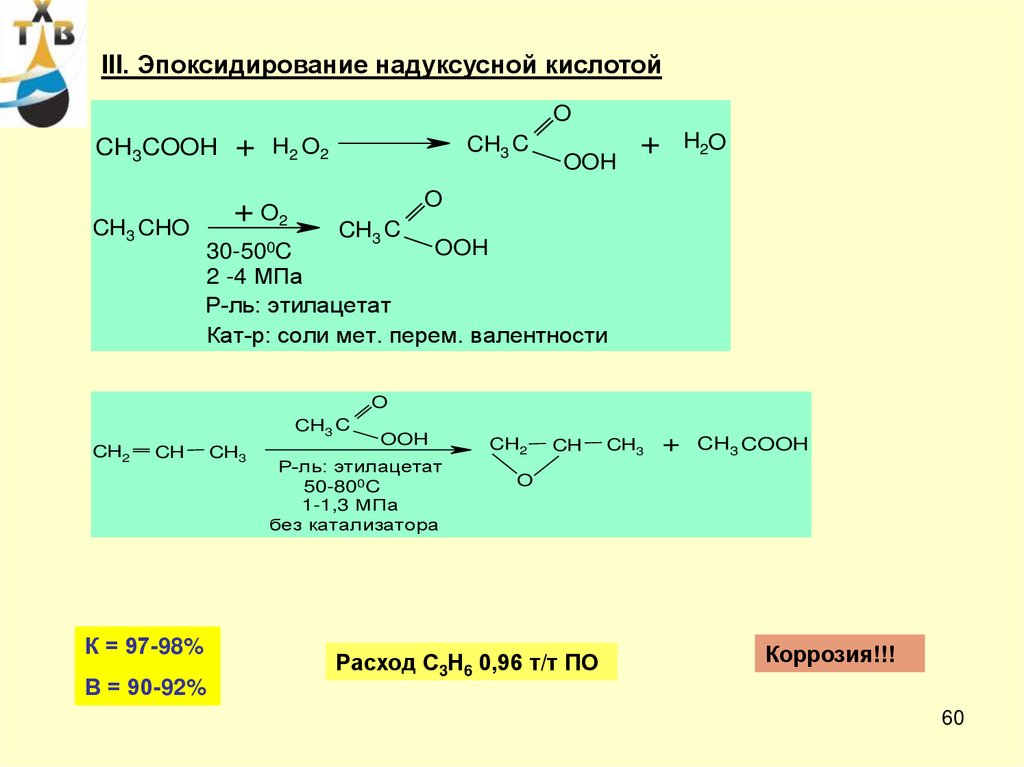




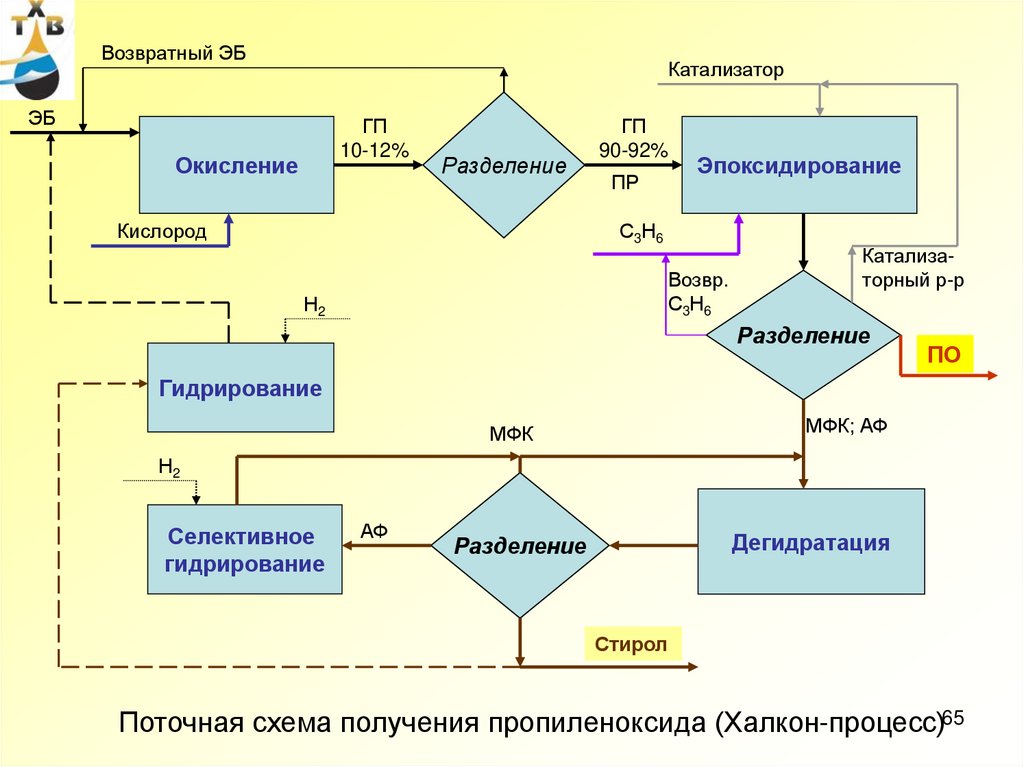

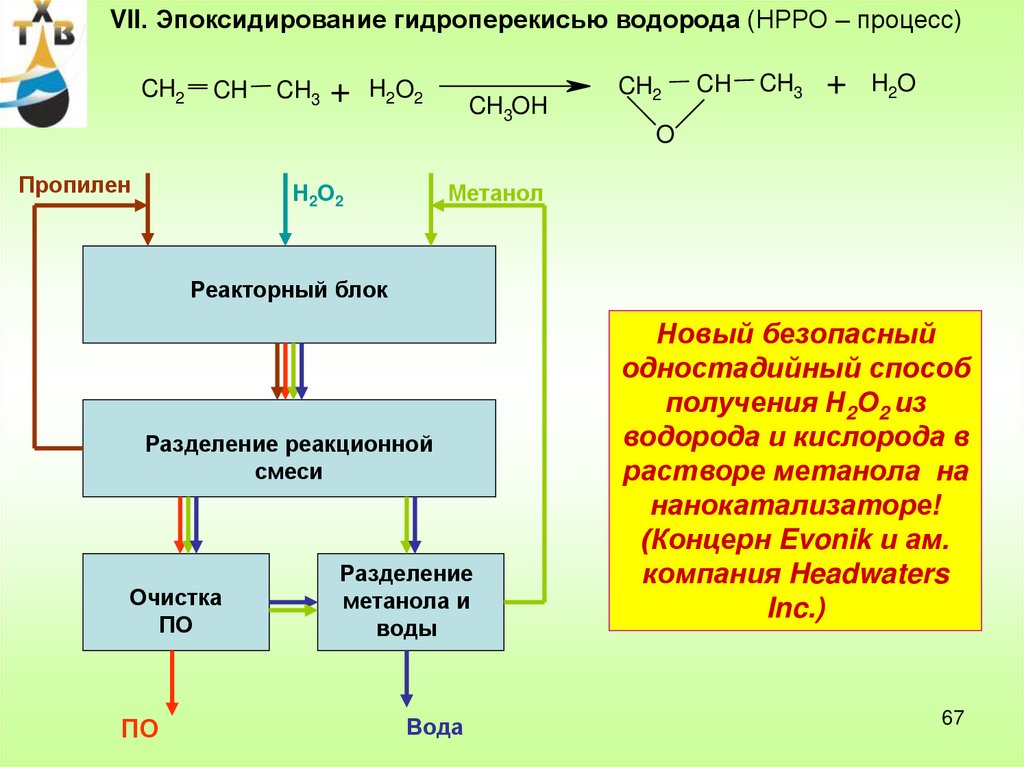


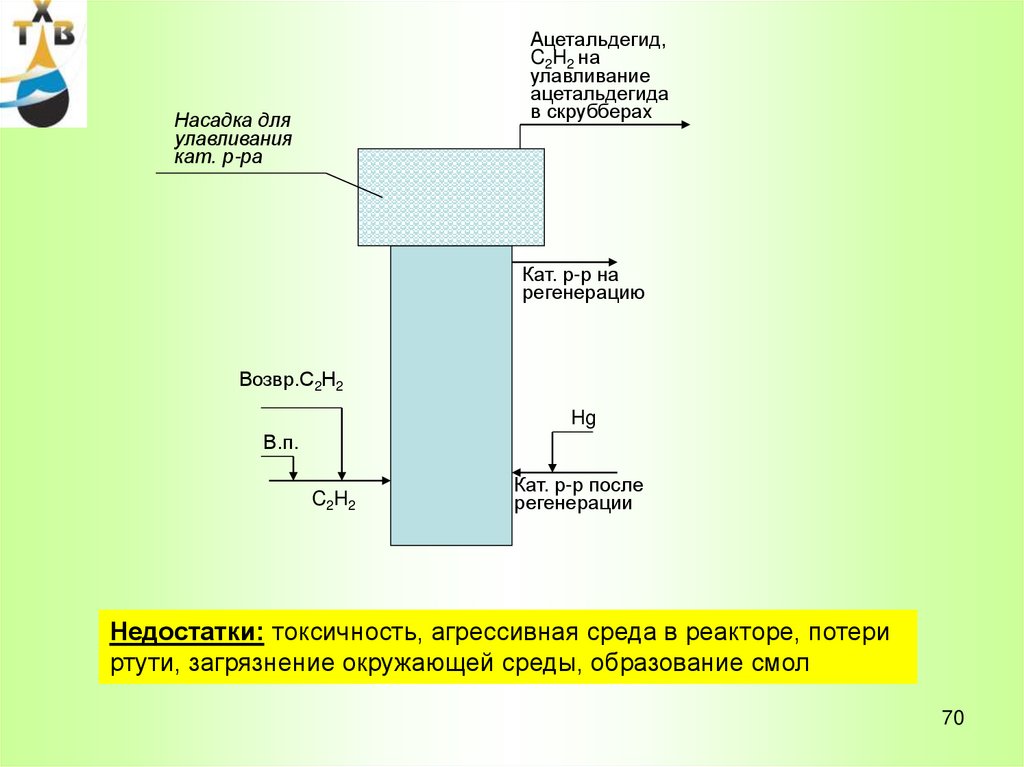
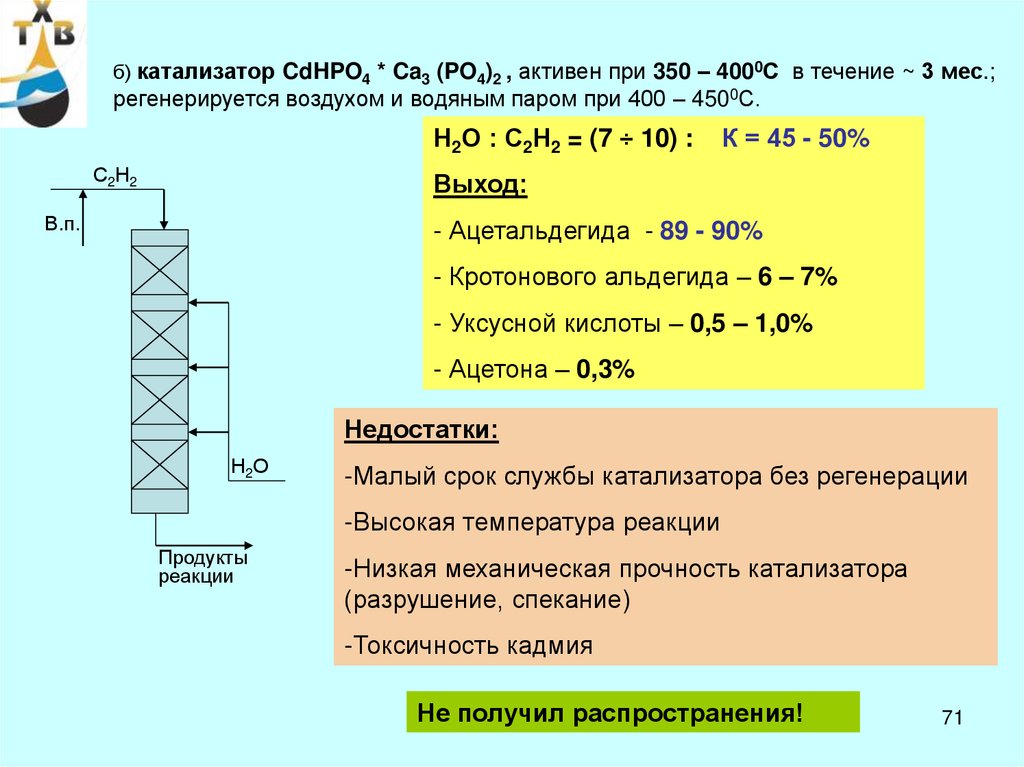

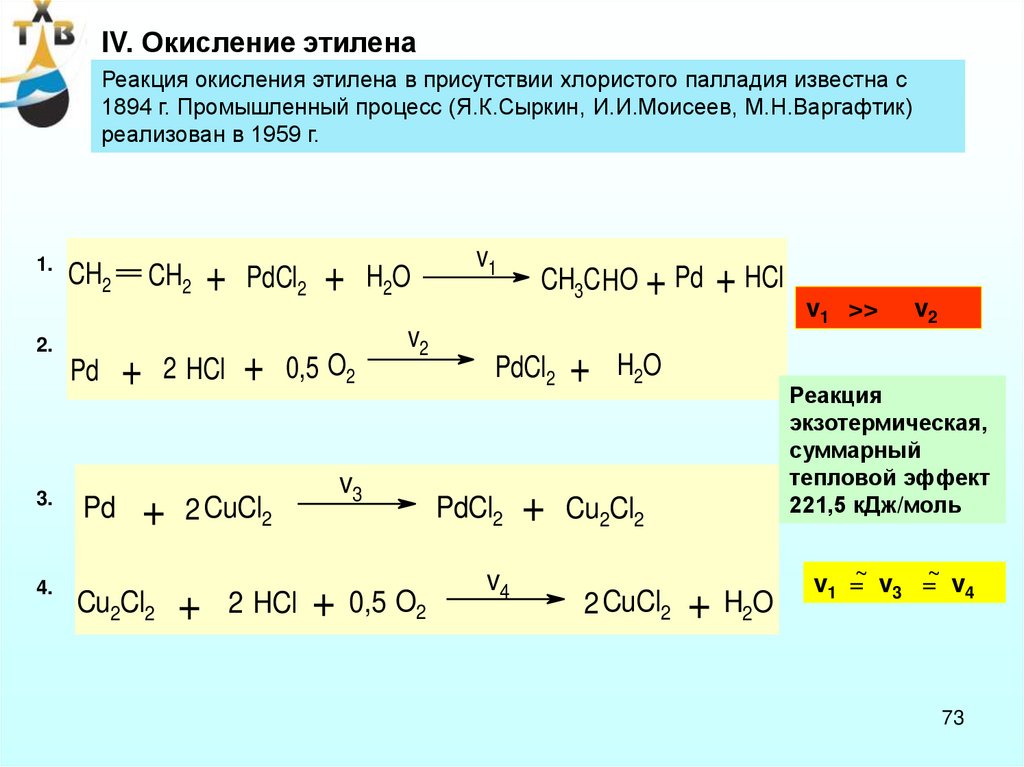




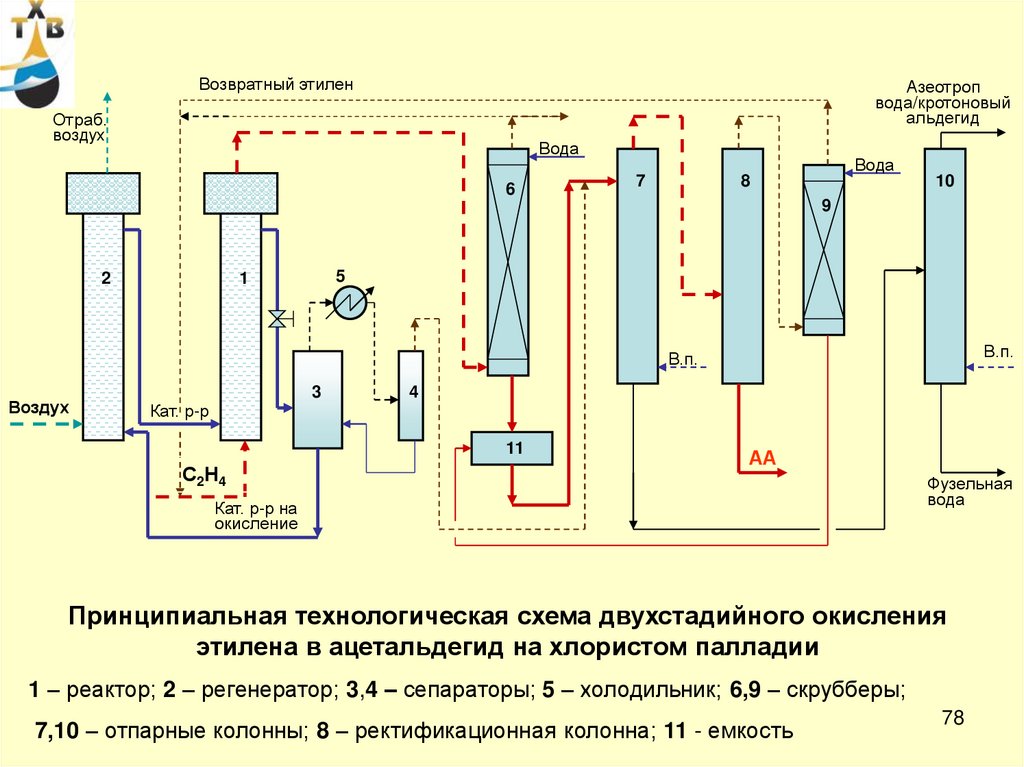


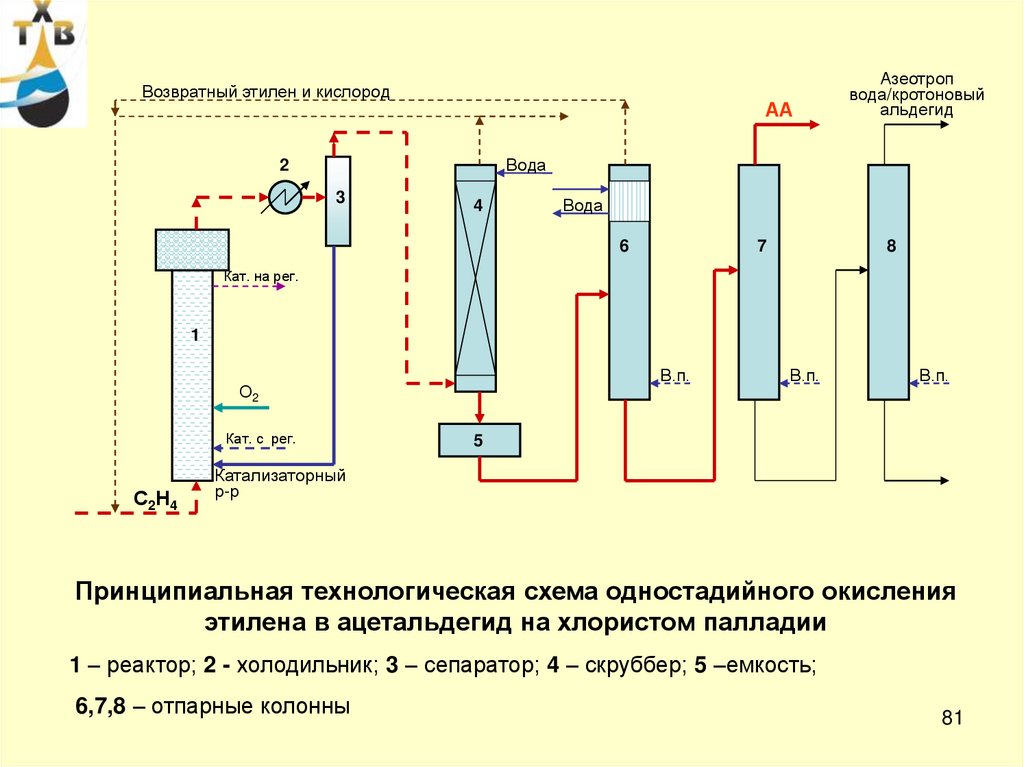


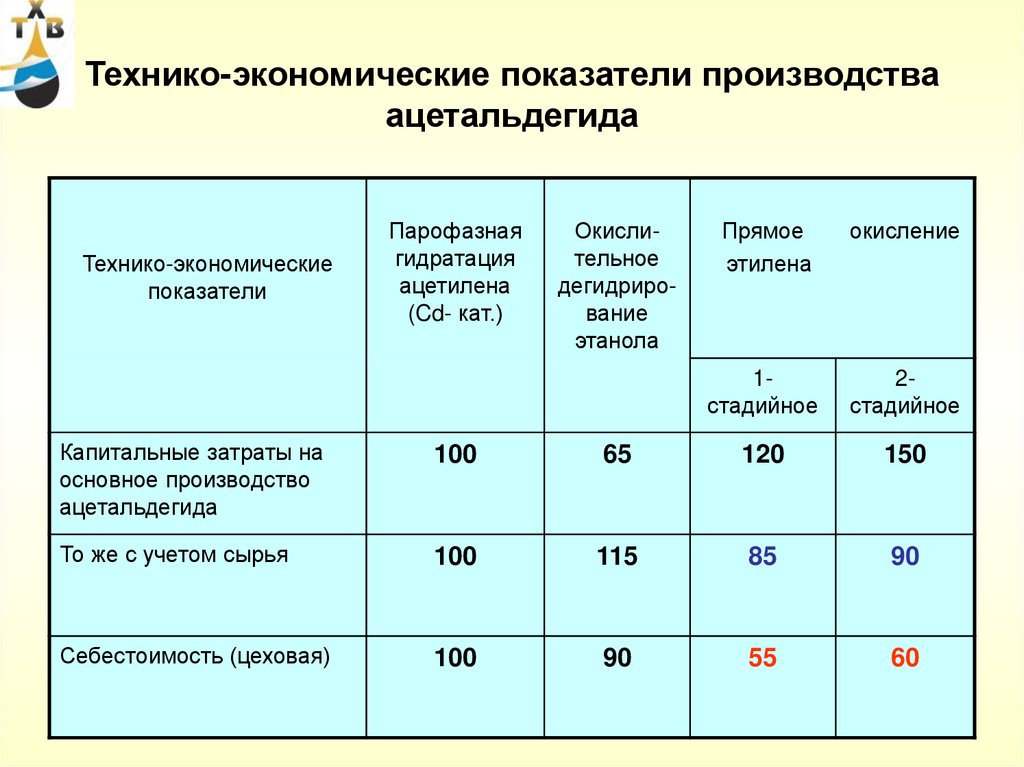
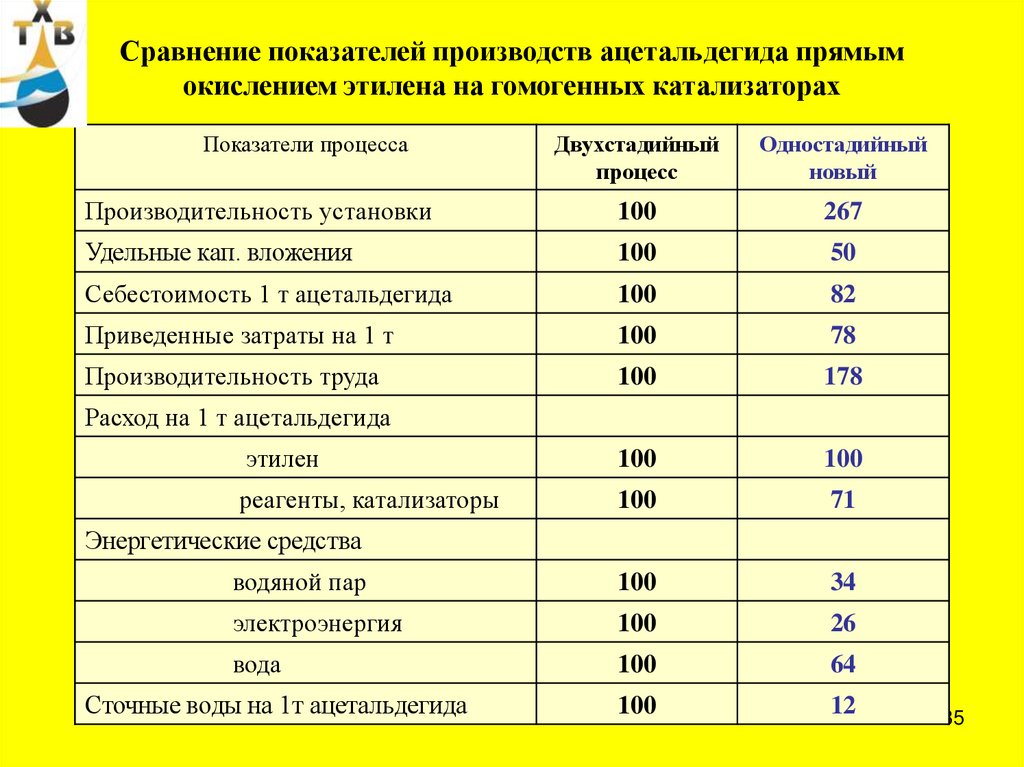
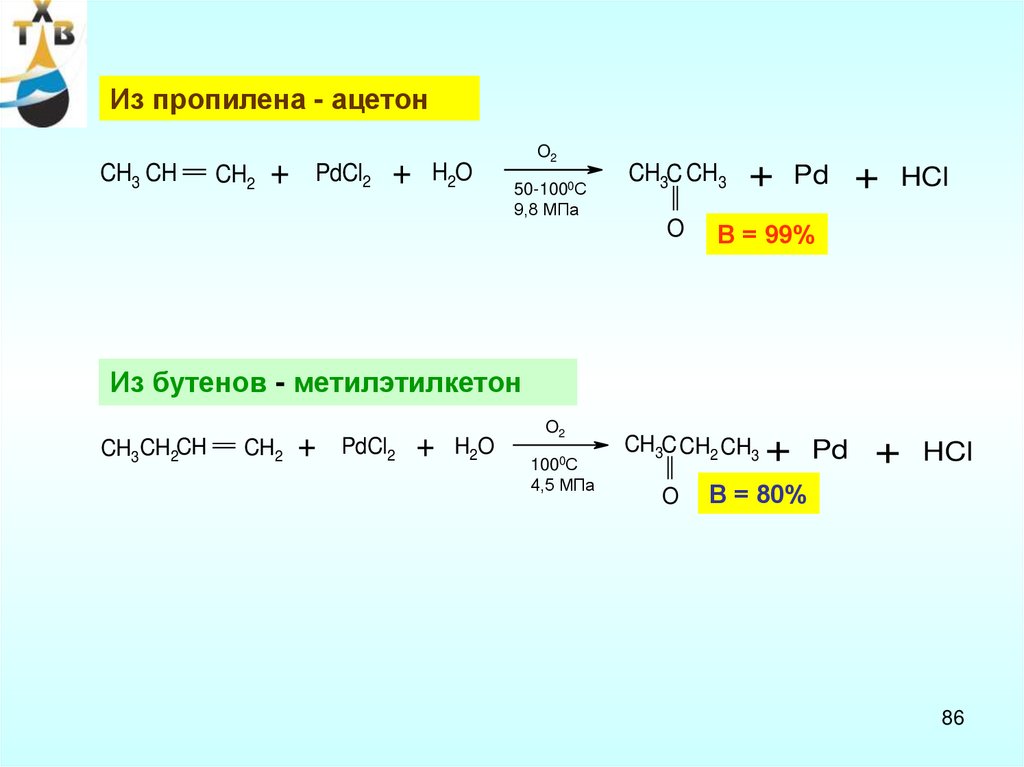




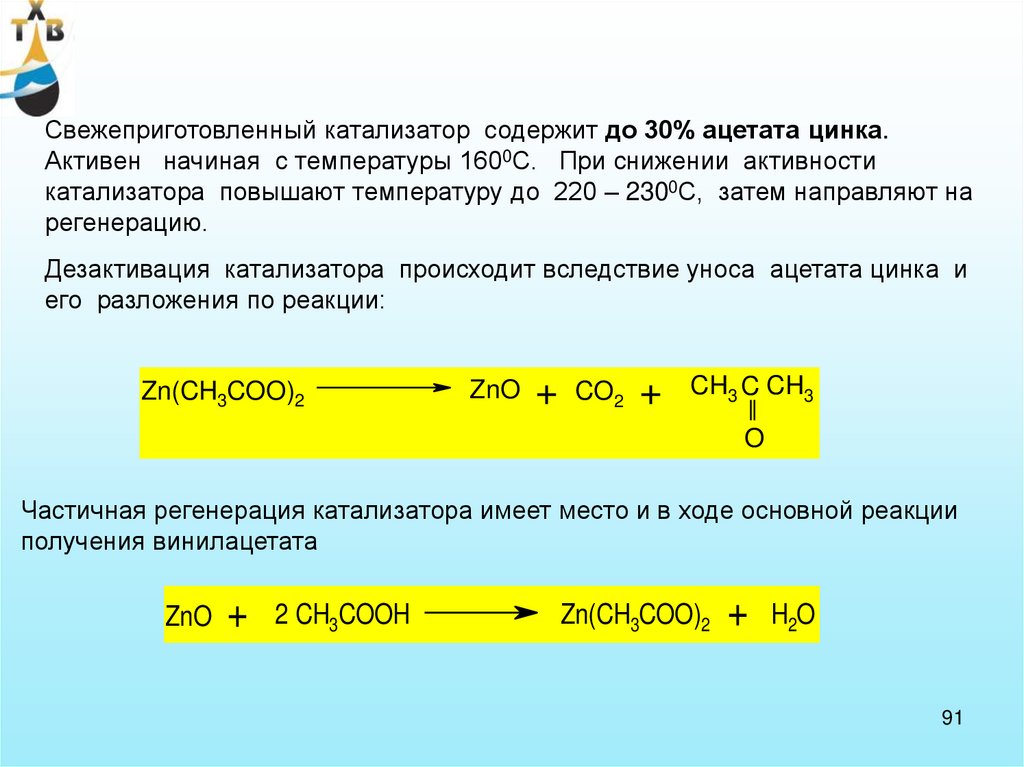

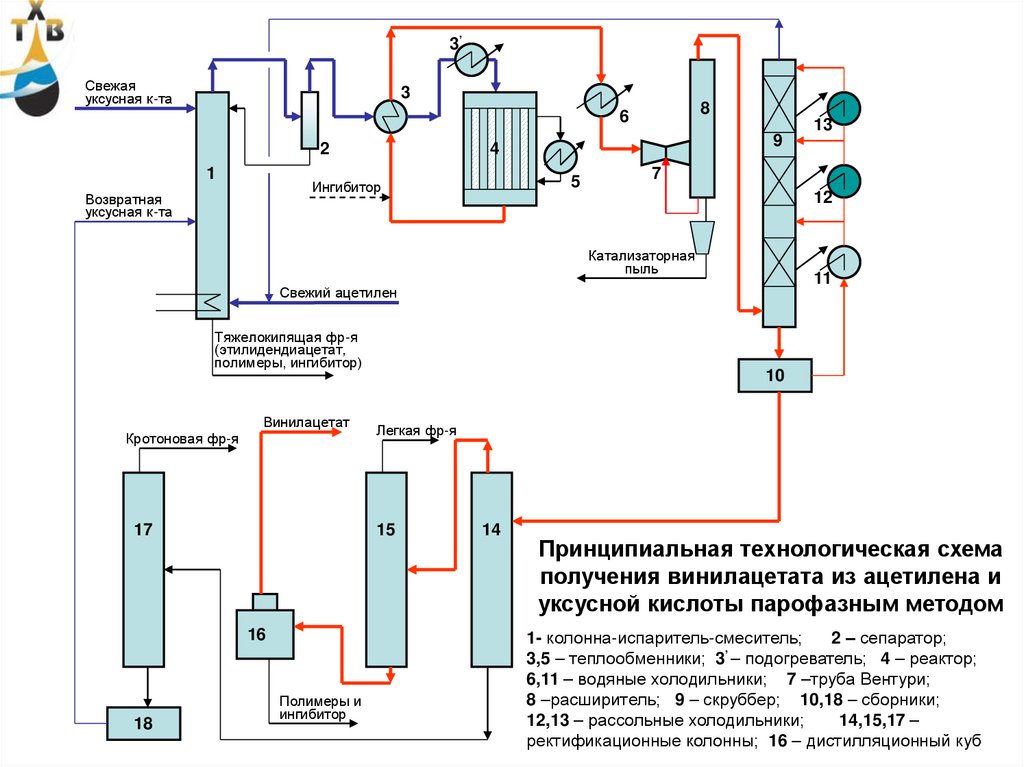



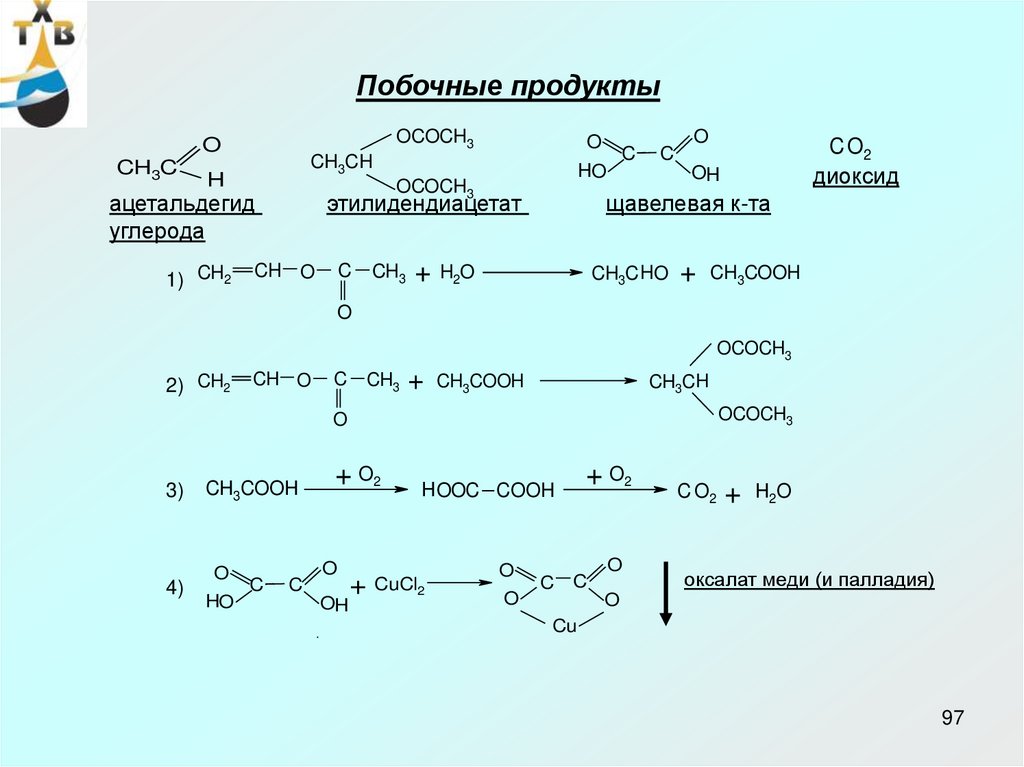

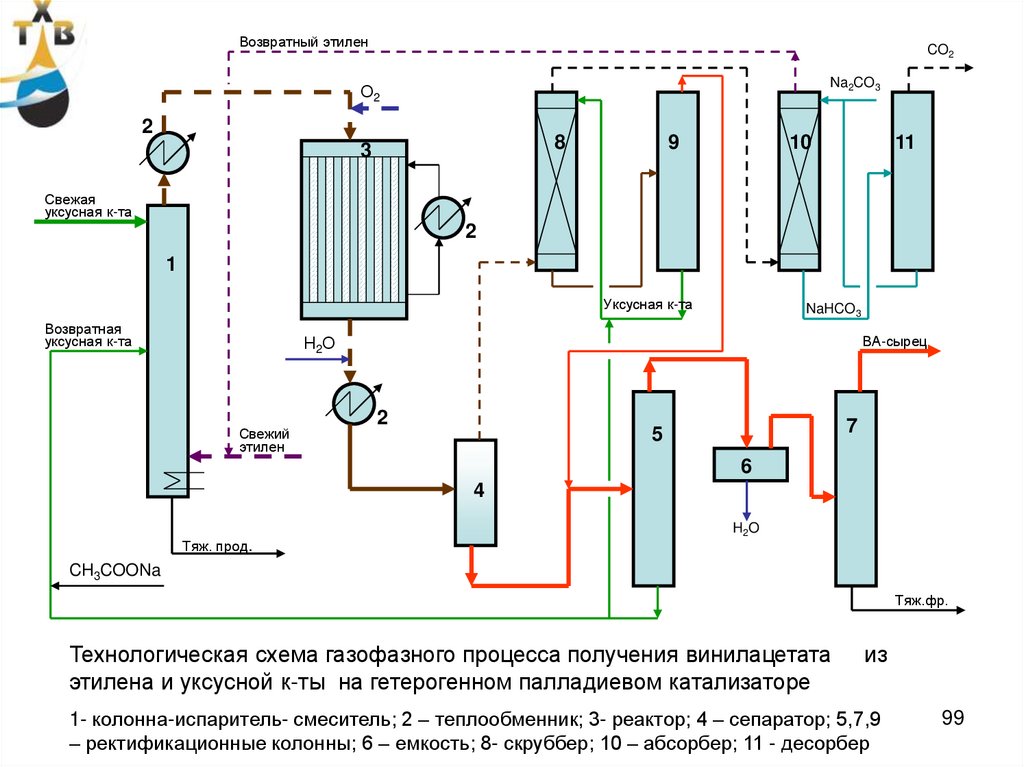



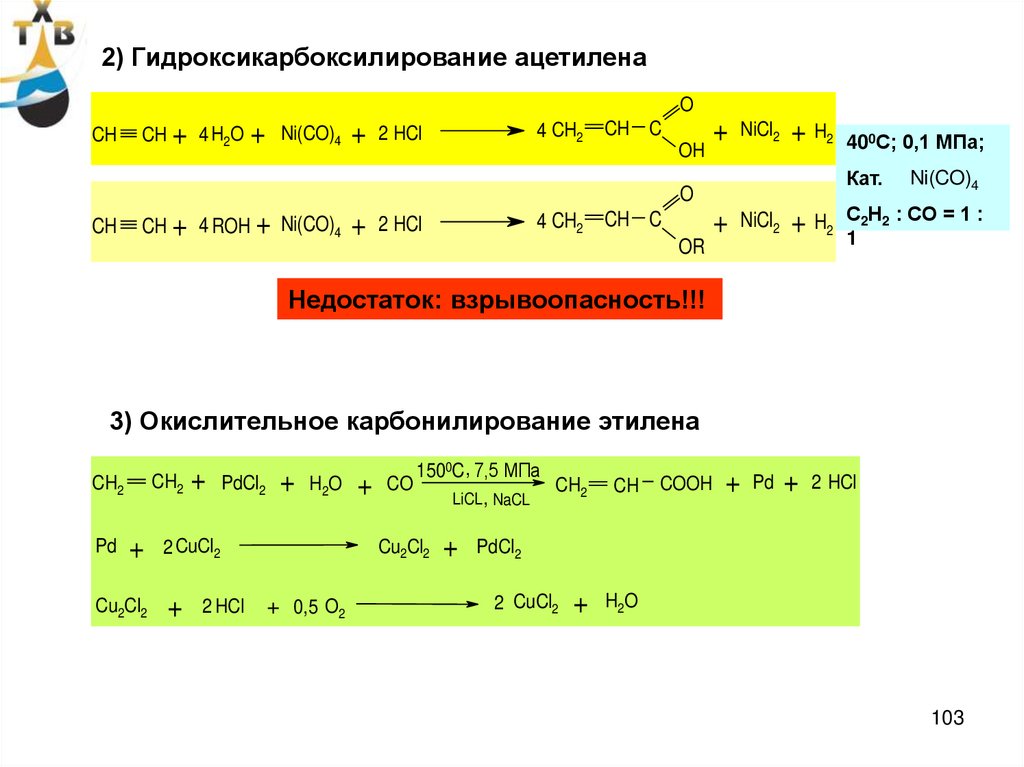




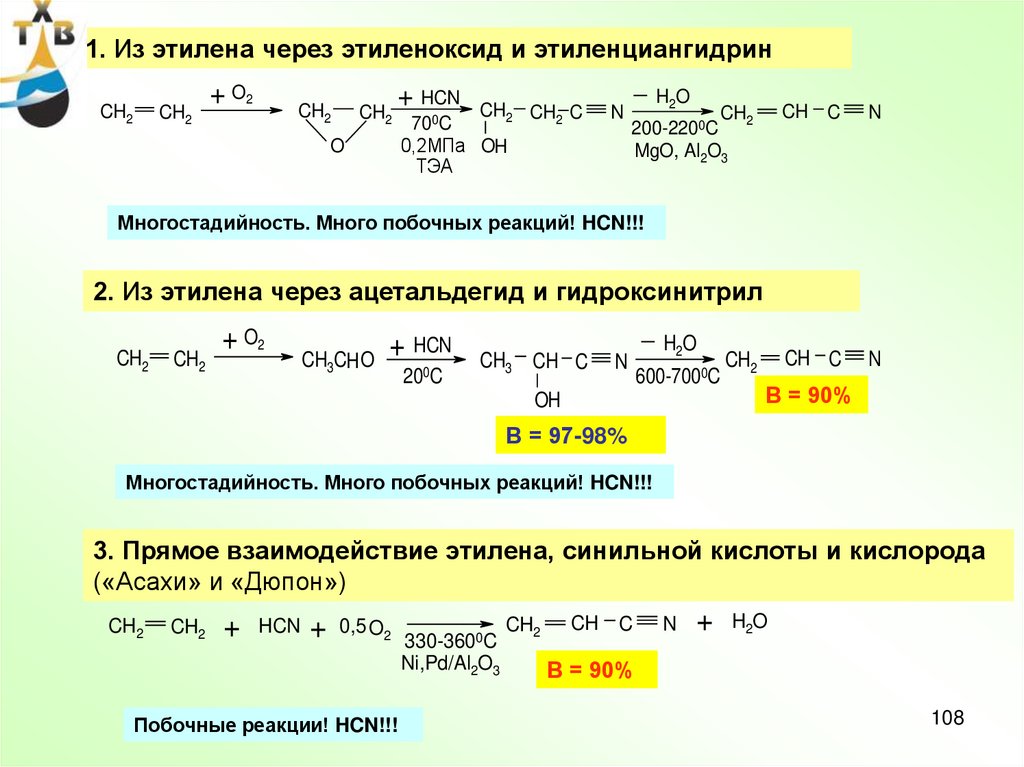



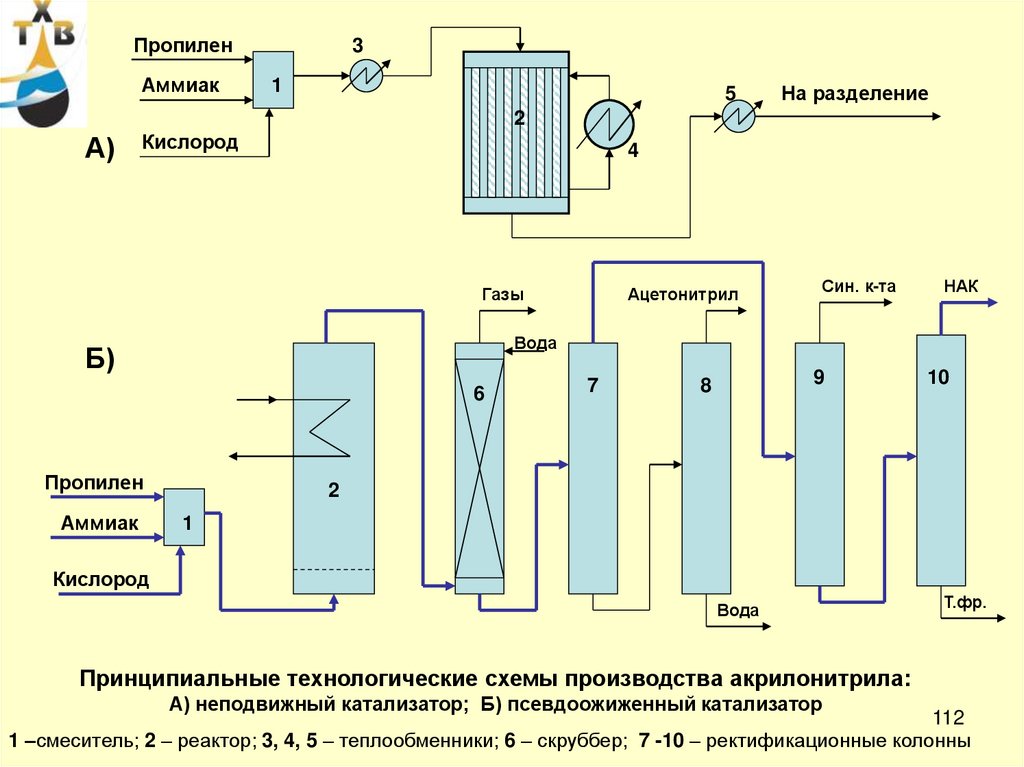






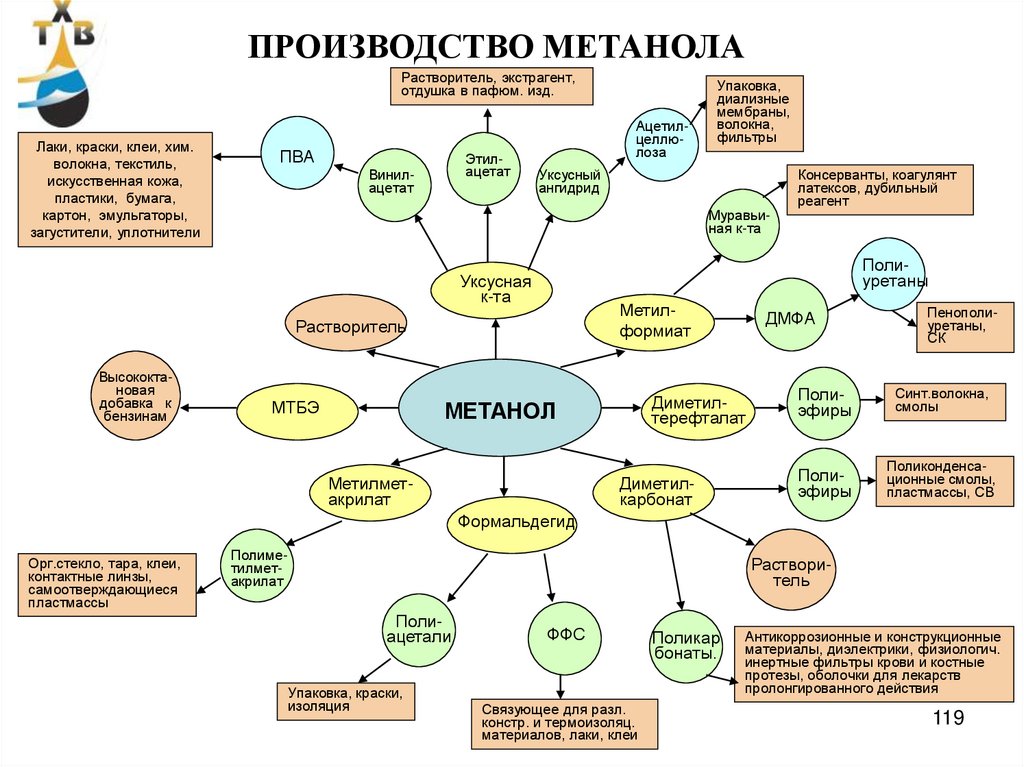

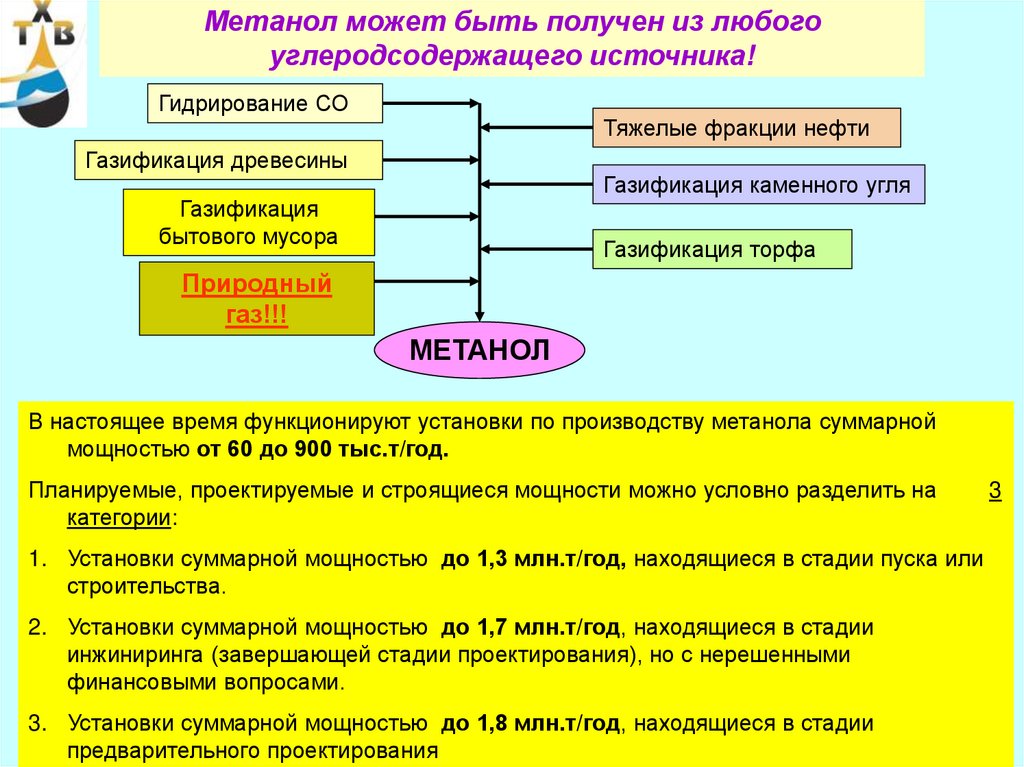

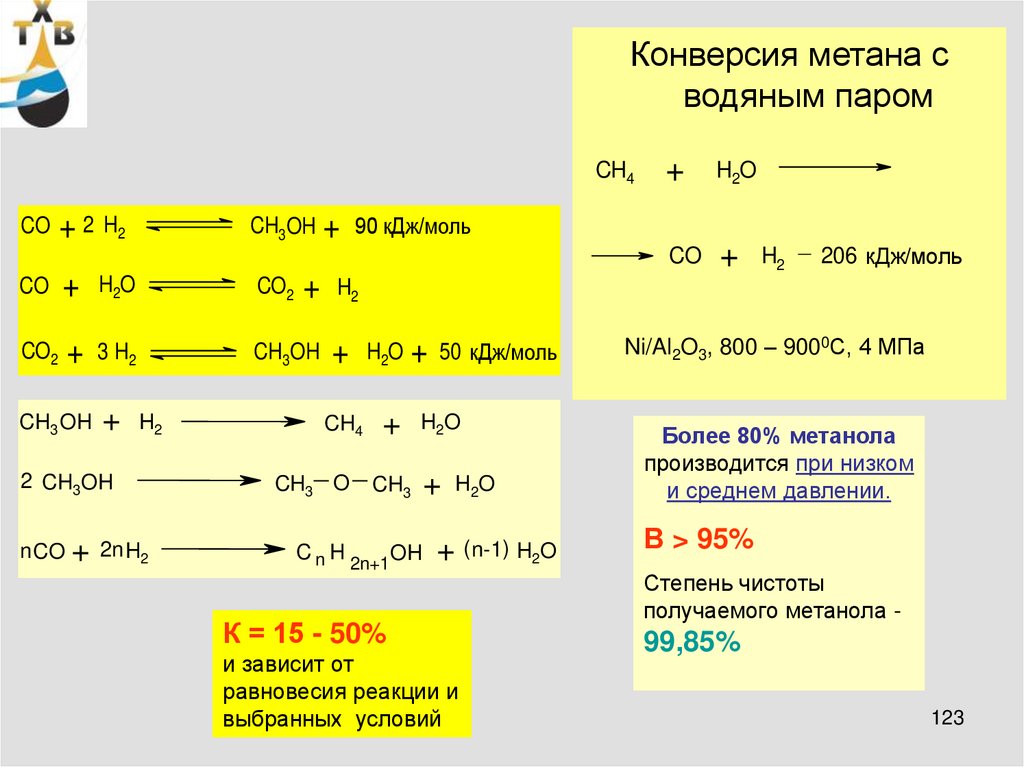

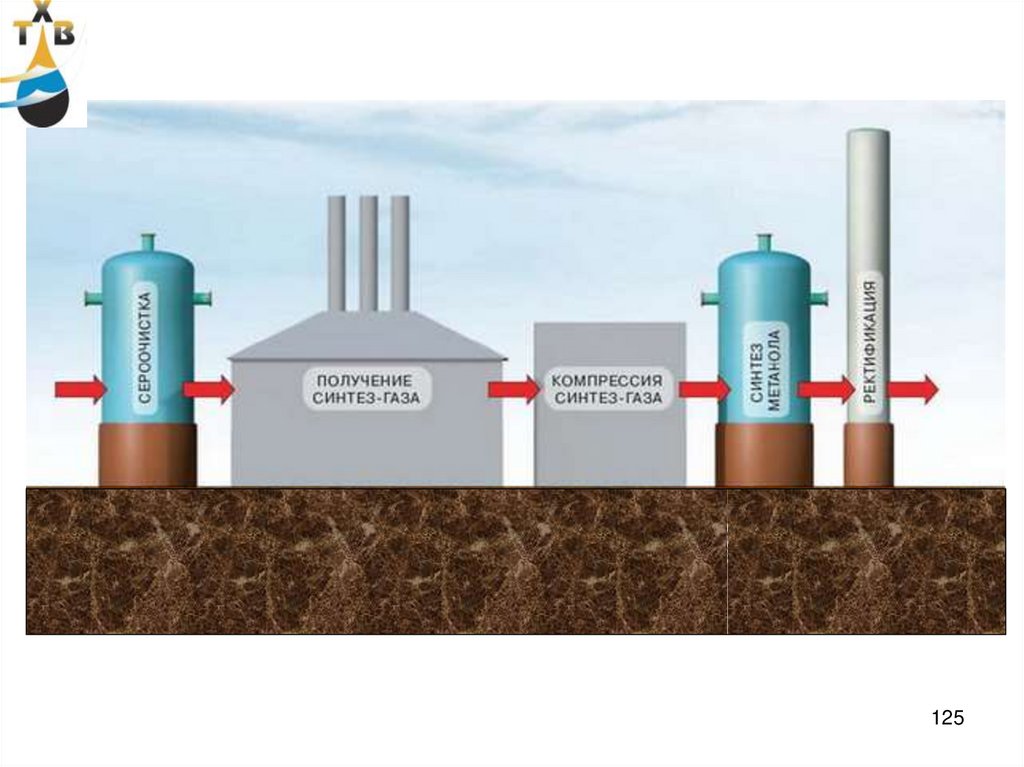
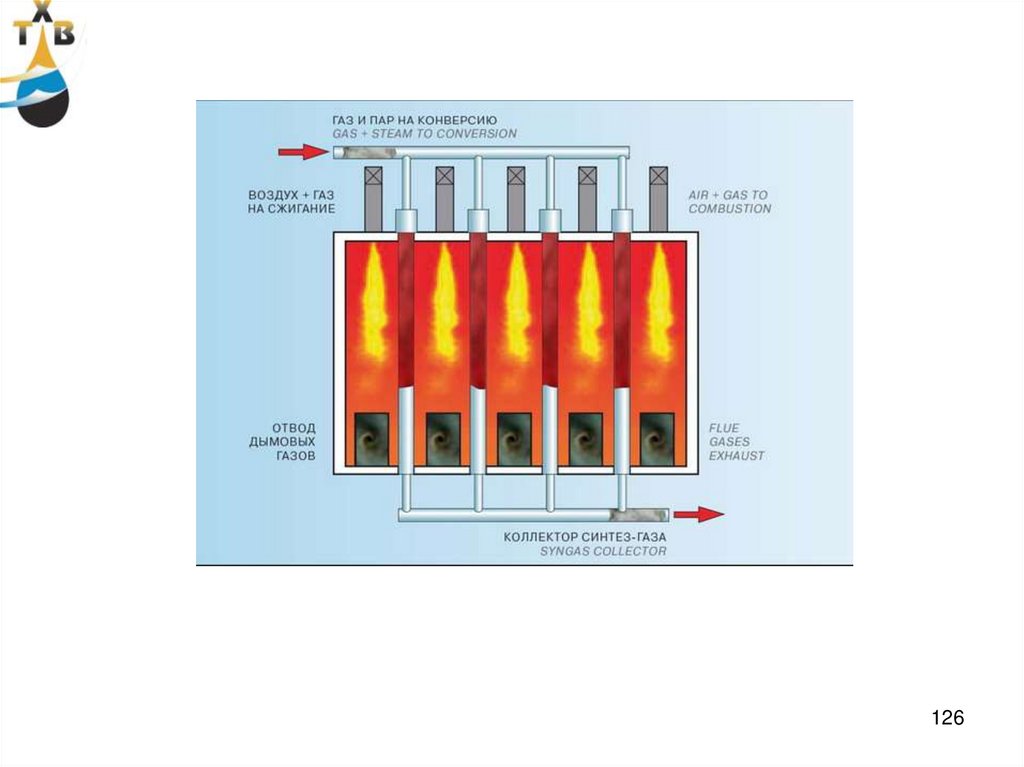
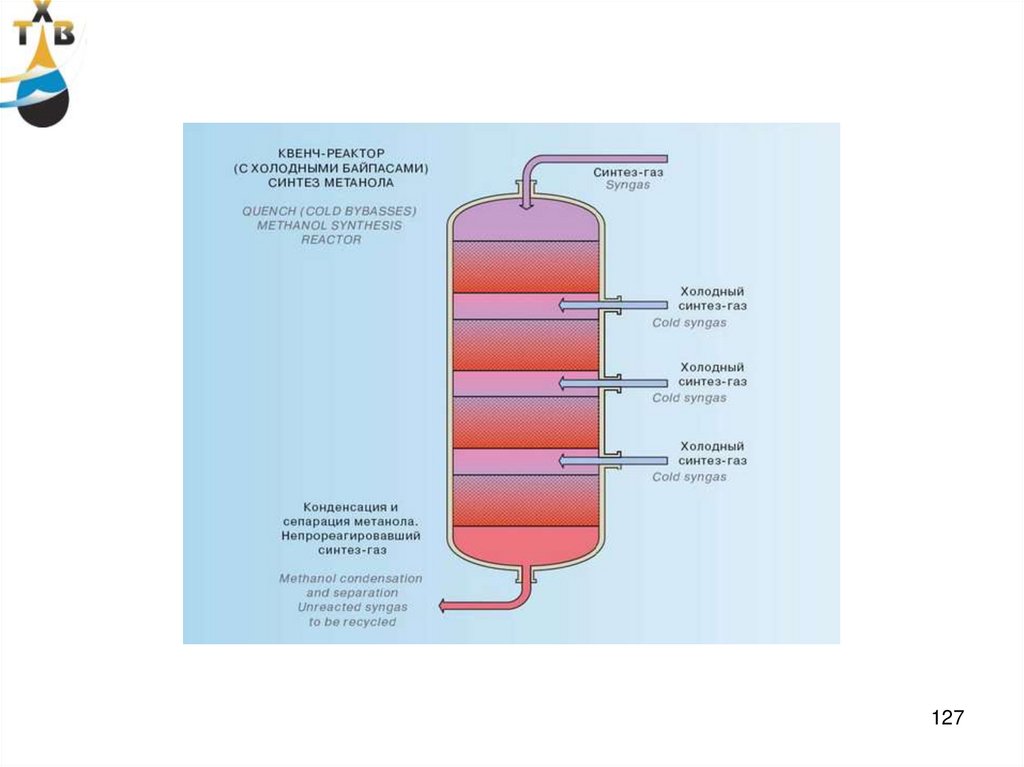
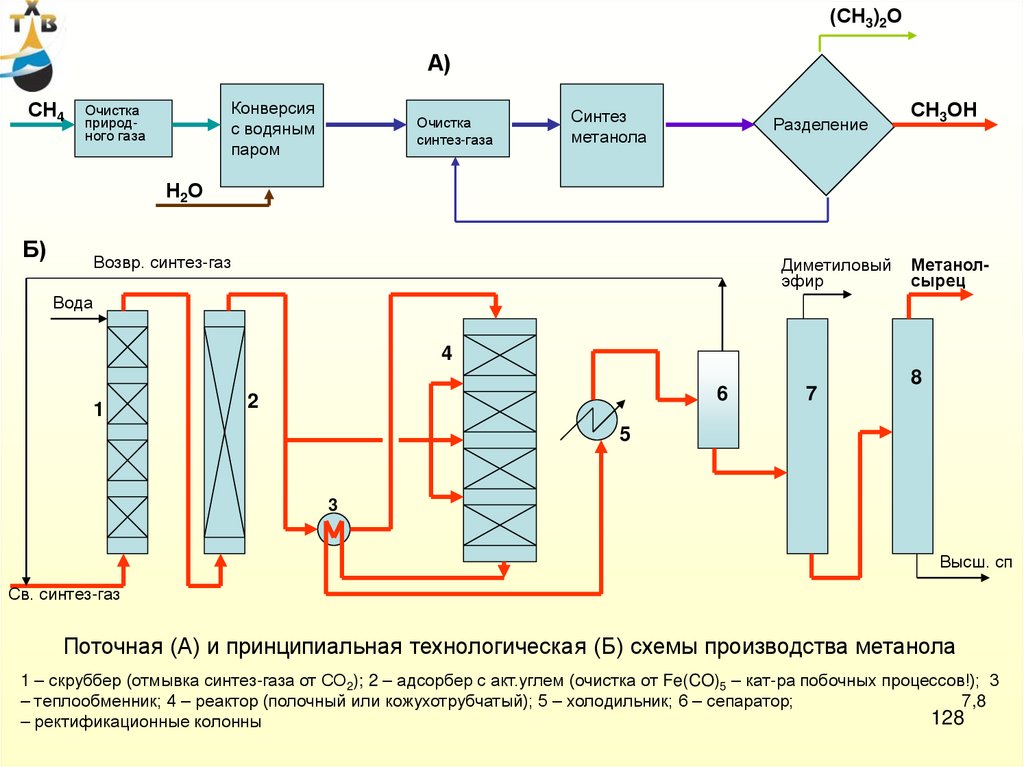

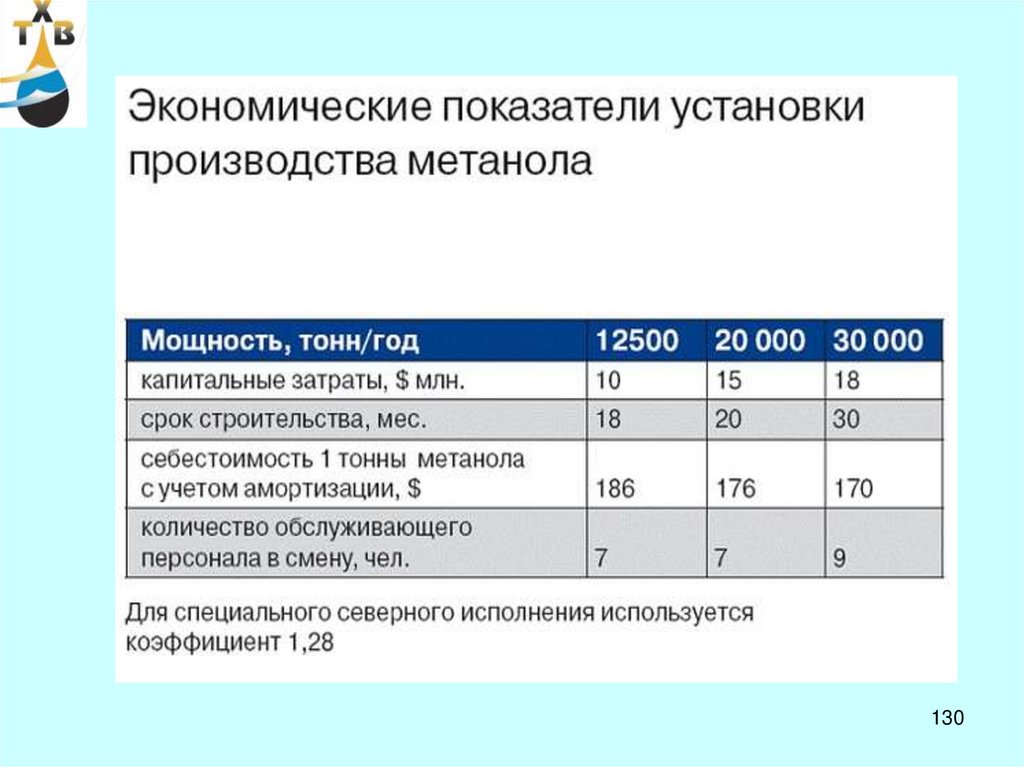




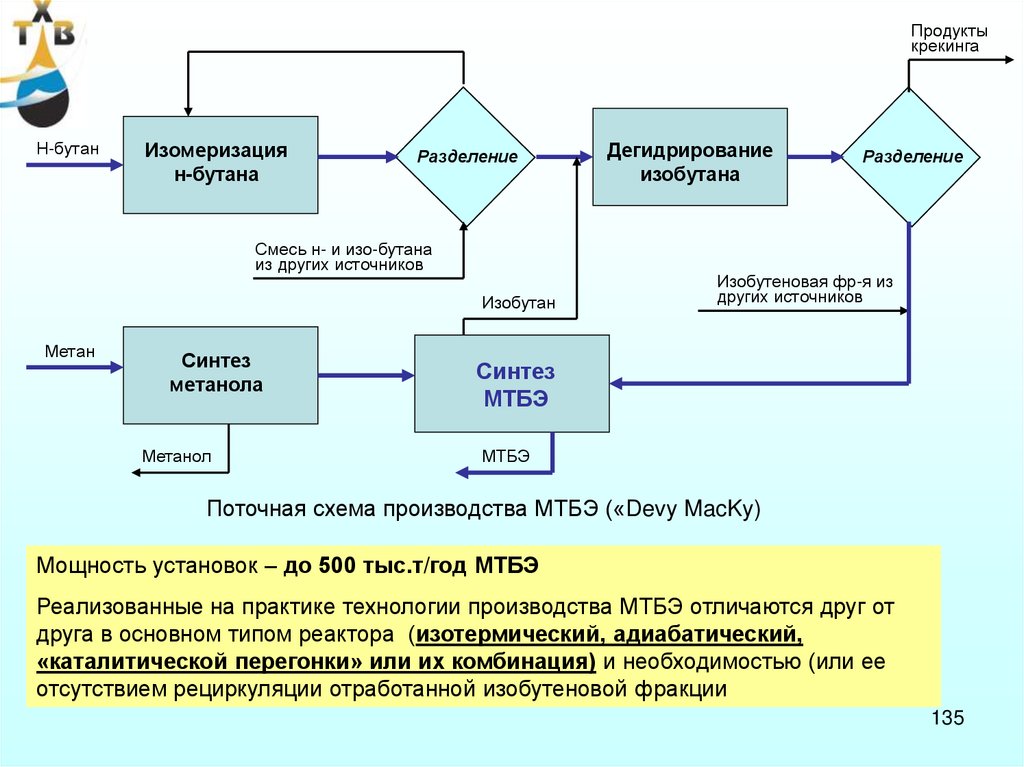
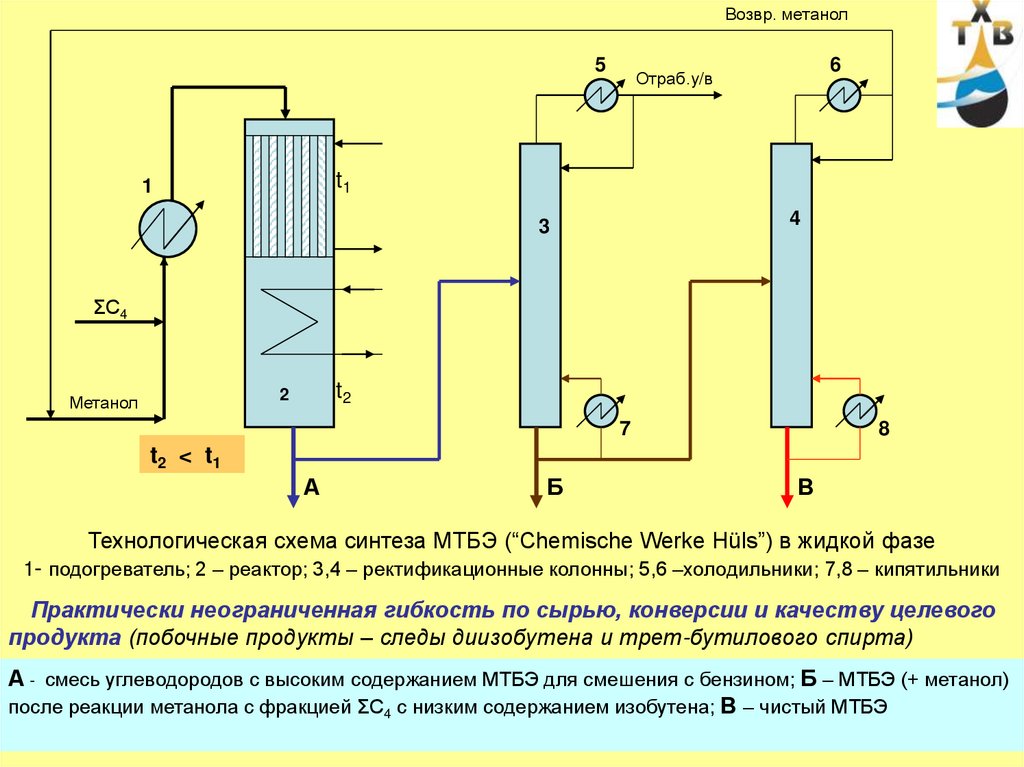

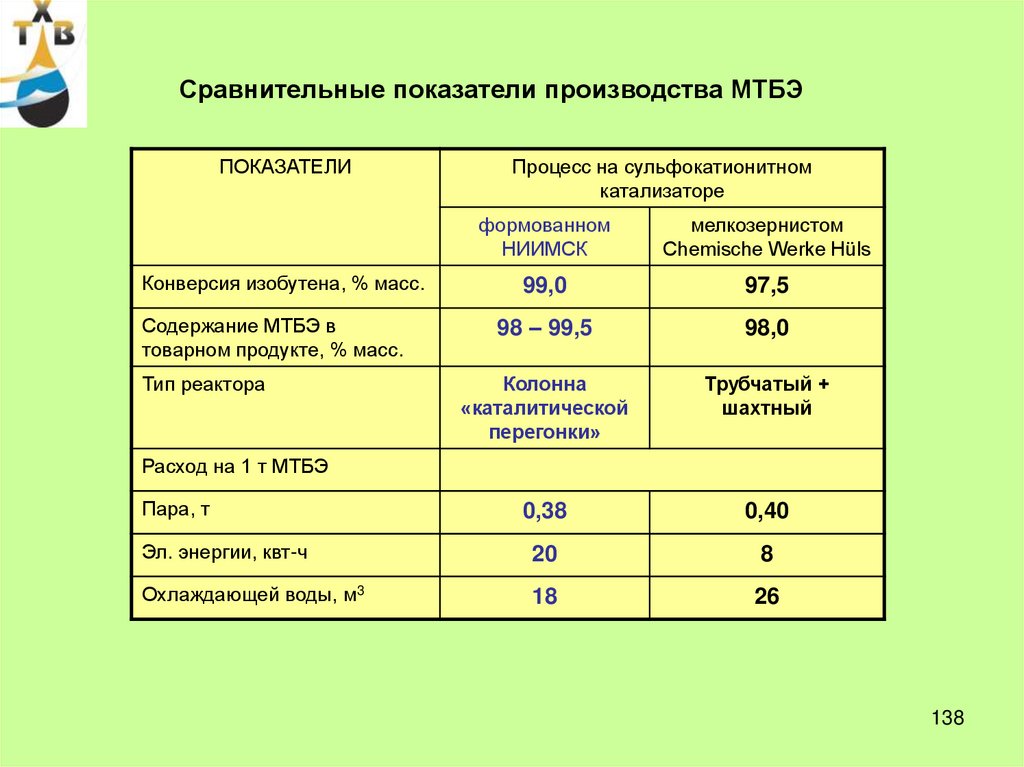















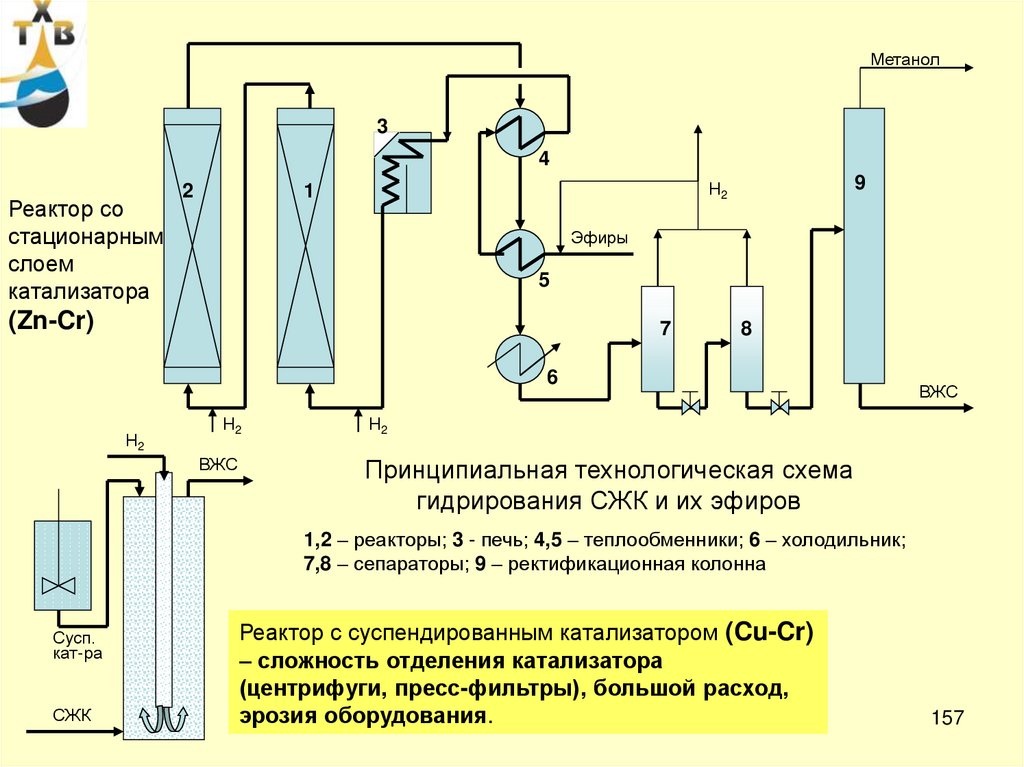
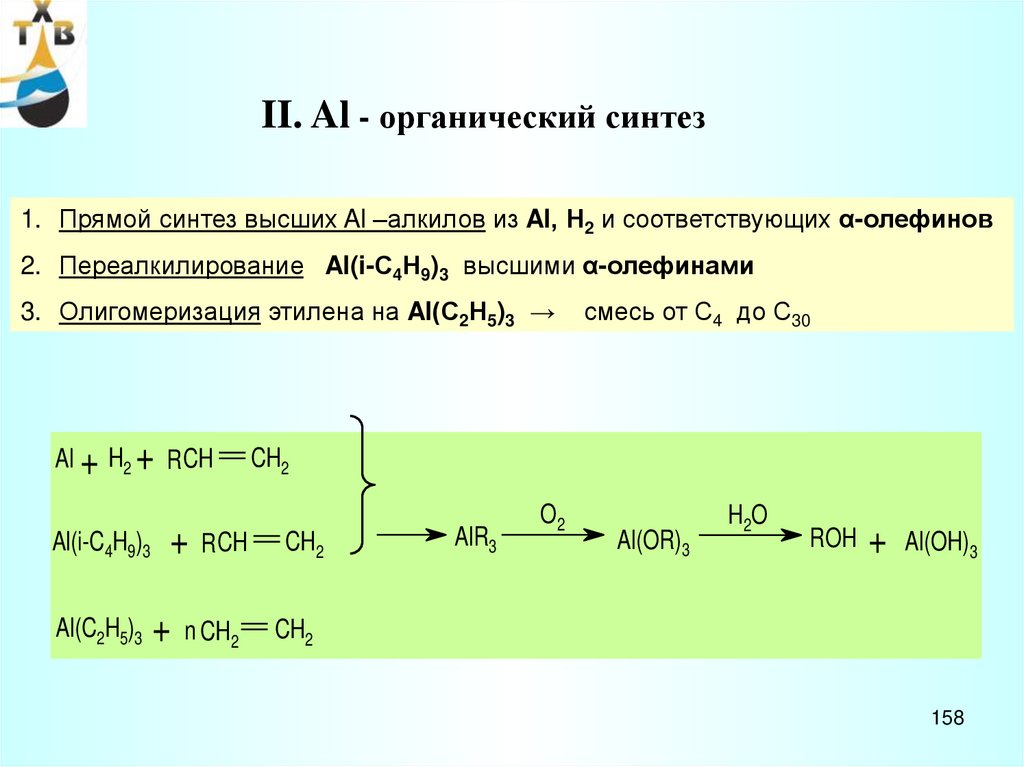
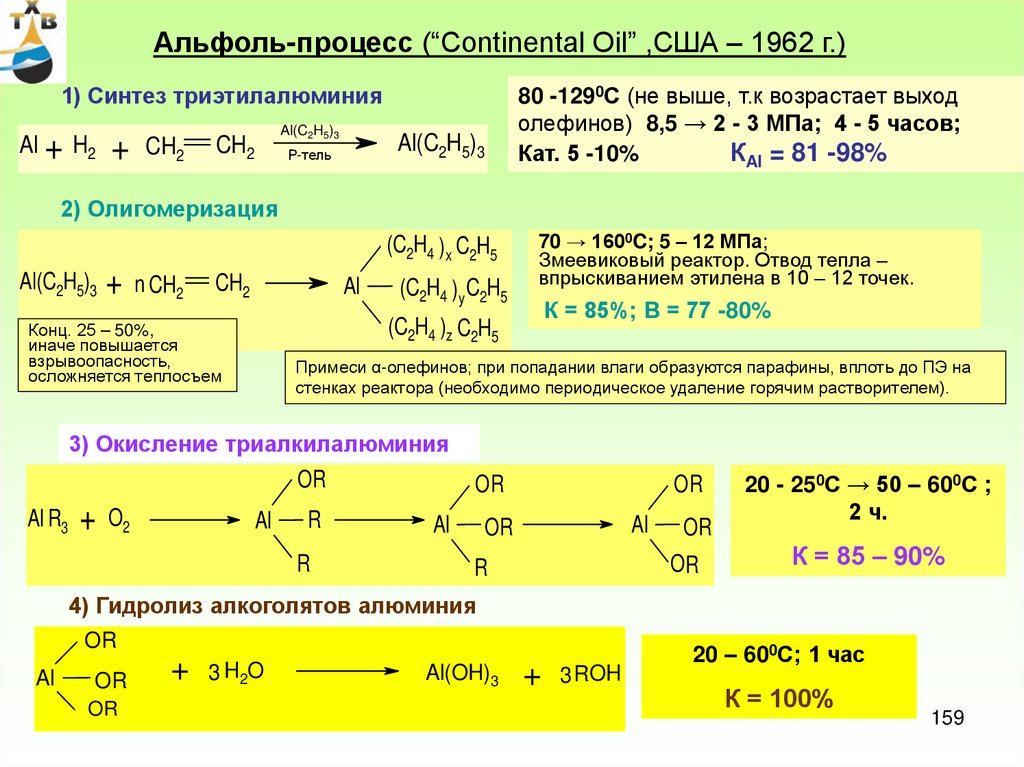
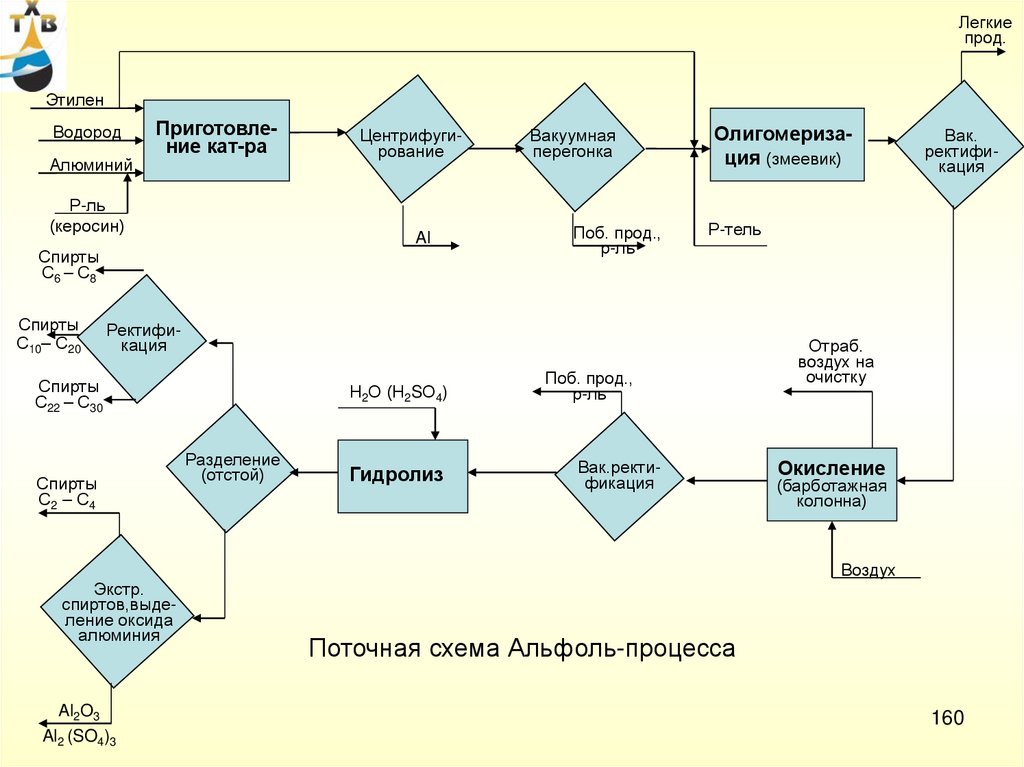



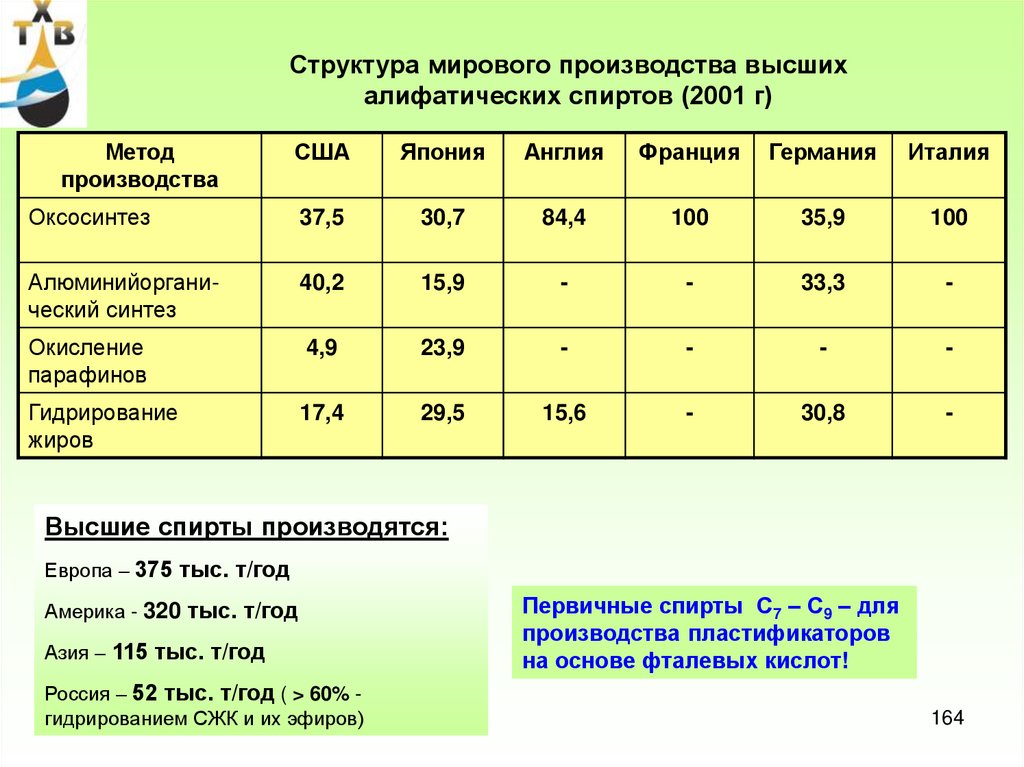
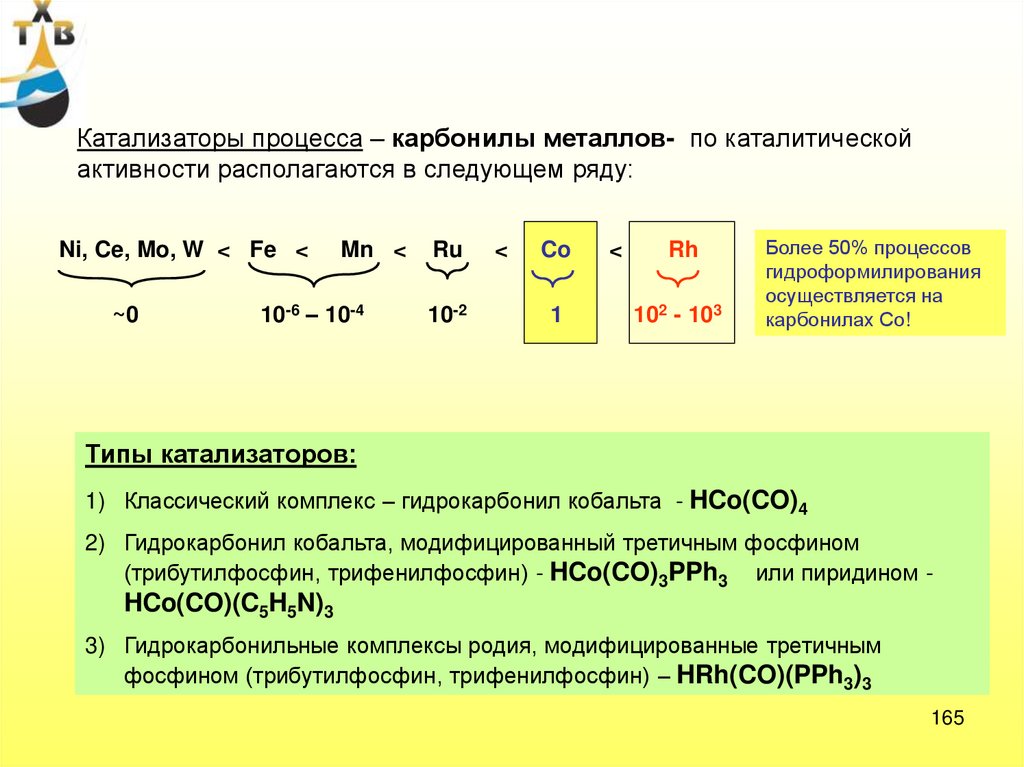

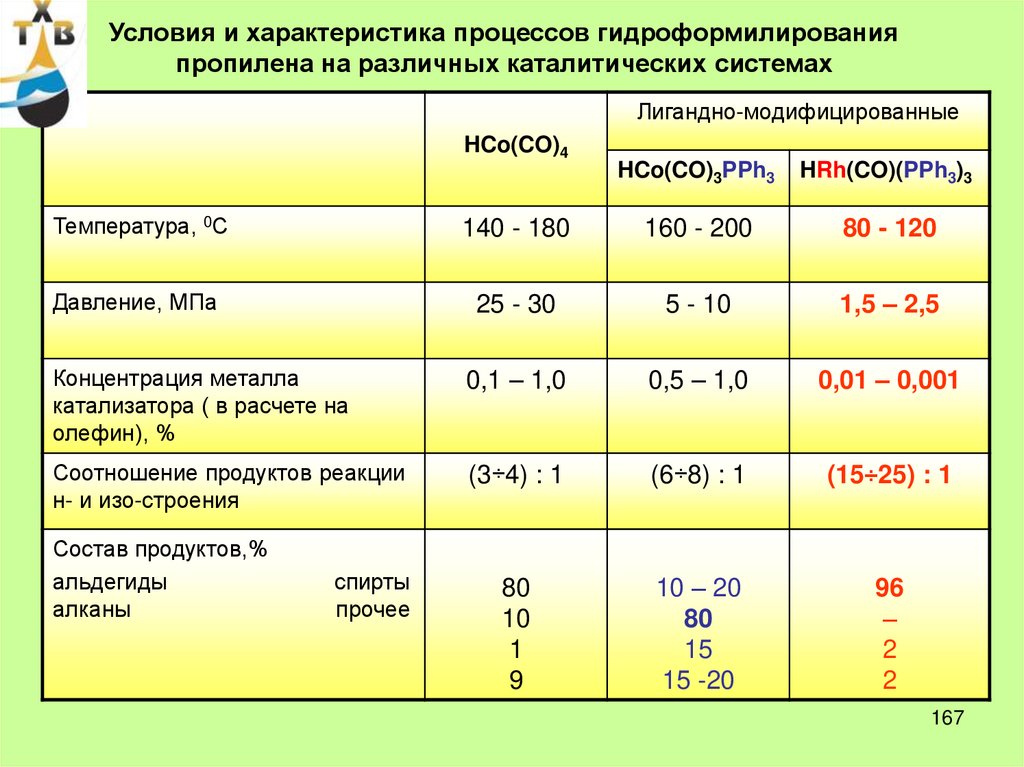
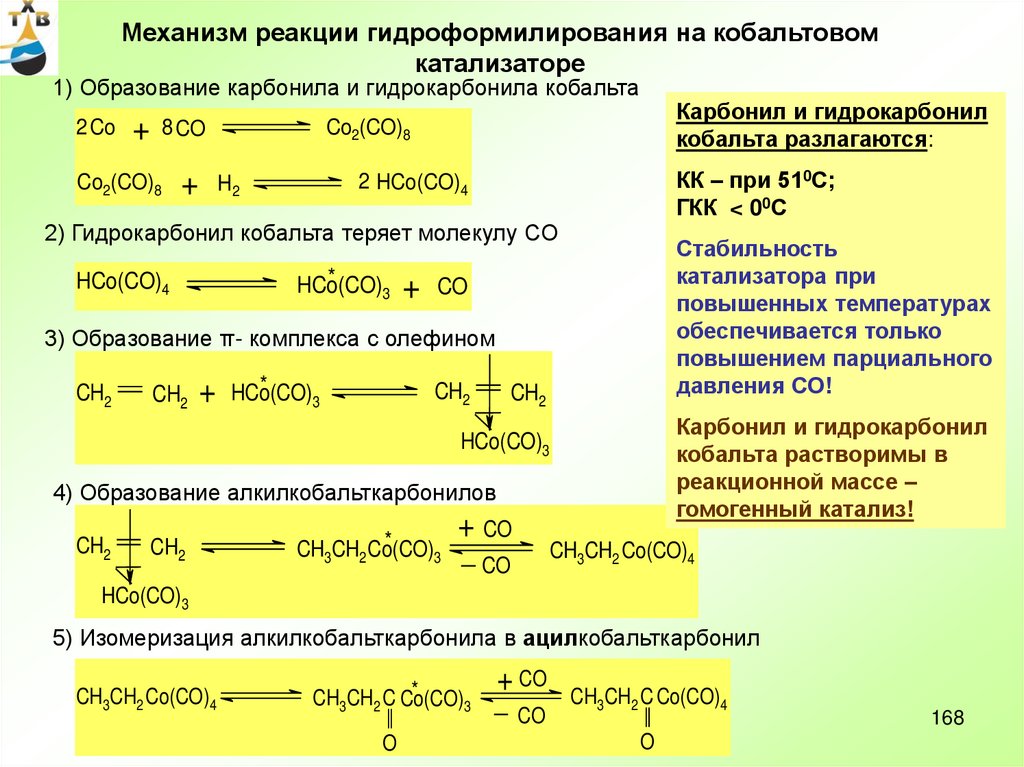
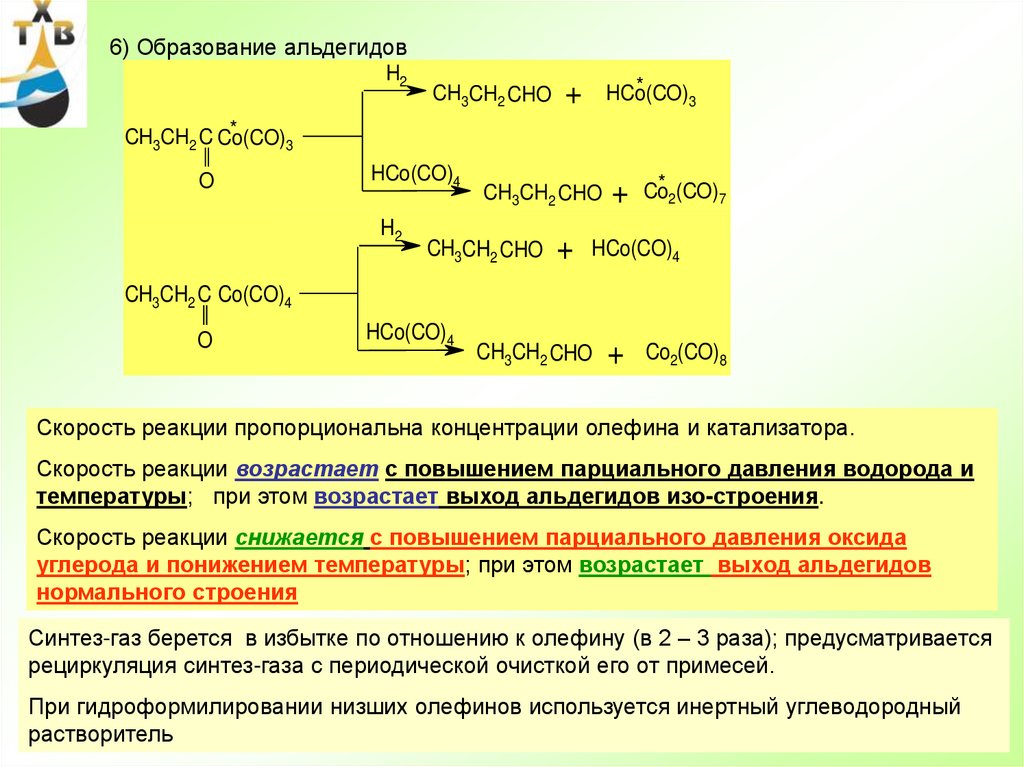

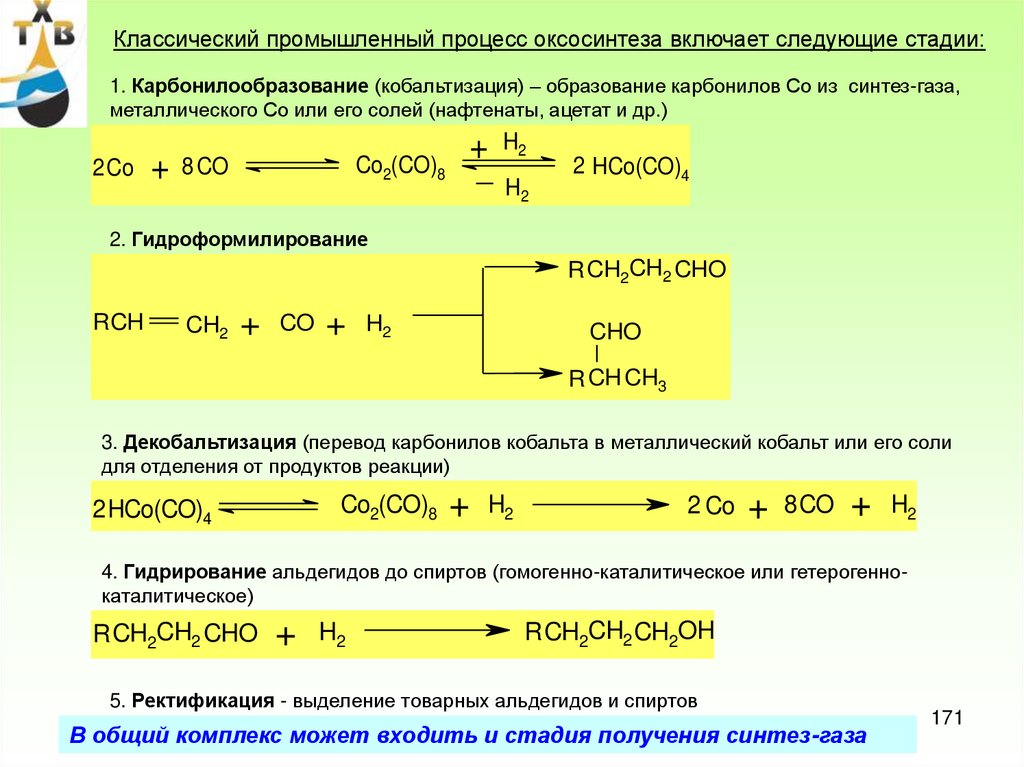



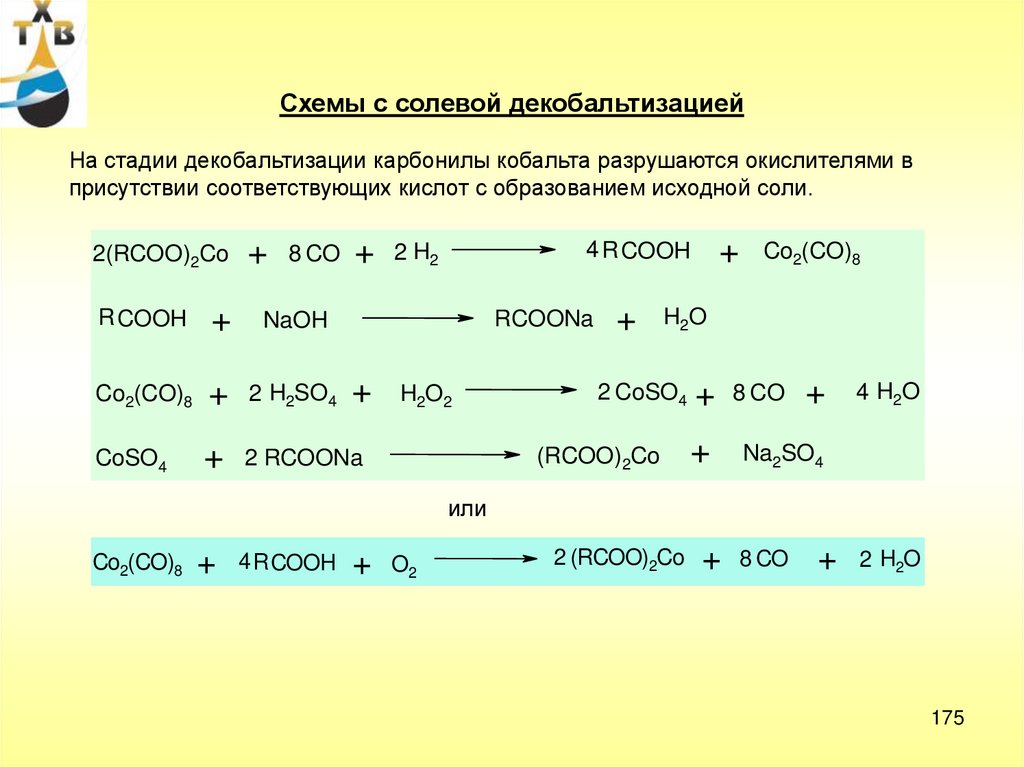





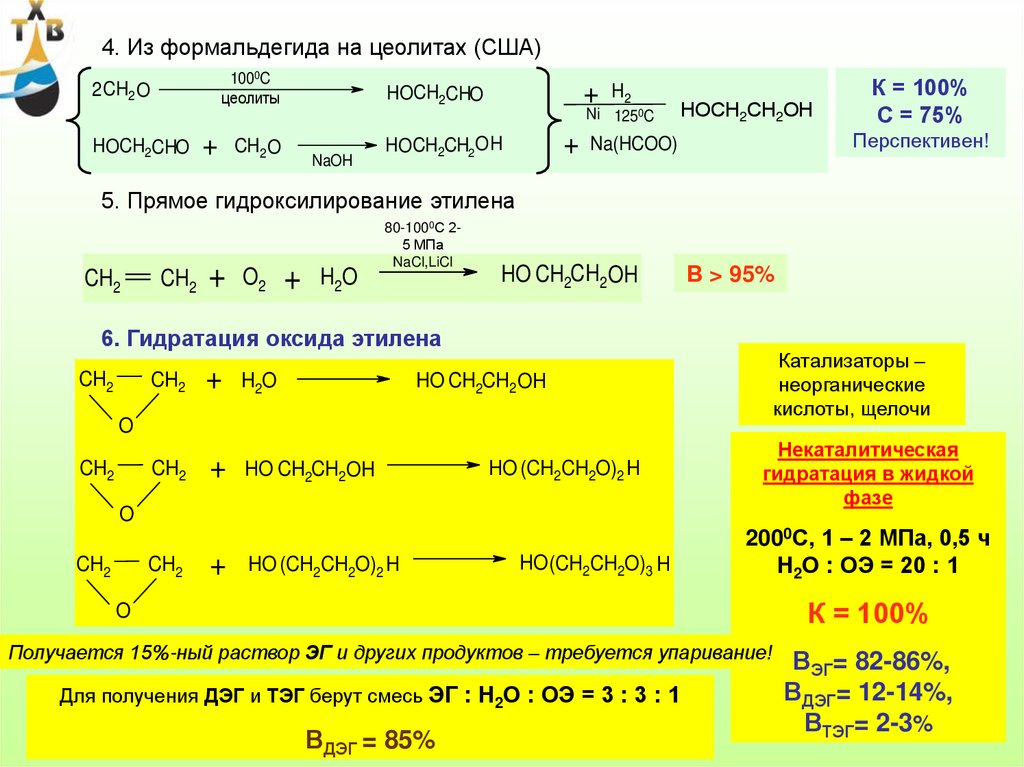
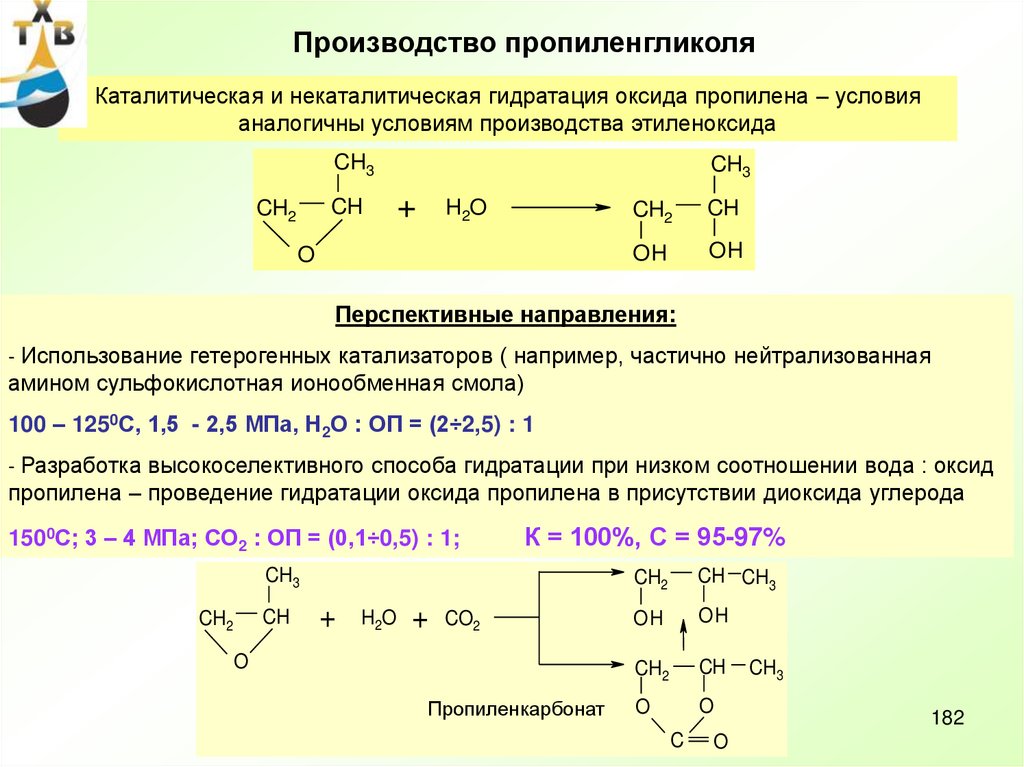
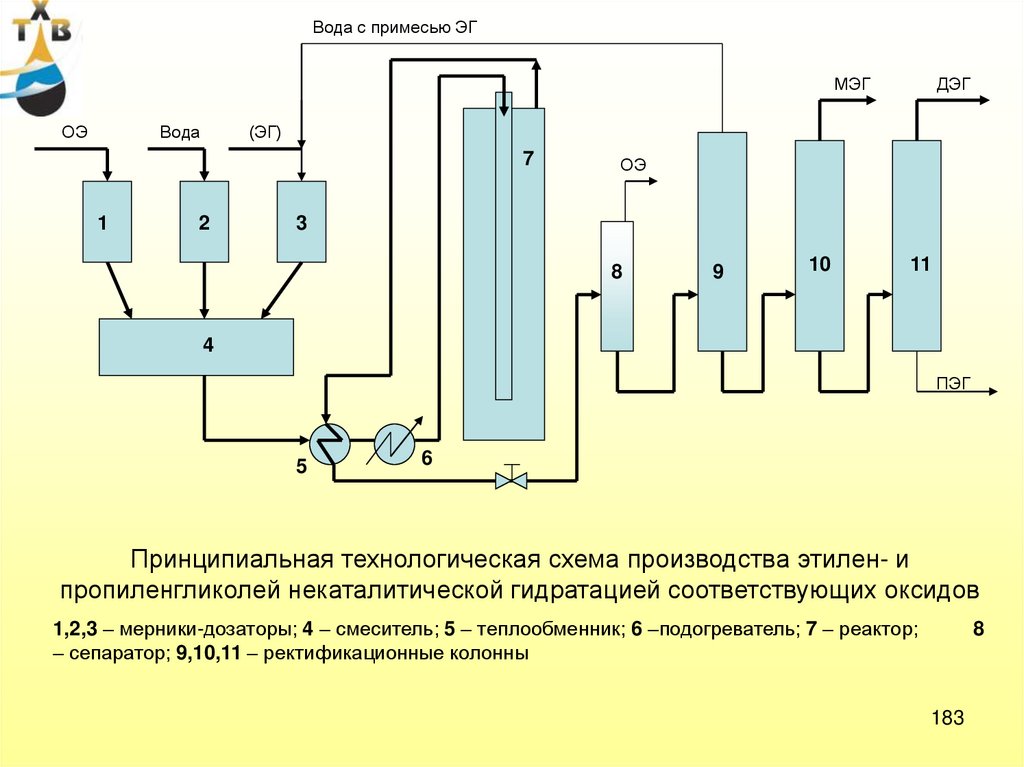
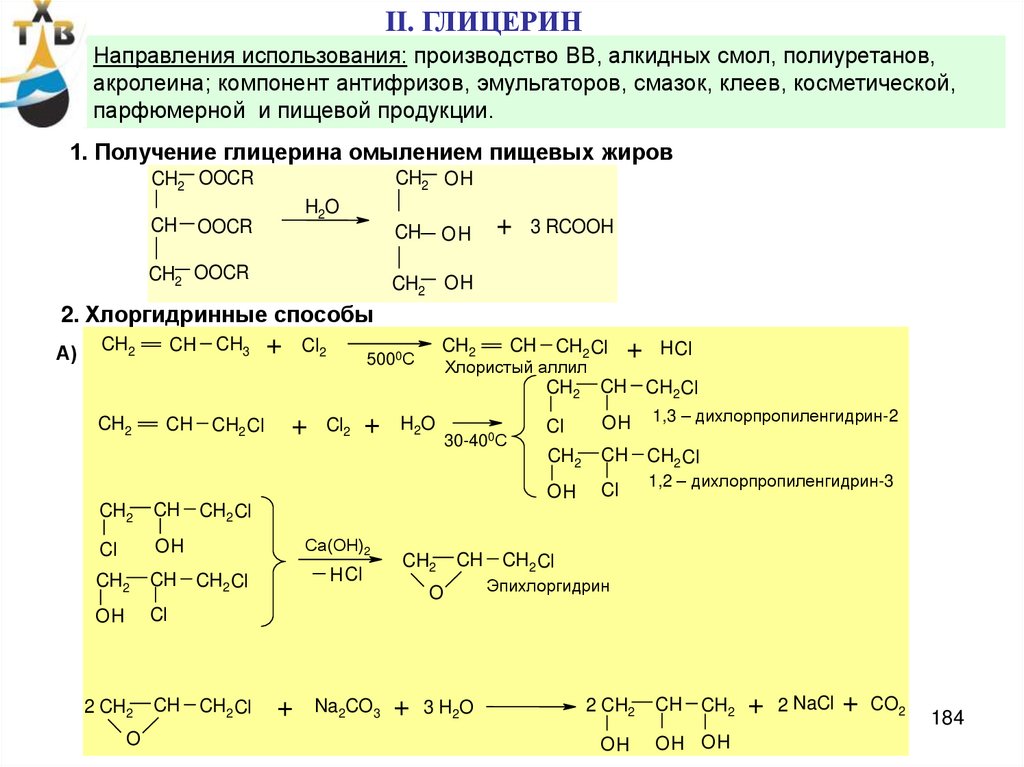
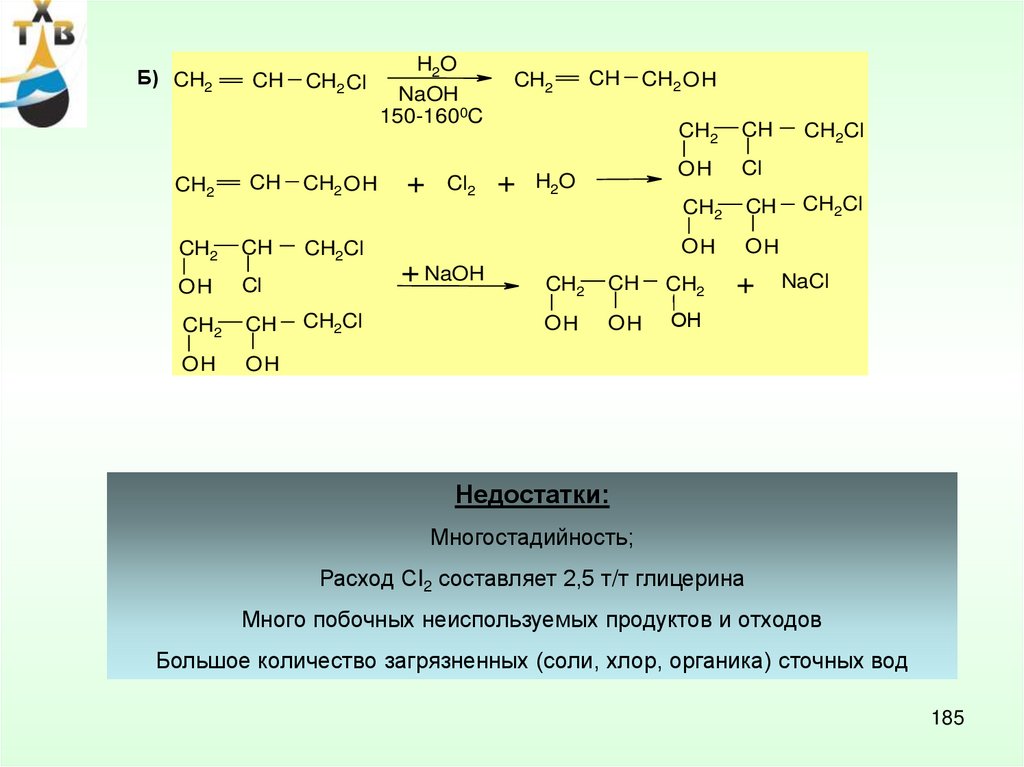
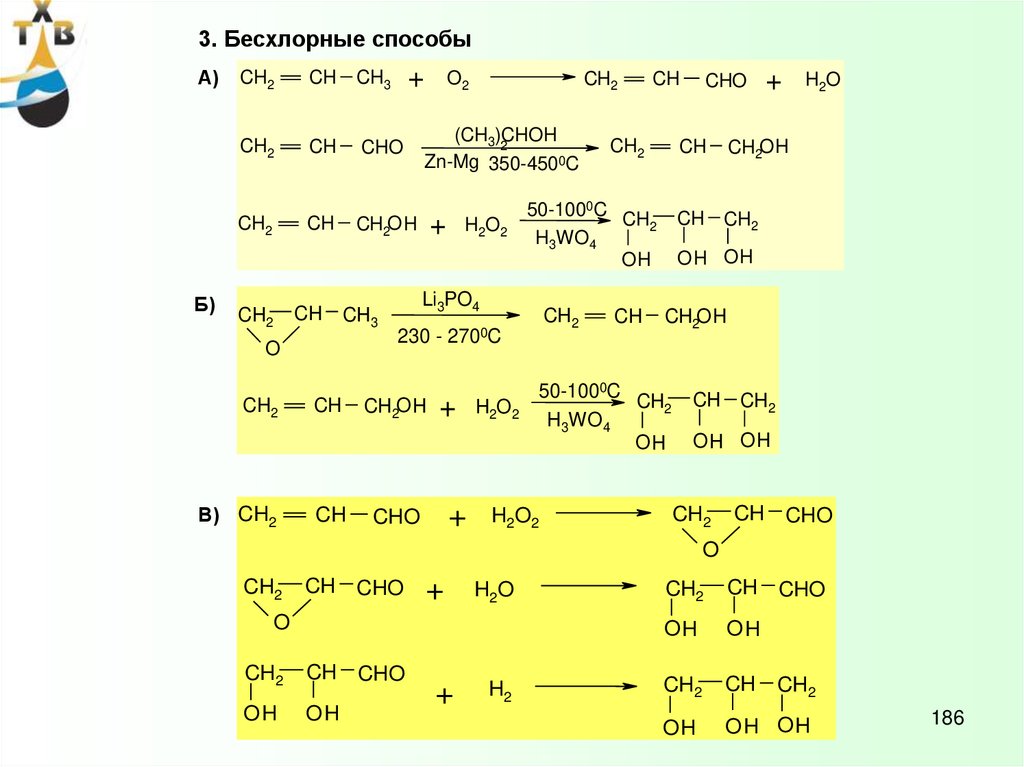


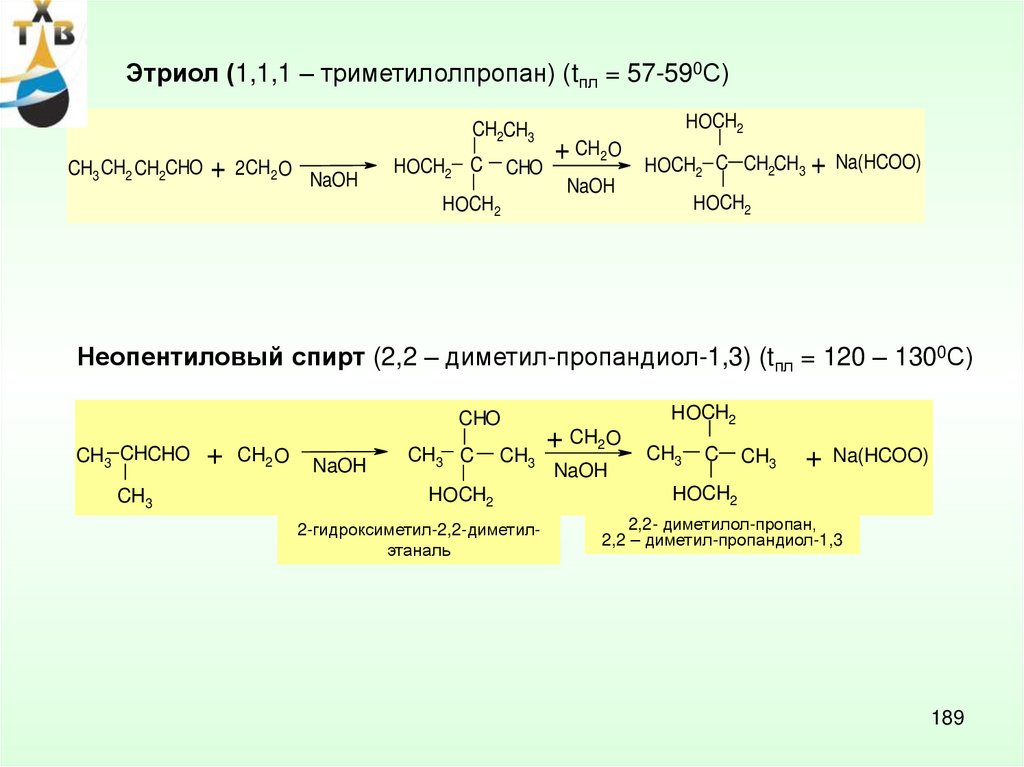
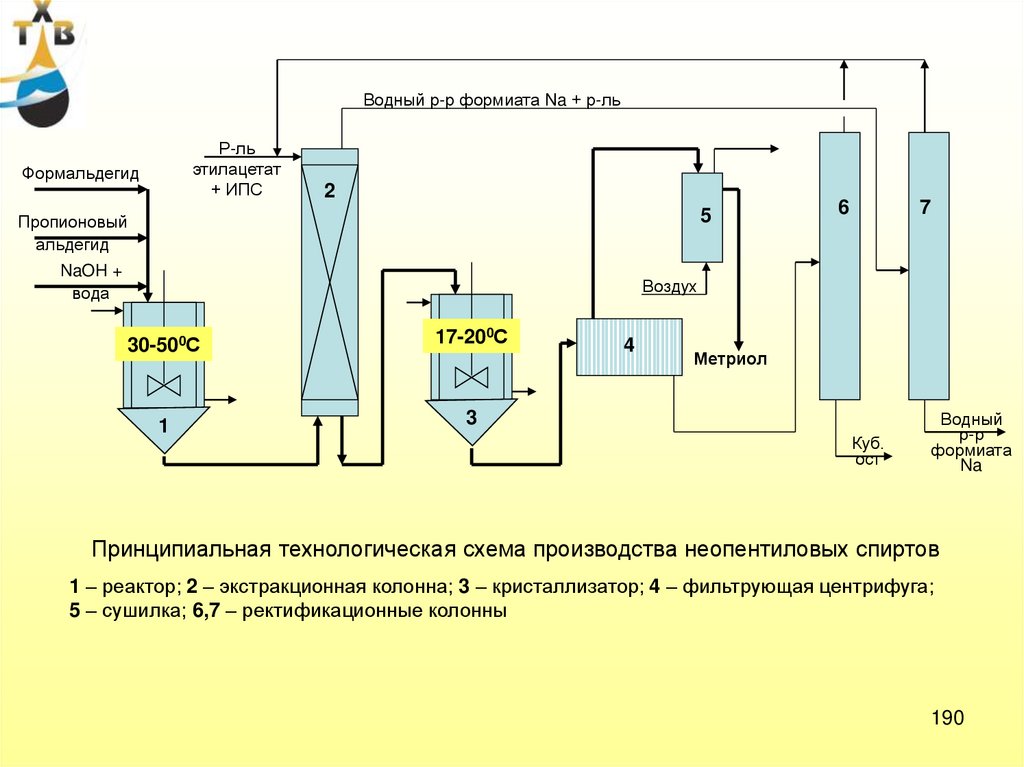
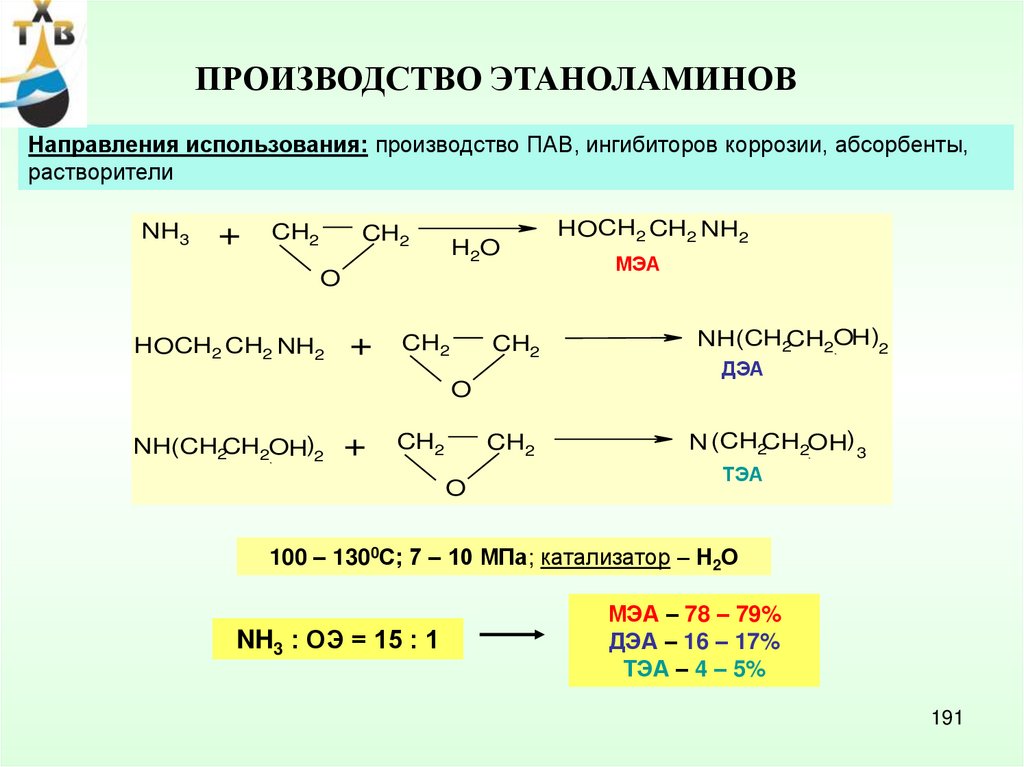
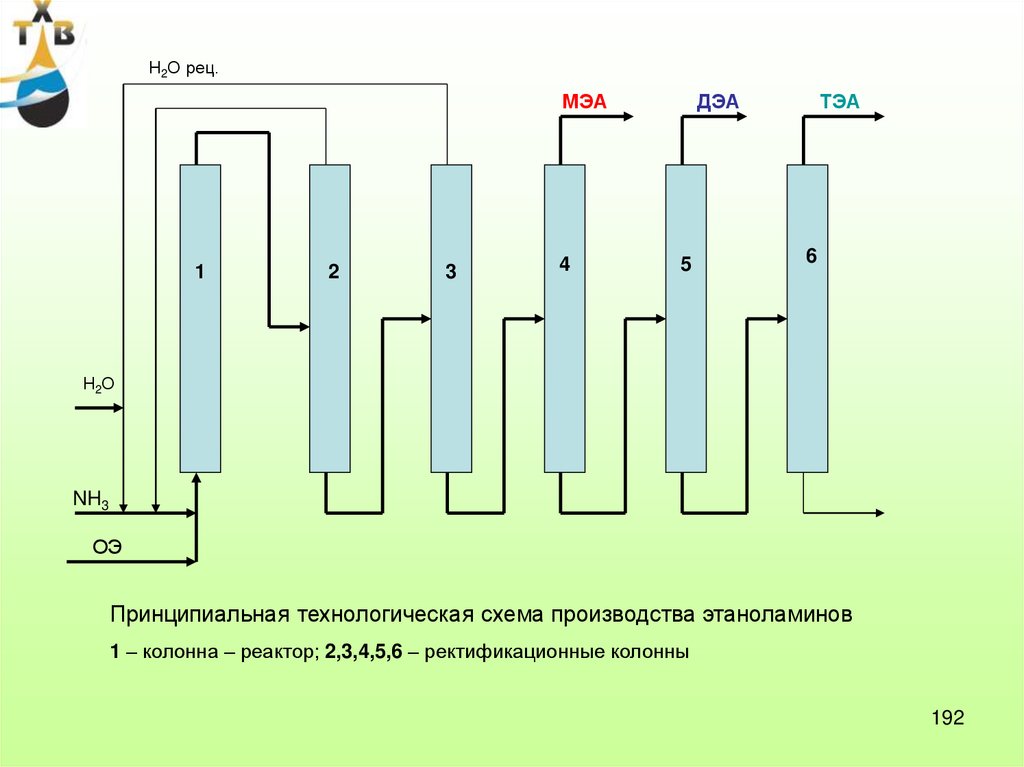


 chemistry
chemistry industry
industry








