Similar presentations:
Мономеры для полимеров (лекция 7)
1.
2 Раздел. Мономеры для полимеров,Лекция 7
получаемых по реакциям поликонденсации
Для получения полимера необходимо, чтобы каждая
молекула прореагировала как минимум двумя
реакционными центрами.
Реакционные центры – это активная часть
функционнальной группы (атом, группа атомов), которая
непосредственно принимает участие в реакции.
Можно выделить три вида реакционных центров.
1. Реакционный центр совпадает с функциональными
группами мономера
Функциональная группа определяет принадлежность мономера к тому
или иному классу соединений и имеет определенную реакционную
способность. Реакционные центры представленных функциональных
групп подчеркнуты:
Cl
O
C
OH
O
C
OR
O
C
Cl
OH
H
N
H
OR
2.
Би- и полифункциональные мономеры такого типа могут бытьразделены на три основных класса:
1) мономеры, содержащие одинаковые функциональные группы,
способные реагировать между собой, например, гликоли (НО–R–OH). В
качестве примера использования таких мономеров может служить реакция
получения простых эфиров из гликоля:
n HO R OH
H O R OH + (n-1) H2O
n
гомофункциональная поликонденсация
2) мономеры, содержащие различные функциональные группы,
способные реагировать между собой, например, гидроксикислоты
(HO–R–COOH), аминокарбоновые кислоты (H2N–R–COOH).
n H2N CH2 5 СOOH
H NH CH2 5 С OH + (n-1) H2O
n
O
гомополиконденсация
3) мономеры, содержащие одинаковые функциональные группы, не
способные в условиях реакции реагировать между собой, но способные
реагировать с функциональными группами другого мономера: диамины
(H2N–R–H2N), дикарбоновые кислоты (HООС–R–COOH), их производные и
др.
n NH CH NH + n HOOC CH COOH
2
2 6
2
28
H NH CH2 6 NH C CH2 8 C OH + (2n-1) H2O
O
O n
гетерополиконденсация
3.
Реакция, в которой помимо мономеров, необходимых для её протекания,участвует ещё один мономер, называется сополиконденсацией
n NH2 R NH2 + 2n HOOC R' COOH + n NH2 R'' NH2
H NH R NH C R' C NH R'' NH C R' C OH + (4n-1) H2O
n
O
O
O
O
2. Реакционный центр не совпадает с функциональной
группой мономера
Примером использования такого типа мономеров является реакция
получения фенолоформальдегидных олигомеров из фенола С6Н5ОН и
формальдегида СН2О:
OH
OH
*
OH
*
CH2OH
*
+ 2 CH2O
*
CH2OH
OH
*
OH
CH2
CH2OH
*
+ H2O
и т.д.
4.
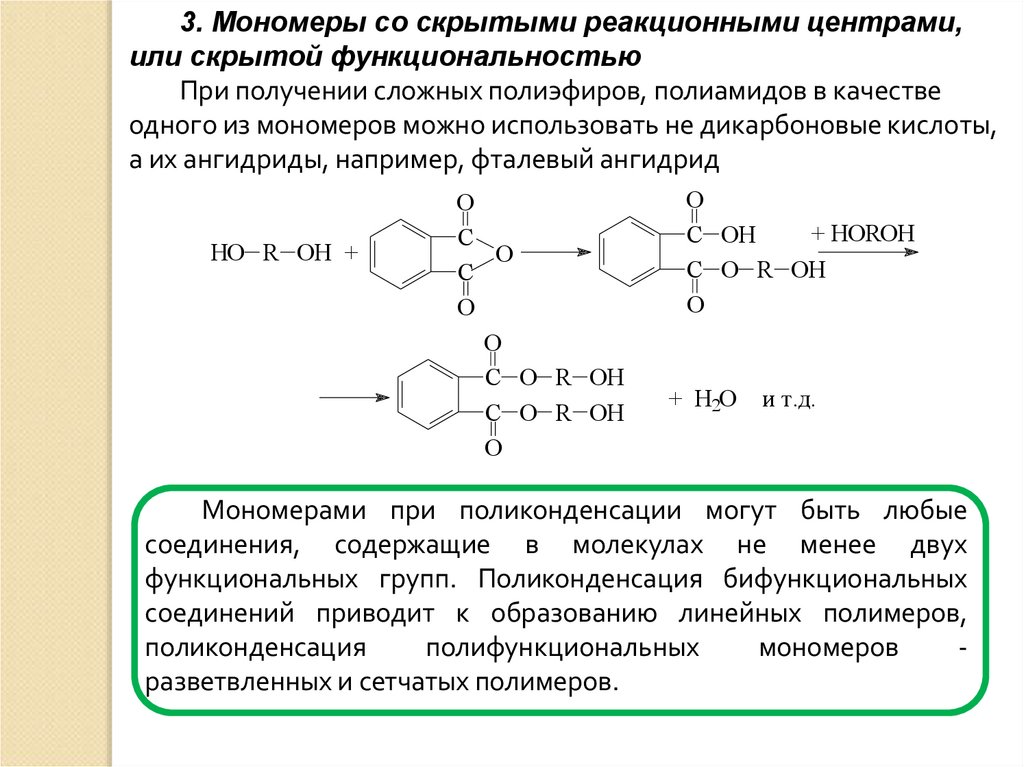
3. Мономеры со скрытыми реакционными центрами,или скрытой функциональностью
При получении сложных полиэфиров, полиамидов в качестве
одного из мономеров можно использовать не дикарбоновые кислоты,
а их ангидриды, например, фталевый ангидрид
HO R OH +
О
С
О
С
О
О
С O R OH
С O R OH
О
О
+ HOROH
С OH
С O R OH
О
+ H2O
и т.д.
Мономерами при поликонденсации могут быть любые
соединения, содержащие в молекулах не менее двух
функциональных групп. Поликонденсация бифункциональных
соединений приводит к образованию линейных полимеров,
поликонденсация
полифункциональных
мономеров
разветвленных и сетчатых полимеров.
5.
2.1. Мономеры для получения феноло- и аминоальдегидныхсмол
Альдегидное сырье: формальдегид, фурфурол,
гексаметилентетрамин, низкомолекулярные полимеры
формальдегида
Формальдегид (метаналь, муравьиный альдегид)
H C
O
H
Основной промышленный метод получения формальдегида —
окисление метанола:
2CH3OH + O2 → 2HCHO + 2H2O
окисление метана:
CH4 + O2 → HCHO + H2O
6.
Доля свободного формальдегида в метаноле невелика, оснавная частьнаходится в виде моно или поли-гидратов.
n НС
О
+ H2O
Н
HO CH2O H, n=1, n>1
n
или в виде ацеталей – гемиформаль
OCH3
HC OH
H
О
НС
+ CH3OH
Н
Фурфурол
Гексаметилентетрамин (уротропин)
N
H2C
6CH2O + 4NH3
N
CH2
H2C
N
CH2
CH2
CH2
+ 6H2O
N
H+
6CH2O + 4NH3
7.
Низкомолекулярные полимерыформальдегида
Формальдегид весьма склонен к полимеризации, которая
ускоряется с понижением температуры и наличием примесей.
Полимеризацией формальдегида в безводных средах в
промышленности получают высокомолекулярный
полиформальдегид – полиоксиметилен:
n CH2O
CH2O
n > 100 полиоксиметилен
n
n от 8-100 параформ
Триоксан
3 CH2O
H2C
O
O
CH2
CH2
O
8.
9.
Качественная реакция на альдегиды:10.
Фенольное сырье: фенол, его гомологи (крезолы,ксиленолы) и двухатомный фенол – резорцин
Фенол (гидроксибензол, карболовая
кислота)
OН
Получают фенол из А) каменноугольной смолы (продукта коксования)
и Б) синтетическим путем.
Крезолы (метилфенолы, гидрокситолуолы)
OH
OH
OH
CH3
о-крезол
CH3
м-крезол
CH3
п-крезол
11.
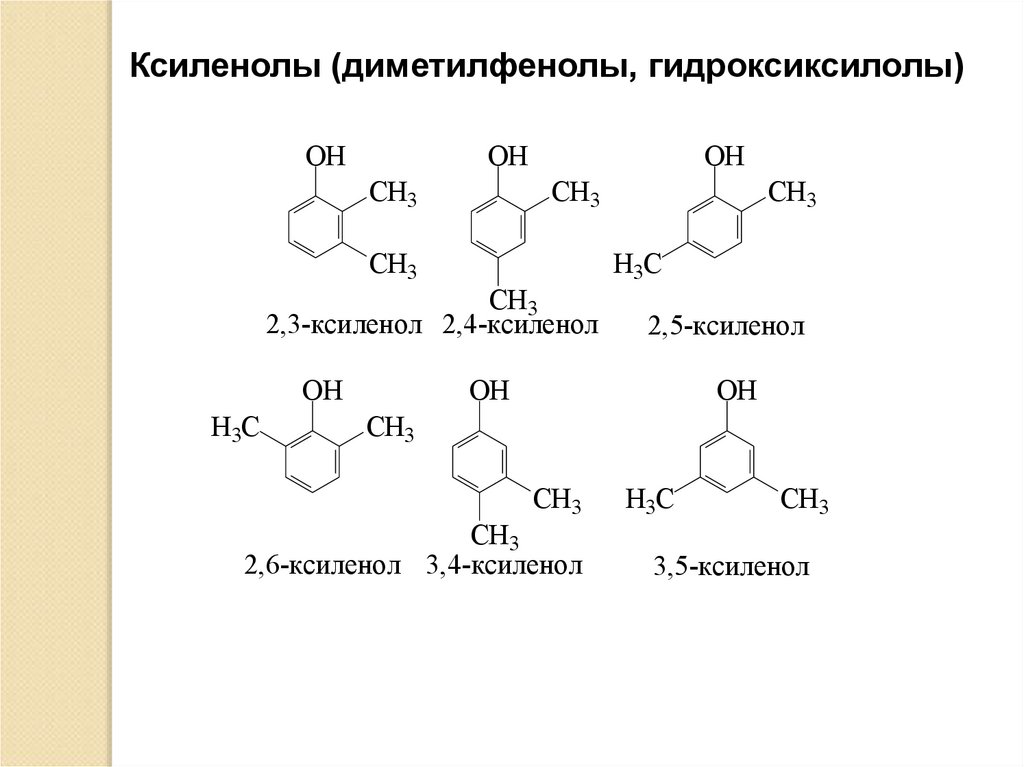
Ксиленолы (диметилфенолы, гидроксиксилолы)OH
OH
OH
СH3
CH3
2,3-ксиленол 2,4-ксиленол
H3C
2,5-ксиленол
OH
OH
OH
H3C
CH3
СH3
CH3
CH3
CH3
CH3
2,6-ксиленол 3,4-ксиленол
H3C
CH3
3,5-ксиленол
12.
Резорцин (м-дигидроксибензол)H2SO4
NaOH
SO3H H SO
2
4
SO3H
м-дисульфокислота
бензола
ONa CO
OH
2
ONa
дифенолят
Химические свойства
Окисление
SO3H
OH
SO3Na
SO3Na
13.
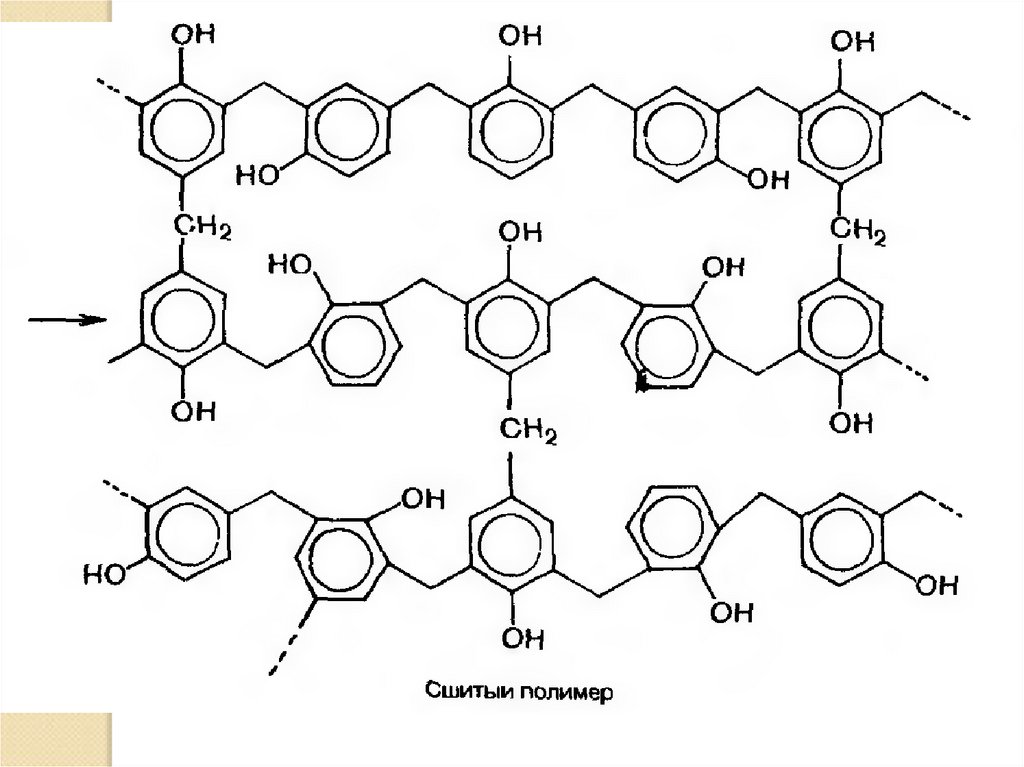
OHOH
OH
H
+ CH2 O
CH2OH
или
CH2OH
OH
OH
HO
OH + H2O
CH2
OH
СH2OH
+
OH
CH2OH
OH
CH2
OH
+ H2O
OH
CH2
+ H2O
14.
*HO
*
CH2
*
OH + HO
CH2OH
*
- H2O
OH
+
HO
CH2
OH
CH2
*
*
OH
- H2O
CH2OH
и т.д.
15.
16.
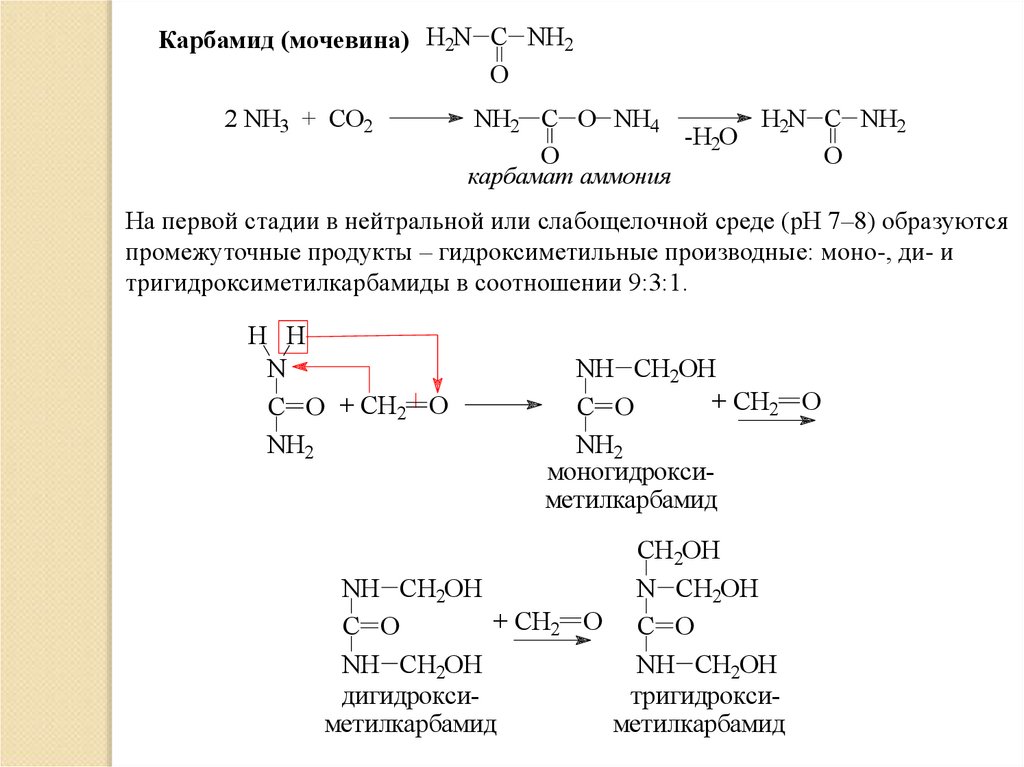
Карбамид (мочевина) H2N C NH2O
2 NH3 + CO2
NH2 C O NH4
H2N C NH2
-H2O
O
O
карбамат аммония
На первой стадии в нейтральной или слабощелочной среде (рН 7–8) образуются
промежуточные продукты – гидроксиметильные производные: моно-, ди- и
тригидроксиметилкарбамиды в соотношении 9:3:1.
H H
N
C O + CH2 O
NH2
NH CH2OH
+ CH2 O
C O
NH2
моногидроксиметилкарбамид
NH CH2OH
+ CH2
C O
NH CH2OH
дигидроксиметилкарбамид
CH2OH
N CH2OH
O C O
NH CH2OH
тригидроксиметилкарбамид0
17.
Вслабокислой
среде
метилольные
производные
взаимодействуют друг с другом по реакции поликонденсации,
образуя олигомер линейной или разветвленной структуры
В общем виде КФС имеют следующее строение:
n H2N C NH2 + (n+1)CH2O
O
CH2OH
H NH C NH CH2 N C NH CH2OH + n H2O
n-1
O
O
18.
NH2Меламин (2,4,6,-триамино-1,3,5-триазин,
триамид циануровой кислоты)
N
H2N
C
C
N
N
C
NH2
В промышленности меламин получают нагреванием карбамида:
NH2
6 H2N C NH2
O
N
H2N
C
C
N
N
C
+ 6 NH3 + 3 CO2
NH2
19.
Присоединение первых трех молекул формальдегида с получением тригидроксиметилмеламинапротекает с большой скоростью при 40 ºС. Наиболее благоприятной является нейтральная или
слабощелочная среда (рН 7–8,5):
NH2
N
H2N
C
C
N
N
C
NH2
H
C O
H
+ 3
NH
N
HOCH2
HN
C
CH2OH
N
C
C NH CH2OH
N
тригидроксиметилмеламин
Следующие три моля формальдегида присоединяются в более жестких условиях (при
значительном избытке формальдегида и температуре выше 80ºС), причем в процессе реакции можно
выделить тетра-, пента- и гексагидроксиметилмеламин.
NH2
N
H2N
C
C
N
N
C
NH2
+ 6
HOCH2
HOCH2
N
N
C
N
C
H
C O
H
CH2OH
N
C
N
CH2OH
HOCH2
N
CH2OH
гексагидроксиметилмеламин
20.
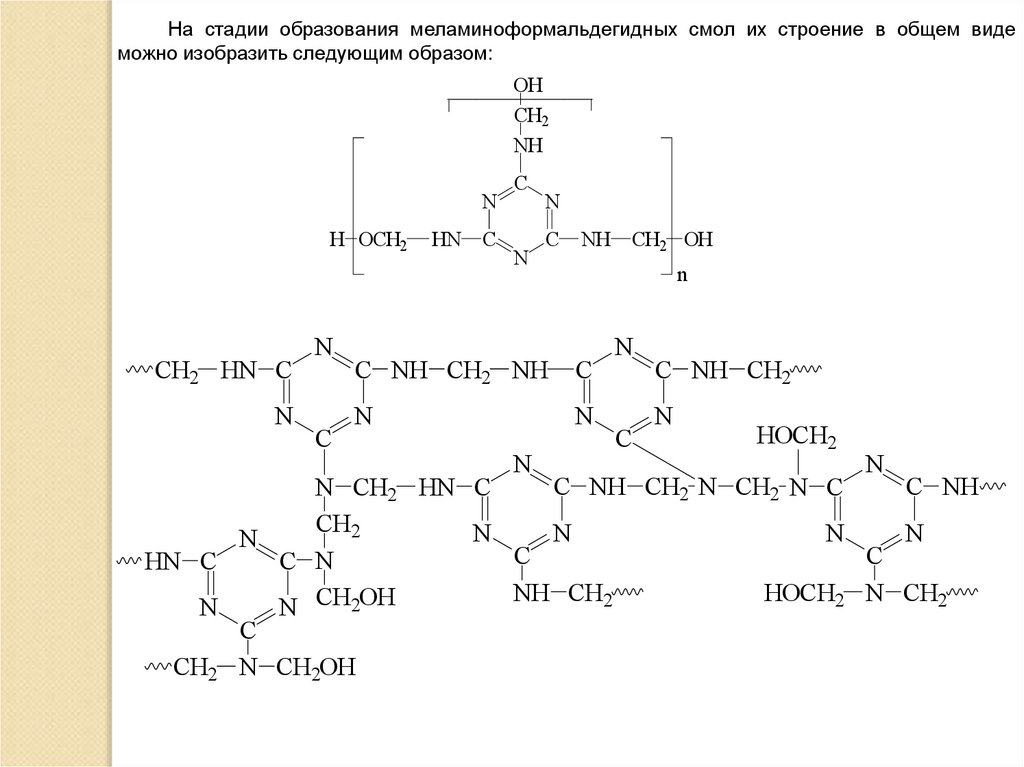
На стадии образования меламиноформальдегидных смол их строение в общем видеможно изобразить следующим образом:
OH
CH2
NH
N
H OCH2
CH2 HN C
N
N
C
HN
C
C
N
N
C
NH
n
C NH CH2 NH
C
N
N
N
CH2 OH
N
C
C NH CH2
N
HOCH2
N
C NH CH2 N CH2 N C
C NH
N CH2 HN C
CH2
N
N
N
N
N
C
C
C N
HN C
NH CH2
HOCH2 N CH2
N
N CH2OH
C
CH2 N CH2OH















 chemistry
chemistry