Similar presentations:
Аминокислоты. Гетерофункциональные соединения, молекулы
1. АМИНОКИСЛОТЫ
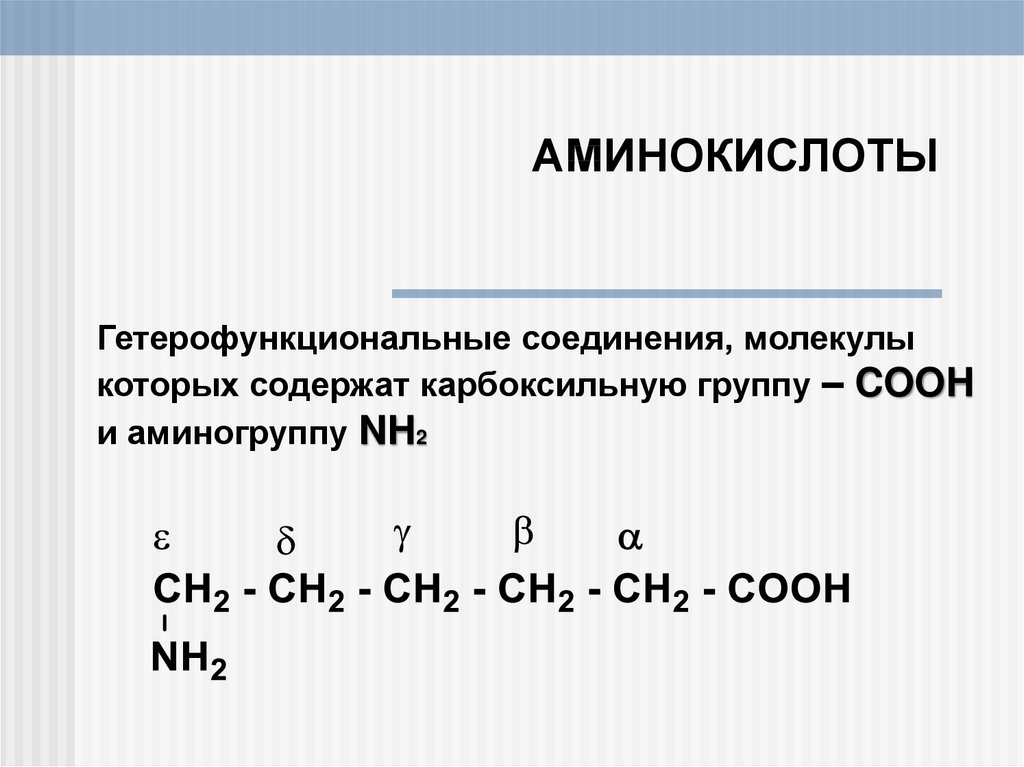
Гетерофункциональные соединения, молекулыкоторых содержат карбоксильную группу – COOH
и аминогруппу NH2
2.
aнеполярный
кислотный
полярный
основный
3.
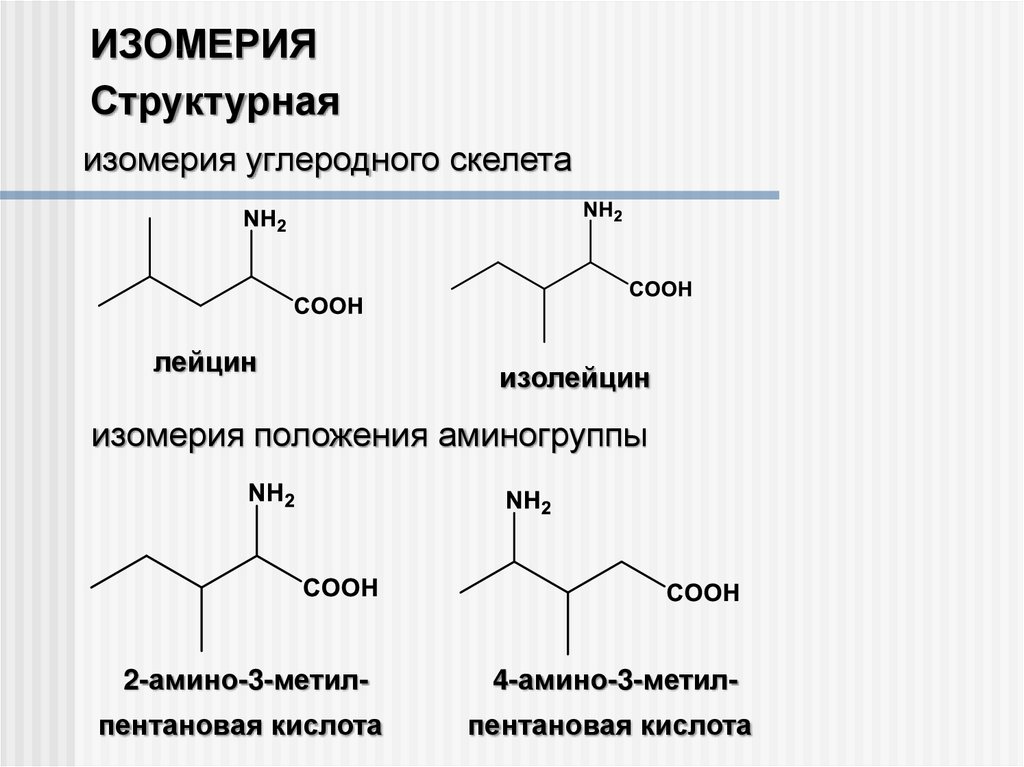
ИЗОМЕРИЯСтруктурная
изомерия углеродного скелета
лейцин
изолейцин
изомерия положения аминогруппы
2-амино-3-метил-
4-амино-3-метил-
пентановая кислота
пентановая кислота
4.
межклассовая изомерияNH2 - CH2 - COOH
СН3 - CH2 - NO2
оптическая изомерия
L - аминокислота
D - аминокислота
5.
СПОСОБЫ ПОЛУЧЕНИЯПолучение α-аминокислот
Аммонолиз галогенпроизводных карбоновых кислот
Аминирование галогенокислот фталимидом
6.
Циангидринный синтез (синтез Штреккера - Зелинского)Зелинский (1906)
7.
Синтез глутамата натрия (E 621)8.
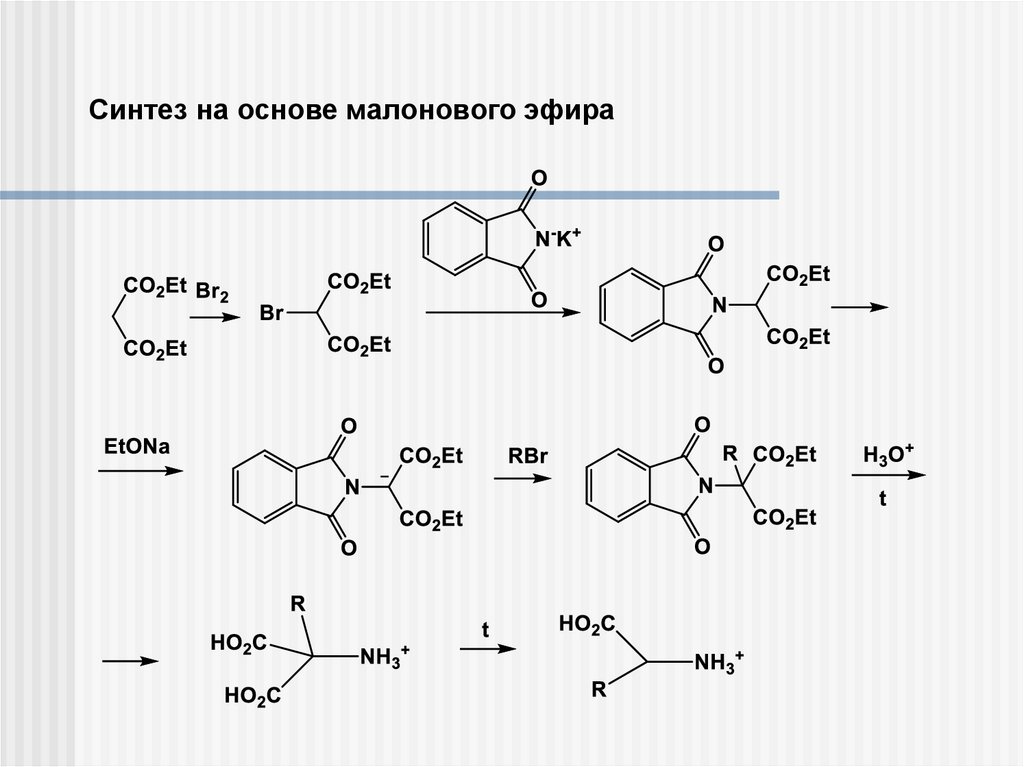
Синтез на основе малонового эфира9.
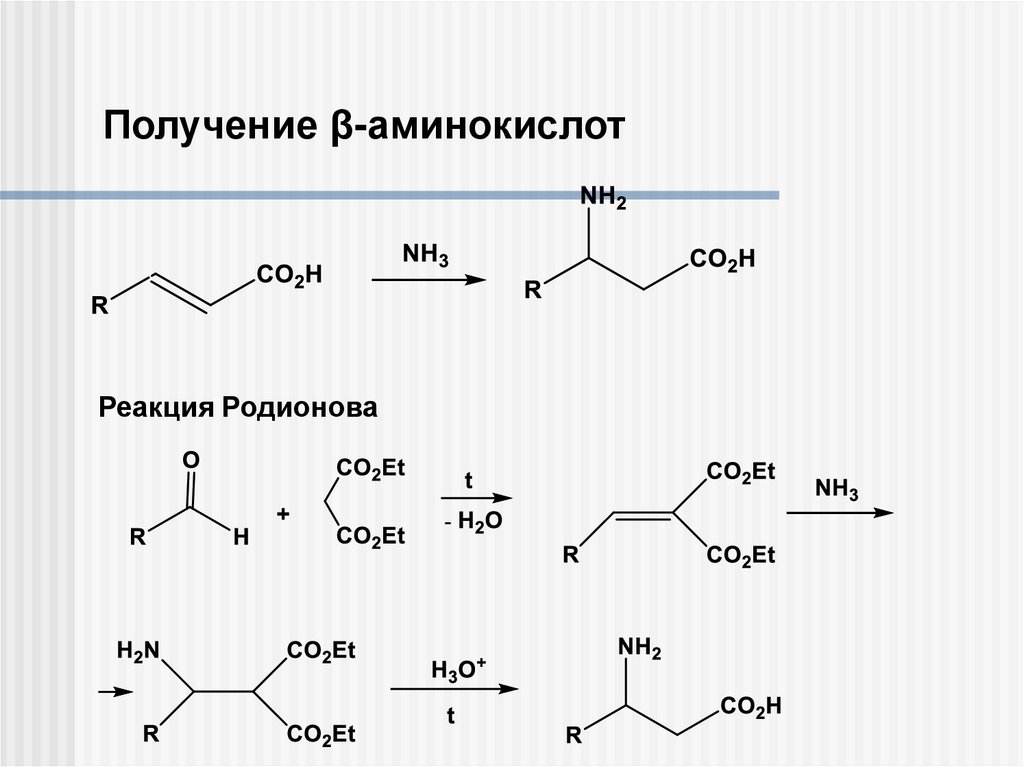
Получение β-аминокислотРеакция Родионова
10.
ON-K+
CO2Et
R
O
R
O
NH2
H3O+
N
t
CO2Et
R
O
Получение γ-, δ- и ε-аминокислот
O
O
NH3
O
p,t
NH
лактам
H3O+
t
H2N
CO2H
CO2H
11.
ХИМИЧЕСКИЕ СВОЙСТВА α- АМИНОКИСЛОТцвиттер-ион
Высокая растворимость в воде, низкая в неполярных растворителях
Высокая температура плавления
Амфотерность
12.
Кислая средаКатод
Нейтральная среда
Щелочная среда
Анод
Величина рН, при которой аминокислота не перемещается в электрическом
поле, называется изоэлектрической точкой. Каждая аминокислота (и пептид)
характеризуется своей изоэлектрической точкой pI = -lg(pH)
13.
Кислотно-основные свойстваС ионами двухвалентных металлов
14.
Реакции аминогруппыДезаминирование (взаимодействие с азотистой кислотой)
N-ацилирование
15.
алкилирование16.
Реакции карбоксильной группыЭтерификация:
Получение галогенангидридов:
17.
Декарбоксилирование18.
Окисление19.
Реакции переаминирования20.
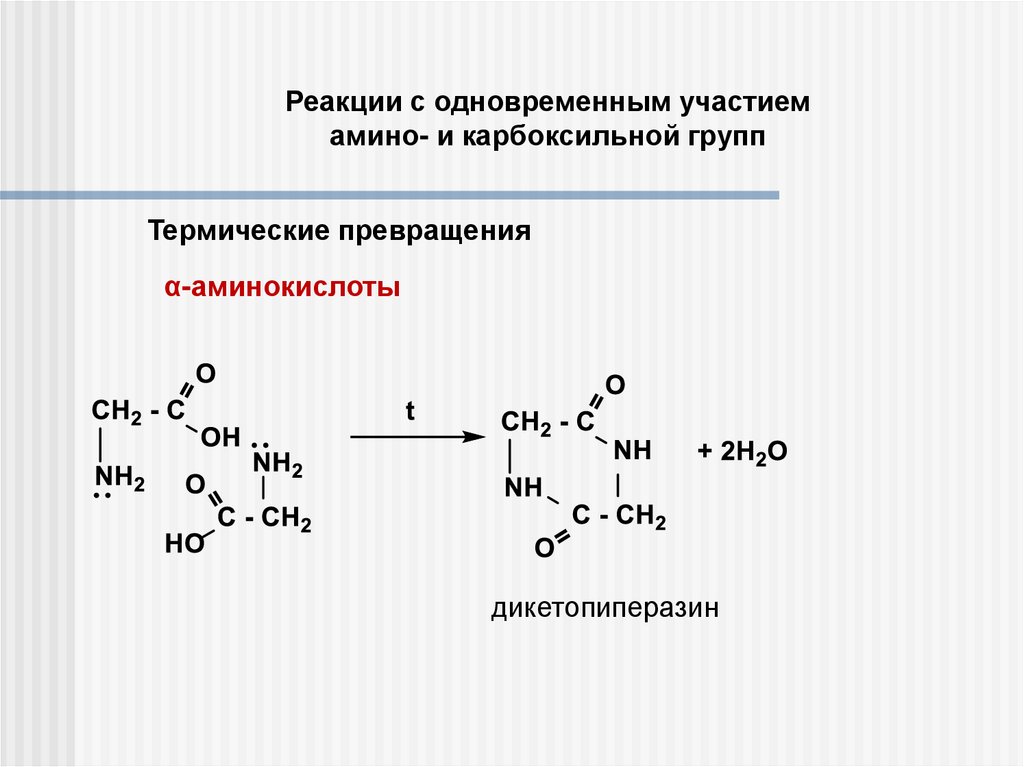
Реакции с одновременным участиемамино- и карбоксильной групп
Термические превращения
α-аминокислоты
дикетопиперазин
21.
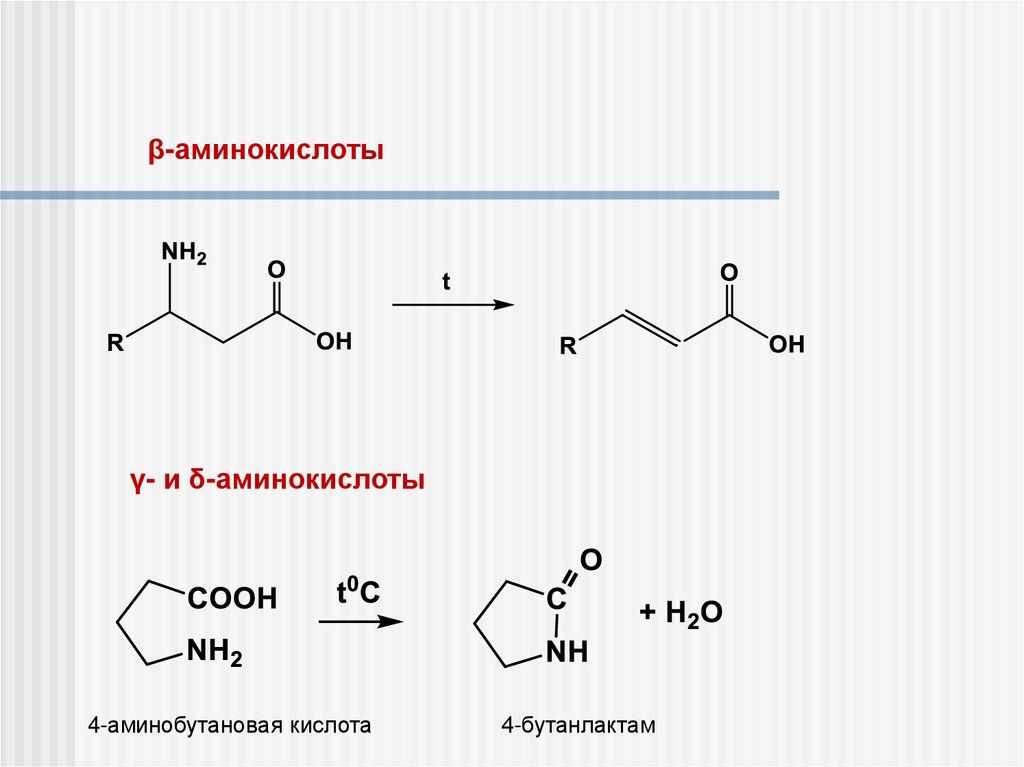
β-аминокислотыγ- и δ-аминокислоты
4-аминобутановая кислота
4-бутанлактам
22.
ε-аминокислотыnH2N(CH2)5COOH → -[ NH – (CH2)5 – CO - ]n + nH2O
6-аминогексановая кислота
поли-ε-капролактам
23.
Пептидыпептидная связь
24.
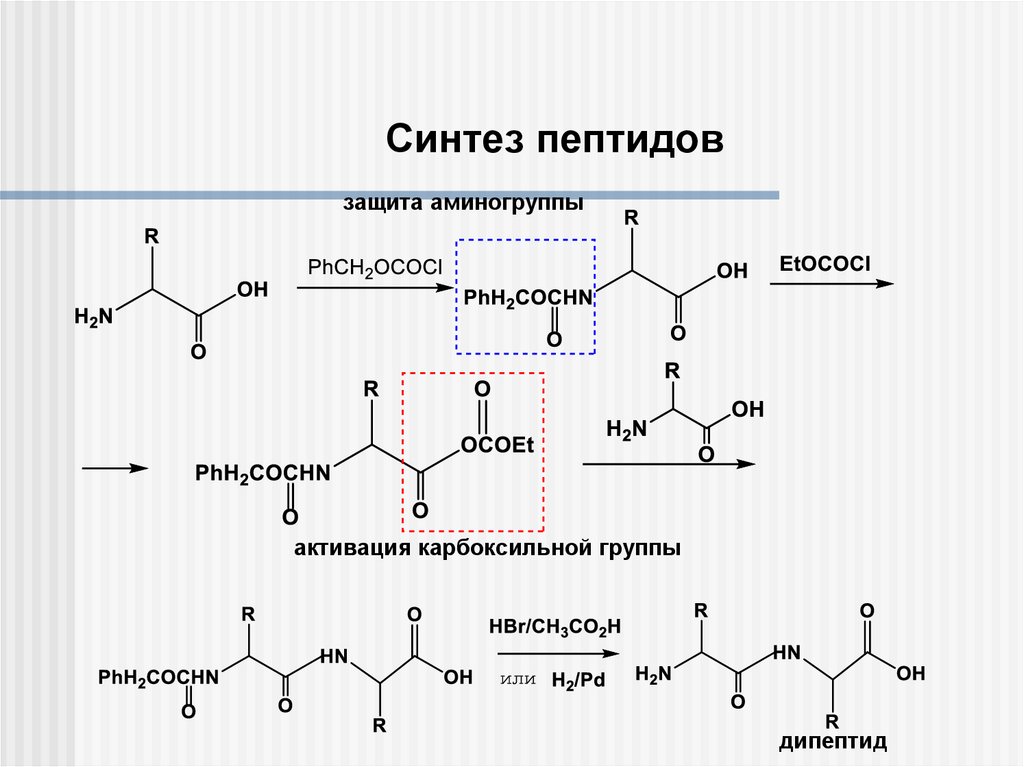
Синтез пептидовзащита аминогруппы
активация карбоксильной группы
дипептид
25.
Приведите аминокислотную последовательность Ala-Gly-Ala.Какие продукты образуются в результате полного гидролиза этого
пептида в среде хлороводородной кислоты?
остаток
аланина
остаток
глицина
остаток
аланина
26.
Уровни структурной организации белковыхмолекул
Каждый белок имеет свой неповторимый аминокислотный
состав и уникальный порядок соединения аминокислот,
называемый первичной структурой белка
27.
пространственная структура отдельных участков белка,приводит к вторичной структуре белковой молекулы
(α-спирали и β-слои)
28.
третичная структура, характеризуется ориентациейполипептидных цепей в пространстве
29.
четвертичной структурой называют ассоциированные междусобой две или более субъединиц, ориентированных в
пространстве
30. Физико-химические свойства белков
1. Коллоидное состояние белковых веществ2. Растворимость и осаждаемость белков
3. Денатурация белков
31. Качественные реакции на аминокислоты и белки
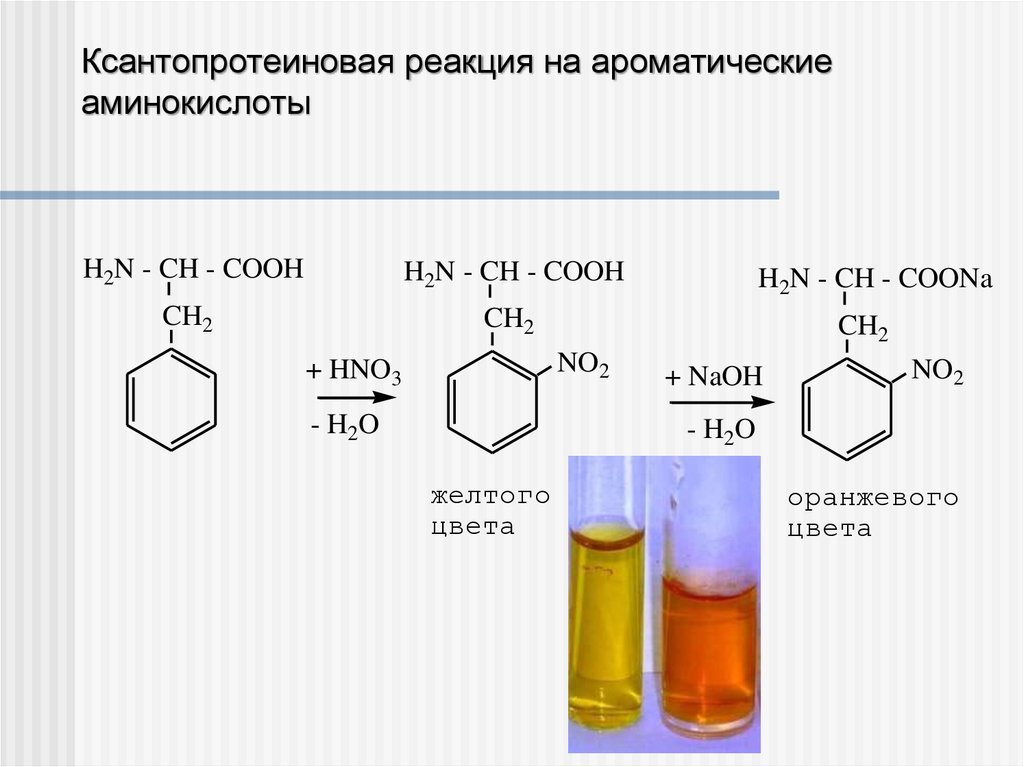
Биуретовая реакция на пептидную связь32. Ксантопротеиновая реакция на ароматические аминокислоты
H2N - CH - COOHH2N - CH - COOH
CH2
CH2
CH2
NO2
+ HNO3
- H2O
H2N - CH - COONa
+ NaOH
NO2
- H2O
желтого
цвета
оранжевого
цвета
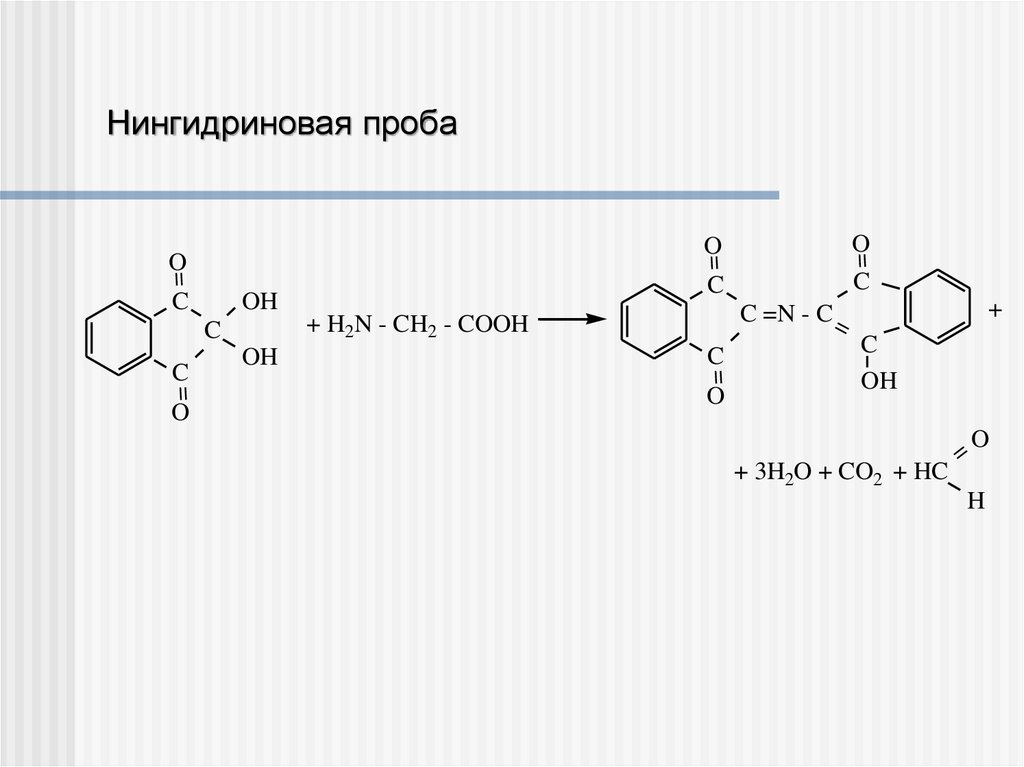
33. Нингидриновая проба
=OH
C
C =N - C=
+ H2N - CH2 - COOH
C
=
OH
C
O
=
=
=
C
C
O
C
O
O
O
+
C
OH
+ 3H2O + CO2 + HC
=
O
H
34. Сульфгидрильная реакция
35. Белковые вещества:
1. Простые белки (Протеины)2. Сложные белки (Протеиды)
36.
Простые белки – эти макромолекулы состоят толькоиз аминокислотных остатков.
Альбумины
Глобулины
Гистоны
Протамины
Сложные белки - состоят из белковой части, к
которой присоединена небелковая, или простетическая
группа.
37.
Липопротеины - соединения простых белков, с жирамиили липоидами
Гликопротеины -представляют собой соединения
простых белков с углеводами
Фосфопротеины – в качестве простетической группы
содержат ортофосфорную кислоту, связанную с
гидроксилом серина или треонина
Хромопротеины- сложные белки, в состав которых
входят окрашенные небелковые компоненты
Нуклеопротеины- простатической группой является
нуклеиновая кислота
38. Биологическая роль пептидов
Участвуют в регуляции различных биологических процессов• Пептидные гормоны (инсулин, окситоцин, вазопрессин)
• Пептиды, регулирующие процессы пищеварения (эндорфин,
гастрин)
• Пептиды, обладающие обезболивающим действием (опиоидные
пептиды)
39. Классификация белков по функциям
• Ферменты• Регуляторные белки
• Рецепторные белки
•Транспортные белки
•Структурные белки
•Защитные белки (белки иммунной системы)






























 chemistry
chemistry