Similar presentations:
Биофизика как наука
1. Биофизика как наука
2.
Биофизика - наука, изучающая физические ифизико-химические процессы, которые
протекают в биологических системах на разных
уровнях организации и являются основой
физиологических актов.
3.
В 1961 году был создан Международный союзчистой и прикладной биофизики (IUPAB)
4.
Цель биофизики: изучение фундаментальныхпроцессов, обеспечивающих основу
жизнедеятельности всех без исключения живых
организмов, независимо от уровня развития,
эволюционной ступени, возраста индивидуума,
среды обитания
5.
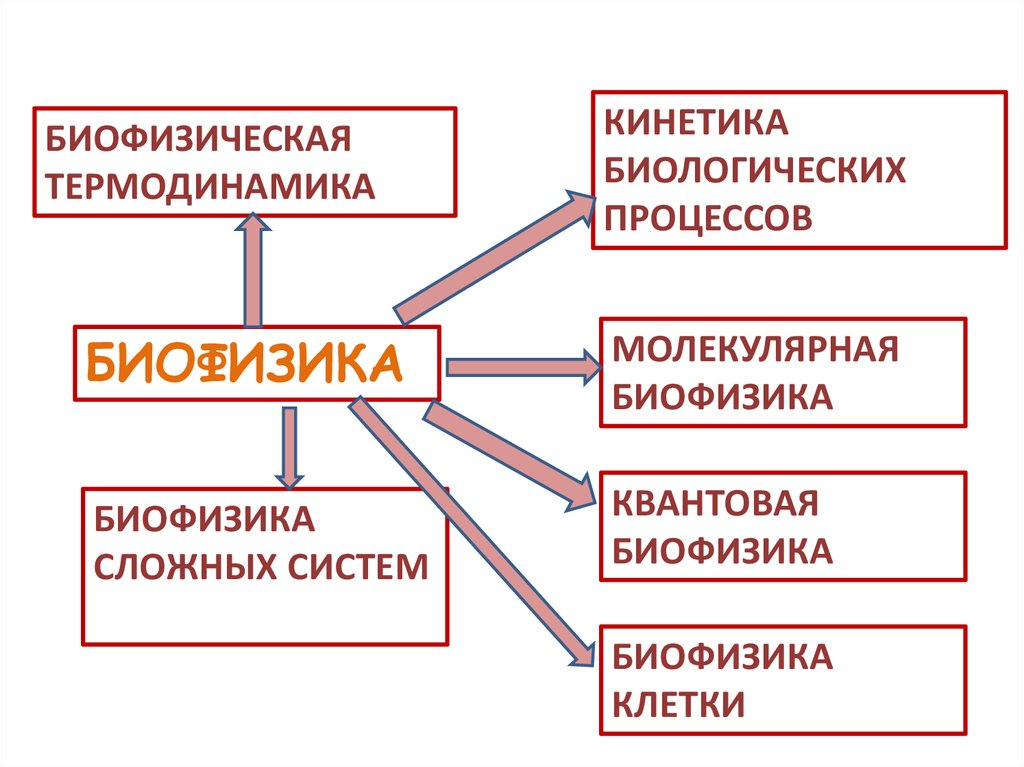
БИОФИЗИЧЕСКАЯТЕРМОДИНАМИКА
КИНЕТИКА
БИОЛОГИЧЕСКИХ
ПРОЦЕССОВ
БИОФИЗИКА
МОЛЕКУЛЯРНАЯ
БИОФИЗИКА
БИОФИЗИКА
СЛОЖНЫХ СИСТЕМ
КВАНТОВАЯ
БИОФИЗИКА
БИОФИЗИКА
КЛЕТКИ
6.
ОСОБЕННОСТИ БИОФИЗИЧЕСКИХМЕТОДОВ ИССЛЕДОВАНИЯ
КОЛИЧЕСТВЕННЫЕ
МЕТОДЫ
ИЗУЧАЕМЫЙ ОБЪЕКТ
РАССМАТРИВАЕТСЯ В
ЦЕЛОМ
СИСТЕМНЫЙ ПОДХОД
7.
Значение биофизики для теоретической ипрактической медицины
раскрытие механизмов возникновения и
протекания патологических процессов в организме на
молекулярном уровне
разработка путей лечения заболевания
разработка методов исследования
8. ОСНОВЫ БИОЛОГИЧЕСКОЙ ТЕРМОДИНАМИКИ
9.
Основные понятия термодинамикиПервый и второй законы термодинамики
Биокалориметрия
Термодинамические потенциалы
Термодинамическое равновесие
состояние и стационарное состояние
Уравнение Пригожина и его анализ
Понятие обобщенной силы и потока, их
взаимосвязь
Принцип взаимности Онзагера. Теорема
Пригожина
10.
ТЕРМОДИНАМИКА –наука,изучающая наиболее общие
законы превращения энергии
11. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ
12.
ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА –часть пространства с материальным
содержимым, ограниченная от
окружающей среды
Любой объект
материального мира
является
термодинамической
системой.
13.
ТЕРМОДИНАМИЧЕСКИЕСИСТЕМЫ
ИЗОЛИРОВАННЫЕ
ЗАКРЫТЫЕ
ОТКРЫТЫЕ
14.
Математическиймаятник ИЗОЛИРОВАННАЯ
СИСТЕМА
ЗАМКНУТАЯ СИСТЕМА
ОТКРЫТАЯ СИСТЕМА
15.
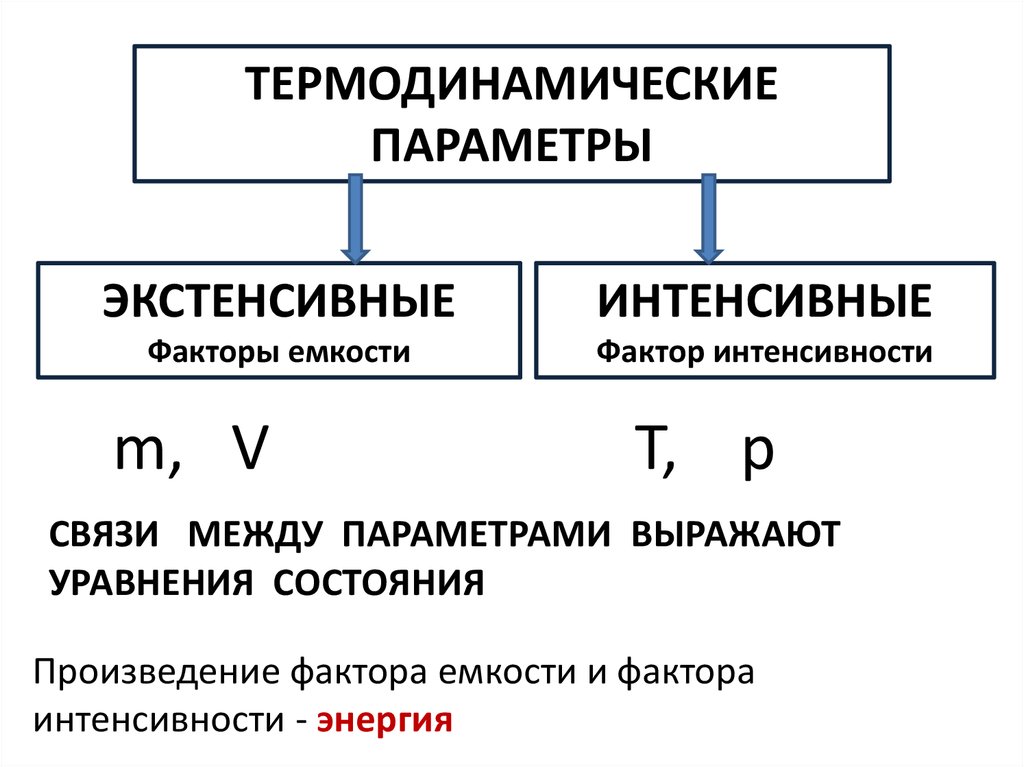
ТЕРМОДИНАМИЧЕСКИЕПАРАМЕТРЫ
ЭКСТЕНСИВНЫЕ
ИНТЕНСИВНЫЕ
Факторы емкости
Фактор интенсивности
m, V
T, p
СВЯЗИ МЕЖДУ ПАРАМЕТРАМИ ВЫРАЖАЮТ
УРАВНЕНИЯ СОСТОЯНИЯ
Произведение фактора емкости и фактора
интенсивности - энергия
16.
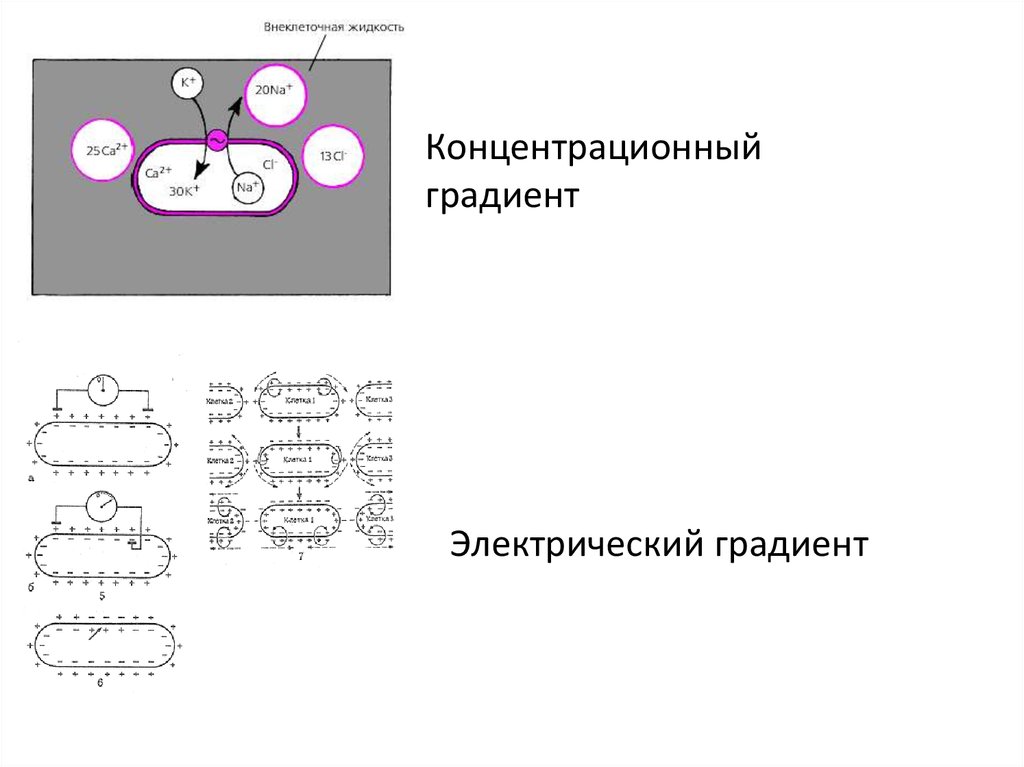
СОСТОЯНИЕ СИСТЕМЫРАВНОВЕСНОЕ СОСТОЯНИЕ: ПАРАМЕТРЫ
СИСТЕМЫ НЕ МЕНЯЮТСЯ С ТЕЧЕНИЕМ ВРЕМЕНИ,
ИНТЕНСИВНЫЕ ПАРАМЕТРЫ ОДИНАКОВЫ ВО ВСЕХ
ТОЧКАХ СИСТЕМЫ .т.е.ГРАДИЕНТЫ РАВНЫ 0
НЕРАВНОВЕСНОЕ СОСТОЯНИЕ: ИНТЕНСИВНЫЕ
ПАРАМЕТРЫ НЕОДНАКОВЫ В РАЗНЫХ ТОЧКАХ СИСТЕМЫ, А
ЗНАЧИТ, СУЩЕСТВУЮТ ГРАДИЕНТЫ,
ЧТО ПРИВОДИТ К ПЕРЕХОДУ В НОВОЕ СОСТОЯНИЕ
17.
Концентрационныйградиент
Электрический градиент
18.
ТЕРМОДИНАМИЧЕСКИЕПРОЦЕССЫ
ОБРАТИМЫЕ
НЕОБРАТИМЫЕ
ВОЗМОЖЕН ПЕРЕХОД ИЗ A в
ВОЗМОЖЕН ПЕРЕХОД ИЗ 1 в 2 И ИЗ 2
В 1 без затрат
энергии
В через R.
ПЕРЕХОД ИЗ В В А ЧЕРЕЗ I НЕВОЗМОЖЕН,
т.к. ПЕРЕХОД A-R-B СОПРОВОЖДАЕТСЯ
ПОТЕРЯМИ ЭНЕРГИИ
19.
ПЕРВЫЙ ЗАКОНТЕРМОДИНАМИКИ
Юлиус Роберт
Майер
(1814-1878)
КОНКРЕТИЗАЦИЯ
ЗАКОНА
СОХРАНЕНИЯ
ЭНЕРГИИ
Джеймс Прескотт
Джоуль
(1818-1889)
20.
Энергия характеризует способность теласовершать работу
21.
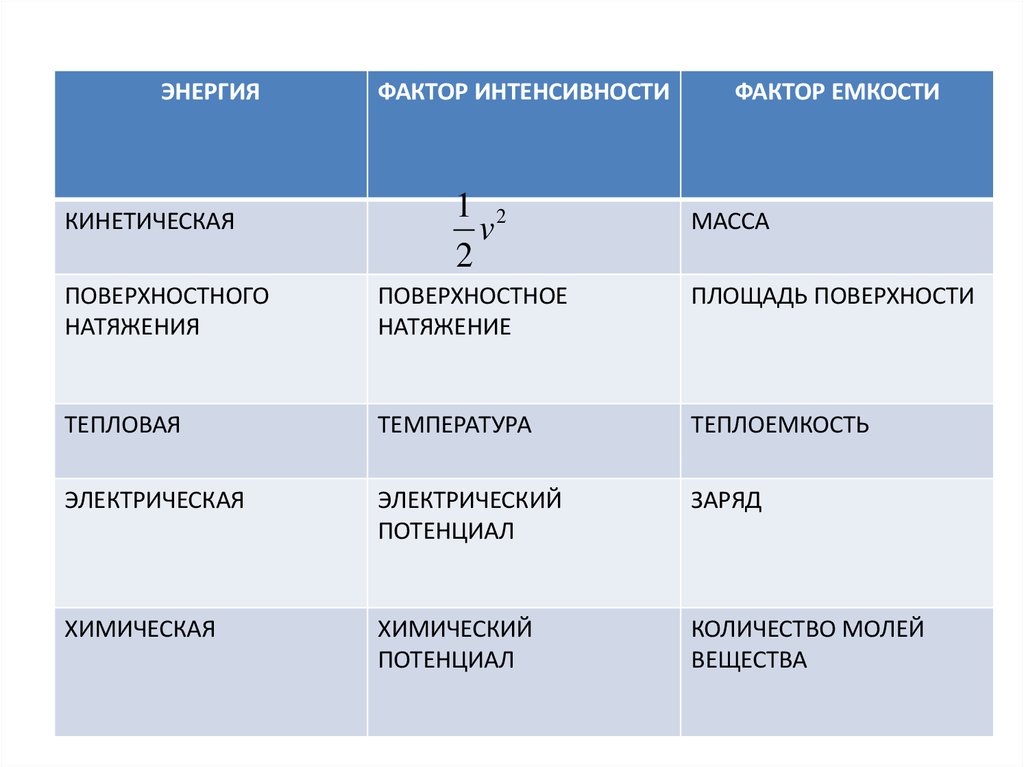
ЭНЕРГИЯКИНЕТИЧЕСКАЯ
ФАКТОР ИНТЕНСИВНОСТИ
1 2
v
2
ФАКТОР ЕМКОСТИ
МАССА
ПОВЕРХНОСТНОГО
НАТЯЖЕНИЯ
ПОВЕРХНОСТНОЕ
НАТЯЖЕНИЕ
ПЛОЩАДЬ ПОВЕРХНОСТИ
ТЕПЛОВАЯ
ТЕМПЕРАТУРА
ТЕПЛОЕМКОСТЬ
ЭЛЕКТРИЧЕСКАЯ
ЭЛЕКТРИЧЕСКИЙ
ПОТЕНЦИАЛ
ЗАРЯД
ХИМИЧЕСКАЯ
ХИМИЧЕСКИЙ
ПОТЕНЦИАЛ
КОЛИЧЕСТВО МОЛЕЙ
ВЕЩЕСТВА
22.
ТЕРМОДИНАМИЧЕСКИЕПОТЕНЦИАЛЫ
U – ВНУТРЕННЯЯ ЭНЕРГИЯ
H - ЭНТАЛЬПИЯ
S - ЭНТРОПИЯ
G – СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
F - СВОБОДНАЯ ЭНЕРГИЯ
ГЕЛЬМГОЛЬЦА
ПОЛНЫЕ ДИФФЕРЕНЦИАЛЫ
ФУНКЦИИ СОСТОЯНИЯ СИСТЕМЫ, т.к. не
зависят от пути протекания процесса
23.
ВНУТРЕННЯЯ ЭНЕРГИЯU f (m, p,V , T )
dU
– полный дифференциал
dU
0
24.
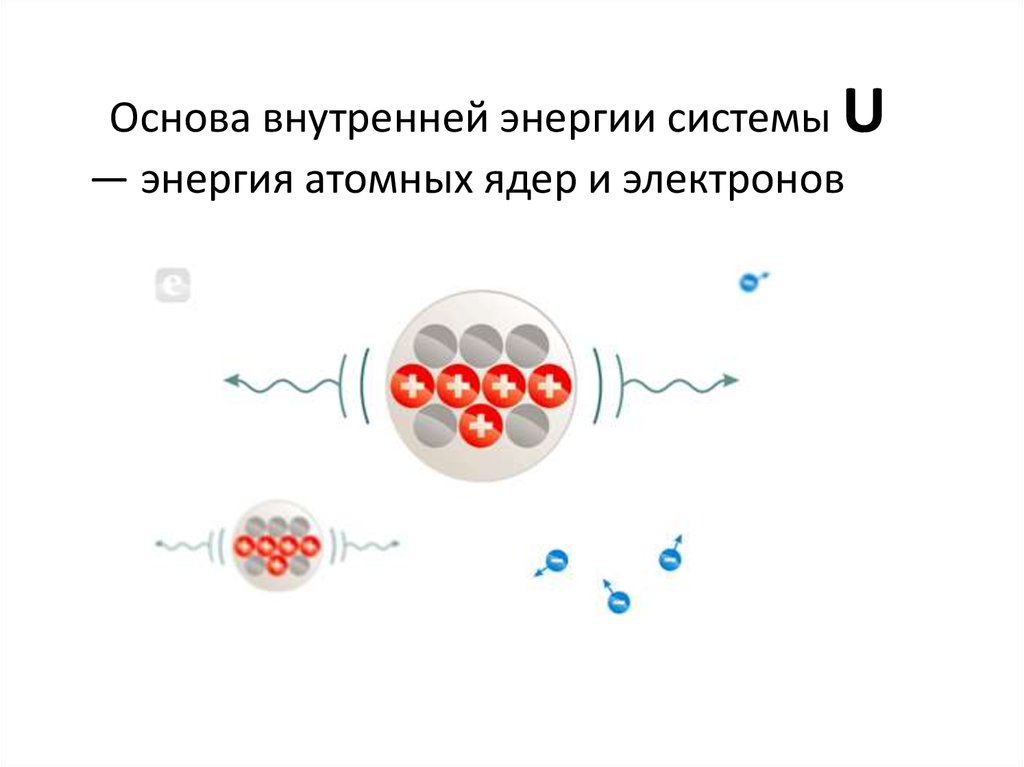
Основа внутренней энергии системы U— энергия атомных ядер и электронов
25.
ФОРМУЛИРОВКАПЕРВОГО ЗАКОНА
ТЕРМОДИНАМИКИ:
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ
ЭНЕРГИИ СИСТЕМЫ
ПРОИСХОДИТ ЗА СЧЕТ
СОВЕРШЕНИЯ РАБОТЫ
или
ПЕРЕДАЧИ ТЕЛУ
ОПРЕДЕЛЕННОГО КОЛИЧЕСТВА
ТЕПЛОТЫ
26.
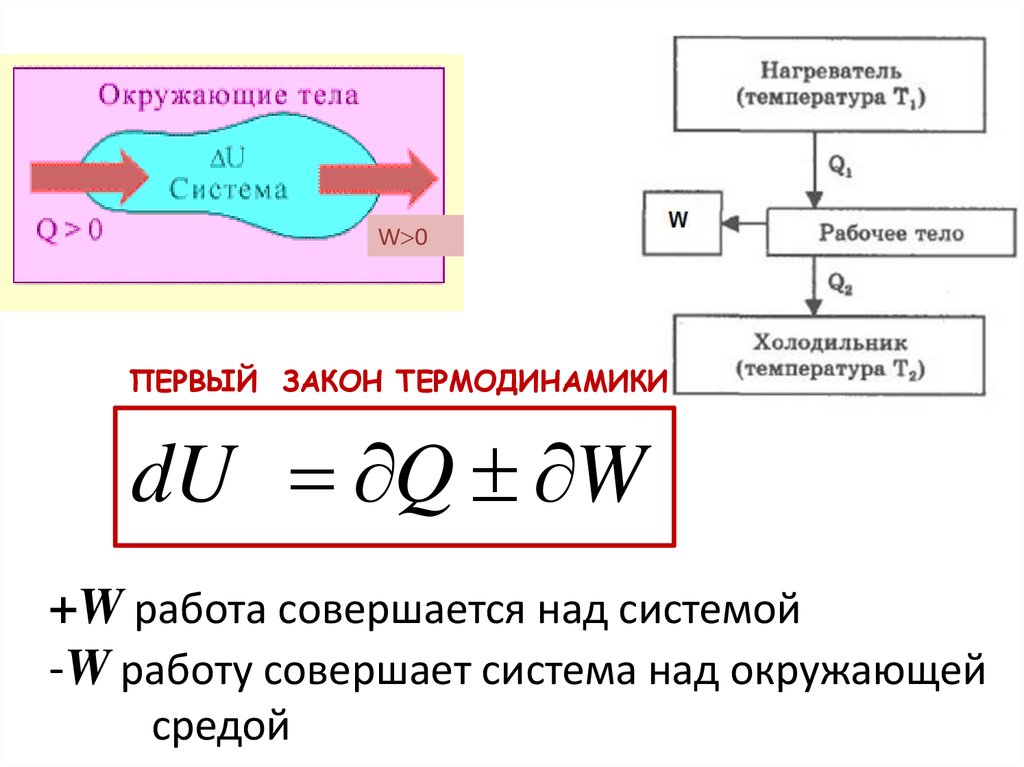
W 0W
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
dU Q W
+W работа совершается над системой
-W работу совершает система над окружающей
средой
27. СЛЕДСТВИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ
ЭНТАЛЬПИЯ – функция состояния системы прир=const
28.
ЗАКОНГ.И.Гесс
(1802–1850)
ГЕССА
Теплота, выделяемая в
химическом процессе не зависит
от того, протекает этот процесс в
одну или в несколько стадий
29.
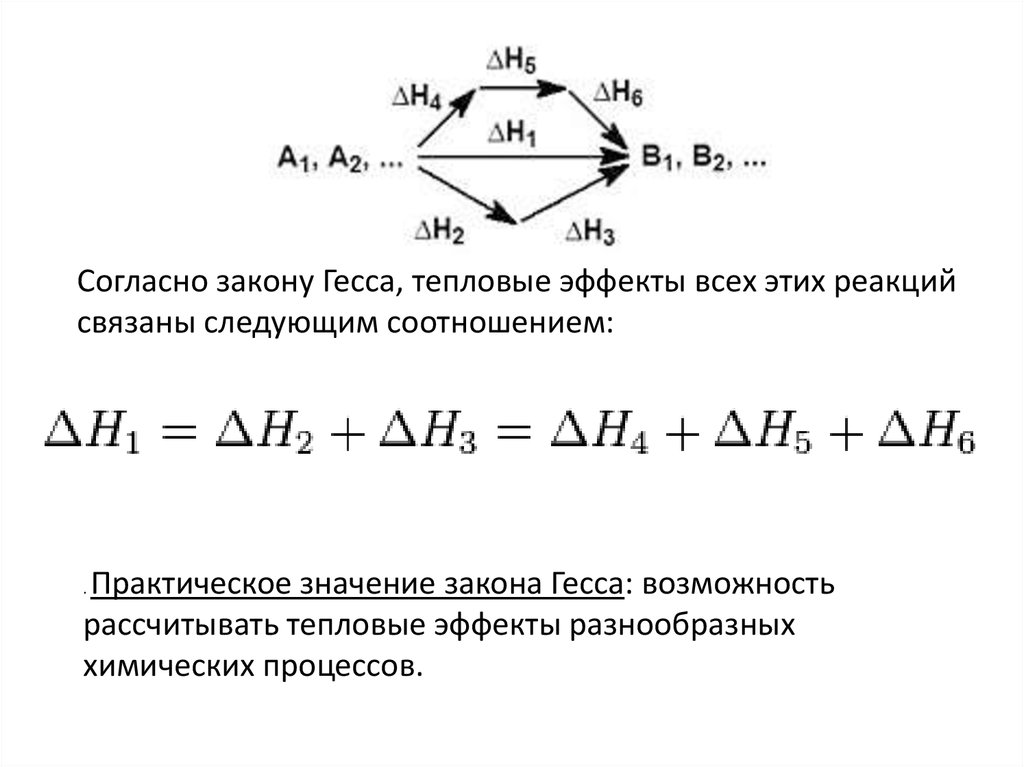
Согласно закону Гесса, тепловые эффекты всех этих реакцийсвязаны следующим соотношением:
Практическое значение закона Гесса: возможность
рассчитывать тепловые эффекты разнообразных
химических процессов.
.
30.
ТЕПЛОВАЯ МАШИНА:ТЕПЛО РАБОТА
БИОЛОГИЧЕСКИЙ ОБЪЕКТ:
ХИМИЧЕСКАЯ ЭНЕРГИЯ РАБОТА
31.
ПРИМЕНИМОСТЬ 1 ЗАКОНА ТЕРМОДИНАМИКИ КЖИВЫМ СИСТЕМАМ
Опыты ЛАВУАЗЬЕ и ЛАПЛАСА (XVIII век)
32.
Опыты ЭТУОТЕРА (ХХ век)Биокалориметр Этуотера — Бенедикта (схема).
33.
КАЛОРИМЕТРИЯ—совокупность
методов
измерения
тепловых
эффектов,
сопровождающих
различные физические, химические и
биологические процессы.
34.
Прямая калориметрия основана наизмерении количества тепла, непосредственно
рассеянного организмом в теплоизолированной
камере.
Калориметр («бомба») Бертло 1— проба
пищи; 2 — камера, заполненная кислородом;
запал; 4 — вода; 5 — мешалка; 6 —
термометр.
35.
НЕПРЯМАЯ КАЛОРИМЕТРИЯ основана наизмерении количества потребленного
организмом кислорода и последующем
расчете энергозатрат с использованием данных
о величинах дыхательного коэффициента
(ДК) и калорического эквивалента
кислорода (КЭ02).
36.
.Респираторный аппарат Шатерникова (схема).
К— камера; Б — баллон с O2; H — мотор, выкачивающий воздух из
камеры;'3 — змеевик для охлаждения воздуха; Щ — сосуд, наполненный
раствором щелочи для поглощения СО2; В — баллон для поглощения
водяных паров хлоридом кальция; Т — термометры. Слева устройство для
автоматической подачи О2 в камеру и поддержания постоянства давления в
ней.
37.
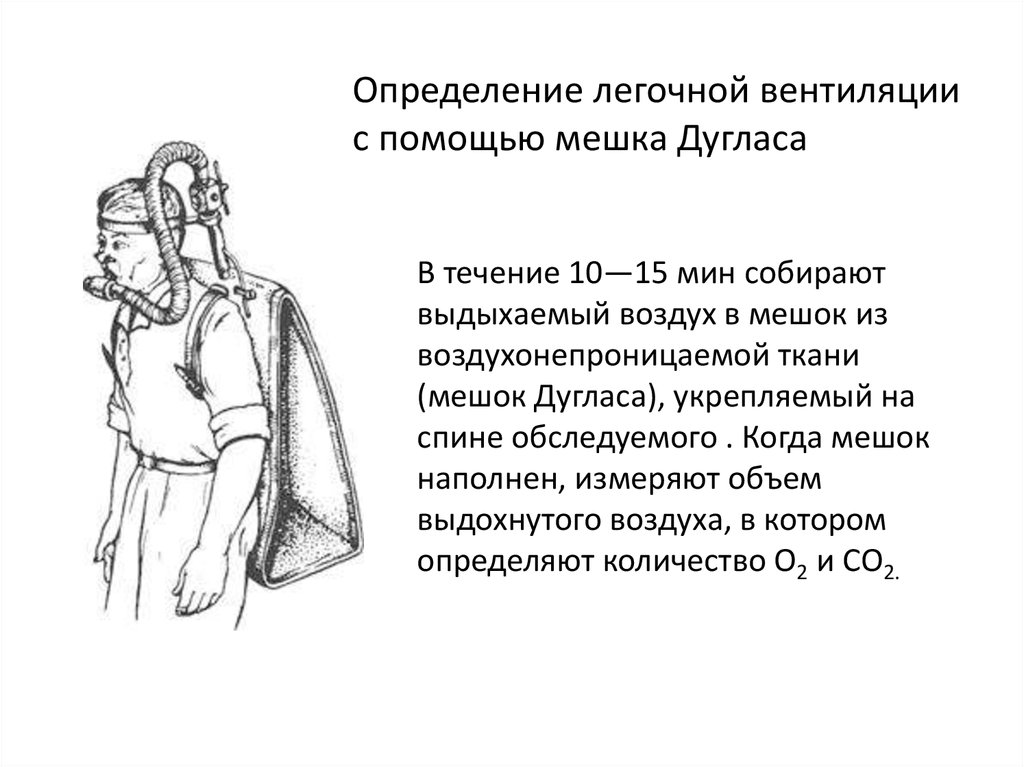
Определение легочной вентиляциис помощью мешка Дугласа
В течение 10—15 мин собирают
выдыхаемый воздух в мешок из
воздухонепроницаемой ткани
(мешок Дугласа), укрепляемый на
спине обследуемого . Когда мешок
наполнен, измеряют объем
выдохнутого воздуха, в котором
определяют количество О2 и СО2.
38.
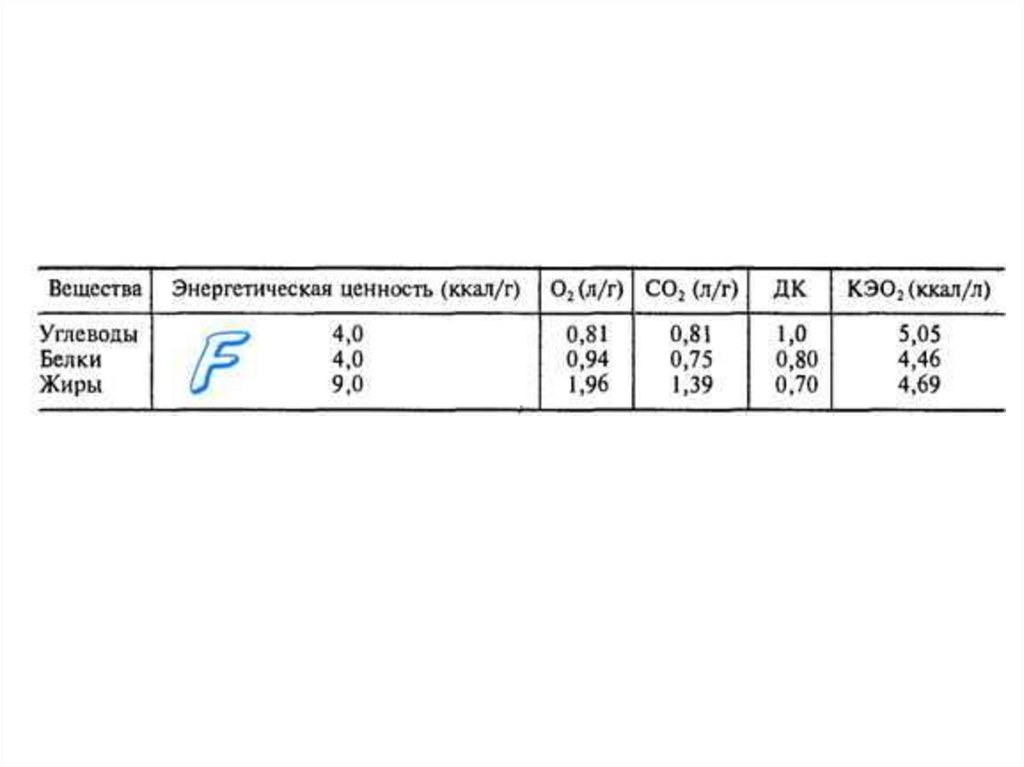
КАЛОРИЧЕСКИЙ ЭКВИВАЛЕНТКИСЛОРОДА (КЭО2) - количество тепла,
освобождающегося после потребления
организмом 1 л О2.
ДЫХАТЕЛЬНЫЙ КОЭФФИЦИЕНТ (ДК)отношение объема выделенного
углекислого газа к объему поглощенного
кислорода.
39.
40. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ ОПРЕДЕЛЯЕТ НАПРАВЛЕНИЕ ПРОЦЕССА
41.
Р.КЛАУЗИУС1822-1888
Теплота не может переходить
сама собой от более холодного
тела к более теплому.
42.
Понятие энтропии было впервые введено в 1865 годуР. Клаузиусом.
Изменение энтропии термодинамической системы
при обратимом процессе есть отношение
изменения общего количества тепла ΔQ к
величине абсолютной температуры T:
или
ЭНТРОПИЯ – ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
При условии Т=const
43. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
QdS 0
T
44. СВЯЗЬ ЭНТРОПИИ С УПОРЯДОЧЕННОСТЬЮ СИСТЕМЫ
ЭНТРОПИЯЛЕД
41 кДж/К
ВОДА (жидкая)
70 кДж/К
ПАР
189 кДж/К
S
45.
РАСПРЕДЕЛЕНИЕВИДОВ ЭНЕРГИЙ ПО
КАЧЕСТВУ В СООТВЕТСТВИИ С ВЕЛИЧИНОЙ
ЭНТРОПИИ В ХОДЕ ПРЕОБРАЗОВАНИЯ
ЭНЕРГИИ В РАБОТУ
Качество энергии
ВИД ЭНЕРГИИ
ВЫСОКОЕ
ГРАВИТАЦИОННАЯ 0
СРЕДНЕЕ
НИЗКОЕ
ЭНТРОПИЯ
ЯДЕРНАЯ
10-6
СВЕТОВАЯ
1
ЭЛЕКТРИЧЕКАЯ
1-10
ХИМИЧЕСКАЯ
1-10
ТЕПЛОВАЯ
10-100
Дж/К
46. ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
47.
1закон термодинамикиdU Q W
-W СИСТЕМА СОВЕРШАЕТ РАБОТУ
2 закон термодинамики
Q TdS
Объединенная запись
TdS dU W
Связанная энергия
48.
СВЯЗАННАЯ ЭНЕРГИЯ TdS РАССЕИВАЕТСЯ В ВИДЕТЕПЛА
СВОБОДНАЯ ЭНЕРГИЯ ТРАТИТСЯ НА СОВЕРШЕНИЕ
ПОЛЕЗНОЙ РАБОТЫ
49.
СВОБОДНАЯ ЭНЕРГИЯГЕЛЬМГОЛЬЦА
При V=const, T=const
Г.Гельмгольц
1821-1894
dF dU TdS
50.
СВОБОДНАЯ ЭНЕРГИЯГИББСА
При p=const, T=const
Дж.У.Гиббс
1839-1903
dG dH TdS
51.
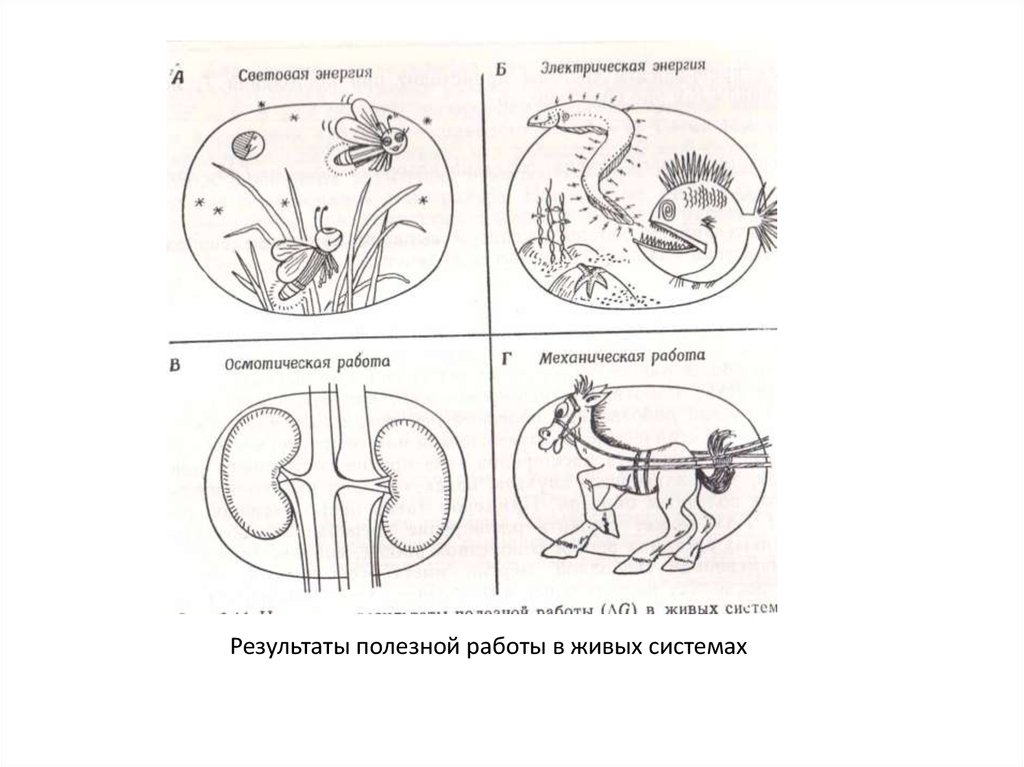
Результаты полезной работы в живых системах52.
Термодинамическоеравновесие
–
фундаментальное
понятие
классической
термодинамики,
характерно
для
изолированных и замкнутых систем
Энтропия максимальна, свободная энергия равна 0.
Система не может совершать работу.
Устойчивое состояние
53.
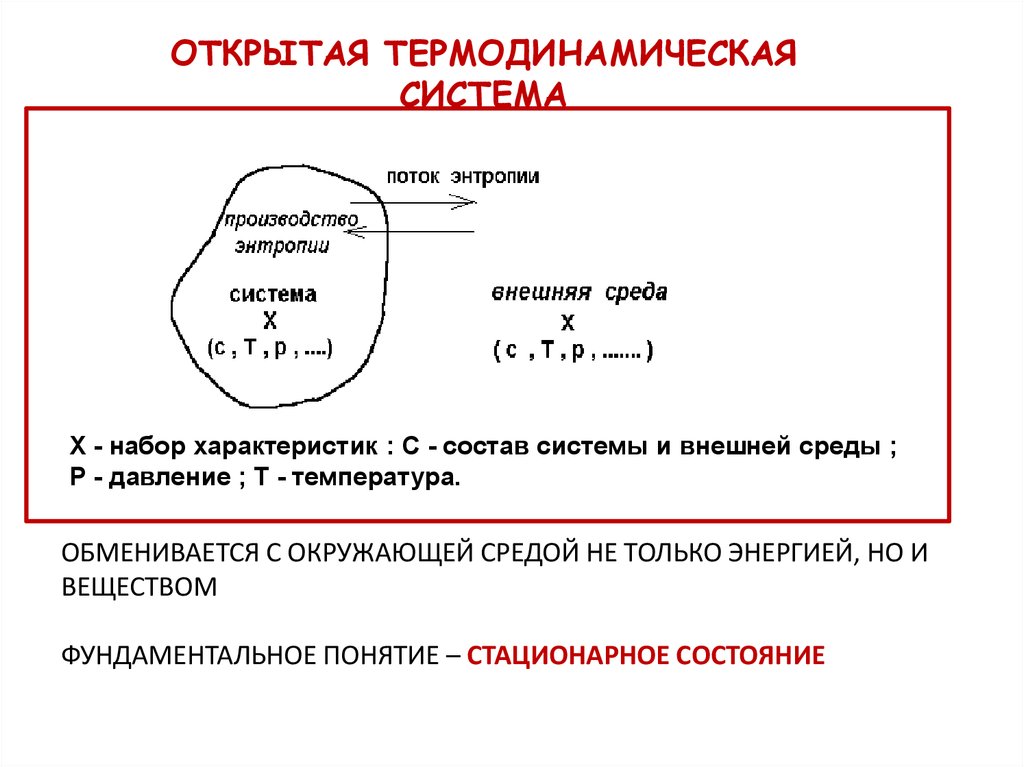
ОТКРЫТАЯ ТЕРМОДИНАМИЧЕСКАЯСИСТЕМА
Х - набор характеристик : С - состав системы и внешней среды ;
Р - давление ; Т - температура.
ОБМЕНИВАЕТСЯ С ОКРУЖАЮЩЕЙ СРЕДОЙ НЕ ТОЛЬКО ЭНЕРГИЕЙ, НО И
ВЕЩЕСТВОМ
ФУНДАМЕНТАЛЬНОЕ ПОНЯТИЕ – СТАЦИОНАРНОЕ СОСТОЯНИЕ
54.
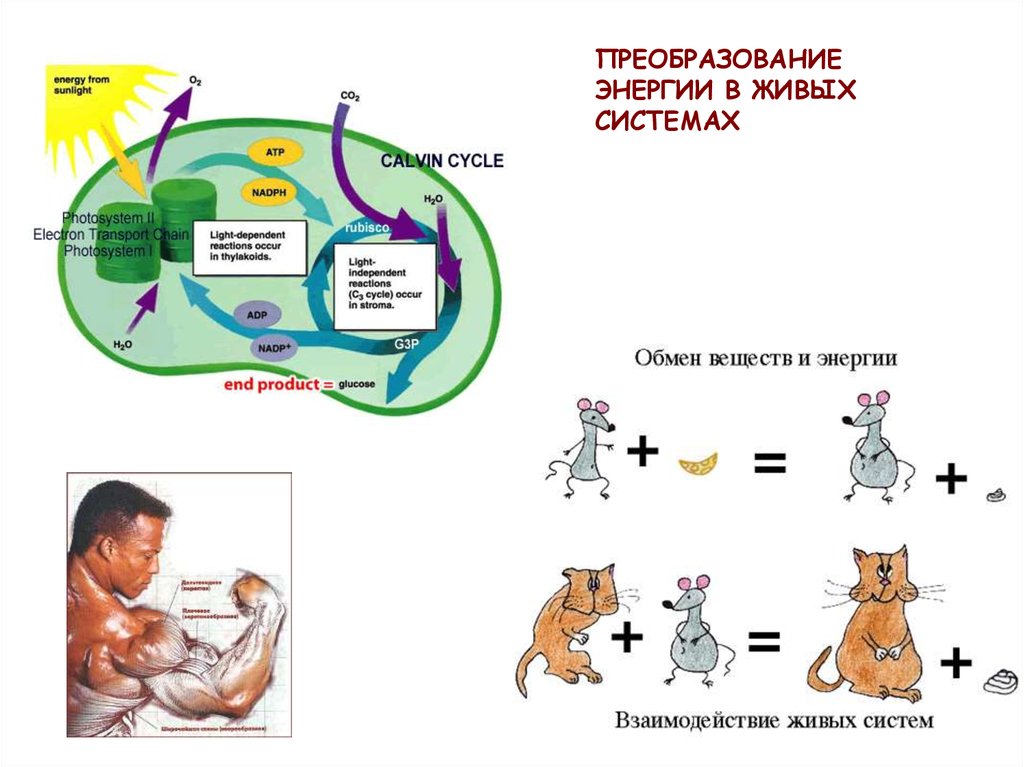
ПРЕОБРАЗОВАНИЕЭНЕРГИИ В ЖИВЫХ
СИСТЕМАХ
55. СТАЦИОНАРНОЕ СОСТОЯНИЕ И ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ
ОБЩЕЕ: основные макроскопические параметры системыостаются постоянными
Отличия
Термодинамическое равновесие
Стационарное состояние
Свободная энергия
минимальна (равна 0)
Свободная энергия
постоянна, но не минимальна
Энтропия максимальна
Энтропия постоянна, но не
максимальна
Градиенты присутствуют
Градиенты отсутствуют
56. ИЗМЕНЕНИЕ ЭНТРОПИИ В ОТКРЫТЫХ СИСТЕМАХ
dS dSe dSi57.
СКОРОСТЬ ПРОДУКЦИИ ЭНТРОПИИ ВОТКРЫТЫХ СИСТЕМАХ
dS dSe dSi
dt
dt
dt
dSi
dSe
dSe
0,
0или
0
dt
dt
dt
ДЛЯ
НЕОБРАТИМЫХ
ПРОЦЕССОВ
dSe/dt может принимать разные значения
58.
dSidSe
dSe dSi
0,
0, но
dt
dt
dt dt
ТОГДА
dS
0
dt
ПРОТИВОРЕЧИЕ СО
ВТОРЫМ ЗАКОНОМ
ТЕРМОДИНАМИКИ
59. СТАЦИОНАРНОЕ СОСТОЯНИЕ
dS dSe dSi0
dt
dt
dt
dSi
dSe
dt
dt
60. ТЕРМОДИНАМИЧЕСКИЕ СИЛЫ И ПОТОКИ
61.
СИЛЫ И ПОТОКИ В НЕРАВНОВЕСНОЙ ТЕРМОДИНАМИКЕ62.
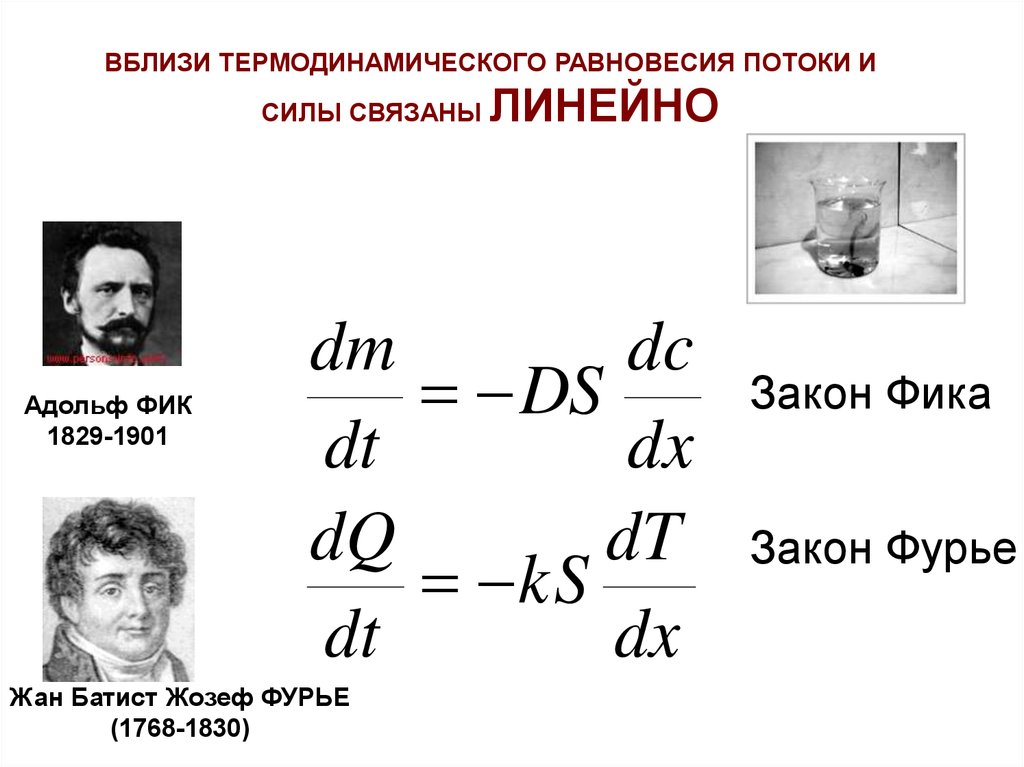
ВБЛИЗИ ТЕРМОДИНАМИЧЕСКОГО РАВНОВЕСИЯ ПОТОКИ ИСИЛЫ СВЯЗАНЫ
Адольф ФИК
1829-1901
ЛИНЕЙНО
dm
dc
DS
dt
dx
dQ
dT
kS
dt
dx
Жан Батист Жозеф ФУРЬЕ
(1768-1830)
Закон Фика
Закон Фурье
63.
Принцип взаимностиОнзагера
J1 L11 X 1 L12 X 2
Ларс ОНЗАГЕР
1903 - 1976
J 2 L22 X 2 L21 X 1
Нобелевская премия
по химии, 1968 г.
L12 L21
J 1 , J 2 потоки
X 1 , X 2 силы
L11 , L22 коэффициен ты" прямых" процессов
L12 , L21 " феноменологические" коэффициен ты
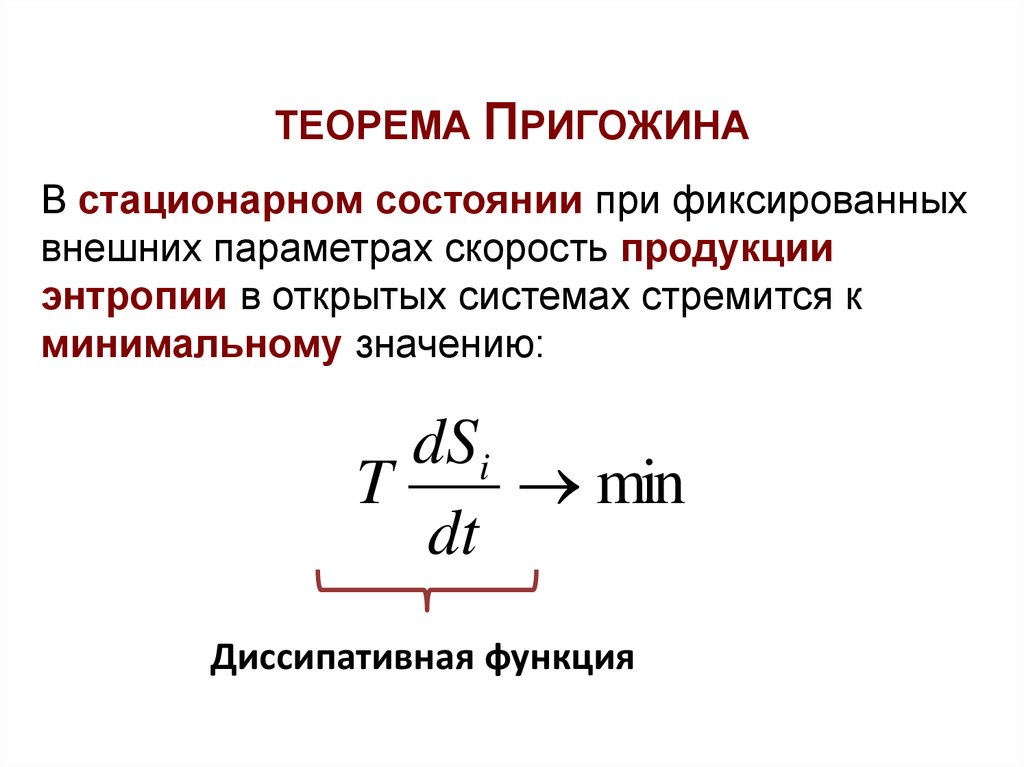
64. ТЕОРЕМА ПРИГОЖИНА о скорости продукции энтропии в открытой системе
И.Р.Пригожин1917 – 2003
Нобелевская премия по химии,
1977
65.
ТЕОРЕМА ПРИГОЖИНАВ стационарном состоянии при фиксированных
внешних параметрах скорость продукции
энтропии в открытых системах стремится к
минимальному значению:
dSi
T
min
dt
Диссипативная функция
66.
Открытая система эволюционирует кстационарному состоянию , которое
характеризуется минимальным
производством энтропии , при данных
условиях.




















































 physics
physics







![II Закон термодинамики. Энтропия “S”- термодинамическая функция состояния [Дж/моль К] (Клаузиус) II Закон термодинамики. Энтропия “S”- термодинамическая функция состояния [Дж/моль К] (Клаузиус)](https://cf3.ppt-online.org/files3/thumb/s/shTr2KkzXY6Gb1DP9c5MVIEZmtq4nJoUfBC7Ll.jpg)
