Similar presentations:
Спирты. Лекция
1.
Спирты• Гидроксильные производные углеводородов называются спиртами
Spiritus vini (лат.) – душа вина.
RCH2OH – первичные спирты
R2CHOH – вторичные спирты
R3COH – третичные спирты
H3C
H2 H2 H2
C C C OH
Бутанол-1 (н-бутанол)
H3C
OH
Бутанол-2
CH3
HO
H2
C C
H
H2
C CH3
H
C
CH3
CH3
2-метил пропанол-1 (изо-бутанол)
H3 C
C
OH
CH3
2-метил пропанол-2 (трет-бутанол)
2.
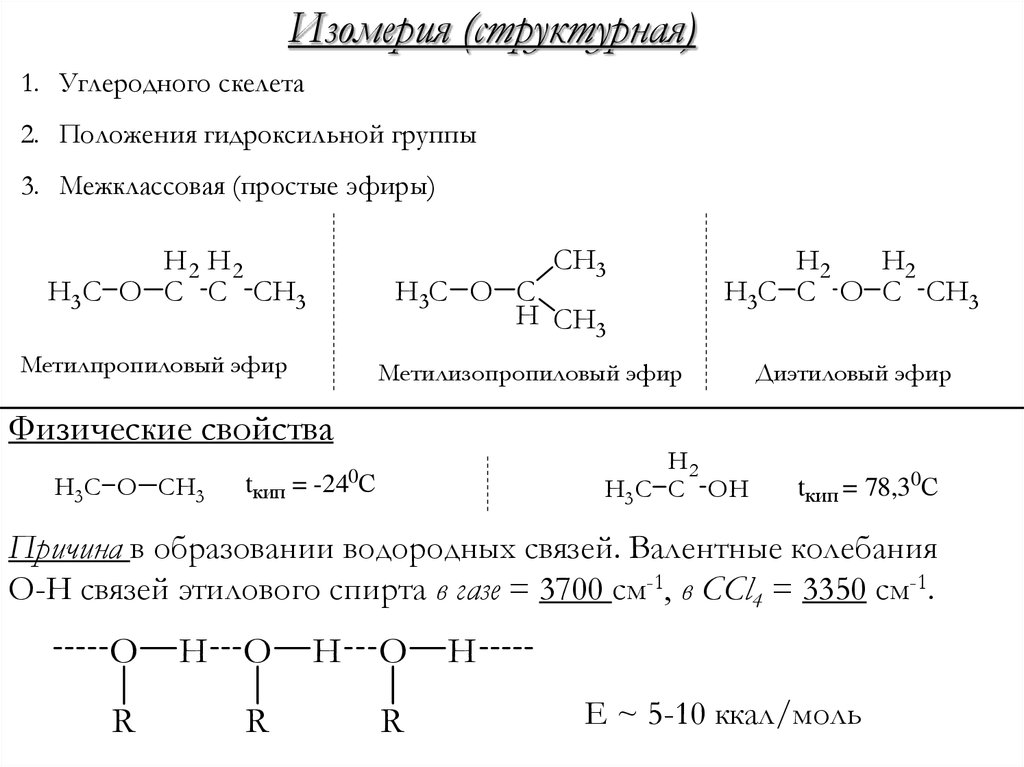
Изомерия (структурная)1. Углеродного скелета
2. Положения гидроксильной группы
3. Межклассовая (простые эфиры)
CH3
H2 H2
H3C O C C CH3
H3C O C
H CH3
Метилпропиловый эфир
Метилизопропиловый эфир
Физические свойства
H3C O CH3
tкип =
H2
H2
H3C C O C CH3
H2
H3C C OH
-240С
Диэтиловый эфир
tкип = 78,30С
Причина в образовании водородных связей. Валентные колебания
O-H связей этилового спирта в газе = 3700 см-1, в CCl4 = 3350 см-1.
O
H O
R
R
H
O
R
H
E ~ 5-10 ккал/моль
3.
Способы получения1. Гидратация олефинов (кислотный катализ):
H3C
C
H
CH2
H+
H3C
H
C
CH3
H2O
H3C
H
C
CH3
OH
2. Действие реактива Гриньяра на карбонильные соединения:
δ-
δ+
CH3MgI + H C
CH3MgI + H3C C
O
H
O
H
O
RMgI + H3C C CH 3
OMgI
H3C CH
H2
H3C C OH + MgOHI
H2O
H
OMgI
H3C C CH3
H2O
H
OMgI
H3C C CH3
R
H2O
H
H3C C CH3 + MgOHI
OH
OH
H3C C CH3 + MgOHI
R
4.
3. Окисление реактива Гриньяра:RMgX
RMgX
O2
ROOMgX
RMgX
O2
ROH
2ROMgX
H2O
2ROH + 2MgOHI
4. Промышленное получение метанола:
CO + 2H2
P, T, ZnO, Cr2O3
CH3OH
5. Восстановление карбонильных соединений:
O
LiAlH4
H3C
H3C C C C
H
H H
Кротиловый альдегид
H2
C C C OH
H H
Кротиловый спирт
LiAlH4 избирательно гидролизует карбонильную группу
6. Гидролиз галоидных алкилов (см. реакции SN1, SN1).
5.
7. Брожение сахаров:C6H12O 6
ферменты
(зимаза)
2C 2H5OH + 2CO 2
Дрожжи – живые одноклеточные организмы, грибки.
Зимаза водорастворима, извлекается из дрожжей (Лебедев, Бюхнер).
Роль зимазы – каталитическая.
Химические свойства спиртов
R O H
III
II
Спирты амфотерны
I
I. Кислотные свойства спиртов:
1. C2H5OH + NaNH2
2C2H5OH + 2Na
C2H5ONa + NH3
Этилат натрия
2C2H5ONa + H2
6.
Слабым кислотам соответствуют анионы, обладающие сильной основностью:CH3
H
C2H5OH > H3C C CH3 > H3C C CH3
Более кислый
OH
OH
Основность соответствующих анионов:
C2H5O
CH3
H
> H3C C CH3 > H3C C CH3
O
O
Алкоголяты третичных спиртов – сильные основания
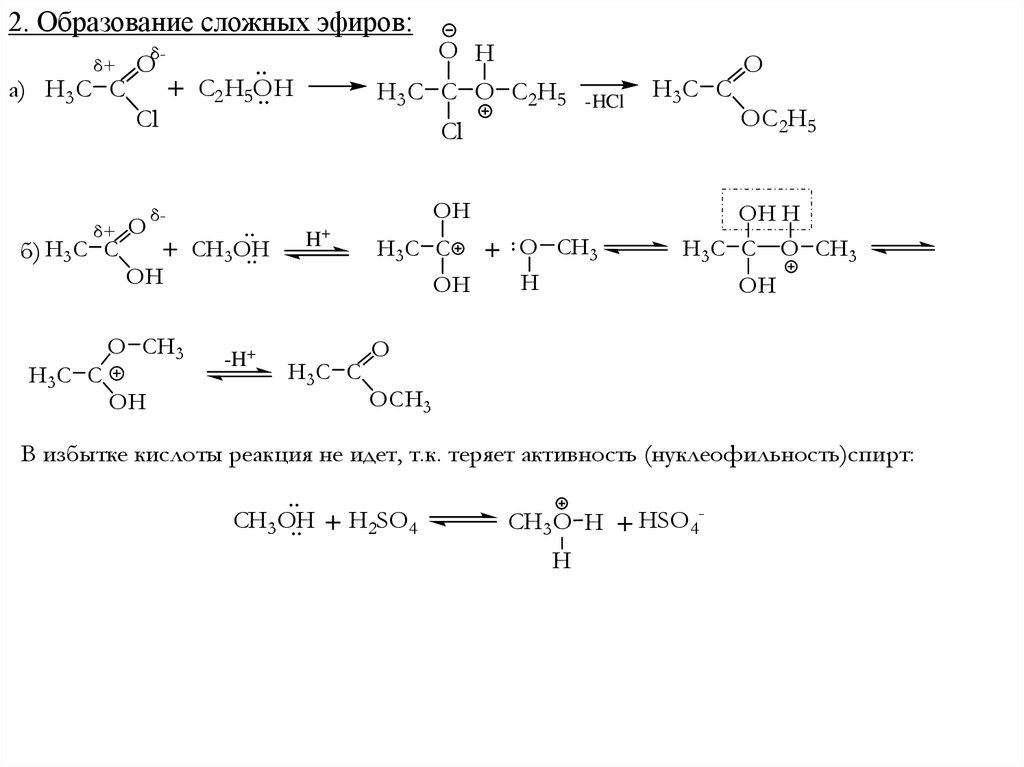
2. Образование простых эфиров:
а)
C2H5OH + CH3I
Slow
C2H5OCH3 + HI
б) Синтез Вильямсона:
C2H5ONa + CH3I
F ast
C2H5OCH3 (S N2)
Одновременно E2, т.к. С2H5O- - сильный нуклеофил:
(CH3)2CHI + CH3O-
H3C C CH2 + CH3OH + IH
7.
2. Образование сложных эфиров:δ+
а) H3C C
H3 C C
+ C2H5OH
Cl
δ+ O
б) H3C C
O H
H3C C O C2H5
δ-
O
H3C C
Cl
OH
δ-
+ CH3OH
H+
OH
O CH3
OH
-HCl
H3C C
OH
-H+
H3C C
+ O CH3
O
OC2H5
OH H
H3C C O CH3
H
OH
O
OCH3
В избытке кислоты реакция не идет, т.к. теряет активность (нуклеофильность)спирт:
CH3OH + H2SO4
CH3O H + HSO4H
8.
I. Основные свойства спиртов:1. Образование галогенидов
а)
HBr
ROH + HBr
RBr + H2O
H2O
ROH + H+
R+ + Br-
R+ + H2O
ROH2
RBr
По механизму SN1 или SN2
б) Реакция с HCl идет только в присутствии солей Льюиса
HCl + ZnCl2
ROH + ZnCl2
- Реактив Лукаса
R O ZnCl2
- [ZnCl 2OH]H
R
Cl-
RCl
9.
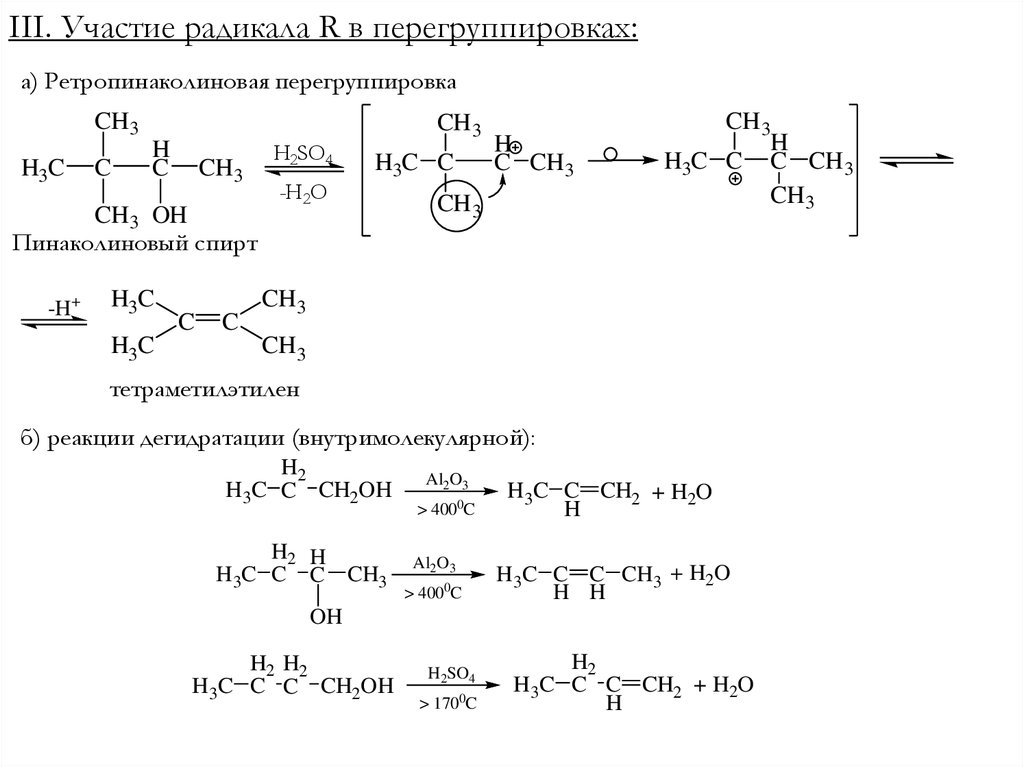
III. Участие радикала R в перегруппировках:а) Ретропинаколиновая перегруппировка
CH 3
H3C
C
H
C
CH 3
CH 3 OH
Пинаколиновый спирт
-H+
H3C
H3C
C
C
H2SO4
-H2O
CH 3
H3C C
H
C CH 3
CH 3
CH 3
H
H3C C C CH 3
CH 3
CH 3
CH 3
тетраметилэтилен
б) реакции дегидратации (внутримолекулярной):
H2
H3C C CH2OH
H2 H
H 3C C C CH3
Al2O3
> 4000C
Al2O3
>
4000C
H3C C CH2 + H2O
H
H 3C C C CH3 + H2O
H H
OH
H2 H2
H 3C C C CH2OH
H2SO4
> 1700C
H2
H3C C C CH2 + H2O
H
10.
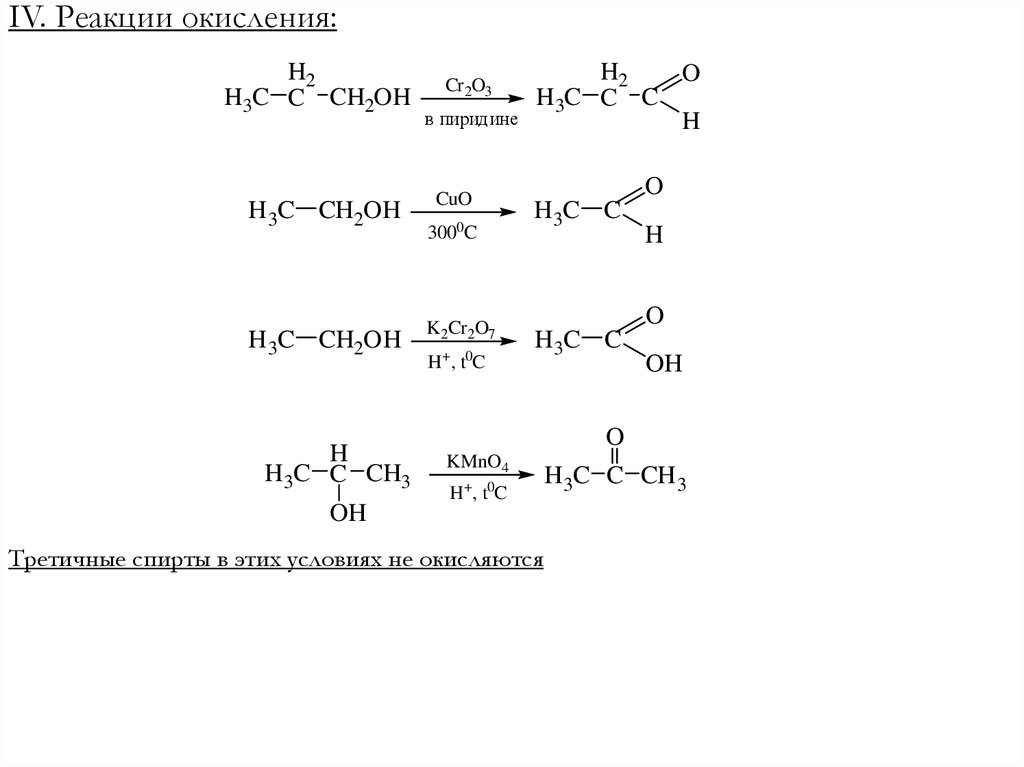
IV. Реакции окисления:H2
H3C C CH2OH
H3C CH2OH
H 3C CH2OH
H
H 3C C CH3
Cr 2O3
в пиридине
CuO
3000C
K2Cr 2O7
H+, t0C
H2
O
H3C C C
H
O
H3C C
H
O
H 3C C
OH
O
KMnO4
H+, t0C
OH
Третичные спирты в этих условиях не окисляются
H 3C C CH 3






 chemistry
chemistry