Similar presentations:
Энтропия. Изменение энтропии в изопроцессах
1.
2.
ЭнтропияАдиабатические процессы в термодинамических системах могут
быть равновесными и неравновесными. Для характеристики
равновесного адиабатического процесса можно ввести некоторую
физическую величину, которая оставалась бы постоянной в
течение всего процесса; ее назвали энтропией S.
Энтропия есть такая функция состояния системы, элементарное
изменение которой при равновесном переходе системы из одного
состояния в другое равно полученному или отданному количеству
теплоты, деленному на температуру, при которой произошел этот
процесс
для бесконечно малого изменения состояния системы
dQ cmdT
dS
T
T
3.
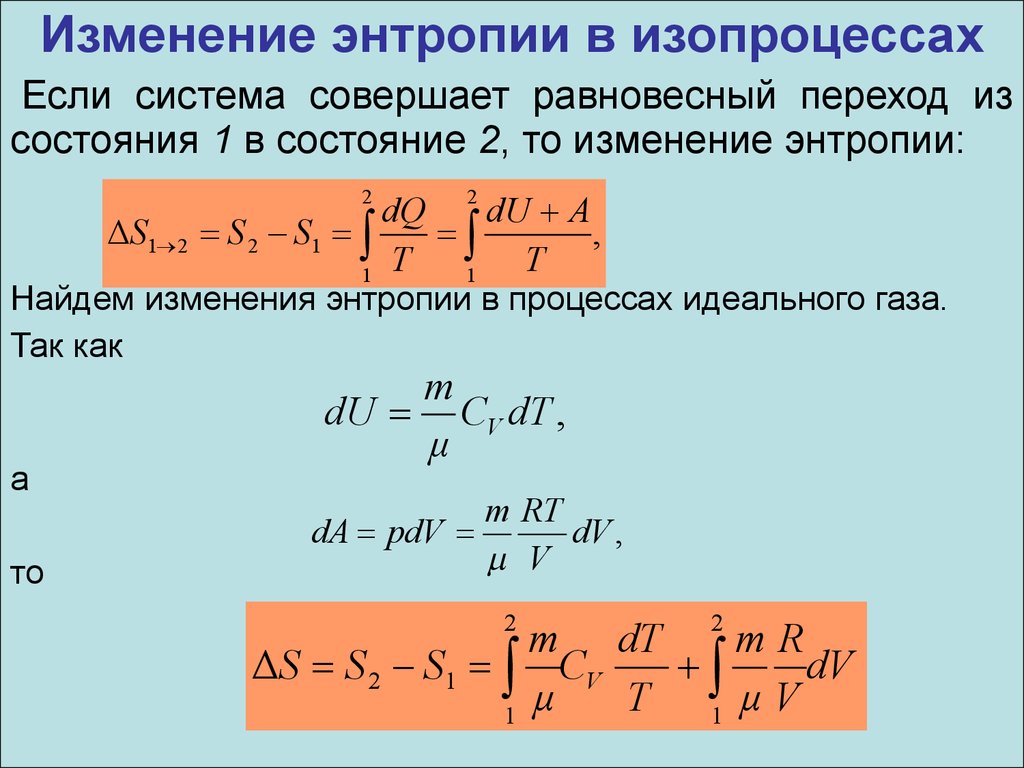
Изменение энтропии в изопроцессахЕсли система совершает равновесный переход из
состояния 1 в состояние 2, то изменение энтропии:
2
2
dQ
dU A
ΔS1 2 S 2 S1
,
T
T
1
1
Найдем изменения энтропии в процессах идеального газа.
Так как
а
то
m
dU CV dT ,
μ
m RT
dA pdV
dV ,
V
2
2
m dT
mR
ΔS S 2 S1 CV
dV
μ
T 1 μV
1
4.
ИлиT2 m
V2
m
ΔS Cv ln R ln
μ
T1 μ
V1
Изменение энтропии S1 2 идеального газа при
переходе его из состояния 1 в состояние 2 не
зависит от пути перехода 1 2.
изохорического
процесса:
изобарического
процесса:
T2
m
ΔS CV ln ,
μ
T1
V1 V2
T
T2 p1 = p2
m 2 dT2 m
ΔS C p
C p ln ,
μ T1
T1
μ
T1
изотермического
процесса:
V2
ΔS mR ln ,
V1
адиабатного
процесса:
dQ 0,
ΔS 0,
Т1 = Т2
5.
Следовательно, S = const, адиабатный процесс по другомуназывают – изоэнтропийным процессом.
Во всех случаях, когда система получает извне теплоту, то Q —
положительно, следовательно, S2 > S1 и энтропия системы
увеличивается.
Если же система отдаст теплоту, то Q имеет отрицательный знак
и, следовательно, S2 < S1; энтропия системы уменьшается.
Энтропия системы пропорциональна массе (или числу частиц) этой
системы
Q=c m ΔT
Масса системы представляется в виде суммы масс ее составных
частей, поэтому энтропия всей системы будет равна сумме
энтропии ее составных частей, т. е. энтропия есть аддитивная
величина.
6.
Изопроцессы могут быть изображены графически в координатныхсистемах, по осям которых отложены параметры состояния.
давление p - объем V
температура Т– объем V
температура Т – давление p
p1V1 p2V2
const
T1
T2
V1
V2
T1 T2
p1 p2 const ( )
V1 V2
При адиабатическом расширении внешняя работа совершается только
за счет внутренней энергии газа, вследствие чего внутренняя энергия, а вместе
с ней и температура газа уменьшаются (Т2 < T1)
При изотермическом процессе Т2 = T1
7.
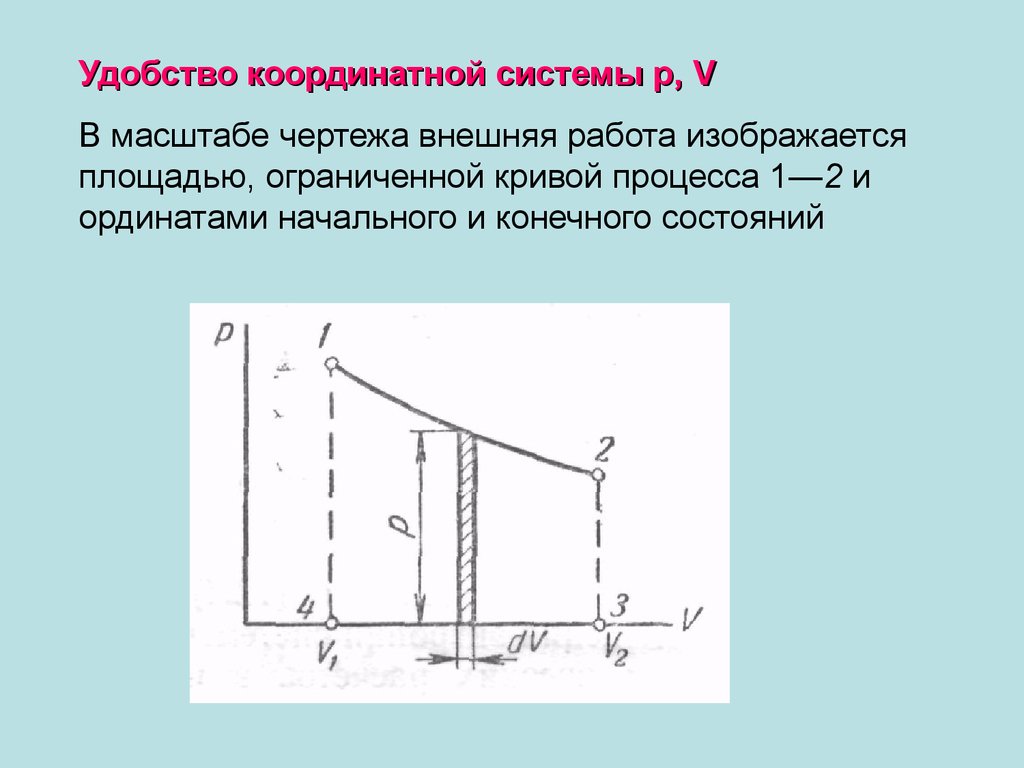
Удобство координатной системы р, VВ масштабе чертежа внешняя работа изображается
площадью, ограниченной кривой процесса 1—2 и
ординатами начального и конечного состояний
8.
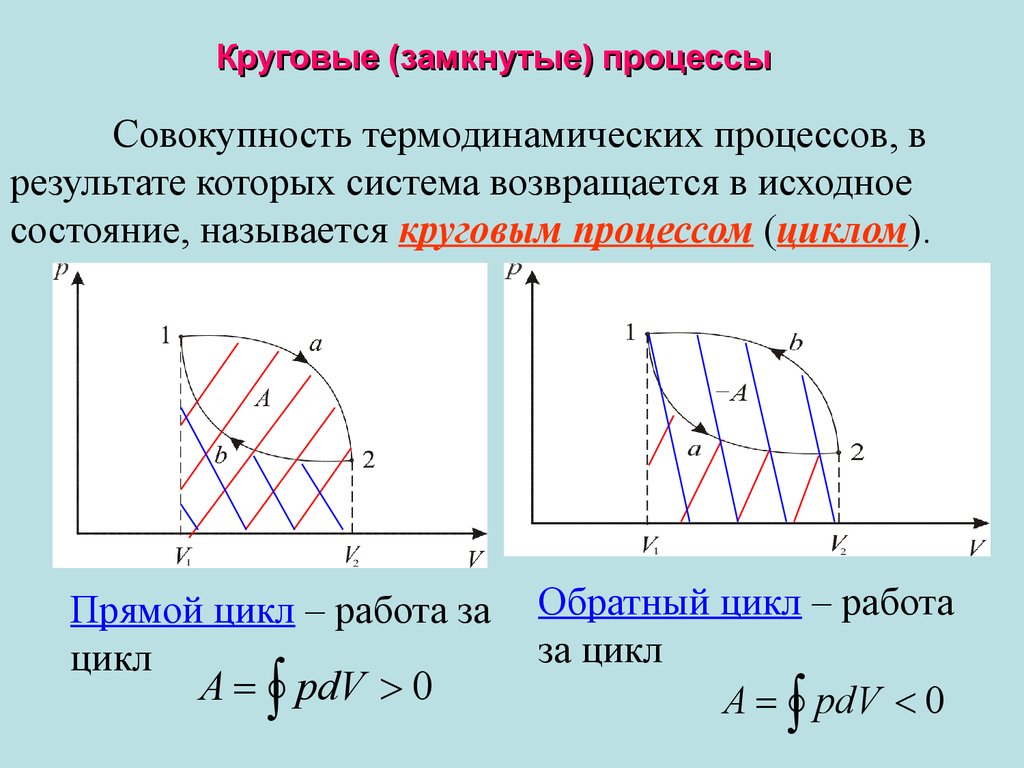
Круговые (замкнутые) процессыСовокупность термодинамических процессов, в
результате которых система возвращается в исходное
состояние, называется круговым процессом (циклом).
Прямой цикл – работа за
цикл
A pdV 0
Обратный цикл – работа
за цикл
A pdV 0
9.
Тепловая машинаЦиклически действующее устройство, превращающее
теплоту в работу, называется тепловой машиной или
тепловым двигателем.
Q1 – тепло, получаемое РТ от нагревателя,
Q2 – тепло, передаваемое РТ холодильнику,
А – полезная работа (работа, совершаемая РТ при
передаче тепла).
10.
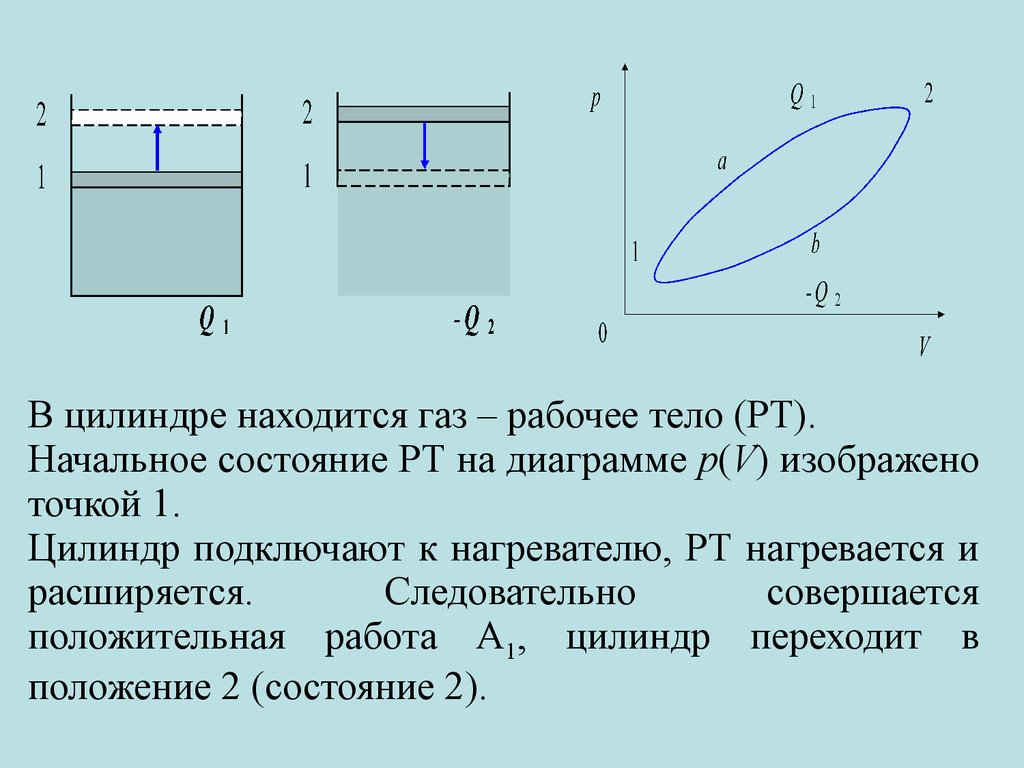
В цилиндре находится газ – рабочее тело (РТ).Начальное состояние РТ на диаграмме p(V) изображено
точкой 1.
Цилиндр подключают к нагревателю, РТ нагревается и
расширяется.
Следовательно
совершается
положительная работа А1, цилиндр переходит в
положение 2 (состояние 2).
11.
Процесс 1–2: –Q1 U 2 U 1 A1
первое начало термодинамики.
Работа А1 равна площади под кривой 1a2.
Чтобы поршень цилиндра вернуть в исходное
состояние 1, необходимо сжать рабочее тело, затратив
при этом работу – А2.
12.
Для того чтобы поршеньсовершил полезную работу,
необходимо выполнить условие:
А2 < А1. С этой целью сжатие
следует
производить
при
охлаждении цилиндра, т.е. от
цилиндра необходимо отводить к
холодильнику тепло –Q2.
Процесс 2–1:
Q2 U 1 U 2 A2
– первое начало термодинамики.
Работа А2 равна площади под кривой 2b1.
13.
Сложим два уравнения иполучим:
Q1 Q2 A1 A2 Aполезная .
Рабочее тело совершает круговой процесс 1a2b1 – цикл.
К.п.д.
Аполезная Q1 Q2
Q2
1 .
Q1
Q1
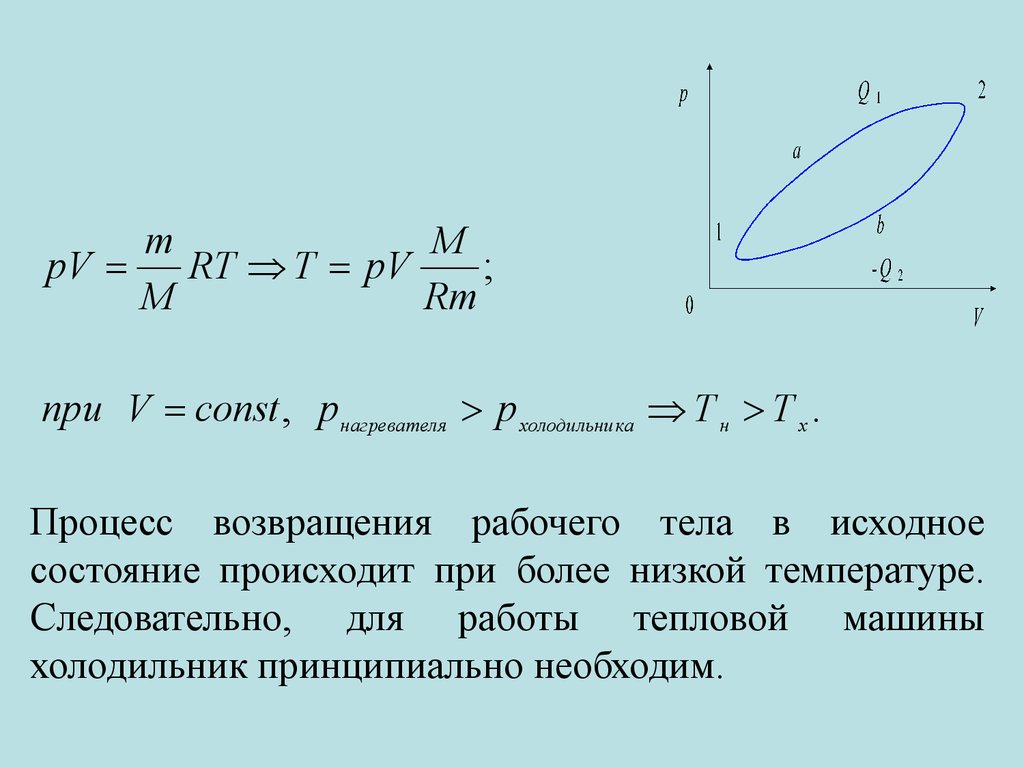
Q1
14.
mM
pV
RT T pV
;
M
Rm
при V const , pнагревателя p холодильника Т н Т х .
Процесс возвращения рабочего тела в исходное
состояние происходит при более низкой температуре.
Следовательно, для работы тепловой машины
холодильник принципиально необходим.
15.
Цикл КарноНикола Леонард Сади Карно –
французский офицер
инженерных войск, в 1824 г.
опубликовал сочинение
«Размышления о движущей силе
огня и о машинах способных
развить эту силу».
Ввел понятие кругового и обратимого
процессов, идеального цикла тепловых машин,
заложил тем самым основы их теории. Пришел к
понятию механического эквивалента теплоты.
16.
Карно вывел теорему, носящую теперь егоимя:
из всех периодически действующих
тепловых машин, имеющих одинаковые
температуры нагревателей и холодильников,
наибольшим КПД обладают обратимые
машины. Причем КПД обратимых машин,
работающих при одинаковых температурах
нагревателей и холодильников, равны друг другу
и не зависят от конструкции машины. При
этом КПД меньше единицы.
17.
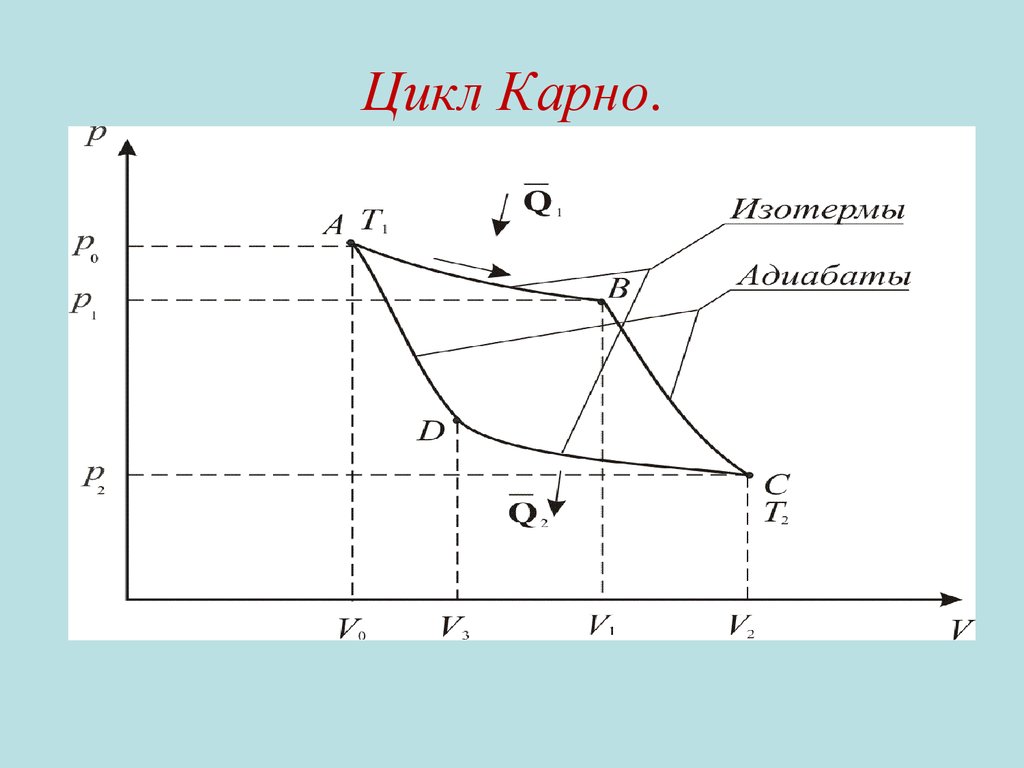
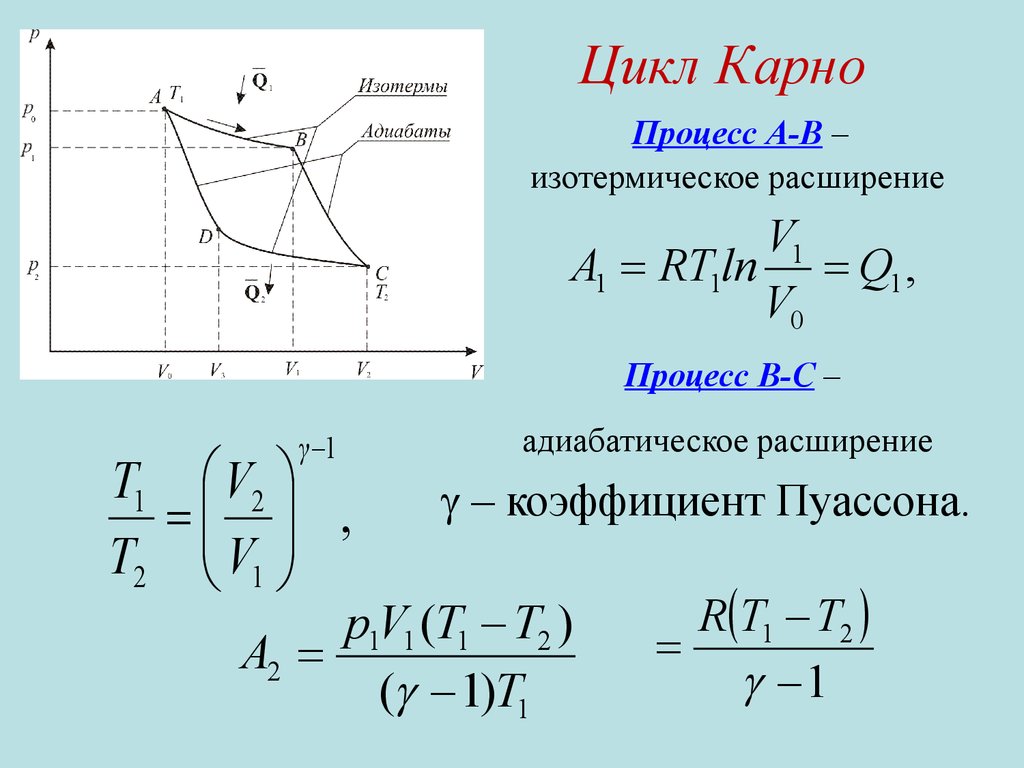
Цикл Карно.18.
Цикл КарноПроцесс А-В –
изотермическое расширение
V1
A1 RT1ln Q1 ,
V0
Процесс В-С –
γ 1
T1 V2
,
T2 V1
адиабатическое расширение
– коэффициент Пуассона.
p1V1 (T1 T2 )
A2
( 1)T1
R T1 T2
1
19.
Цикл КарноПроцесс С-D –
изотермическое сжатие
V3
A3 RT2ln Q2
V2
Процесс D-A –
адиабатическое сжатие
V3
V0
γ 1
T1
T2
R
A4
(T1 T2 )
1
20.
V1 R(T1 T2 )A RT1 ln
V0
1
V3 R(T1 T2 )
RT2 ln
V2
1
A Q1 Q2
Q2
T2
1 1
Q1
Q1
Q1
T1
21.
T21
T1
Если Т2 = 0, то η = 1, что невозможно, т.к.
абсолютный нуль температуры не существует.
Если Т1 = ∞, то η = 1, что невозможно, т.к.
бесконечная температура не достижима.
КПД цикла Карно η < 1 и зависит от
разности температур между нагревателем и
холодильником (и не зависит от конструкции
машины и рода рабочего тела).
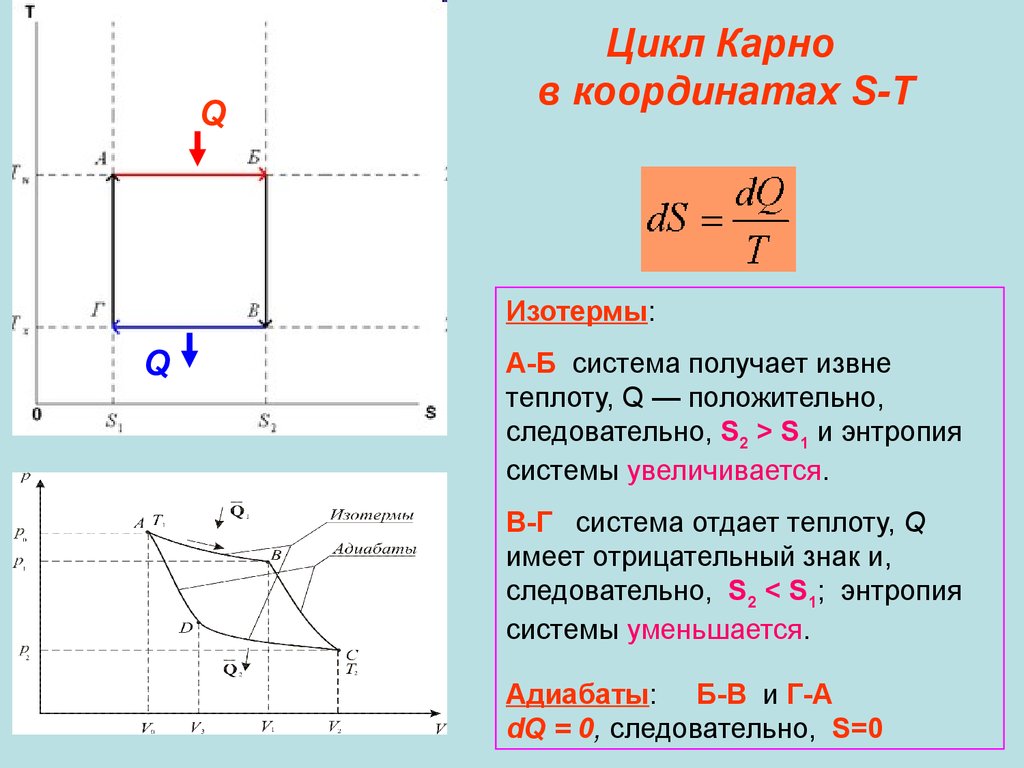
22. Цикл Карно в координатах S-T
QЦикл Карно
в координатах S-T
Изотермы:
Q
А-Б система получает извне
теплоту, Q — положительно,
следовательно, S2 > S1 и энтропия
системы увеличивается.
В-Г система отдает теплоту, Q
имеет отрицательный знак и,
следовательно, S2 < S1; энтропия
системы уменьшается.
Адиабаты: Б-В и Г-А
dQ = 0, следовательно, S=0
23.
Теоремы Карно.1. К.п.д. η обратимой идеальной тепловой
машины Карно не зависит от рабочего
вещества.
2. К.п.д. необратимой машины Карно не может
быть больше к.п.д. обратимой машины Карно.
24.
ВТОРОЕНАЧАЛО
ТЕРМОДИНАМИКИ
25.
dQФункция состояния, дифференциал которой T dS , называется –
энтропией.
Энтропия обозначается S – это отношение полученной или
отданной теплоты к температуре при которой произошла эта
отдача.
Изучение всевозможных равновесных круговых процессов
показало, что сумма отношений ΔQl/T1, подсчитанных для
участков процесса, при которых система получает теплоту,
всегда равна сумме отношений ΔQ2/T2, вычисленных для
участков процесса, при которых система отдает теплоту
Q1
Q2
T T
1
2
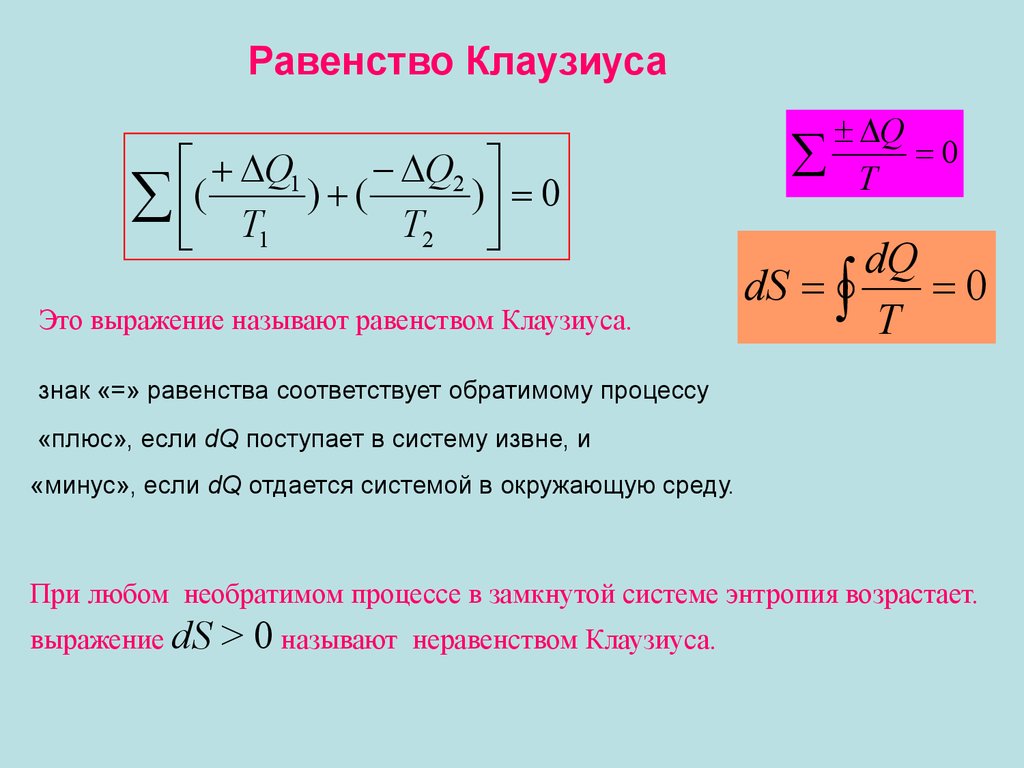
26.
Равенство КлаузиусаQ1
Q2
( T ) ( T ) 0
1
2
Это выражение называют равенством Клаузиуса.
Q
T 0
dQ
dS
0
T
знак «=» равенства соответствует обратимому процессу
«плюс», если dQ поступает в систему извне, и
«минус», если dQ отдается системой в окружающую среду.
При любом необратимом процессе в замкнутой системе энтропия возрастает.
выражение dS
> 0 называют
неравенством Клаузиуса.
27.
Следствия из равенства Клаузиуса :Q
T 0
Так как для каждого из подвергнутых исследованию
круговых процессов сумма равна нулю, то выражение
универсально, т.е. соблюдается для всех без исключения
круговых процессов и термодинамических систем.
dQ
dS
0
T
Для того чтобы найти формулировку единого
закона, произведем исследование равенства
Клаузиуса и вытекающих из него следствий.
28.
1. круговые процессы, в течение которых систематолько получает, но не отдает теплоту, невозможны.
Q1
Q2
( T ) ( T ) 0
1
2
В этом случае все элементарные количества теплоты были бы со
Q
знаком «плюс», сумма
была бы отлична от нуля. Т.е.
T
Q
отсутствовали бы
отрицательные члены этой суммы T , соответствующие отдаче
тепла от системы в окружающую среду.
такие процессы не противоречили бы первому закону
термодинамики, т. е. закону сохранения энергии, так как система,
получив извне теплоту Q1 могла бы совершить эквивалентное
количество положительной внешней работы А = Q1 и вернуться в
исходное состояние с тем же значением внутренней энергии.
29.
2. круговые процессы, в течение которых систематолько отдает теплоту, но не получает невозможны.
Q1
Q2
(
)
(
) 0
T
T2
1
Тогда все элементарные количества теплоты были бы со знаком
Q была бы отлична от нуля. Т.е. отсутствовали бы
«минус», сумма
T
Q
положительные члены этой суммы T
, соответствующие
получению тепла системой от окружающей среды отсутствовали бы.
Такие процессы также не противоречили бы закону
сохранения энергии, так как работой внешних сил
можно было бы полностью компенсировать убыль
энергии системы от отдачи теплоты в окружающую
среду (— А = — Q2), и система могла бы вернуться в
исходное состояние с общим балансом энергии,
равным нулю.
30.
осуществить такой круговой процесс, в результатекоторого система полностью превращала бы в
механическую работу всю полученную извне теплоту
Q1 невозможно; часть этой теплоты Q2 система
обязательно возвращает в окружающую среду.
Пользуясь понятием коэффициента использования теплоты
при круговых процессах
Q2
T2
A Q1 Q2
η
1
1
Q1
Q1
Q1
T1
можно утверждать, что этот коэффициент никогда не может
быть равен единице.
31.
Пусть получение теплоты извне и отдача ее окружающим телам происходитизотермически.
Q1 Q2
T1 T2
или
Q1 T1
Q2 T2
т. е. система, совершающая круговой процесс в прямом направлении (Q1
> Q2), получает теплоту Q1 от тел, имеющих высокую температуру Т1, и
отдает теплоту Q2 телам, имеющим низкую температуру Т2.
Для осуществления кругового процесса необходимо существование
разности температур между окружающими систему телами.
В результате прямого кругового процесса не только происходит
превращение некоторого количества теплоты Q = Q1—Q2 в механическую
работу, но обязательно имеет место «непроизводительный» переход теплоты
Q2 от горячих тел к холодным.
Чем больше разность между температурой Т1, при которой система получает
теплоту Q1 и температурой Т2, при которой отдается неиспользуемая теплота
Q2, тем выше коэффициент полезного действия кругового процесса η= (Q1 —
Q2)/Q1 = (Т1— T2)/T1 и, следовательно, тем меньше Q2.
32.
В результате круговых процессов, идущих вобратном направлении, система получает теплоту
Q1 от окружающих тел, имеющих низкие
температуры, использует работу А, совершаемую
внешними силами, для повышения температуры и
затем передает теплоту Q2 = Q1 + А телам,
имеющим высокие температуры.
Q1
Q2
(
)
(
) 0
T
T2
1
3. при круговом процессе увеличение энтропии системы от
притока теплоты полностью компенсируется уменьшением
энтропии от отдачи теплоты, и суммарное изменение энтропии
равно нулю.
Q1
Q2
S
0
T1
T2
в каждом определенном равновесном состоянии система имеет
вполне определенное значение энтропии.
33.
Второе начало термодинамики1) невозможны круговые процессы, в результате которых система
только получала бы извне теплоту Q1 и совершала эквивалентную
положительную внешнюю работу А = Q1
2) круговые процессы, совершаемые любыми термодинамическими
системами, сопровождаются получением некоторого количества
теплоты Q1 от тел, имеющих высокие температуры, обязательной
отдачей части этой теплоты Q2 телам, имеющим низкие температуры, и
превращением разности Q1 — Q2 в механическую работу.
теплота связана с беспорядочным движением частиц системы, а
механическая работа обусловлена упорядоченным движением этих частиц.
Можно утверждать, что превращение теплоты в механическую работу есть
переход энергии беспорядочного движения молекул системы в энергию
упорядоченного движения. В связи с этим второй закон термодинамики
можно понимать иначе:
3) при помощи круговых процессов, совершаемых какой-нибудь
термодинамической системой, невозможно полностью превратить
энергию беспорядочного теплового движения частиц окружающих тел в
энергию упорядоченного движения самих этих тел
34.
Тепловое движение молекулодноатомного газа идёт в среднем
тем интенсивнее, чем больше его
внутренняя энергия. Скорость
Совершение над газом работы на каждой отдельной молекулы при
элементарном участке dh.
этом может изменяться даже при
Совершаемая работа показана
постоянстве внутренней энергии
красными лампочками
всего газа
35.
U2-U1=Q - AПрименяя это соотношение к круговым процессам, полагали U1= U2, и поэтому
Q = А. При этом считалось очевидным, что, возвращаясь в исходное
состояние, система приобретает в точности то же самое значение внутренней
энергии, которое она имела вначале.
внутренняя энергия термодинамических
систем есть однозначная функция
состояния этих систем.
I начало термодинамики
при равновесном круговом процессе суммарное изменение энтропии
термодинамических систем равно нулю, т. е., возвращаясь в исходное
состояние, система приобретает в точности то же самое значение своей
энтропии, которую она имела вначале.
II начало термодинамики
4) энтропия термодинамической системы, находящейся в
равновесном состоянии, есть однозначная функция этого
состояния.
36.
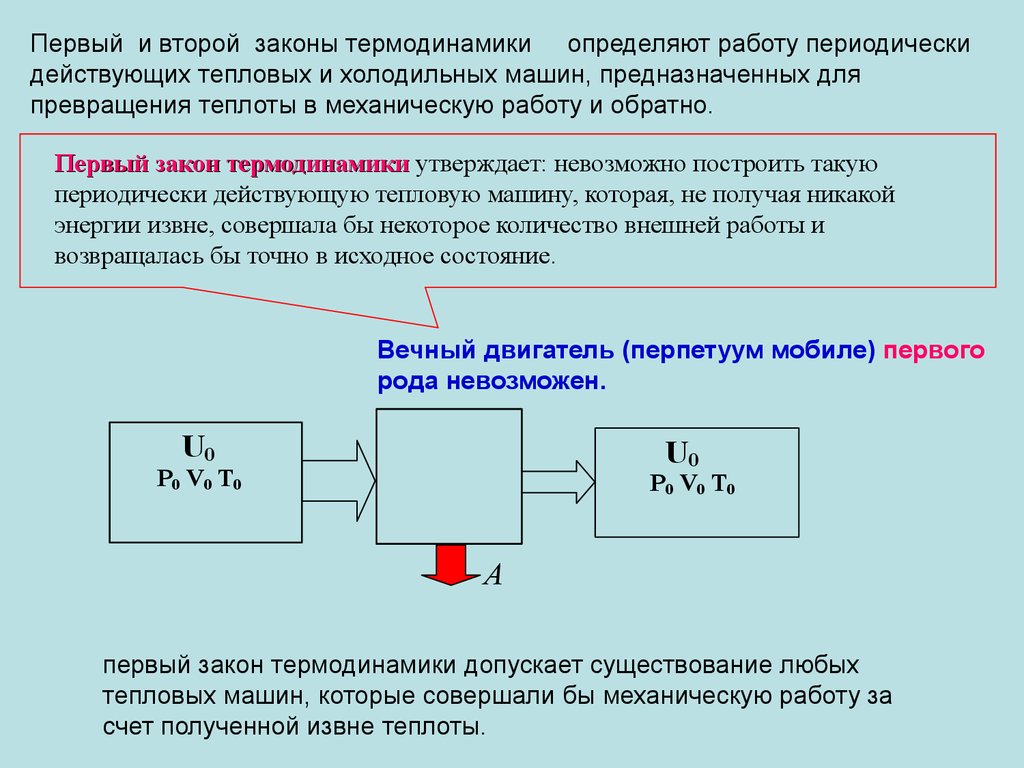
Первый и второй законы термодинамики определяют работу периодическидействующих тепловых и холодильных машин, предназначенных для
превращения теплоты в механическую работу и обратно.
Первый закон термодинамики утверждает: невозможно построить такую
периодически действующую тепловую машину, которая, не получая никакой
энергии извне, совершала бы некоторое количество внешней работы и
возвращалась бы точно в исходное состояние.
Вечный двигатель (перпетуум мобиле) первого
рода невозможен.
U0
U0
P0 V0 T0
P0 V0 T0
А
первый закон термодинамики допускает существование любых
тепловых машин, которые совершали бы механическую работу за
счет полученной извне теплоты.
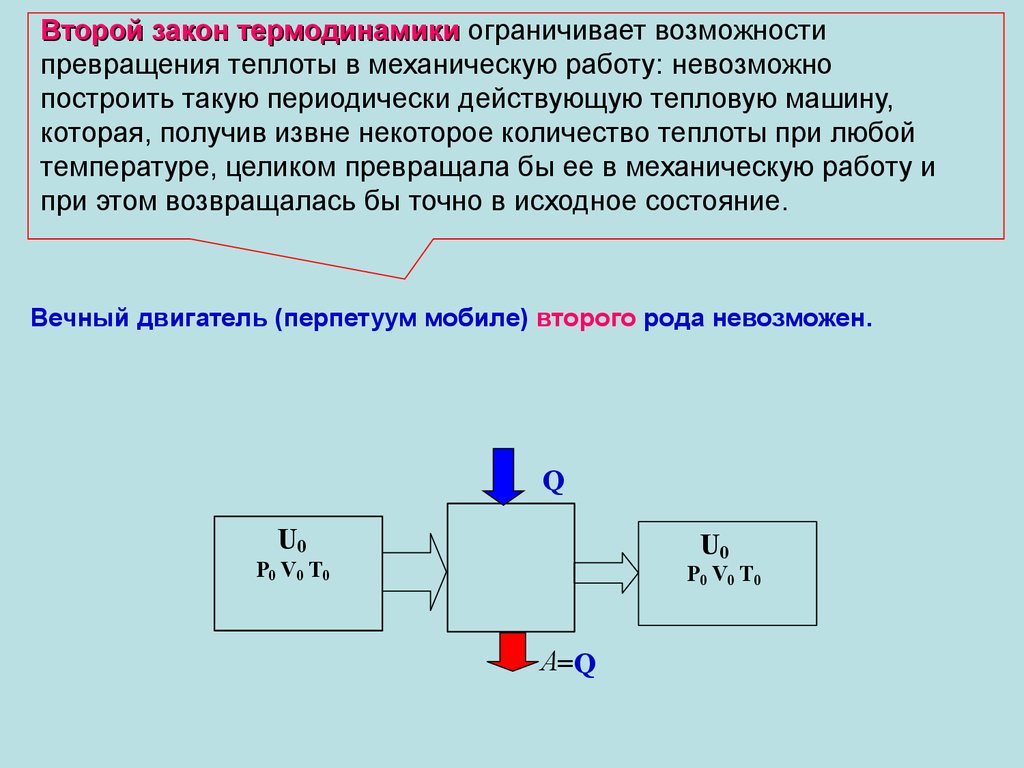
37.
Второй закон термодинамики ограничивает возможностипревращения теплоты в механическую работу: невозможно
построить такую периодически действующую тепловую машину,
которая, получив извне некоторое количество теплоты при любой
температуре, целиком превращала бы ее в механическую работу и
при этом возвращалась бы точно в исходное состояние.
Вечный двигатель (перпетуум мобиле) второго рода невозможен.
Q
U0
U0
P0 V0 T0
P0 V0 T0
А=Q
38. Примеры конструкций вечного двигателя
Колесо Да Винчи39.
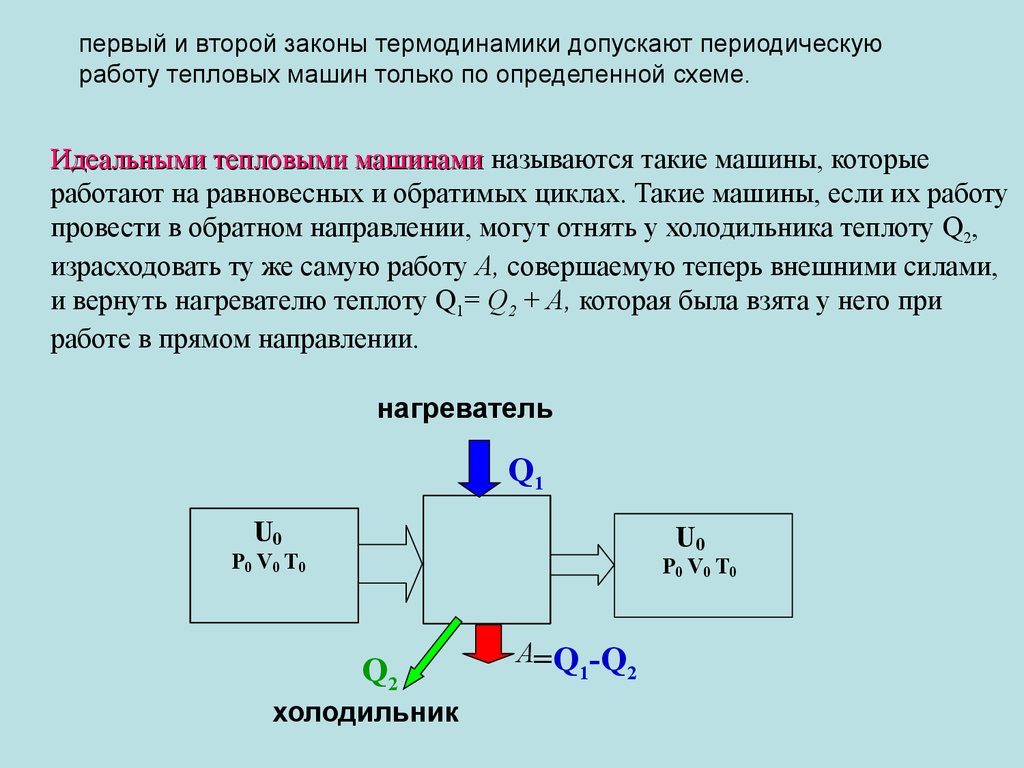
первый и второй законы термодинамики допускают периодическуюработу тепловых машин только по определенной схеме.
Идеальными тепловыми машинами называются такие машины, которые
работают на равновесных и обратимых циклах. Такие машины, если их работу
провести в обратном направлении, могут отнять у холодильника теплоту Q2,
израсходовать ту же самую работу А, совершаемую теперь внешними силами,
и вернуть нагревателю теплоту Q1= Q2 + А, которая была взята у него при
работе в прямом направлении.
нагреватель
Q1
U0
U0
P0 V0 T0
P0 V0 T0
Q2
холодильник
А=Q -Q
1
2
40.
Можно показать, что при заданных температурах источника теплоты Т1 ихолодильника Т2 коэффициент полезного действия КПД всех идеальных
тепловых машин, работающих как в прямом, так и в обратном
направлениях, независимо от их конструкции, состава рабочего вещества
и характера совершаемого в машине цикла, одинаков и равен:
Аполезная Q1 Q2 T1 T2
.
Q1
Q1
T1
41.
Идеальныйгаз
42.
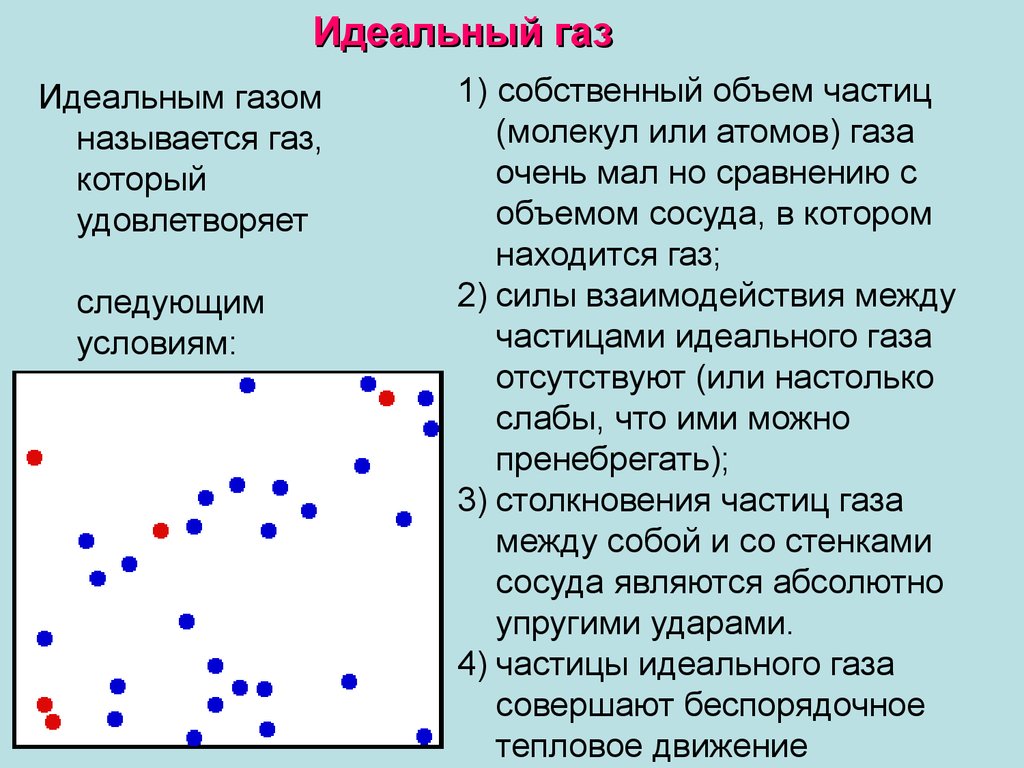
Идеальный газИдеальным газом
называется газ,
который
удовлетворяет
следующим
условиям:
1) собственный объем частиц
(молекул или атомов) газа
очень мал но сравнению с
объемом сосуда, в котором
находится газ;
2) силы взаимодействия между
частицами идеального газа
отсутствуют (или настолько
слабы, что ими можно
пренебрегать);
3) столкновения частиц газа
между собой и со стенками
сосуда являются абсолютно
упругими ударами.
4) частицы идеального газа
совершают беспорядочное
тепловое движение
43.
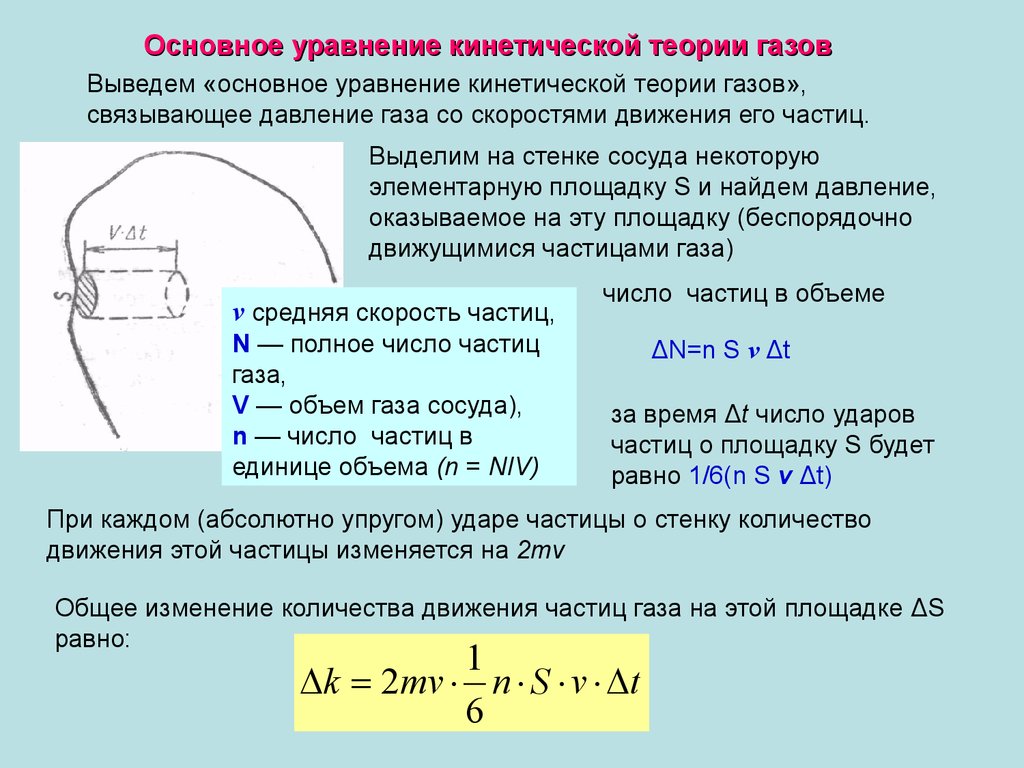
Основное уравнение кинетической теории газовВыведем «основное уравнение кинетической теории газов»,
связывающее давление газа со скоростями движения его частиц.
Выделим на стенке сосуда некоторую
элементарную площадку S и найдем давление,
оказываемое на эту площадку (беспорядочно
движущимися частицами газа)
v средняя скорость частиц,
N — полное число частиц
газа,
V — объем газа сосуда),
n — число частиц в
единице объема (n = NIV)
число частиц в объеме
ΔN=n S v Δt
за время Δt число ударов
частиц о площадку S будет
равно 1/6(n S v Δt)
При каждом (абсолютно упругом) ударе частицы о стенку количество
движения этой частицы изменяется на 2mv
Общее изменение количества движения частиц газа на этой площадке ΔS
равно:
1
k 2mv n S v t
6
44.
Согласно второму закону Ньютона, это изменение должно быть вызваносилой, приложенной со стороны стенки к частицам газа.
k 1
F
m n S v2
t 3
Тогда давление на газ, т. е. внешняя сила, действующая на газ со
стороны единичной площадки, равна р = F/S
основное уравнение
1
кинетической теории газов
p n m v2
3
n=N/V
1
pV N m v 2
3
45.
Мы предполагали, что скорости молекул одинаковы; если же в газеимеются молекулы с разными скоростями
1
1
1
1
2
2
2
2
pV ( N1 m1 v1 N 2 m2 v2 ...) m N i vi m N vкв
3
3
3
3
vкв называется средней квадратичной скоростью молекул газа;
она отличается от средней арифметической скорости
Теоретическое вычисление скоростей молекул основано на двух
предположениях:
1) в газе не существует даже двух молекул, имеющих в точности
одинаковые скорости;
2) число молекул ΔN, скорости которых лежат в узких пределах между v и
v + Δv (например, от 100 до 101 м/с или от 500 до 501 м/с), прямо
пропорционально общему числу молекул N, ширине интервала Δv и
зависит от величины скорости и.
46.
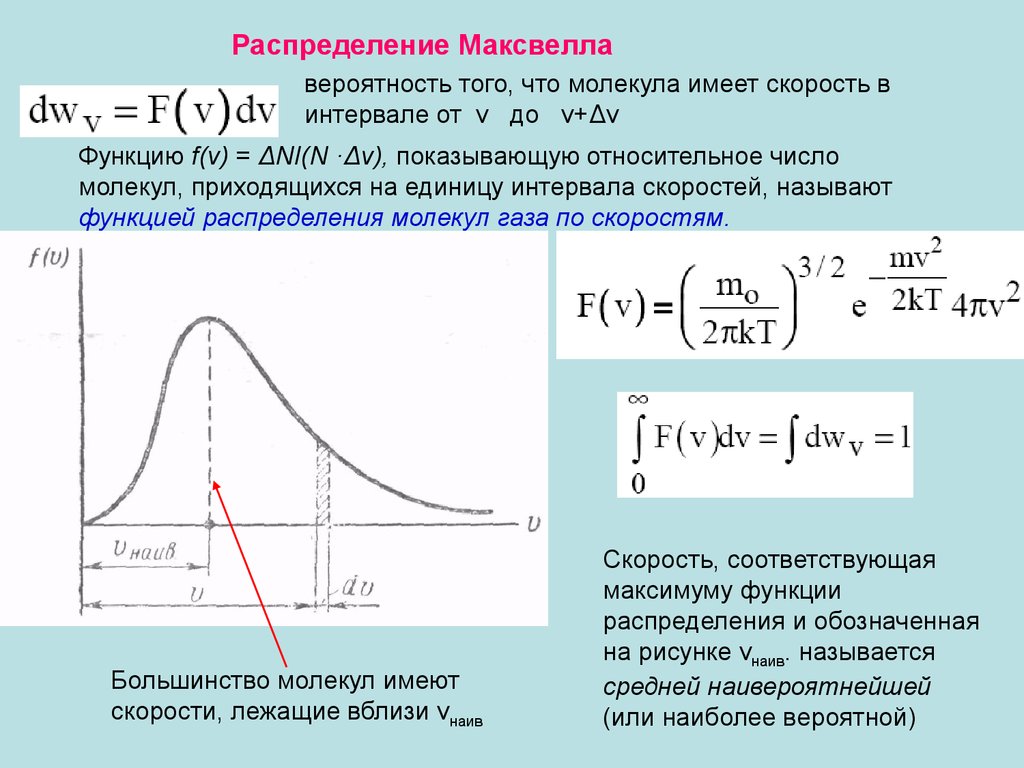
Распределение Максвеллавероятность того, что молекула имеет скорость в
интервале от v до v+Δv
Функцию f(v) = ΔNI(N ·Δv), показывающую относительное число
молекул, приходящихся на единицу интервала скоростей, называют
функцией распределения молекул газа по скоростям.
Большинство молекул имеют
скорости, лежащие вблизи vнаив
Скорость, соответствующая
максимуму функции
распределения и обозначенная
на рисунке vнаив. называется
средней наивероятнейшей
(или наиболее вероятной)
47.
48.
Уравнение состояния идеального газаПусть в объеме V при давлении р и температуре Т находятся N молекул газа.
М = Nm
Число молекул в газе
Количество газа
M
N N 0 N 0
M
Объем газа V (м2), давление p (Н/м2), температура T— по абсолютной шкале
Кельвина
Измерения показали, что у газов при равновесных переходах из одного
состояния в другое изменения параметров р, V и Т с некоторым
приближением удовлетворяют объединенному закону Бойля—Мариотта и
Гей-Люссака: для данной массы газа отношение произведения объема газа
на его давление к абсолютной температуре сохраняется постоянным при
переходе газа из одного равновесного состояния в другое:
pV
const
T
идеальный газ определяется как такой газ, который в точности подчиняется
законам Бойля—Мариотта и Гей-Люссака, а следовательно, объединенному
закону
49.
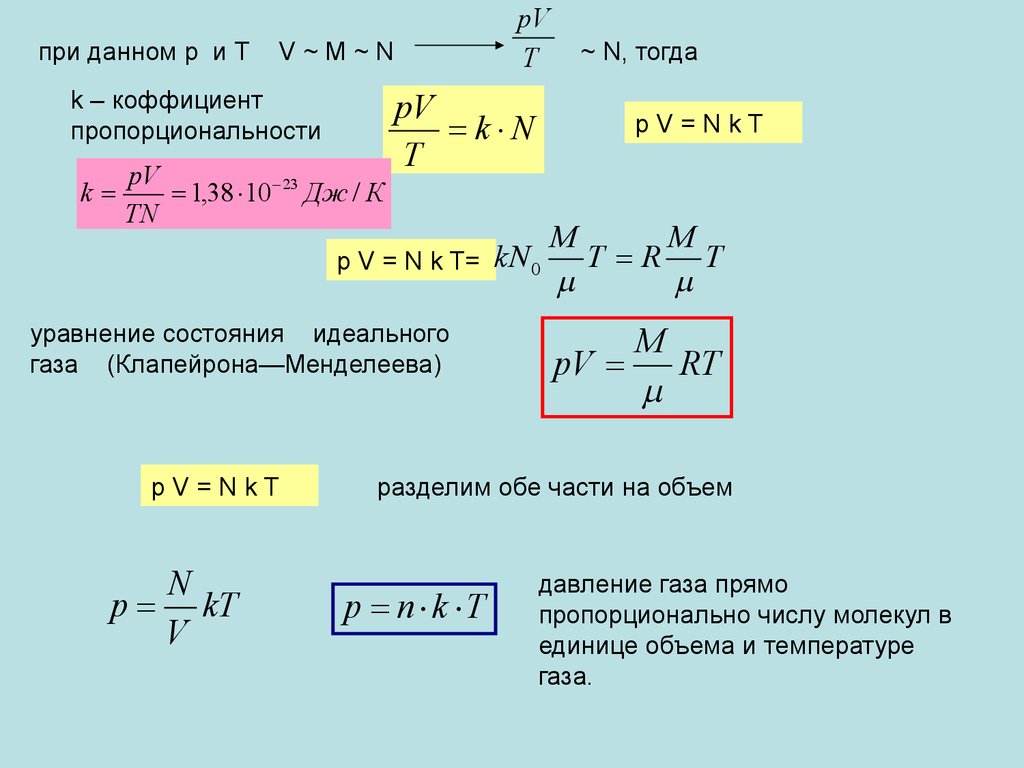
при данном р и ТV~М~N
k – коффициент
пропорциональности
k
pV
T
pV
1,38 10 23 Дж / К
TN
pV
k N
T
pV=NkT
p V = N k T= kN 0
уравнение состояния идеального
газа (Клапейрона—Менделеева)
pV=NkT
N
p kT
V
~ N, тогда
M
M
T R T
M
pV
RT
разделим обе части на объем
p n k T
давление газа прямо
пропорционально числу молекул в
единице объема и температуре
газа.
50.
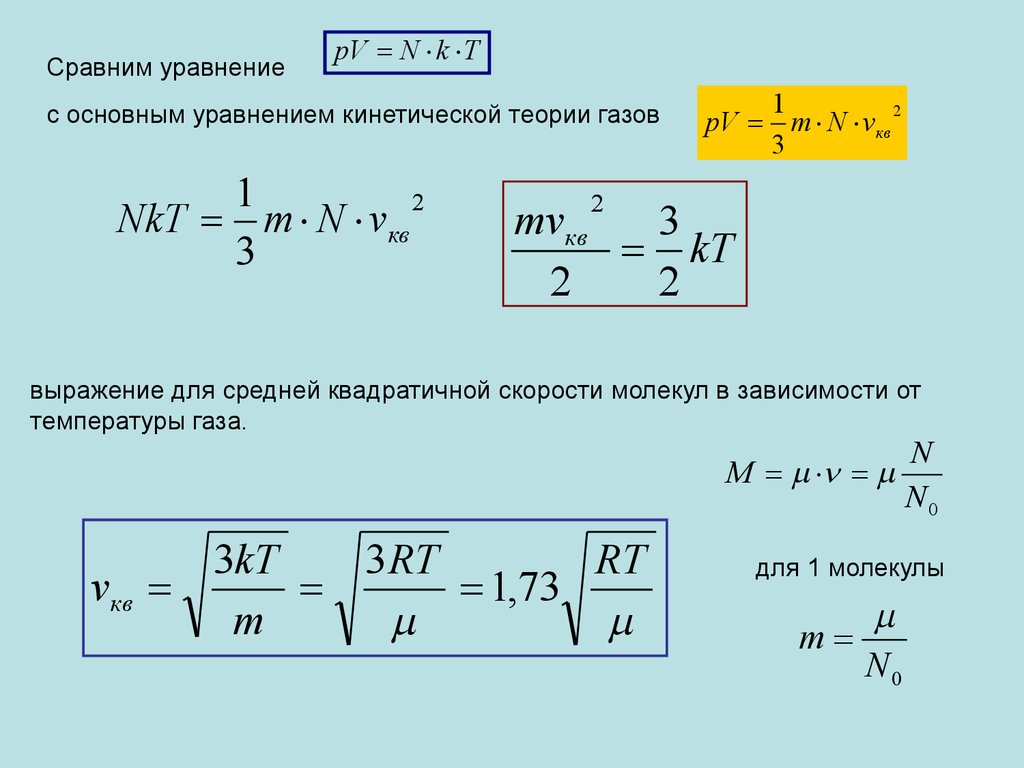
Сравним уравнениеpV N k T
с основным уравнением кинетической теории газов
1
2
NkT m N vкв
3
1
2
pV m N vкв
3
2
mvкв
3
kT
2
2
выражение для средней квадратичной скорости молекул в зависимости от
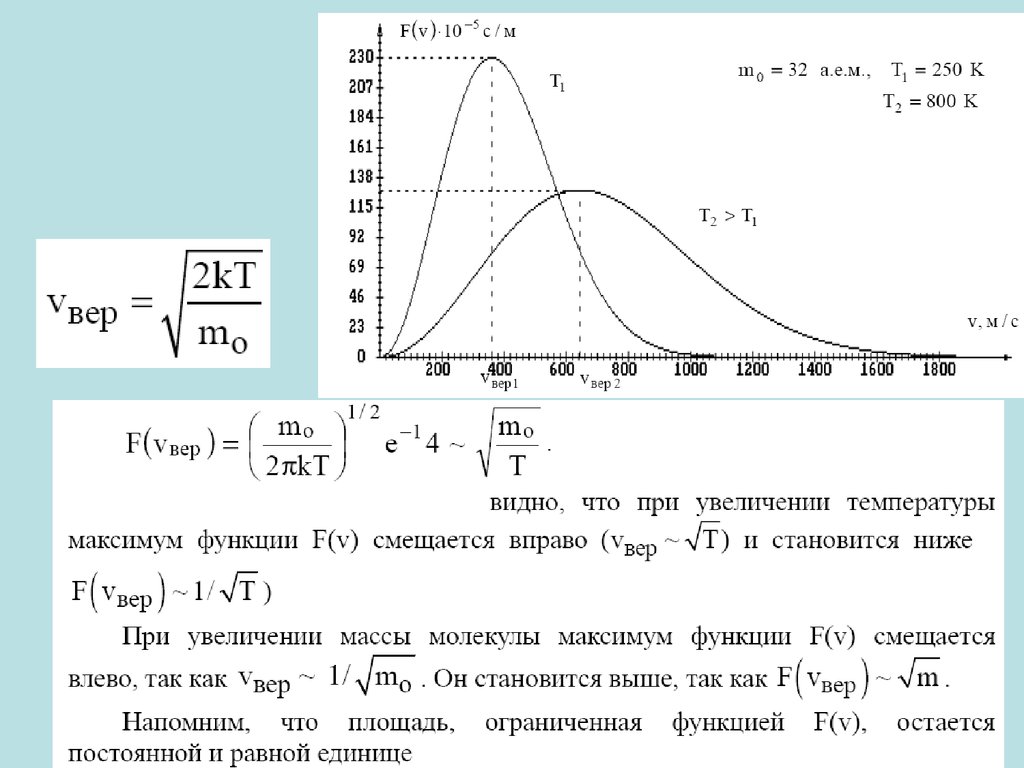
температуры газа.
M
3kT
3RT
RT
vкв
1,73
m
N
N0
для 1 молекулы
m
N0












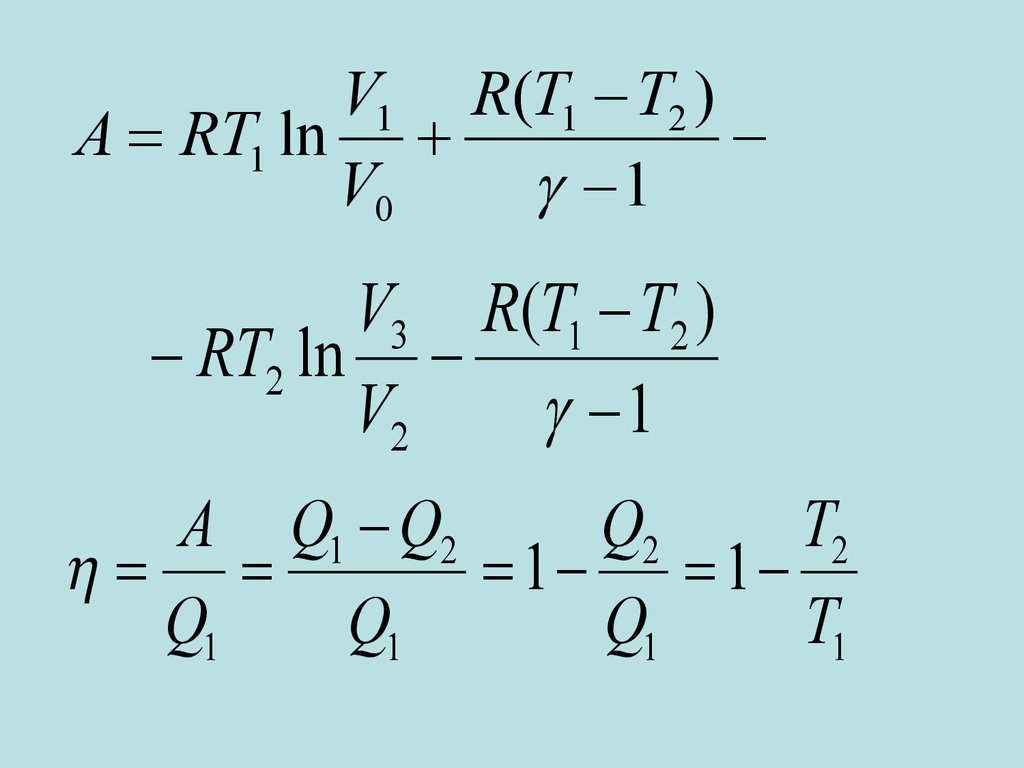

















 physics
physics chemistry
chemistry








