Similar presentations:
Энтропия
1.
12.
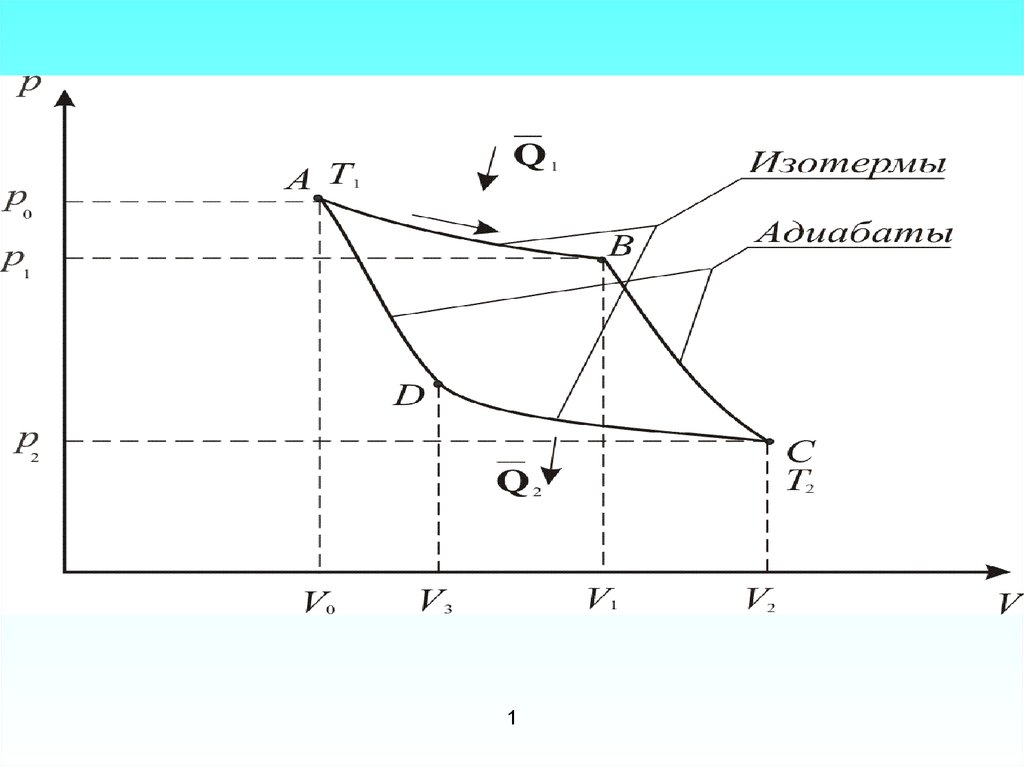
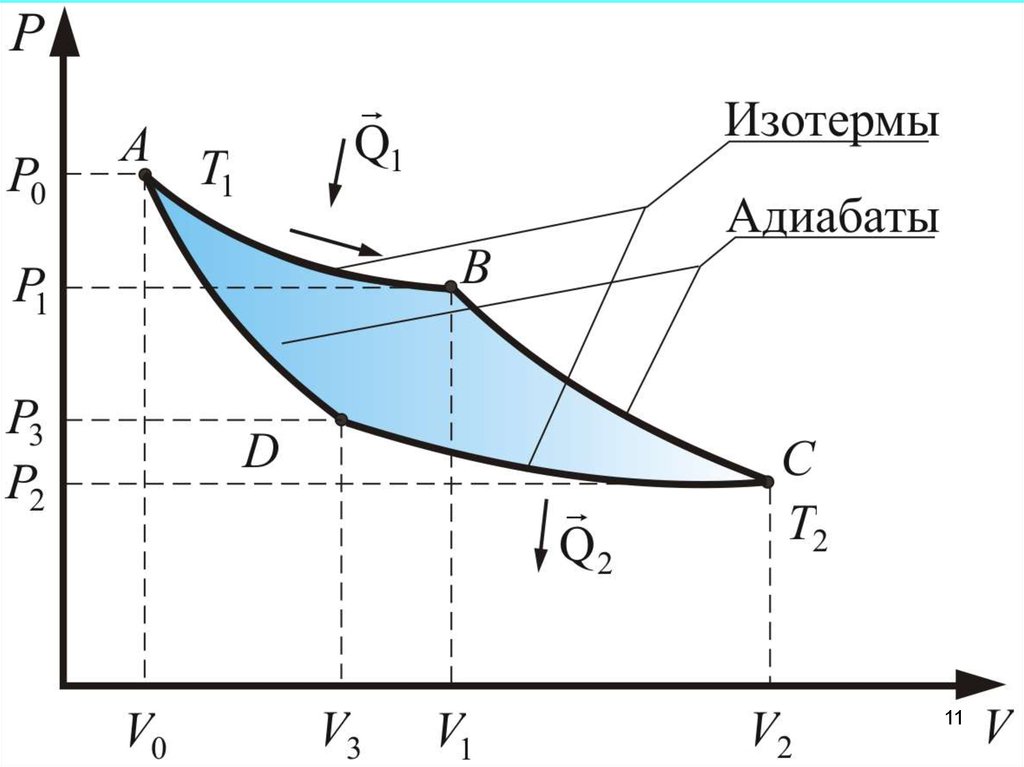
Процесс А-В – изотермическое расширениеV1
A1 RT1ln Q1 ,
V0
Процесс В-С – адиабатическое расширение.
γ 1
T1 V2
, – коэффициент Пуассона.
T2 V1
p1V1 (T1 T2 )
R T1 T2
A2
1
( 1)T1
2
3.
Процесс С-D – изотермическое сжатиеV3
A3 RT2ln Q2
V2
Процесс D-A – адиабатическое сжатие.
V3
V0
γ 1
T1
T2
R
A4
(T1 T2 )
1
3
4.
V1 R (T1 T2 )A RT1 ln
V0
1
V3 R(T1 T2 )
RT2 ln
V2
1
Q2
T2
A Q1 Q2
η
1
1
Q1
Q1
Q1
T1
4
5.
Если Т2 = 0, то η = 1, что невозможно, т.к.абсолютный нуль температуры не существует.
Если Т1 = ∞, то η = 1, что невозможно, т.к.
бесконечная температура не достижима.
КПД цикла Карно η < 1 и зависит от
разности температур между нагревателем и
холодильником (и не зависит от конструкции
машины и рода рабочего тела).
5
6.
Теоремы Карно.1. К.п.д. η обратимой идеальной тепловой
машины Карно не зависит от рабочего
вещества.
2. К.п.д. необратимой машины Карно не может
быть больше к.п.д. обратимой машины Карно.
6
7.
МОЛЕКУЛЯРНАЯФИЗИКА
ТЕРМОДИНАМИКА
Энтропия
7
8. Вопросы
1. Приведенная теплота. Энтропия2. Изменение энтропии
3. Поведение энтропии в процессах
изменения агрегатного состояния
8
9. 1. Приведенная теплота. Энтропия
Из рассмотренного цикла Карновидно, что равны между собой
отношения теплот к температурам, при
которых они были получены или
отданы в изотермическом процессе:
Q1 Q2
T1
T2
9
10. Отношение теплоты Q в изотермическом процессе к температуре, при которой происходила передача теплоты, называется приведенной
теплотой Q' :Q
Q'
T
(1)
Для подсчета приведенной теплоты в
произвольном процессе необходимо разбить
этот процесс на бесконечно малые участки,
где Т можно считать константой.
Приведенная теплота на таком участке
10
будет равна
d' Q / dT .
11.
1112. Суммируя приведенную теплоту на всех участках процесса, получим: Тогда в обратимом цикле Карно имеем:
Суммируя приведенную теплоту на всехучастках процесса, получим:
2
d' Q
Q'1 2
T
1
Тогда в обратимом цикле Карно имеем:
B
C
D
A
d' Q
d' Q
d'Q
d' Q
Q'Карно
.
T
T
T
T
1
2
A
B
C
D
12
13. Этот результат справедлив для любого обратимого процесса. Таким образом, для процесса, происходящего по замкнутому циклу (2) Из
Этот результат справедлив для любого обратимогопроцесса.
Таким образом, для процесса, происходящего по
замкнутому циклу
d' Q
обр
0.
(2)
Из равенства нулю интеграла, взятого по
замкнутому контуру, следует, что подынтегральное
выражение
dQ
T - есть полный дифференциал некоторой
функции, которая определяется только
состоянием системы и не зависит от пути, каким
система пришла в это состояние.
T
13
14. Это позволяет ввести новую функцию состояния S: (3) Функция состояния, полный дифференциал которой равен , называется
Это позволяет ввести новую функциюсостояния S:
dQ
dS
T
(3)
Функция состояния, полный дифференциал
dQ
которой равен
, называется энтропией.
T
Энтропия S – это отношение полученной или отданной теплоты к температуре, при которой происходил этот процесс.
14
15. Понятие энтропии было впервые введено Рудольфом Клаузиусом в 1865 г. Для обратимых процессов изменение энтропии: (4) - это
Понятие энтропии было впервыевведено Рудольфом Клаузиусом в 1865
г.
Для обратимых процессов
изменение энтропии:
ΔS обр 0, т.к.
dQобр
T
0
- это выражение называется
равенство Клаузиуса.
(4)
15
16. Клаузиус Рудольф Юлиус Эмануэль (1822 – 1888) – немецкий физик-теоретик, один из создателей термодинамики и кинетической теории
газов. Егоработы
посвящены
молекулярной
физике,
термодинамике,
теории паровых машин, теоретической
механике, математической физике. Развивая
идеи Н. Карно, точно сформулировал
принцип эквивалентности теплоты и работы.
16
17. В 1850 г. получил общие соотношения между теплотой и механической работой (первое начало термодинамики) и разработал идеальный
термодинамический циклпаровой
машины
(цикл
РанкинаКлаузиуса). Ввел понятие энтропии.
17
18. 2. Изменение энтропии в изопроцессах
Энтропия системы является функцией еесостояния, определенная с точностью до
произвольной постоянной.
Если система совершает равновесный
переход из состояния 1 в состояние 2, то
изменение энтропии:
dQ
dU A
S 2 S1
T
T
1
1
2
ΔS1 2
2
(5)
18
19. Таким образом, по этой формуле можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии
dQdU A
S 2 S1
T
T
1
1
2
ΔS1 2
2
Таким образом, по этой формуле
можно определить энтропию лишь с
точностью до аддитивной постоянной, т.е.
начало энтропиипроизвольно.
Физический смысл имеет лишь
разность
энтропий.
Исходя из этого, найдем изменения
энтропии в процессах идеального газа.
19
20. Так как, а то или (6)
Так как,а
m
dU CV dT ,
μ
m RT
dA PdV
dV ,
μ V
2
2
m dT
mR
то ΔS S 2 S1 CV
dV
μ
T
μ
V
1
1
или
m
T2 m
V2
ΔS CV ln R ln
μ
T1 μ
V 1 (6)
20
21. т.е. изменение энтропии S12 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 2.
т.е. изменение энтропии S1 2идеального газа при переходе его из
состояния 1 в состояние 2 не зависит
от вида перехода 1 2.
Каждый из изопроцессов
идеального газа характеризуется
своим изменением энтропии, а
именно:
m
T2
изохорический: ΔS CV ln
μ
T1
V =V
1
2
,т.к.,
21
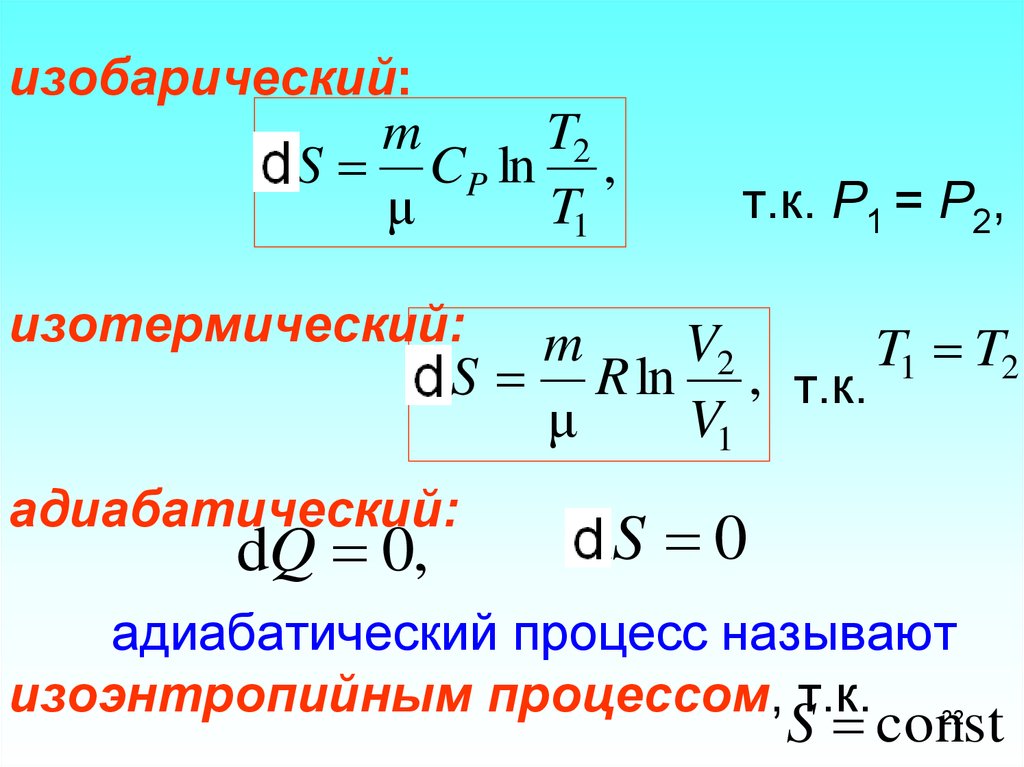
22. изобарический: т.к. Р1 = Р2, изотермический: т.к. адиабатический: адиабатический процесс называют изоэнтропийным процессом,
изобарический:m
T2
ΔS CP ln ,
μ
T1
т.к. Р1 = Р2,
изотермический:
m
V2
T1 T2
ΔS R ln , т.к.
μ
V1
адиабатический:
dQ 0,
ΔS 0
адиабатический процесс называют
изоэнтропийным процессом, т.к.
S const
22
23.
Изменение энтропии в изопроцессах:Изохорический ΔS m CV ln T2 ,
μ
T1
процесс:
т.к.
Изобарический
m
T2
ΔS C p ln ,
процесс:
μ
T1
т.к.
Изотермически
V2
ΔS mR ln ,
й процесс:
V1
т.к. Т1 = Т2
Адиабатически
й процесс:
V1 V2
P1 = P2
dQ 0,
то ΔS 0,
изоэнтропийный процесс
23
24. 3. Поведение энтропии в процессах изменения агрегатного состояния
Рассмотрим три агрегатныхсостояния: твердое, жидкое и
газообразное и два перехода к
ним.
Фазовый переход «твердое тело –
жидкость»
Из школьного курса физики хорошо
известны четыре факта об этом
переходе.
24
25. 1. Переход вещества из твердого состояния (фазы) в жидкое называется плавлением, а обратный – кристаллизация. 2. При плавлении
система поглощаеттепло,
а
при
отвердевании
–
отдает тепло.
3. В процессе плавления температура
системы остается постоянной до тех пор,
пока вся система не расплавится эта
температура
называется
температурой плавления.
….
25
26. 4. Закон плавления: количество тепла Q, которое необходимо для плавления вещества массой dm, пропорционально этой массе: (7)
4. Закон плавления: количество теплаQ, которое необходимо для плавления
вещества массой dm, пропорционально
этой массе:
Q λdm.
(7)
Коэффициент пропорциональности λ
есть константа, зависящая только от
вещества системы и называемая
удельной теплотой плавления.
26
27. Этот закон справедлив и для кристаллизации, правда, с одним отличием: Q в этом случае – тепло выделяемое системой. В
Этот закон справедлив и длякристаллизации, правда, с одним
отличием: Q в этом случае – тепло
выделяемое системой.
В обобщенном виде закон
можно записать так:
при плавлении Q λdm,
Q
λ
d
m
.
при кристаллизации
27
28. Изменение энтропии в процессе этого фазового перехода можно найти просто, если считать процесс равновесным. Это вполне
допустимое приближение,если считать, что разность температур
между системой и тем объектом, который
поставляет системе тепло, не слишком
велика, намного меньше температуры
плавления.
28
29. Тогда можно использовать термодинамический смысл энтропии: с точки зрения термодинамики энтропия – это такая функция состояния
системы, изменение которой dS вэлементарном равновесном процессе
равно отношению порции тепла Q,
которое система получает в этом
процессе, к температуре системы Т:
Q
dS
T
29
30. или . Подставим сюда выражение для Q, получим: .
S2или
Q
ΔS S 2 S1 dS
T
S1
1
2
.
Подставим сюда выражение для Q,
получим:
2
λd m
ΔS
T
1
.
30
31. Так как температура системы в данном фазовом переходе не меняется и равна температуре плавления, то подынтегральное выражение
этовеличина, которая в ходе процесса не
меняется, поэтому она от массы m
вещества не зависит. Тогда:
ΔS λm Tпл
.
(8)
31
32. Из этой формулы следует, что при плавлении энтропия возрастает, а при кристаллизации уменьшается. Физический смысл этого
ΔS λm TплИз этой формулы следует, что при
плавлении энтропия возрастает, а при
кристаллизации
уменьшается.
Физический
смысл
этого
результата
достаточно
ясен:
фазовая область молекулы в твердом теле
гораздо меньше, чем в жидкости, так как в
твердом теле каждой молекуле доступна
только малая область пространства между
соседними узлами кристаллической решетки,
а в жидкости молекулы занимают всю область
32
пространства.
33. Поэтому при равной температуре энтропия твердого тела меньше энтропии жидкости. Это означает, что твердое тело представляет
собой болееупорядоченную, и менее хаотичную
систему, поэтому и энтропия его
меньше, чем у жидкости.
33
34. Фазовый переход «жидкость – газ»
Этот переход обладает всемисвойствами перехода «твердое тело –
жидкость».
Существует четыре факта также
знакомые из школьного курса физики.
1: переход вещества из жидкости в
газовую фазу называется испарением,
а обратный переход – конденсацией.
34
35. 2: при испарении система поглощает тепло, при конденсации – теряет. 3: процессы испарения и конденсации протекают в широком
диапазоне температур,но фазовым переходом они являются лишь
тогда, когда процесс захватывает всю массу
вещества. Это происходит при определенной
температуре Тк, которая называется
температурой кипения. Для каждого
вещества температура кипения своя.
35
36. В процессе фазового перехода «жидкость – газ» температура остается постоянной и равной температуре кипения до тех пор, пока вся
система неперейдет из одной фазы в другую.
4: закон испарения: количество
тепла Q, необходимое для испарения
вещества массой dm, пропорционально
этой массе:
Q rdm
.
(9)
36
37. Коэффициент пропорции r в этом выражении, есть константа, зависящая от вещества системы, называемая удельной теплотой
испарения.Этот закон справедлив и для конденсации,
правда с одним отличием: Q в этом случае –
тепло выделяемое системой.
Закон испарения можно записать в
общем виде:
Q rdm,
(10)
где знак плюс относится к испарению, а знак
минус – к конденсации.
37
38. Изменение энтропии в этом процессе можно найти просто, считая процесс равновесным. И опять это вполне допустимое приближение,
приусловии, что разность температур между
системой и «поставщиком» тепла
невелика, т.е. намного меньше
температуры кипения.
Тогда изменение энтропии:
S2
2
2
S1
1
1
ΔS S 2 S1 dS Q T rdm rm Tk
38
39. Из формулы следует, что при испарении энтропия возрастает, а при конденсации уменьшается.
ΔS S2 S1 rm TkИз формулы следует, что при
испарении энтропия возрастает,
а при конденсации уменьшается.
39
40. Физический смысл этого результата состоит в различии фазовой области молекулы в жидкости и газе. Хотя в жидкости и газе каждой
молекуле доступнався
область
пространства,
занятая
системой, но сама эта область для
жидкости существенно меньше, чем для
газа. В жидкости силы притяжения между
молекулами удерживают на определенном
расстоянии друг от друга, поэтому каждая
молекула хотя и имеет возможность
свободно
мигрировать
по
области
40
пространства,
41. занятой жидкостью, но не имеет возможности «оторваться от коллектива» остальных молекул: стоит ей оторваться от одной молекулы,
как тут жепритягивается другая. Поэтому объем
жидкости зависит от её количества
и никак не связан с объемом сосуда.
41
42. Молекулы газа ведут себя иначе. У них гораздо больше свободы, среднее расстояние между ними таково, что силы притяжения очень
малы, и молекулы«замечают друг друга» лишь при
столкновениях. В результате газ всегда
занимает весь объем сосуда.
42
43. Поэтому при равных температурах фазовая область молекул газа значительно больше фазовой области молекул жидкости, и энтропия
газабольше энтропии жидкости. Газ,
по
сравнению с жидкостью, гораздо
менее
упорядоченная,
более
хаотичная система и энтропия газа
больше энтропии жидкости.
43








































 physics
physics








