Similar presentations:
Классификация дисперсных систем. (Лекция 5)
1. Классификация дисперсных систем
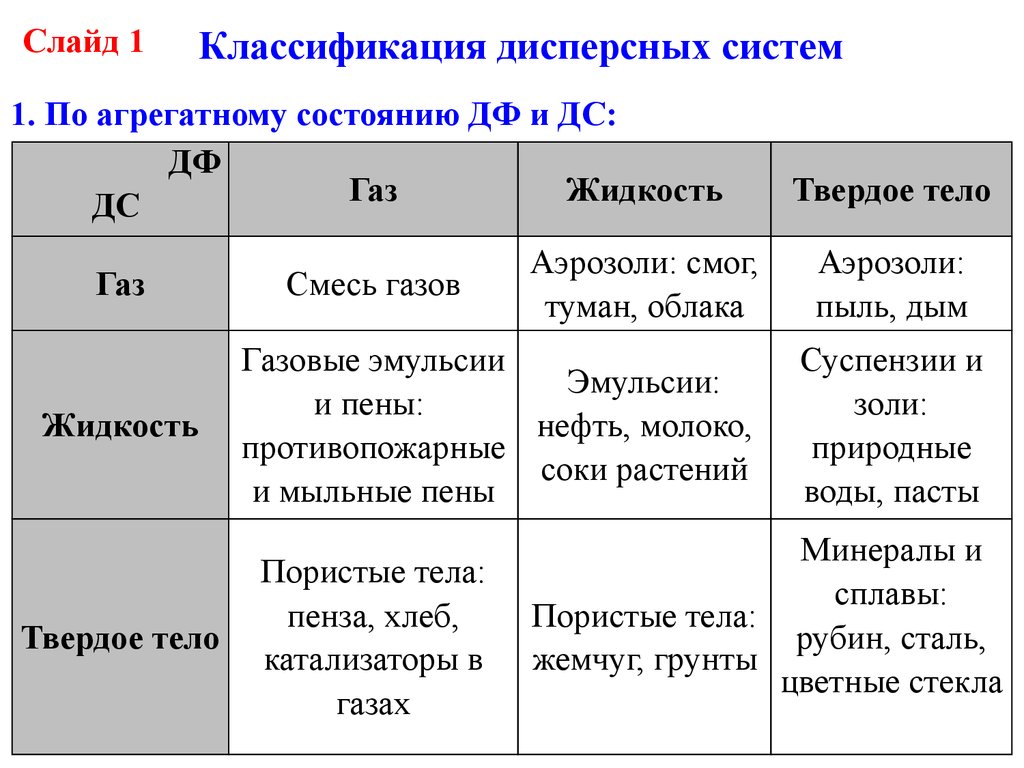
Слайд 1Классификация дисперсных систем
1. По агрегатному состоянию ДФ и ДС:
ДФ
Газ
Жидкость
ДС
Газ
Жидкость
Твердое тело
Смесь газов
Аэрозоли: смог,
туман, облака
Газовые эмульсии
Эмульсии:
и пены:
нефть, молоко,
противопожарные
соки растений
и мыльные пены
Пористые тела:
пенза, хлеб,
катализаторы в
газах
Твердое тело
Аэрозоли:
пыль, дым
Суспензии и
золи:
природные
воды, пасты
Минералы и
сплавы:
Пористые тела:
рубин, сталь,
жемчуг, грунты
цветные стекла
2.
2.3 Концентрация, способы выражения состава раствораСлайд 2
где Мэ – молярная масса эквивалента
(mэкв – эквивалентная масса), г/моль.
3. Расчет Мэкв:
•Расчет Мэкв:Мэ = М Э = ,
где Э – эквивалент - число, показывающее какая доля частиц
вещества при химических реакциях присоединяет или замещает один
атом водорода, ½ атомов кислорода.
Пример:
H2SO4 + NaOH = NaHSO4 + H2O, Э=1;
H2SO4 + 2NaOH = Na2SO4 + 2H2O, Э=.
1. Эквивалент кислоты: n - основность.
2. Эквивалент основания: n- кислотность.
3. Эквивалент соли : Э = , где n - степень окисления атомов
металла, z - число атомов металла.
4. Эквивалент оксида : Э = n - степень окисления атомов
элемента, z - число атомов элемента).
5. Эквивалент простого вещества: n – число электронов
в Э0 ne → Э n.
4.
Пример:Э(H3PO4) = ;
Э(Са(OH)2) =
Э(Al2(SO4)3) =
5.
4. Моляльная концентрация (моляльность)n
Cмоль
кг ,[
m =
m р - ля
5. Мольная доля
6. Титр раствора
/
].
nв
Nв =
nв + n р - ля
m
Т = ,[ г / мл].
Vр
Пример, а) распечатка, задание 1-3; б) Глинка. Задачник.
6.
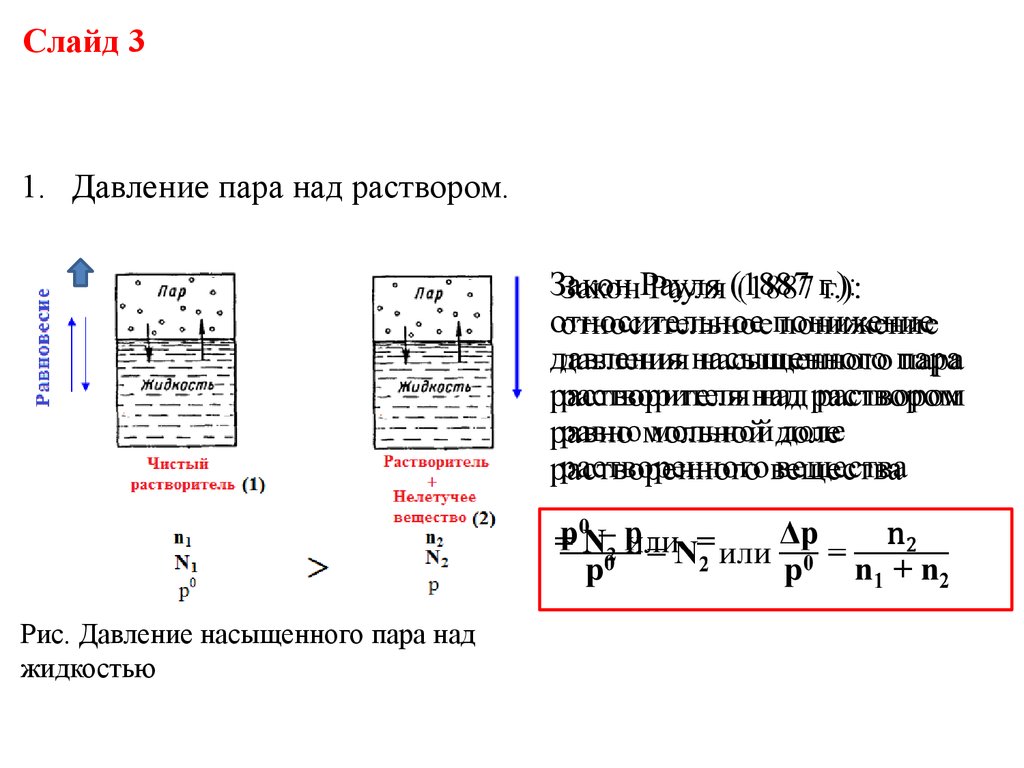
Слайд 31. Давление пара над раствором.
Закон Рауля (1887 г.):
относительное понижение
давления насыщенного пара
растворителя над раствором
равно мольной доле
растворенного вещества
= N2 или =
Рис. Давление насыщенного пара над
жидкостью
7.
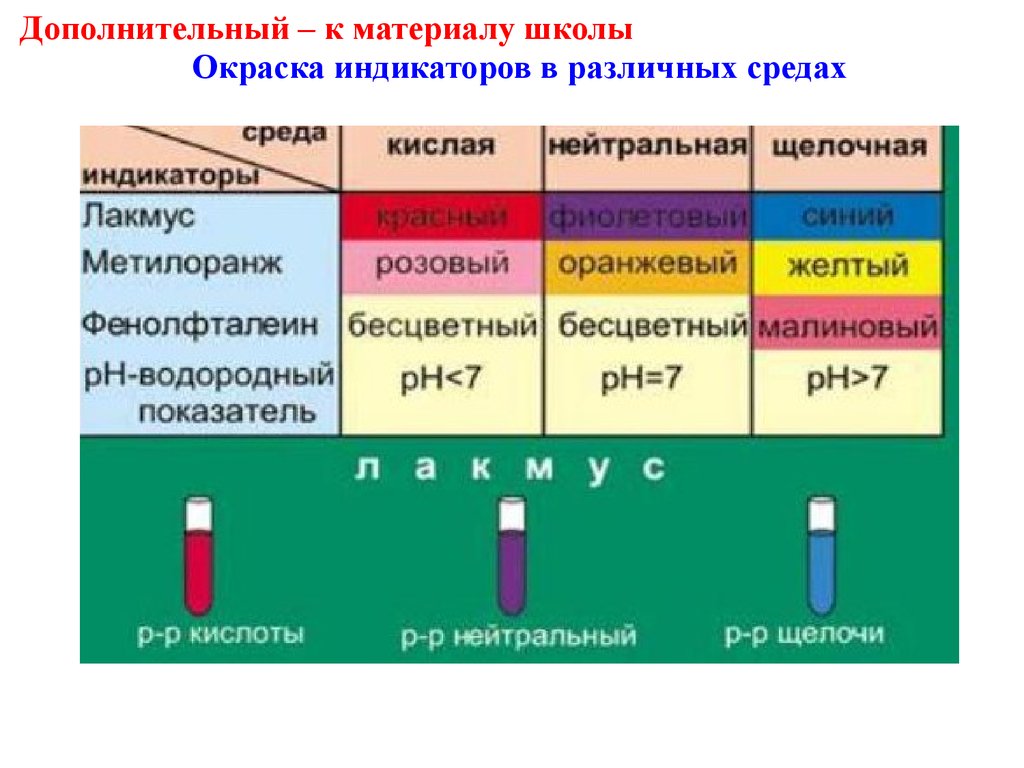
Дополнительный – к материалу школыОкраска индикаторов в различных средах


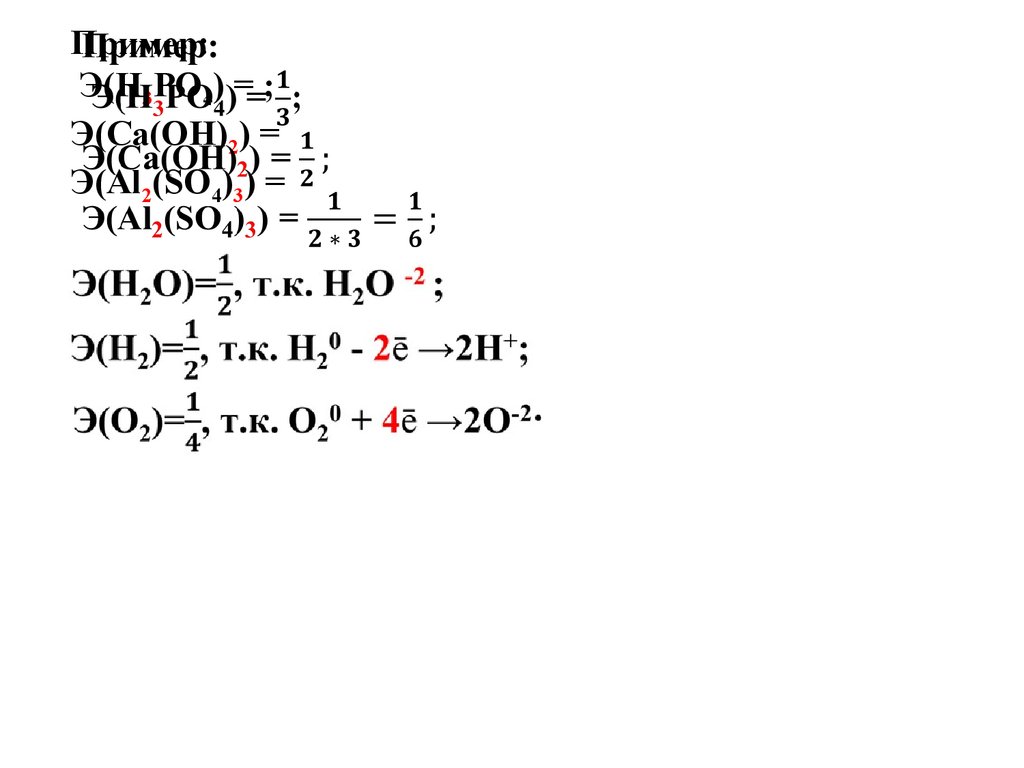

 chemistry
chemistry








