Similar presentations:
Растворы. Классификация растворов. (Лекция 5)
1.
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ СПБГЭТУРАСТВОРЫ
ВЕСЕННИЙ СЕМЕСТР 2015-2016 УЧ.ГОД
2.
Растворы. Классификация растворовРаствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
Растворитель – компонент, количество которого в системе
преобладает либо не меняет своего агрегатного состояния
Компоненты растворов сохраняют свои уникальные свойства
и не вступают в химические реакции между собой
с образованием новых соединений
t
2H +O →2H O
2
2
2
2
3.
Растворы. Классификация растворовРаствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
Растворитель – компонент, количество которого в системе
преобладает либо не меняет своего агрегатного состояния
По агрегатному состоянию:
Газообразные растворы
(Смесь газов)
Жидкие растворы
1. растворы твердых веществ в жидкостях:
соль+Н2О, сахар+Н2О , йод+Н2О
2. растворы газообразных веществ в жидкостях:
лимонады, нашатырный спирт
3. растворы жидкостей в жидкостях:
уксус, водка
воздух – это раствор кислорода, паров воды,
углекислого газа (СО2) и благородных газов в азоте
3
4.
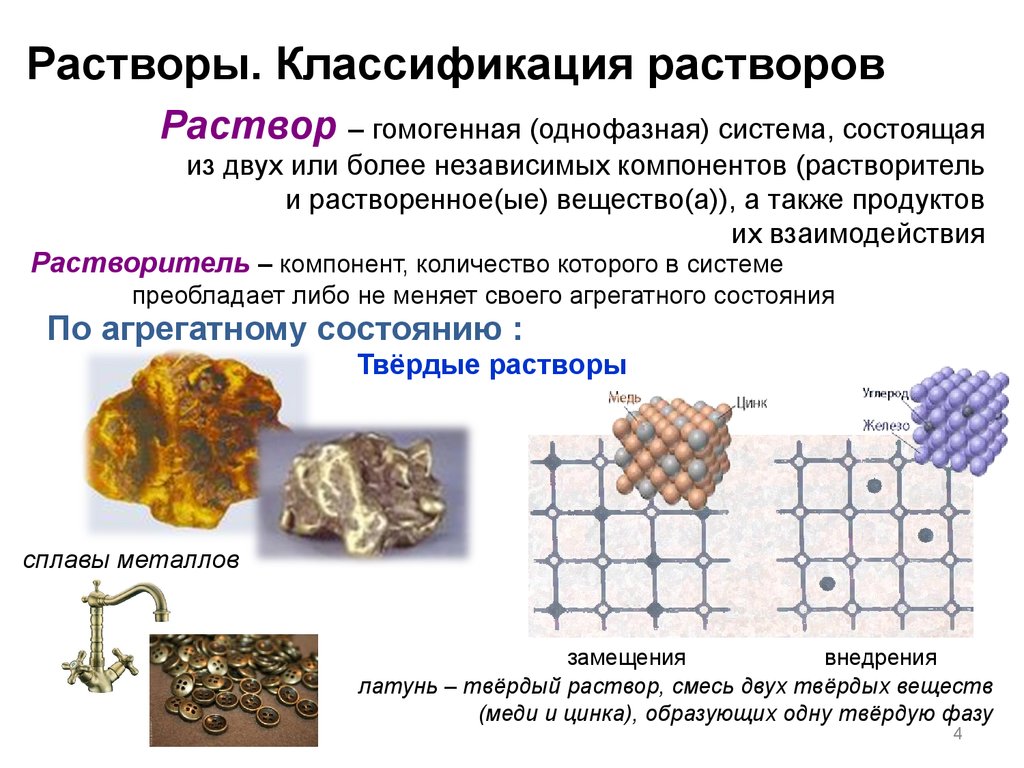
Растворы. Классификация растворовРаствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
Растворитель – компонент, количество которого в системе
преобладает либо не меняет своего агрегатного состояния
По агрегатному состоянию :
Твёрдые растворы
сплавы металлов
замещения
внедрения
латунь – твёрдый раствор, смесь двух твёрдых веществ
(меди и цинка), образующих одну твёрдую фазу
4
5.
Растворы. Классификация растворовПо относительным количествам растворенного
вещества:
разбавленные и концентрированные
По соотношению преобладания частиц,
переходящих в раствор и удаляющихся из раствора:
ненасыщенные, насыщенные и пересыщенные
Раствор концентрация которого ниже концентрации mi° > m
i
насыщенного раствора называется ненасыщенным
Насыщенный раствор – это раствор, который
в равновесии с твёрдой фазой
mi° = mi находится
растворенного вещества и содержит
максимально возможное при данных условиях
количество этого вещества
Пересыщенный раствор - раствор,
в котором при данной температуре
содержится бОльшее количество растворенного
вещества, чем возможно в насыщенном растворе
mi° < mi
5
6.
Растворы. Классификация растворовПо размеру частиц:
Истинный раствор – однофазная система, образованная
не менее чем двумя компонентами (т.е. компоненты равномерно
распределены в системе на уровне атомов, молекул или ионов)
Коллоидный раствор – тонкодисперсная
(гетерогенная) система с размерами частиц
от 500 до 1 нм
при пропускании через него луча света
образуется светящаяся дорожка – конус
Эмульсия – дисперсная система, состоящая
из микроскопических капель жидкости
(дисперсной фазы), распределенных
в другой жидкости (дисперсионной среде
Суспензия или взвесь – это
грубодисперсная система с твёрдой
дисперсной фазой и жидкой дисперсионной
средой
6
7.
Физические и химические процессыпри растворении
Физическая теория растворов – идея
индифферентности и подобия газовым системам
(Я.Вант-Гофф)
Процесс растворения является результатом диффузии, т.е.
проникновением растворенного вещества в промежутки
между молекулами растворителя, т.е. физическое явление
(Вант-Гофф, Аррениус, Оствальд)
Якоб Хендрик
Вант-Гофф
Химическая теория (Д.И.Менделеев)
Растворение является результатом химического
взаимодействия растворенного вещества с
молекулами растворителя, т.е. химическое явление
Сольватация – процесс взаимодействия
растворителя и растворённого вещества
Дмитрий Иванович
Менделеев
7
8.
Физические и химические процессыпри растворении
Механическая
смесь
Раствор
• переменность состава
• непрерывная, плавная
зависимость свойств от состава
Химическое
соединение
• однородность состава по всей фазе
• наличие теплового эффекта
при образовании
Физико-химическая теория растворов
8
9.
Физические и химические процессыпри растворении
Тепловой эффект, сопровождающий процесс растворения,
относящийся к 1 молю растворенного вещества называется
молярной теплотой растворения
∆Нраств.
∆Н1 > 0 – количество теплоты, затраченной на распределение частиц растворяемого
вещества среди молекул растворителя (процесс эндотермический)
∆Н2 < 0 – количество теплоты, выделяющейся при взаимодействии растворенного
вещества с молекулами растворителя и образование связей между ними
(тепловой эффект сольватации, процесс экзотермический)
для твёрдого вещества:
∆Н1 > 0 – энергия, необходимая для разрушения кристаллической решетки и
энергия необходимая для разрыва связей между молекулами
растворителя (процесс эндотермический)
В зависимости от преобладания первой или второй составляющих,
процесс растворения может быть экзотермическим или эндотермическим:
если │∆Н2│> │∆Н1│, процесс экзотермический и ∆Нраств. < 0
если │∆Н2│< │∆Н1│, процесс эндотермический и ∆Нраств. > 0
KOH
∆Нраств. = –55.65 кДж/моль
NH4NO3
∆Нраств. = 26.48 кДж/моль
9
10.
Способы выражения концентрацииКонцентрация – соотношение между количеством
растворенного вещества и растворителя или количеством
растворенного вещества и всего раствора
m
i =
Способы выражения концентрации растворов
• Массовая доля ( ) – отношение массы растворенного
вещества к массе раствора
i =
• Объемная доля ( ) – отношение объема растворенного
вещества к объему раствора
ui
j
100
å uk
k =1
Xi =
• Молярная доля (X) – отношение числа молей растворенного
вещества к сумме числа молей всех компонентов раствора
j
i
100
å mk
k =1
ni
j
100
å nk
k =1
• Молярная концентрация (молярность) (См, моль/л) – число моль
растворенного вещества в одном литре раствора
• Нормальная концентрация или молярная концентрация
эквивалента (нормальность) (Сн, моль экв/л) – число моль
эквивалентов растворенного вещества, содержащихся
в одном литре раствора
1 м р-р H2SO4 = 2 н р-р H2SO4
• Титр (СТ, мг/мл или г/мл) – масса растворенного вещества,
содержащаяся в одном миллилитре раствора
• Моляльность (Сm, моль/кг) – число моль растворенного вещества,
приходящееся на 1 кг растворителя
10
11.
Растворимость веществ.Факторы, влияющие на растворимость
Растворимость – количественная характеристика
соотношения компонентов насыщенного раствора
коэффициент растворимости вещества (Р) – наибольшая масса
вещества, способная при данной температуре
раствориться в 100 г растворителя
Например, при 20°С в 100 г воды с образованием насыщенного раствора
растворяется 36.0 г NaCI, значит Р(NaCI) = 36
молярная растворимость вещества (S) – число молей вещества,
способное при данной температуре раствориться в 1 л указанного
растворителя с образованием насыщенного раствора
Пример: S(NaCI) = 6.154 моль/л
коэффициент поглощения газа – наибольший объем газа, который может
раствориться в единице объема растворителя при данной температуре
и парциальном давлении газа 1 атм.
Так при 20°С коэффициенты поглощения водой азота и кислорода,
молекулы которых неполярны, составляют соответственно 0.016 и 0.031
Для газов, молекулы которых полярны, коэффициент их поглощения водой
значительно выше, например для HCI – 500, NH3 – 1300
11
12.
Растворимость веществ.Факторы, влияющие на растворимость
Растворимость веществ зависит:
• от природы реагирующих веществ
• от концентрации раствора
• от температуры
• присутствия других веществ в растворе
• от давления (для газообразных веществ)
12
13.
Растворимость твердых веществв жидкостях
• от природы реагирующих веществ
• от температуры
Для идеальных растворов справедливо уравнение Шредера
DHраствор. N1 – растворимость твердого вещества
æ ¶ ln N1 ö
ç ¶T ÷ =
DHраствор. – энтальпия растворения 1 моль вещества
2
è
øP
RT
в почти насыщенном растворе
Процесс растворения
1. Плавление твердого вещества
2. Смешение жидкого вещества с идеальным раствором
DHсмеш. = 0
для идеального раствора
DHплавл.
æ ¶ ln N1 ö
ç ¶T ÷ =
è
øP
RT 2
DHраствор. = DHплавл.
так как
DHплавл. > 0
то
æ ¶ ln N1 ö
ç ¶T ÷ > 0
è
øP
Идеальная растворимость
твердого вещества
увеличивается с температурой
13
14.
Растворимость жидкостей в жидкостях• от природы реагирующих веществ
• от температуры
• от высокого давления
Неограниченная растворимость – жидкости смешиваются в любых
пропорциях
Растворимость до известного предела – имеет место расслаивание
Качественная зависимость:
ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ
14
15.
Растворимость газов в жидкостях• Растворимость газов в жидкостях при повышении температуры
УМЕНЬШАЕТСЯ
• Растворимость газов в жидкостях зависит от давления под
которым он находится над жидкостью
Закон Генри
при постоянной температуре растворимость газа в данной жидкости
прямо пропорциональна давлению этого газа над раствором
k – константы скорости
p – давление газа над раствором
c – концентрация
Г – константа Генри
v = k1 p v = k2 с
v = v
1
с k1
= = p=c
p k2
Уильям Генри
Закон пригоден лишь для идеальных растворов и невысоких давлений
Закон Дальтона
n
P = å pi
в случае растворения смеси газов в жидкости
каждый из них растворяется пропорционально
своему парциальному давлению
i =1
pi
mi =
P
Джон Дальтон
15
16.
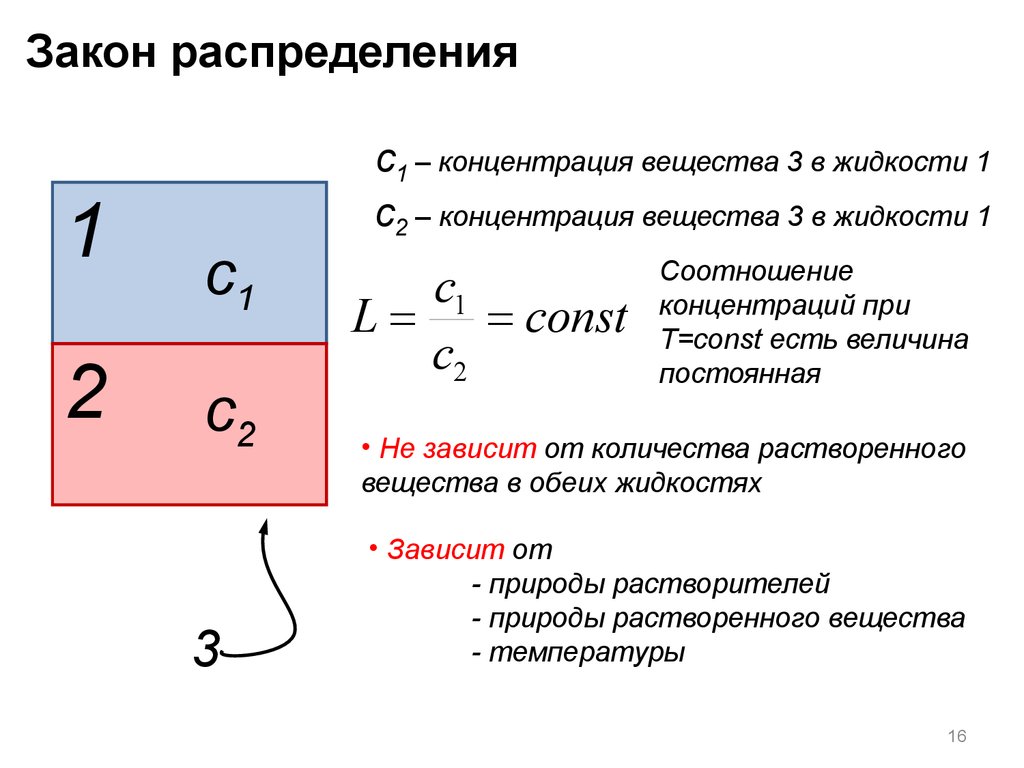
Закон распределения1
2
c1
c2
3
c1 – концентрация вещества 3 в жидкости 1
c2 – концентрация вещества 3 в жидкости 1
c1
L = = const
c2
Соотношение
концентраций при
T=const есть величина
постоянная
• Не зависит от количества растворенного
вещества в обеих жидкостях
• Зависит от
- природы растворителей
- природы растворенного вещества
- температуры
16
17.
Законы РауляПервый закон Рауля
связывает давление
насыщенного пара над раствором с его составом
Парциальное давление насыщенного пара компонента
раствора прямо пропорционально его мольной доле в
растворе, причём коэффициент пропорциональности
равен давлению насыщенного пара над чистым
компонентом
°
pi = pi X i
Франсуа Мари
Рауль
Для бинарного раствора, состоящего
из компонентов А и В, где компонент А – растворитель,
удобнее использовать другую формулировку:
°
pА - pА
= XB
°
pА
Относительное понижение парциального
давления пара растворителя над раствором
не зависит от природы растворённого
вещества и равно его мольной доле
в растворе
17
18.
Законы РауляОтносительное понижение парциального давления
пара растворителя над раствором не зависит от
природы растворённого вещества и равно его
мольной доле в растворе
Франсуа Мари
Рауль
∆Нраств. > 0
∆V > 0
∆Нраств. < 0
∆V < 0
Причиной отклонений от
закона Рауля является то
обстоятельство, что
однородные частицы
взаимодействуют
друг с другом иначе,
чем разнородные
(сильнее в случае
положительных
и слабее в случае
отрицательных отклонений)
18
19.
Законы РауляВторой закон Рауля
Понижение температуры замерзания раствора
и повышение температуры его кипения
прямо пропорционально
моляльной концентрации раствора
DTк = K эcm
DTз = K кр cm
KЭ и Kкр – эбулиоскопическая и криоскопическая
константы, характеризующие растворитель
Франсуа Мари
Рауль
DT не зависит от природы растворенного вещества,
а определяется природой растворителя и моляльностью,
т.е. числом молекул, растворенных в определенном количестве растворителя
- Повышение температуры
Эти свойства разбавленных растворов зависят
кипения
только от числа частиц растворенного
- Понижение температуры
вещества, но не от их природы
замерзания
Поэтому эти свойства назвали коллигативными
(в том смысле, что они «зависят от количества»)
19
20.
ОсмосЯвление осмоса (по-гречески значит «толкать») представляет
собой самопроизвольный переход чистого растворителя в раствор,
отделенный от него полупроницаемой мембраной, т.е.
перегородкой проницаемой для молекул растворителя, но не
проницаемой для растворенного вещества
Осмотическое давление П – давление,
которое надо приложить
к раствору для прекращения переноса
растворителя
pП
+
p
Растворитель
Одинаковы
при равновесии
Раствор
транспорт жидкостей через
клеточную мембрану
20
21.
Растворы электролитовЭлектролиты – вещества, которые в растворе или в
расплаве состоят полностью или частично из ионов
Электролиты – проводники второго рода
(с ионной проводимостью)
Электролиты – НЕ ПОДЧИНЯЮТСЯ законам Рауля
Сильные электролиты при растворении в воде практически полностью
диссоциируют на ионы независимо от их концентрации в растворе, поэтому
в уравнениях диссоциации сильных электролитов ставят знак равенства (=)
К сильным электролитам относятся:
- растворимые соли
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI
- основания, образованные щелочными (LiOH, NaOH, KOH и т.д.)
и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2)
Слабые электролиты в водных растворах лишь частично (обратимо)
диссоциируют на ионы. Поэтому в уравнениях диссоциации слабых электролитов
ставят знак обратимости (⇄)
К слабым электролитам относятся:
- почти все органические кислоты и вода
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)3, Zn(OH)2 и др.
21
22.
Растворы электролитовСтепень диссоциации – доля растворенного электролита,
которая распалась на ионы
В растворах сильных электролитов
В растворах слабых электролитов
+
22
A B 2A + B
KД =
KД
2
С + С 2А
B
2C
=
1 -
1- » 1
=
KД
С
C A2 B
»1
Константа диссоциации в одном и том же
растворителе при постоянной температуре –
величина постоянная, свойственная данному
электролиту
Степень диссоциации – характеризует
состояние электролита в растворе
только данной концентрации
и меняется с ее изменением
Закон разбавления Оствальда – с разбавлением
раствора его степень диссоциации увеличивается
22
23.
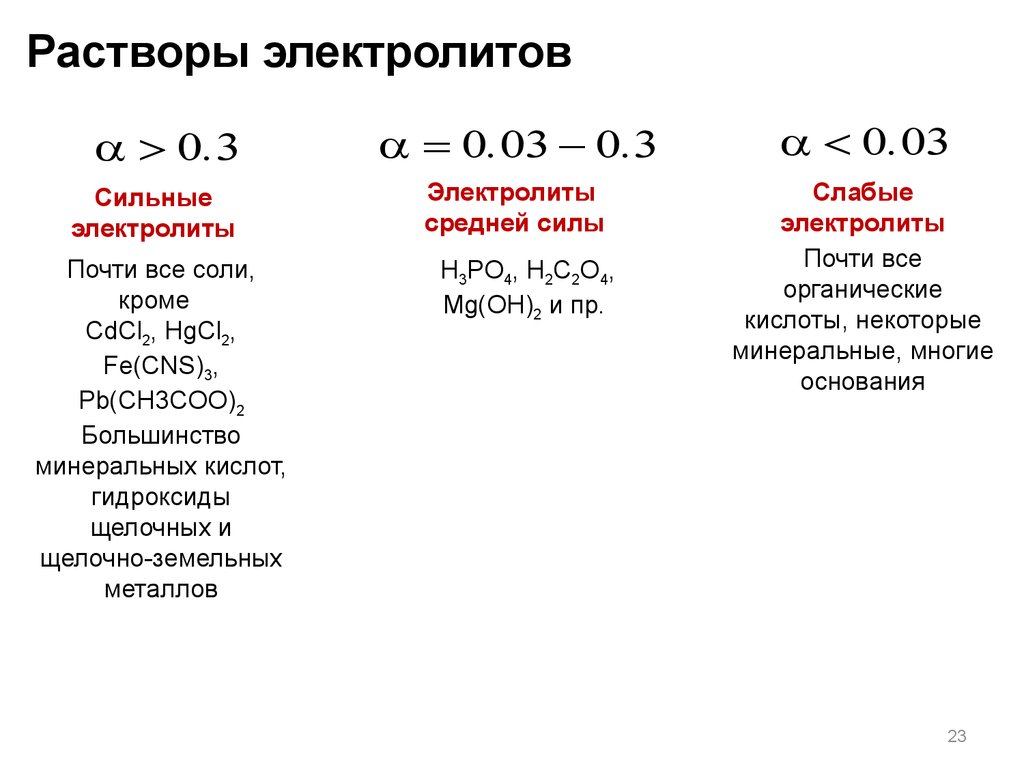
Растворы электролитов> 0.3
Сильные
электролиты
Почти все соли,
кроме
CdCl2, HgCl2,
Fe(CNS)3,
Pb(CH3COO)2
Большинство
минеральных кислот,
гидроксиды
щелочных и
щелочно-земельных
металлов
= 0.03 - 0.3
< 0.03
Электролиты
средней силы
Слабые
электролиты
Почти все
органические
кислоты, некоторые
минеральные, многие
основания
H3PO4, H2C2O4,
Mg(OH)2 и пр.
23
24.
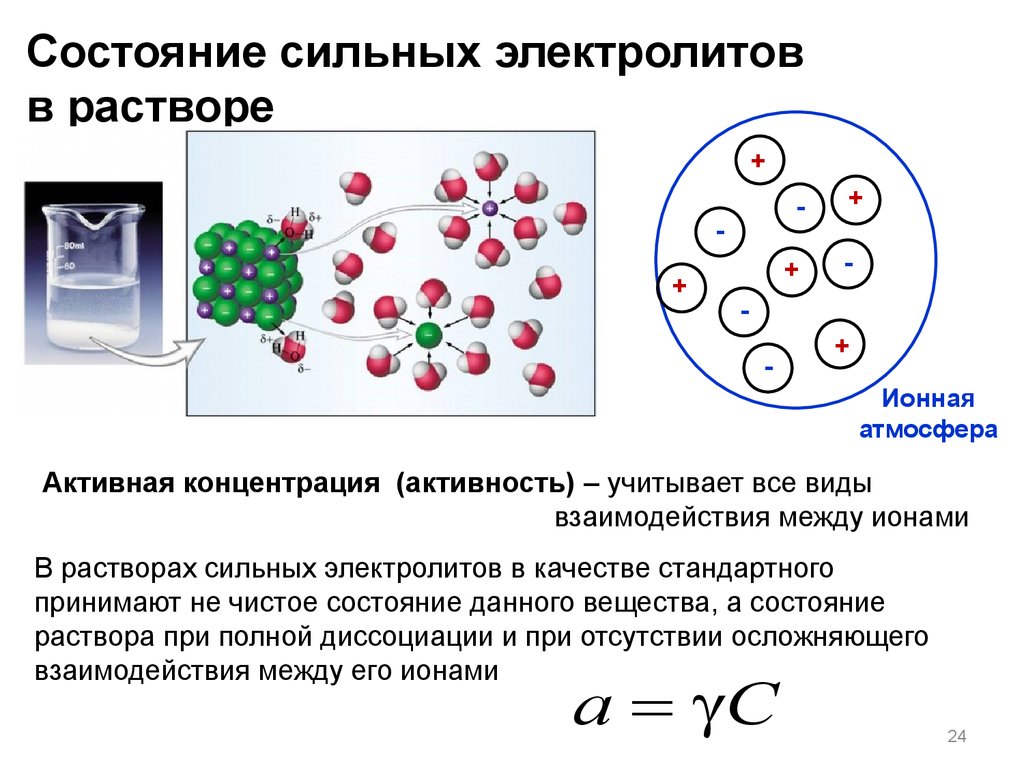
Состояние сильных электролитовв растворе
+
-
+
+
+
-
-
+
Ионная
атмосфера
Активная концентрация (активность) – учитывает все виды
взаимодействия между ионами
В растворах сильных электролитов в качестве стандартного
принимают не чистое состояние данного вещества, а состояние
раствора при полной диссоциации и при отсутствии осложняющего
взаимодействия между его ионами
a = C
24
25.
Водородный показательH 2O H
+
+ OH
-
H + OH -
KД =
= 1.8 10-16
H 2O
H 2O << 1
H OH = K
+
-
H + = OH -
Можно принять концентрацию
недиссоциированных молекул
воды постоянной
Д
H 2O = K B
Ионное произведение воды
K B = H + OH - = 10-14
В чистой воде
H + =
pH = -lg H
K B » 10-7
+
25
26.
Водородный показательK B = H + OH - = 10-14 Ионное произведение воды
H = 10
H > 10
H < 10
+
-7
+
-7
+
- 7 моль/л - СРЕДА ОСНОВНАЯ
моль/л - СРЕДА НЕЙТРАЛЬНАЯ
моль/л - СРЕДА КИСЛАЯ
pH = -lg H
+
- Водородный показатель
26
27.
Водородный показательВещество
Электролит в свинцовых аккумуляторах
Желудочный сок
Лимонный сок (5% р-р лимонной кислоты)
Пищевой уксус
Кока-кола
Яблочный сок
Пиво
Кофе
Шампунь
Чай
Кожа здорового человека
Кислотный дождь
Слюна
Молоко
Чистая вода
Кровь
Морская вода
Мыло (жировое) для рук
Отбеливатель (хлорная известь)
Концентрированные растворы щелочей
pH
<1.0
1.0-2.0
2.0±0,3
2.4
3.0±0.3
3.0
4.5
5.0
5.5
5.5
5.5
< 5.6
6.8-7.4
6,6-6,9
7.0
7.36-7.44
8.0
9.0-10.0
12.5
>13
27
28.
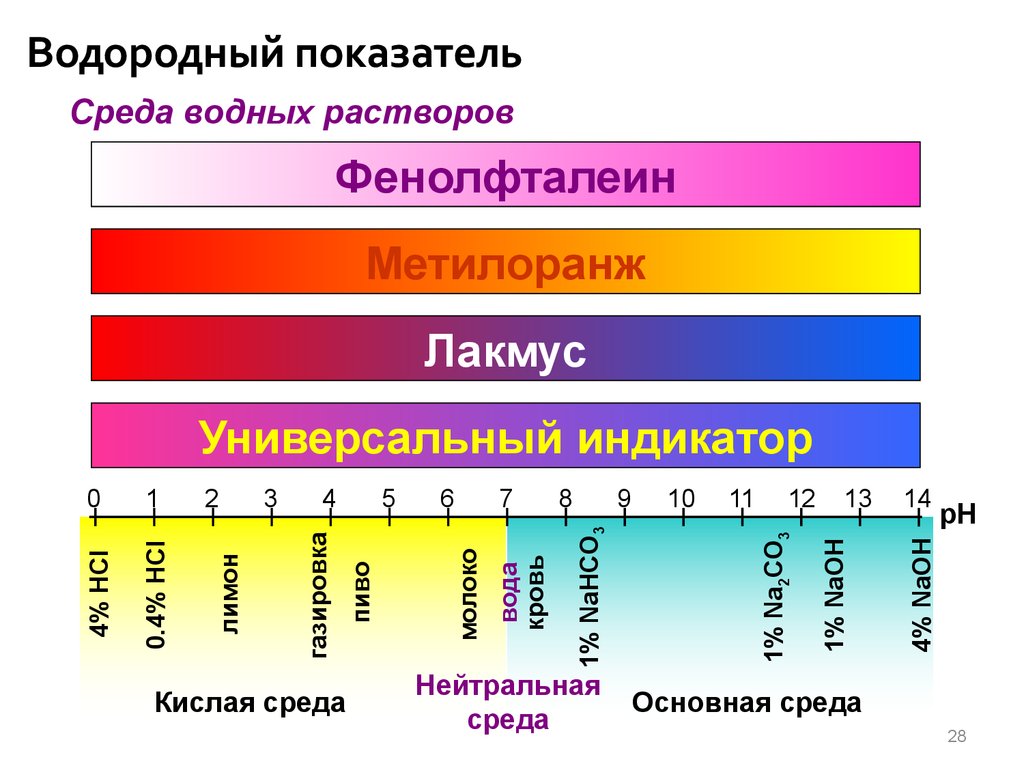
Водородный показательСреда водных растворов
Фенолфталеин
Метилоранж
Лакмус
Кислая среда
9
Нейтральная
среда
10
11
12
13
14
pH
4% NaOH
8
1% NaOH
7
1% Na2CO3
6
1% NaHCO3
5
вода
кровь
4
молоко
3
пиво
0.4% HCl
2
газировка
1
лимон
0
4% HCl
Универсальный индикатор
Основная среда
28























 physics
physics chemistry
chemistry








