Similar presentations:
Классификация дисперсных систем. Электрокинетические свойства. Строение мицелл
1.
Классификация дисперсных систем.Электрокинетические свойства.
Строение мицелл
Химия
для специальности 31.05.01 Лечебное дело
Институт фундаментальных основ и информационных технологий в медицине
Автор: кандидат химических наук, доцент
Иванова Надежда Семёновна
2.
ПЛАН ЛЕКЦИИ1. Определение коллоидной химии как науки. Основные понятия.
2. Классификации дисперсных систем.
3. Методы получения коллоидных растворов.
4. Методы очистки коллоидных растворов.
5. Электрокинетические свойства коллоидов.
6. Мицеллярная теория строения лиофобных золей. Факторы
агрегативной устойчивости золя.
7. Электротермодинамический ( ) и электрокинетический ( )
потенциалы в мицелле, причина их возникновения. Факторы, влияющие
на -потенциал.
8. Электрофорез и электроосмос. Расчет -потенциала.
2
3.
Коллоидная химия ‒ …… наука о поверхностных явлениях и
дисперсных системах.
… наука о коллоидном состоянии вещества.
… физика и химия реальных тел.
3
4.
Основные понятия:1. Дисперсность ‒ мерой её служит удельная поверхность
(Sуд). Sуд ‒ площадь раздела фаз, приходящаяся на единицу
массы или объёма дисперсной фазы.
Sуд = 6 · а-1
2. Гетерогенность ‒ мерой её служит поверхностное
натяжение (σ ‒ величина энергии единицы поверхности).
4
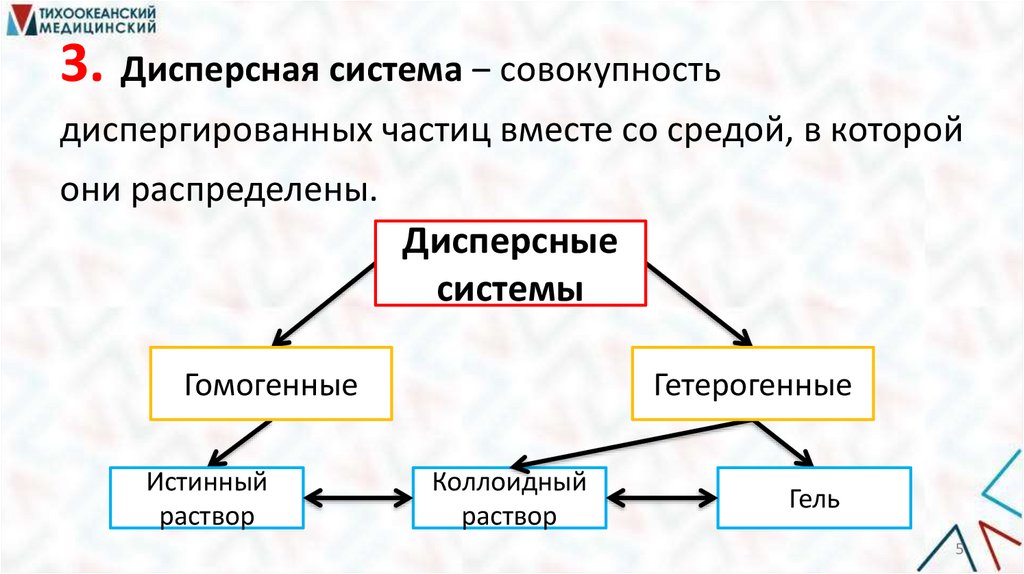
5.
3. Дисперсная система ‒ совокупностьдиспергированных частиц вместе со средой, в которой
они распределены.
Дисперсные
системы
Гомогенные
Истинный
раствор
Гетерогенные
Коллоидный
раствор
Гель
5
6.
4. Дисперсная фаза (ДФ) ‒ совокупностьдиспергированных частиц, размеры которых больше
молекулярных.
5. Дисперсионная среда (ДС) ‒ однородная
непрерывная фаза, в которой возможен переход из
одной точки в другую без выхода за пределы этой фазы.
Дисперсность и гетерогенность связаны друг с
другом GS = σ · S. Для объекта коллоидной химии,
дисперсной системы, GS велика, что делает его
термодинамически неустойчивым.
6
7.
По характерувзаимодействия
ДФ с ДС
По размеру
частиц ДФ
Классификации
дисперсных
систем
По агрегатному
состоянию ДФ и
ДС
По силе
взаимодействия
частиц ДФ
7
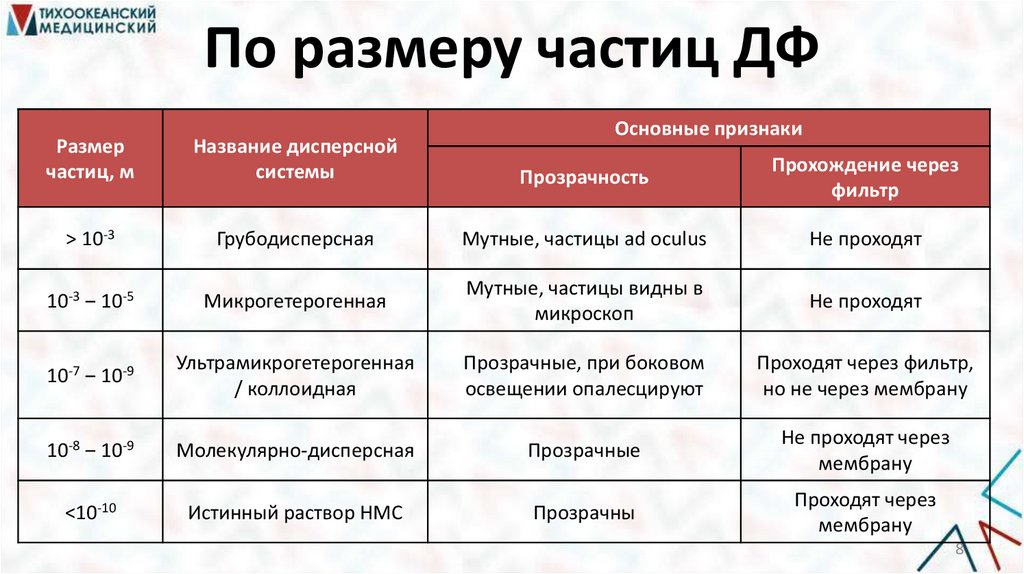
8.
По размеру частиц ДФОсновные признаки
Размер
частиц, м
Название дисперсной
системы
Прозрачность
Прохождение через
фильтр
> 10-3
Грубодисперсная
Мутные, частицы ad oculus
Не проходят
10-3 ‒ 10-5
Микрогетерогенная
Мутные, частицы видны в
микроскоп
Не проходят
10-7 ‒ 10-9
Ультрамикрогетерогенная
/ коллоидная
Прозрачные, при боковом
освещении опалесцируют
Проходят через фильтр,
но не через мембрану
10-8 ‒ 10-9
Молекулярно-дисперсная
Прозрачные
Не проходят через
мембрану
<10-10
Истинный раствор НМС
Прозрачны
Проходят через
мембрану
8
9.
По характеру взаимодействия ДФ с ДСЛиофобные системы
(золи, суспензии, эмульсии, пены,
аэрозоли)
Лиофильные системы
(молекулярно-дисперсные
системы)
Слабое взаимодействие между ДФ и ДС.
Эндэргонический процесс.
Термодинамически неустойчивы и
необратимы. Необходим стабилизатор
при получении.
Сильное взаимодействие между ДФ и ДС.
Экзэргонический процесс.
Термодинамически устойчивы и
обратимы. Образуются самопроизвольно.
9
10.
По силе взаимодействия частиц ДФСвободнодисперсные системы
(золи, суспензии, эмульсии,
аэрозоли, кровь)
Связнодисперсные системы
(гели, студни, костная ткань,
биомембраны)
Частицы ДФ обособлены и свободно
перемещаются друг относительно
друга.
Частицы ДФ связаны друг с другом
достаточно сильно, образуя
пространственную сетку. ДС заполняет
внутренность этой сетки.
10
11.
Методы получения коллоидныхрастворов
Речь идёт только о золях (лиофобных коллоидах).
а
Коллоидный
раствор
Истинный
раствор
а ‒ укрупнение частиц истинного
раствора до коллоидных размеров.
Конденсационные методы.
б
Грубодиспер
сная система
б ‒ размельчение частиц
грубодисперсной системы до
коллоидных размеров.
Диспергационные методы. 11
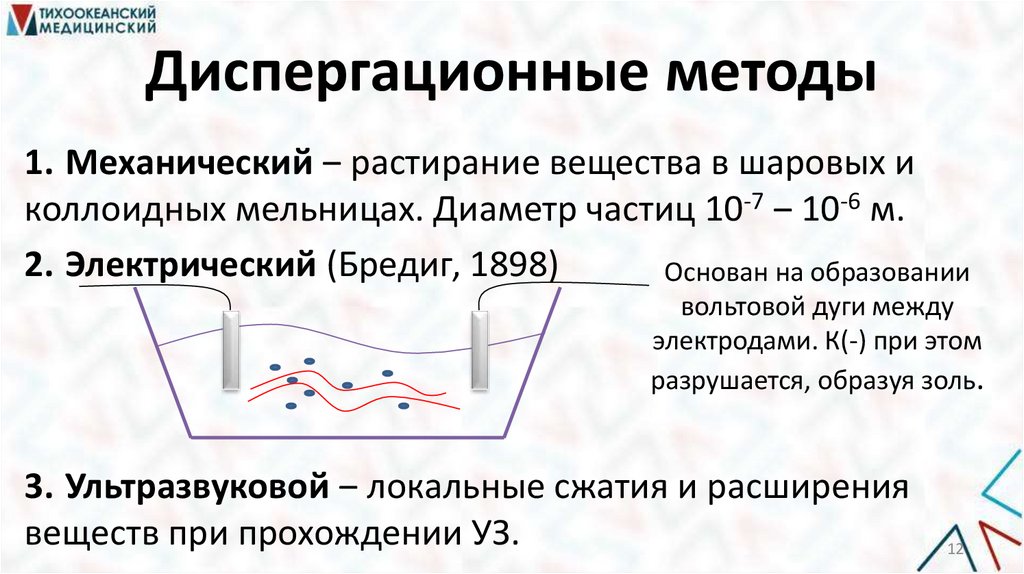
12.
Диспергационные методы1. Механический ‒ растирание вещества в шаровых и
коллоидных мельницах. Диаметр частиц 10-7 ‒ 10-6 м.
2. Электрический (Бредиг, 1898)
Основан на образовании
вольтовой дуги между
электродами. К(-) при этом
разрушается, образуя золь.
3. Ультразвуковой ‒ локальные сжатия и расширения
веществ при прохождении УЗ.
12
13.
Конденсационные методы1. Физические. Метод замены растворителя ‒ основан
на различной растворимости одного и того же вещества в
2-х растворителях.
Необходимые условия метода: вещество в одном
растворителе хорошо растворяется, в другом ‒ плохо или
совсем не растворяется. Растворители хорошо
растворяются друг в друге.
13
14.
2. Химические проводят, выполняя 2 условия:а) используют достаточно разбавленные растворы;
б) берут небольшой избыток одного из реагирующих
веществ, который выполняет роль стабилизатора
образующихся коллоидных частиц.
Химические методы основаны на реакциях окисления,
восстановления, обмена, гидролиза и т.д.
t
FeCl3 + 3H2O Fe(OH)3↓ + 3HCl
14
15.
Томас Грэм(1805—1869)
15
16.
Методы очистки золейВсе методы основаны на неспособности
коллоидных частиц проходить через поры мембран
естественного происхождения.
1. Диализ
Н2О
16
17.
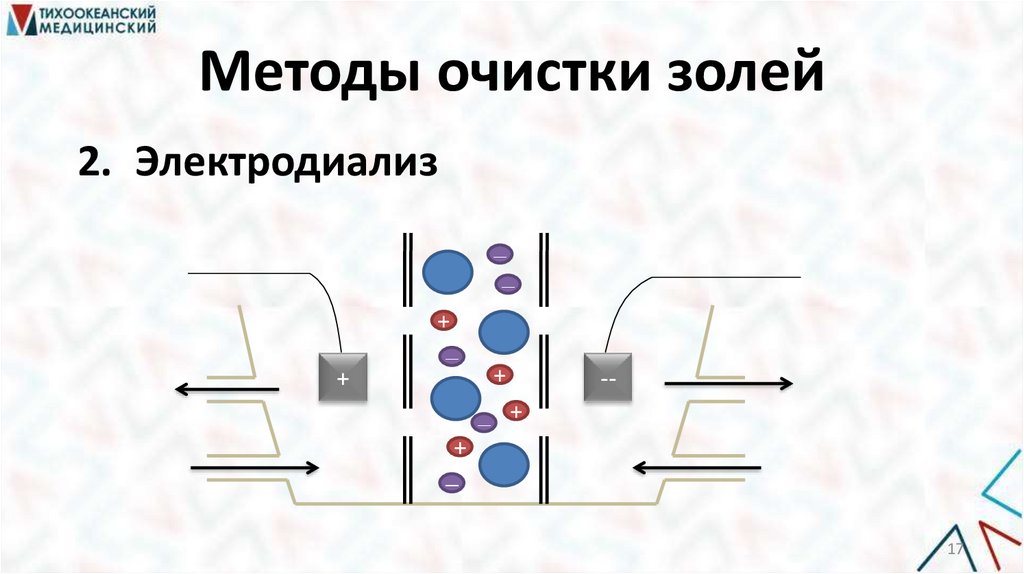
Методы очистки золей2. Электродиализ
‒
‒
+
+
‒
+
‒
+
--
‒ +
17
18.
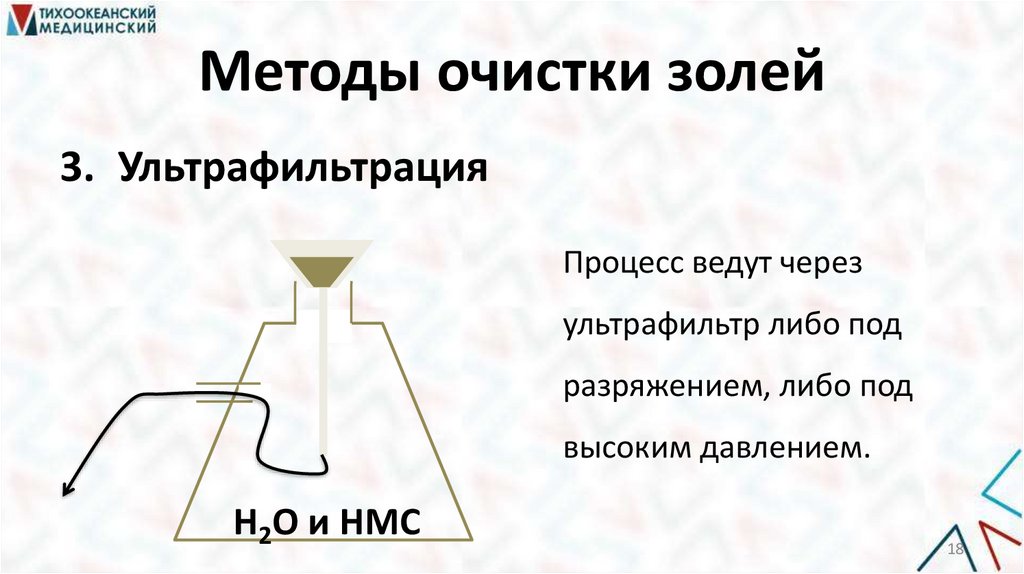
Методы очистки золей3. Ультрафильтрация
Процесс ведут через
ультрафильтр либо под
разряжением, либо под
высоким давлением.
Н2О и НМС
18
19.
Методы очистки золей4. Компенсационный / вивидиализ.
Принципиальное отличие от диализа в том, что омывающий
раствор не вода, а физраствор с добавками тех веществ, которые в
биожидкости необходимо сохранить.
Используется в аппарате «искусственная почка» для очистки
крови от токсинов. Кроме этого, этим методом в крови были
определены свободные аминокислоты, глюкоза, мочевина и их
концентрации.
19
20.
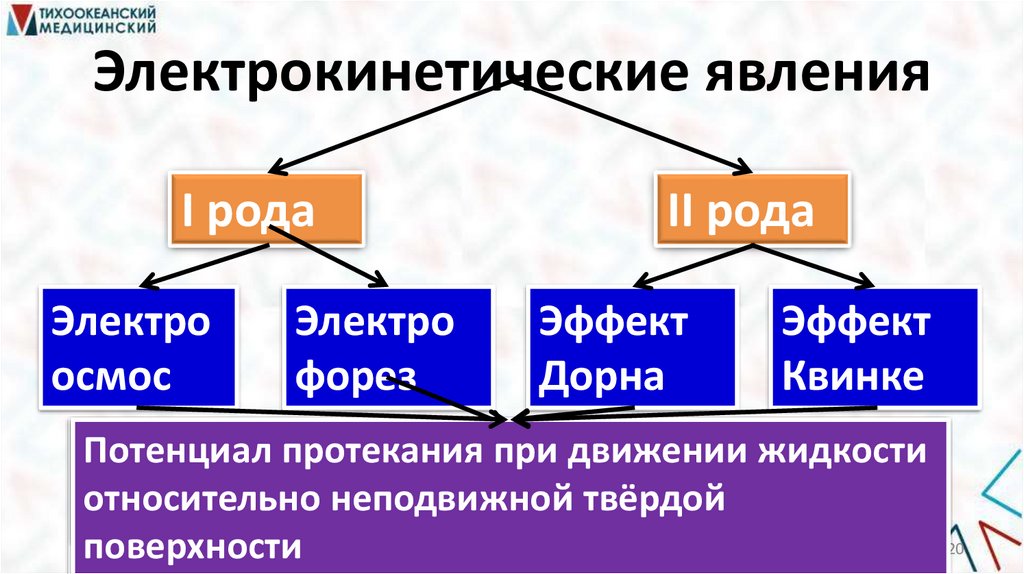
Электрокинетические явленияI рода
Электро
осмос
Электро
форез
II рода
Эффект
Дорна
Эффект
Квинке
Движение
жидкости
относительно
Потенциал
протекания
при
жидкости
Потенциал
оседания
придвижении
движении
Движение
частиц
ДФ
в
неподвижной
твёрдой поверхности
пористых
относительно
частиц ДФ
в неподвижной
неподвижной
жидкости
неподвижной
ДС твёрдой
20
мембран
поверхности
21.
Мицеллярная теория лиофобных золейМицелла ‒ гетерогенная микросистема,
состоящая из микрокристалла ДФ, окружённого
сольватированными ионами стабилизатора.
В мицелле выделяют следующие части:
‒ микрокристаллы ДФ; их число
определяют «m».
21
22.
Мицеллярная теория лиофобных золейс адсорбированными
на нём
Входят –в агрегат
адсорбционный
слой
потенциалопределяющими
ионами (ПОИ).
противоионов, прочно связанных
электростатическим притяжением с
– ионы, сообщающие заряд коллоидной частице;
ядром; «n – x».
находят по правилу Панета – Фаянса – Гана. Их число
Входят в диффузионный
определяют «n».
слой противоионов,
– ионы, заряд
которых
число
которых равно «х»
22
противоположен заряду ПОИ.
23.
Мицеллярная теория лиофобных золей– ядро с
адсорбционным слоем противоионов, являющаяся
гигантским многозарядным ионом.
Источником ПОИ и противоионов являются
стабилизаторы – электролиты (один из
реагентов, продукт реакции, постороннее
вещество).
23
24.
Получение золя конденсационным методомпо реакции обмена
избыток
BaCl2 + H2SO4 BaSO4↓ + 2HCl
стабилизатор
2+
Ba
ПОИ
{
агрегат
–
2Cl
противоион
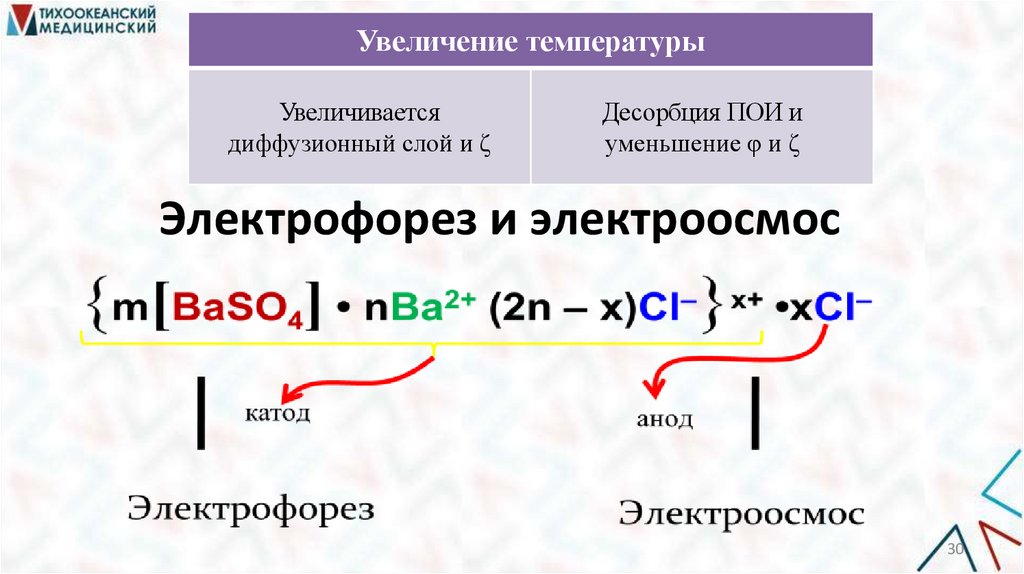
m[BaSO4] ·nBa2+ ·(2n – x)Cl–
}
x+
·xCl–
24
25.
Мицелла{m[BaSO ] • nBa (2n – x)Cl } • xCl
4
2+
–
x+
–
а г р е г аят д р о г р а на удлс ао р б ц и о н н ы й с л о й д и ф ф у з и о н н ы й с л о й
МИЦЕЛЛА
25
26.
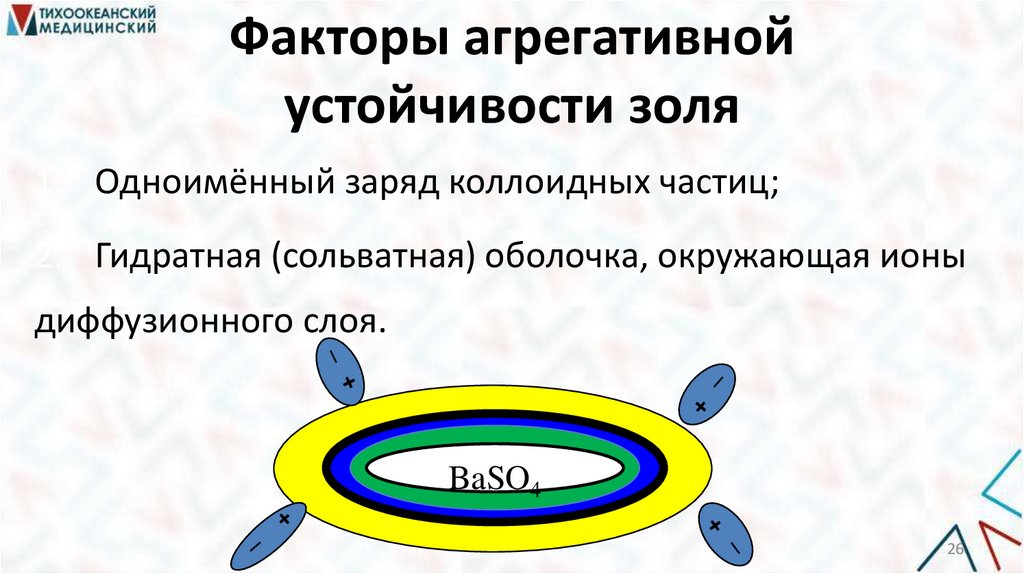
Факторы агрегативнойустойчивости золя
1. Одноимённый заряд коллоидных частиц;
2. Гидратная (сольватная) оболочка, окружающая ионы
диффузионного слоя.
BaSO4
26
27.
Возникновение ДЭС и потенциалов вмицелле
{m[BaSO ] • nBa (2n – x)Cl } • xCl
4
2+
–
x+
–
• На границе между ядром и всеми противоионами
возникает ДЭС и потенциал, который называется
электротермодинамическим ( ,ε)
• На границе между гранулой и противоионами
диффузионного
слоя
возникает
ДЭС
и
электрокинетический потенциал (ζ)
27
28.
Возникновение ДЭС и потенциалов вмицелле
• По величине 0 ≤ ζ < . При ζ = 0 имеет место
изоэлектрическая точка золя (ИЭТ), в которой
происходит полное разрушение золя.
• ζкрит. = ±30 мВ. При этом значении золь начинает
разрушаться.
Т.о., по величине ζ можно судить об устойчивости
золя: чем больше ζ, тем устойчивее золь.
28
29.
Факторы, влияющие на ζКонцентрация стабилизатора.
{m[BaSO4]
• nBa2+
0
– –
(2n
– x)Cl
• 2nCl
} }
x+
xCl–
Состояние ИЭТ золя, ζ = 0. Золь разрушается.
Концентрация посторонних электролитов.
При введении посторонних электролитов, ионы которых обладают
более высокой адсорбционной способностью, чем ионы стабилизатора,
возможна перезарядка частиц золя.
29
30.
Увеличение температурыУвеличивается
диффузионный слой и ζ
Десорбция ПОИ и
уменьшение φ и ζ
Электрофорез и электроосмос
30
31.
Расчёт ζПоскольку ζ обнаруживает себя при попадании
мицеллы в электрическое поле, для его расчёта
используются данные электрофореза и электроосмоса.
U0
ε0 ε ζ
U э.ф.
E
η
U0 η
ζ
ε0 ε E
Uэ.ф. – электрофоретическая
подвижность
U0 – скорость движения частиц при
электрофорезе
η – вязкость ДС
ε0/ε – диэлектрическая постоянная ДС и
ДФ
31
























 chemistry
chemistry