Similar presentations:
Газы и их свойства
1. Газы и их свойства
2.
Что же такое газы?Что бы ответить на этот вопрос, надо
изучить свойства газа.
3. ДАВЛЕНИЕ ГАЗА
Волейбольная камера при накачиваниираздувается во все стороны
4.
Поведение газа с позиции трехположений МКТ:
1. Газ состоит из молекул
2. Молекулы хаотично и беспрерывно
движутся
3. Молекулы взаимодействуют между
собой
5.
Идеальный газ —модель газа, в которойпредполагается, что потенциальной
энергией молекул можно пренебречь по
сравнению с их кинетической энергией
6. Микроскопические параметры идеального газа
1.2.
3.
Масса молекул
Скорость движения молекул
Энергия молекул
7.
nN
V
Концентрация – это физическая
величина, измеряемая отношением
числа частиц к объему, в котором они
находятся.
N
n
V
8.
Давление – макроскопический параметр(обозначается латинской буквой P) и
определяется ударами молекул. данная
величина зависит от массы молекулы,
ее скорости движения и от
концентрации: (где m0 – масса одной
молекулы).
9.
Данная величина зависит от:- массы молекулы
- скорости движения
- концентрации
p k m0 n v
2
10. Преобразование
12
P m0 V n
3
замена
получаем
2
p n E
3
E
m0 V 2
2
11.
Давление идеального газа на стенкисосуда прямо пропорционально
концентрации молекул в сосуде и их
средней кинетической энергии.
12.
Давление газа связано с одним из егосвойств, которое называется упругостью.
Свойство упругости используется во
многих механизмах.
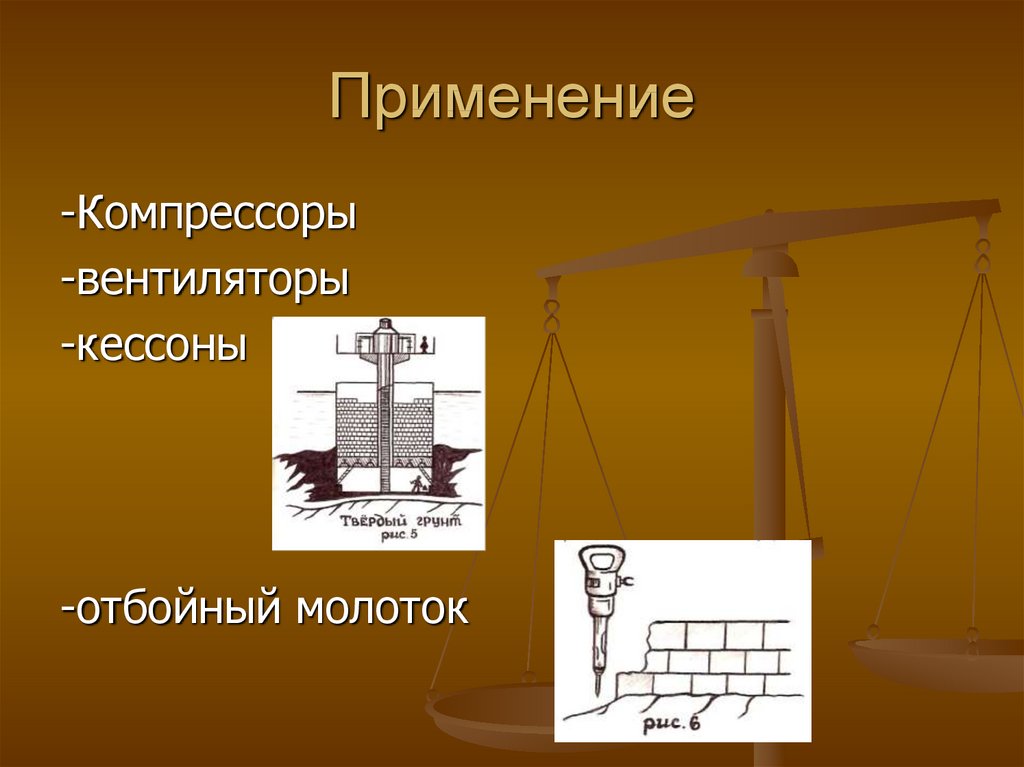
13. Применение
-Компрессоры-вентиляторы
-кессоны
-отбойный молоток
14. Температура
В ванную с тающим льдом поместимразные по объему сосуды,
заполненными различными газами при
разных давлениях так, чтобы число
молекул в сосудах также было
различным
15.
В результате установится тепловоеравновесие, и давление газов перестанет
меняться. Газы будут иметь такую же
температуру, как и окружающий их лед.
Эту температуру мы назовем нулем
градусов.
16.
Экспериментально выявленный фактможно объяснить, предположив, что при
тепловом равновесии средние
кинетические энергии молекул всех
газов одинаковые, следовательно, и
температура будет являться мерой
средней кинетической энергии.
3 pV
E
2 N
17.
Чем же измеряется температура и каковаединица ее размерности?
Прибор для измерения температуры
называется – термометр, а измеряется в
градусах Цельсия.
3
1C k
2
0
23
k
1
,
38
10
Дж, где
Дж/град
k- постоянная Больцмана
18.
3Так как на 1 градус приходится k Дж и
2
на T градусов приходится E Дж, то
из решения
составленной пропорции следует, что
3
E kT
2
19.
При изменении температуры идеальногогаза на 1 градус, средняя кинетическая
энергия каждой из молекул изменяется на
3
k
2
3
23
1
,
38
10
джоулей (на
Дж).
2
20.
Мы пришли к важному выводу:средняя кинетическая энергия
хаотичного поступательного
движения
молекул одноатомного идеального
газа
прямо пропорциональна его
температуре.
21.
Если Е=0, то Т=0. Это соображениеопределяет одну опорную точку, которая
носит абсолютный характер и, поэтому,
может быть названа абсолютным
нулем.
22.
Шкала температур, у которой нольсоответствует такому состоянию, с
интервалами, равными интервалам в
шкале Цельсия, называется шкалой
Кельвина, а сама температура,
измеренная по этой шкале, называется
абсолютной температурой.
23.
соотношение между температурнымишкалами Цельсия и Кельвина:
t T 273,15
24. Газовые законы
макроскопические параметры газа(
p, V , T
) взаимосвязаны
25. Нам известно, что :
2Давление газа на стенки сосуда : p n E
3
3
Средняя кинетическая энергия : E kT
2
Следовательно, между давлением газа,
концентрацией молекул и абсолютной
температурой существует зависимость:
p nkT
26.
NТак как n
, а число молекул N в
V
объеме V - через число Авогадро N a
и количества вещества
, которое
связано с
массой газа
и его молярной массой
m
( ) , то мы переходим к следующему
соотношению:
m
m
pV
N a kT
27.
Очевидно, произведение постоянных N a иk тоже будет постоянным. Поэтому
лучше обозначить его буквой R . В
физике эта величина называется
универсальной газовой постоянной, и она
равна:
Äæ
R 8,31
Ê ìîëü
28.
В итоге мы имеем уравнение, имеющееназвание Менделеева – Клапейрона:
pV
m
RT
29.
Если какой-либо параметр газа остается впроцессе изменения его состояния
постоянным ,то такие процессы
называются изопроцессами.
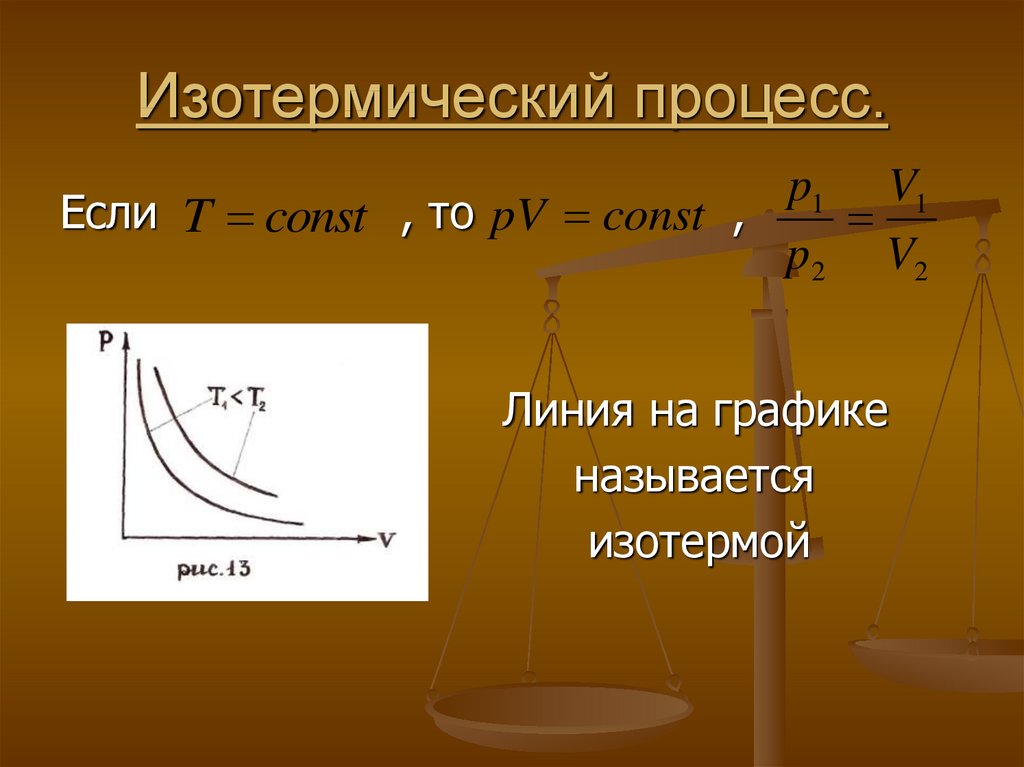
30. Изотермический процесс.
p1 V1Если T const , то pV const ,
p 2 V2
Линия на графике
называется
изотермой
31. Изохорический процесс.
Если V const , тоp
const
T
,
p1 T1
p 2 T2
Линия на графике
называется
изохорой
32. Изобарный процесс.
Если p constV
, то
const
T
,
V1 T1
V2 T2
Линия на графике
называется
изобарой































 physics
physics








