Similar presentations:
Коррозия металлов
1. Коррозия металлов
2. 1. Коррозия – это процесс самопроизвольного разрушения металла под действием окружающей среды.
2. Коррозия– это процесс переходаметалла в то природное,
естественное состояние, в котором
мы встречаем его в земной коре.
3.
Ущерб, наносимый коррозиейМировая потеря 20 млн. тонн металла в год
Еще более значимы косвенные потери
4.
Делийскаяжелезная колонна
Возраст 1600 лет
Высота 7, 2 м, вес около 6 тонн
Эйфелева башня
Красили 18 раз,
отчего ее масса 9000 т
каждый раз увеличивалась
на 70 т (в сумме - 1260 т)
5.
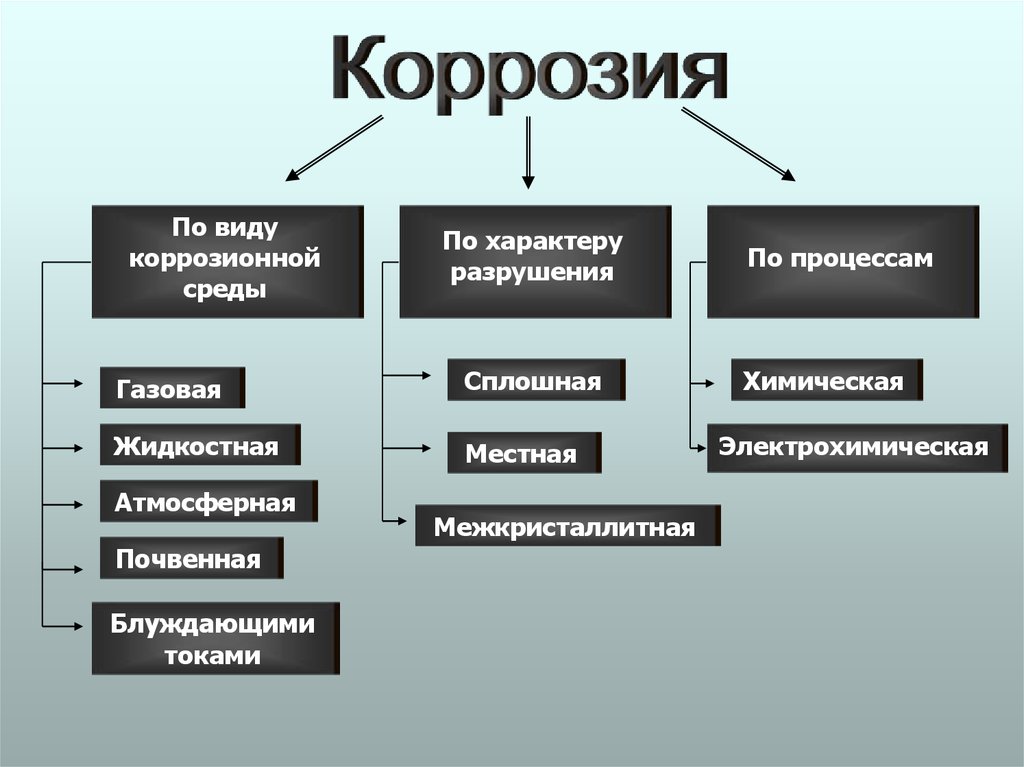
6.
По видукоррозионной
среды
По характеру
разрушения
Газовая
Сплошная
Жидкостная
Местная
Атмосферная
Почвенная
Блуждающими
токами
Межкристаллитная
По процессам
Химическая
Электрохимическая
7.
По видукоррозионной среды
8.
ГазоваяЖидкостная
Атмосферная
Почвенная
Блуждающими
токами
9. По характеру разрушений
10. Сплошная коррозия
РавномернаяНеравномерная
11. Местная коррозия
ЯзвеннаяТочечная
Пятнами
12. Причины возникновения местной коррозии
Соль на дорогахМорская вода
Межкристаллитная коррозия
13.
По процессам14. Химическая коррозия
Химическая коррозия – самопроизвольное разрушение металловв среде окислительного газа (кислорода, галогенов и т.д.) при
повышенных температурах или в жидких не электролитах.
Газовая
2Fe + 3Cl2 = 2FeCl3
4Fe + 3О2 = 2Fe2 О3
В жидких
не электролитах
• В нефти
• В сере
• В органических веществах
Cu + S = CuS
2 Ag + S = Ag2S
2Al + 6ССl4 = 3C2Cl6 + 3AlCl3
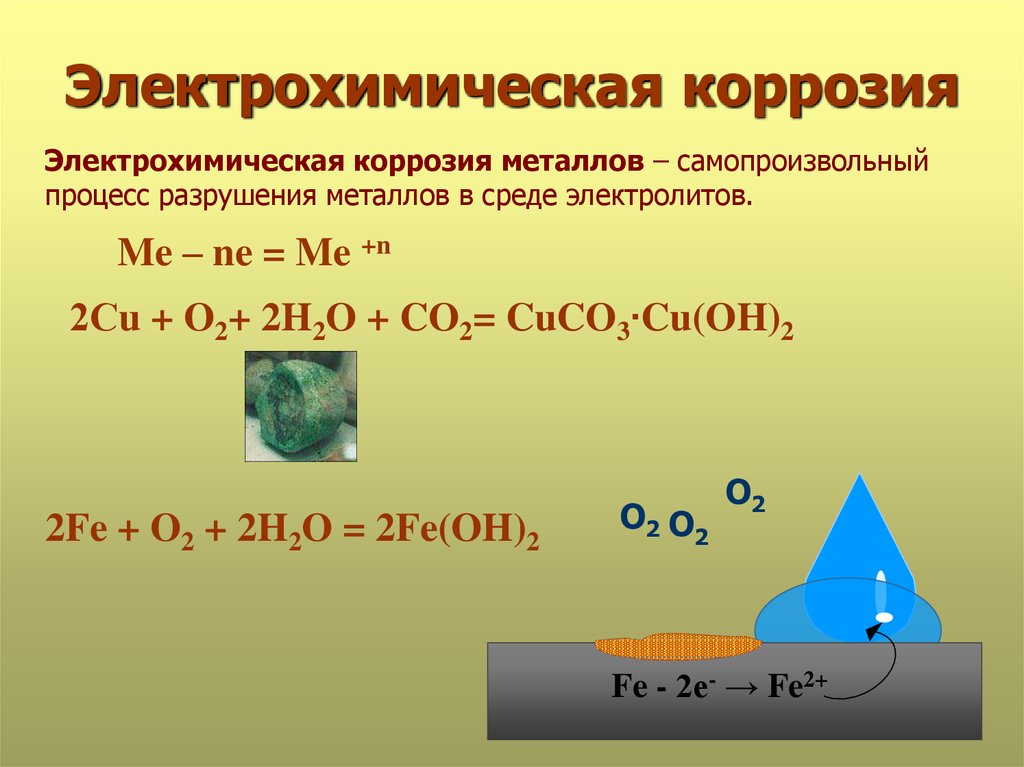
15. Электрохимическая коррозия
Электрохимическая коррозия металлов – самопроизвольныйпроцесс разрушения металлов в среде электролитов.
Me – ne = Me +n
2Сu + O2+ 2H2O + CO2= CuCO3∙Cu(OH)2
2Fe + O2 + 2H2O = 2Fe(OH)2
О2 О2
О2
Fe - 2е- → Fe2+
16. Защита металлов от коррозии
17. Применение ингибиторов
Ингибиторы - это вещества,способные замедлять протекание
химических процессов или
останавливать их.
Известно более 5 тысяч
18. Нанесение защитных покрытий
•Краска•Лак
•Грунтовка
•Смола
•Эмаль
Пластмасса
Масло
19. Покрытие антикоррозионным металлом
НикелированиеХромирование
Оцинковка
20. Покрытие антикоррозионным металлом
Покрытиеалюминием
Лужение
Позолота
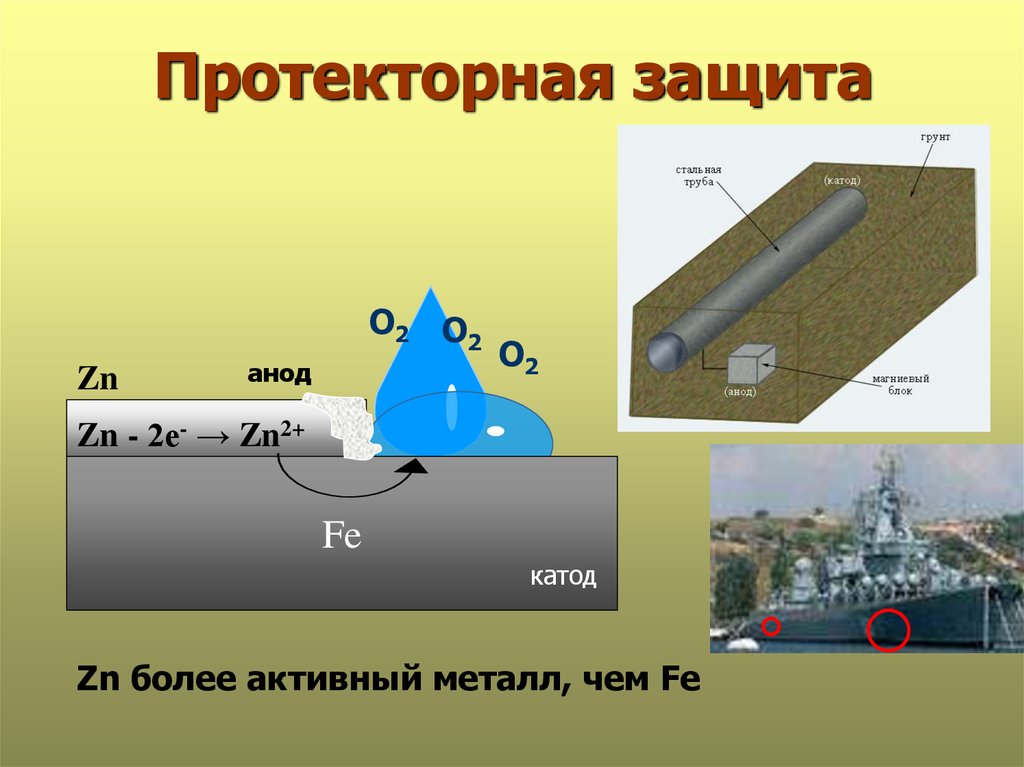
21. Протекторная защита
О2 О2Zn
анод
О2
Zn - 2е- → Zn2+
Fe
катод
Zn более активный металл, чем Fe
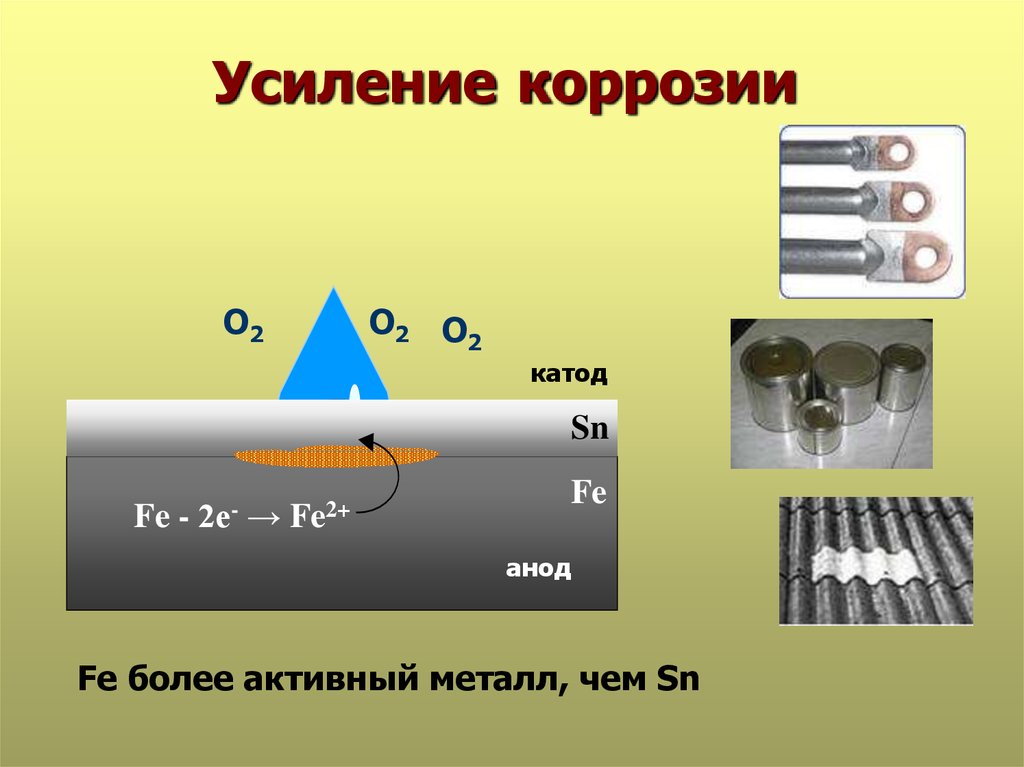
22. Усиление коррозии
О2О2 О2
катод
Sn
Fe -
2е-
→
Fe
Fe2+
анод
Fe более активный металл, чем Sn
23. Задача 1
Сантехника попросили поставить водопроводный кран,на стальную трубу. В наличии оказались хромированный
и медный краны. Какой кран лучше выбрать?
Аргументируйте ответ.
24. Задача 2
Человек поставил на зуб золотую коронку, по истечениинекоторого времени возникла необходимость в еще одной
коронке, но средств на коронку у него нет.
Возможен ли вариант, чтобы поставить на зуб
стальную коронку?
Что Вы можете предложить в решении данной проблемы?




















 chemistry
chemistry