Similar presentations:
Коррозия металлов
1.
При взаимодействии металлов с веществамиокружающей среды на их поверхности образуются
соединения,
обладающие
совершенно
иными
свойствами, чем сами металлы. В обычной жизни мы
часто употребляем слова «ржавчина», «ржавление»,
видя коричнево-рыжий налет на изделиях из железа и
его сплавов. Ржавление — это частый случай
коррозии.
2. Разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются):
Коррозия — это процесс самопроизвольного разрушения металлов и сплавовпод влиянием внешней среды (от лат. corrosio — разъедание).
Разрушению подвергаются практически все металлы, в результате чего
многие их свойства ухудшаются (или совсем теряются): уменьшаются
прочность, пластичность, блеск, снижается электропроводность, а
также возрастает трение между движущимися деталями машин,
изменяются размеры деталей и т. д.
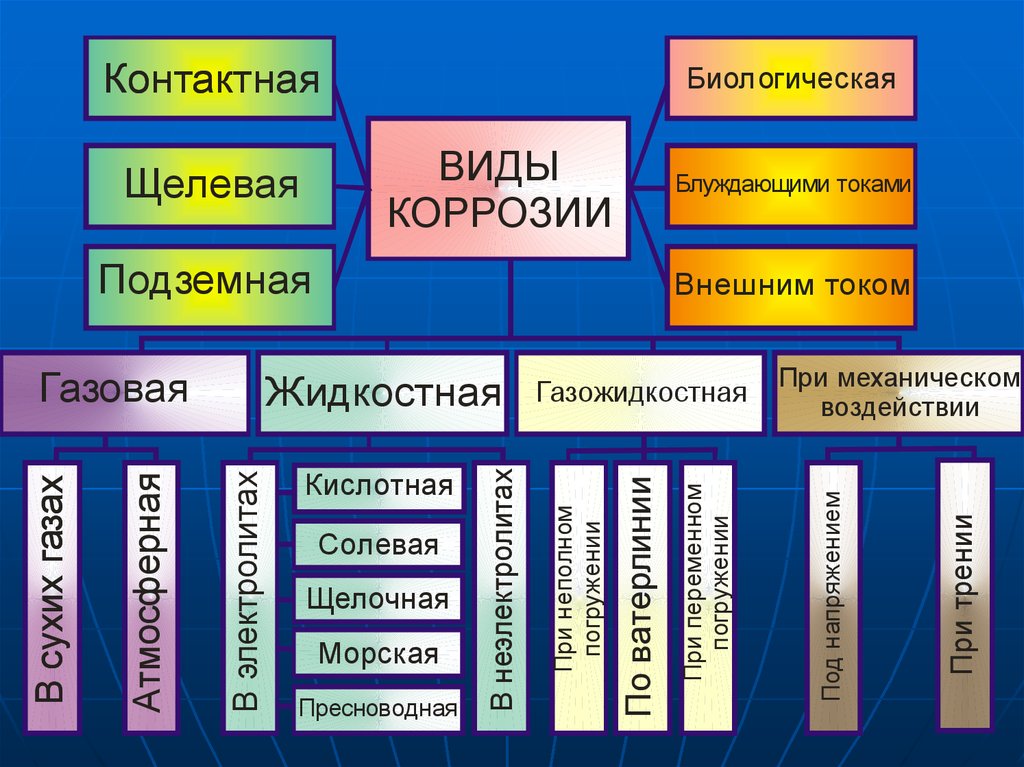
3.
КонтактнаяБиол огическая
ВИДЫ
КОРРОЗИИ
Блуждающими токами
Подземная
Пресноводная
При трении
Морская
При механическом
воздействии
Под напряжением
Щелочная
По ватерлинии
Солевая
Газожидкостная
При неполном
погружении
Кислотная
В неэлектролитах
Жидкостная
В электролитах
Атмосферная
В сухих газах
Газовая
Внешним током
При переменном
погружении
Щелевая
4. ХИМИЧЕСКАЯ КОРРОЗИЯ
Данная коррозия протекает в средеокислительного газа при
повышенных температурах или в
жидких неэлектролитах. Сущность
процессов коррозии этого вида
сводится к окислительновосстановительной реакции,
осуществляемой непосредственным
переходом электронов металла на
окислитель:
5.
4 Fe + 3 O2 = 2 Fe2O3К химической коррозии относятся
процессы взаимодействия металлов
с сухими газами /например,
продуктами сгорания топлива в
тепловых двигателях/ или жидкими
органическими веществами
/нефтепродуктами в резервуарах
нефтеналивных судов/.
6. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Происходит в токопроводящей среде(в электролите) с возникновением
внутри системы электрического тока.
Скорость такой коррозии
увеличивается с присутствием
примесей в образце. При этом одни
участки поверхности выполняют роль
анода (отдают электроны), а другие —
роль катода (принимают электроны).
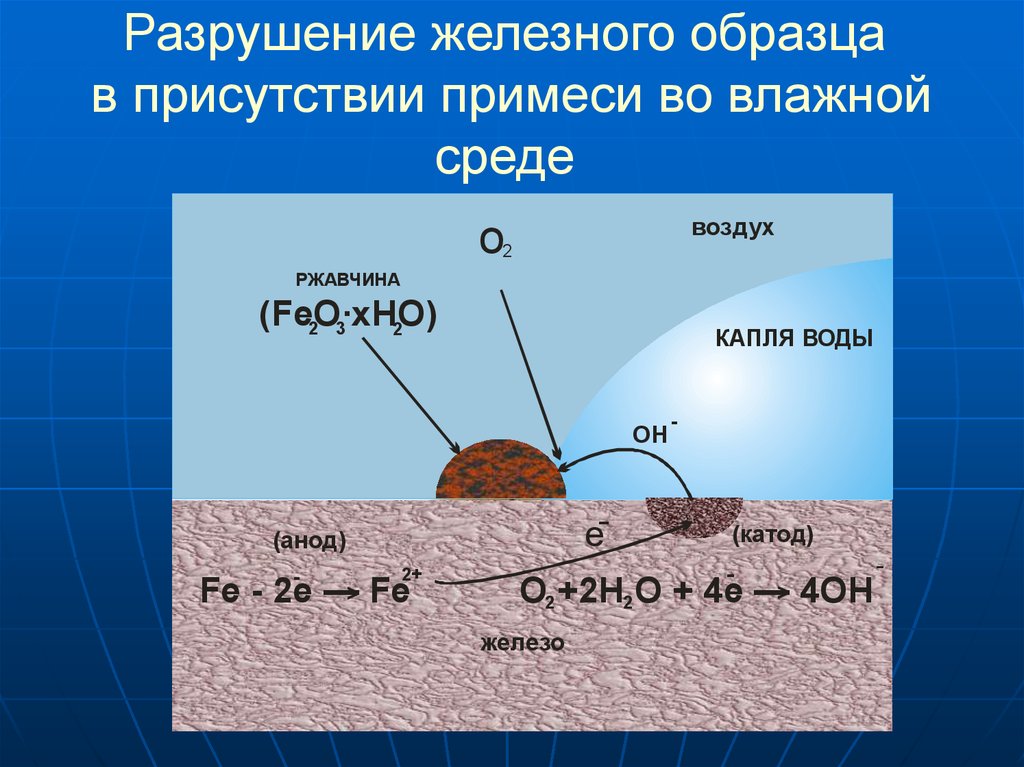
7. Разрушение железного образца в присутствии примеси во влажной среде
воздухo
2
РЖАВЧИНА
(FeO·xHO)
2 3
2
КАПЛЯ ВОДЫ
OH
e-
(анод)
2+
Fe - 2е —> Fe
-
-
(катод)
-
O2 +2H2 O + 4 e —> 4OH
железо
-
8.
На железе, как более активном металле,при соприкосновении с электролитом
происходят
процессы
окисления
(растворения) металла и перехода его
катионов в электролит:
Fe 2e Fe
2
9.
Поток электронов перемещается к катодномуучастку (примесь) с меньшей активностью,
на нем накапливается избыточное
количество электронов. Таким образом,
данные участки могут «поделиться»
электронами, поэтому на них возможны
процессы восстановления:
O2 2H 2O 4e 4OH
10.
Далее катионы Fe2+ и гидроксид-ионысоединяются.
Образуется гидроксид железа(II), который в
присутствии кислорода и воды переходит в
гидроксид железа (III):
4Fe(OH )2 2H 2O O2 4Fe(OH )3
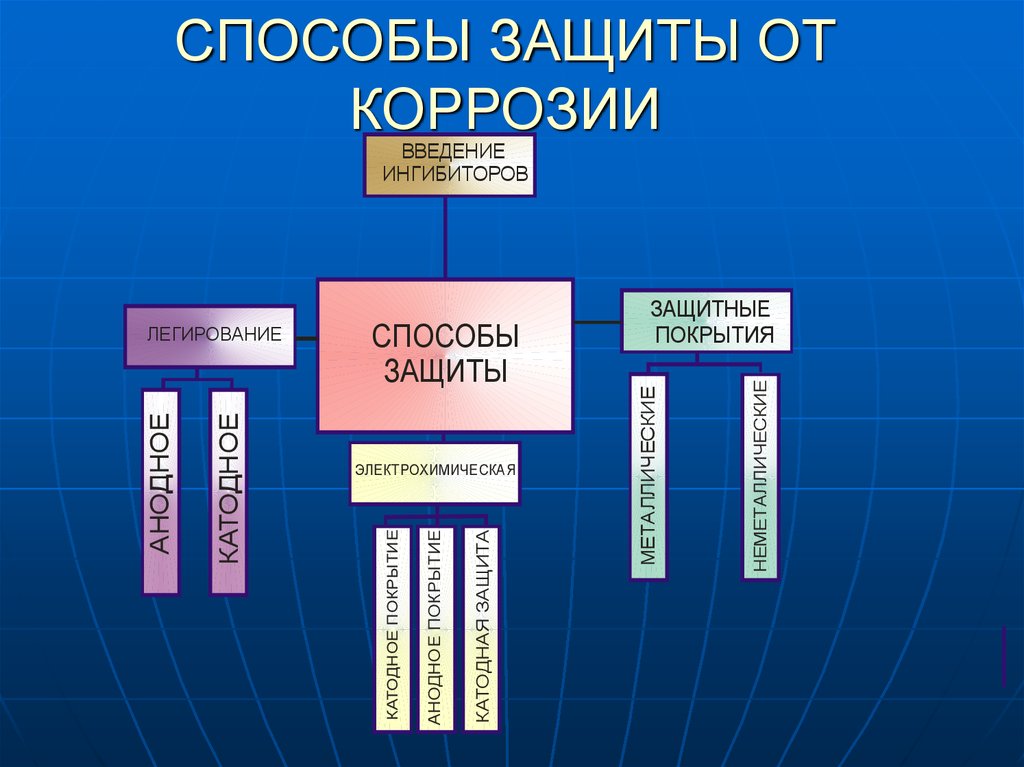
11. СПОСОБЫ ЗАЩИТЫ ОТ КОРРОЗИИ
ВВЕДЕНИЕИНГИБИТОРОВ
НЕМЕТАЛЛИЧЕСКИЕ
КАТОДНАЯ ЗАЩИТА
АНОДНОЕ ПОКРЫТИЕ
ЭЛЕКТРОХИМИЧЕСКАЯ
МЕТАЛЛИЧЕСКИЕ
СПОСОБЫ
ЗАЩИТЫ
КАТОДНОЕ ПОКРЫТИЕ
КАТОДНОЕ
АНОДНОЕ
ЛЕГИРОВАНИЕ
ЗАЩИТНЫЕ
ПОКРЫТИЯ
12. ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА
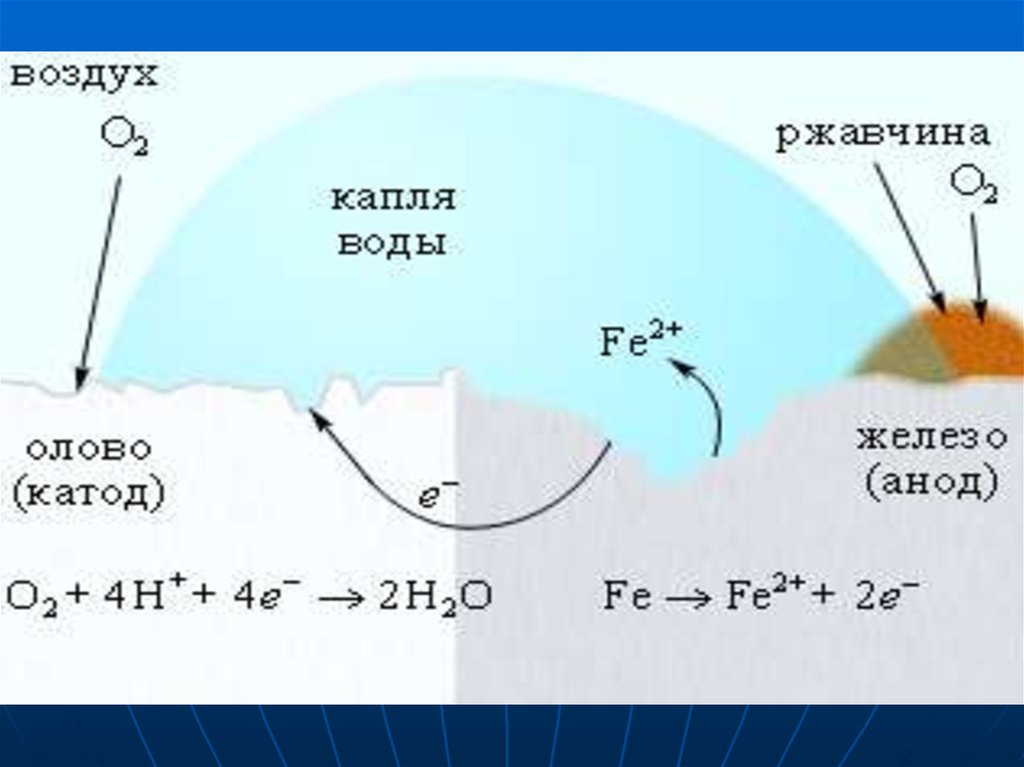
КАТОДНЫЕ ПОКРЫТИЯпокрытия менее активными
металлами более активных,
например, Sn на Fe (луженое
железо). При повреждении
покрытия возникает коррозионный
элемент, в котором основной
металл служит анодом и
растворяется, а металл покрытия –
катодом, на котором выделяется Н2
или восстанавливается О2.
13.
14.
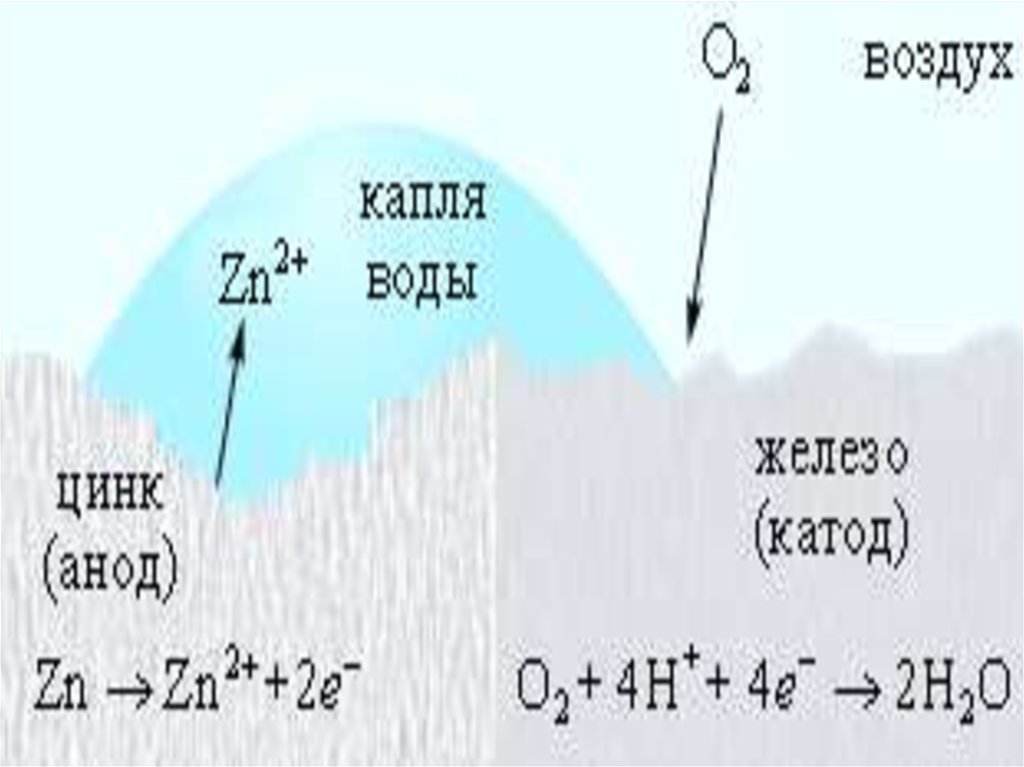
АНОДНЫЕ ПОКРЫТИЯпокрытия более активными
металлами менее активных,
например, Zn на Fe (оцинкованное
железо). При повреждении
покрытия возникает коррозионный
элемент, в котором основной металл
служит катодом, на котором
выделяется Н2 или
восстанавливается О2, а металл
покрытия – анодом, который
растворяется:
15.
16.
КАТОДНАЯ ЗАЩИТАКонструкция подключается к
отрицательному полюсу
постоянного тока. Используется в
сочетании с лакокрасочными и
другими изоляционными
покрытиями. Катодная защита
широко используется для
уменьшения коррозии подземных и
подводных трубопроводов и
стальных опор высоковольтных
передач, нефтяных платформ и
причалов.
17.
18.
ПРОТЕКТОРНАЯ ЗАЩИТАК защищаемому металлу
присоединяется большой образец
другого, более активного металла,
выполняющего роль анода и
окисляющегося. Протектор, в
частности, применяется для
защиты от коррозии подводных
частей морских судов.















 chemistry
chemistry








