Similar presentations:
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
1.
Министерство образования и науки Российской ФедерацииМосковский технологический университет
Институт тонких химических технологий
Германий, его характеристика, способы
получения органопроизводных, химические
свойства. Практическое применение
Выполнил: Ефименко Д.А.
Студент группы ХЕМО-01-17
2.
Германий (лат. Germanium) химический элемент IV группыпериодической системы Д.И.
Менделеева, относится к семейству
металлов. Обозначен порядковым
номером 32. Представляет собой
твердое вещество серо-белого цвета с
металлическим блеском.
3.
Существование и свойства Германияпредсказал в 1871 году Д.И.
Менделеев и назвал этот неизвестный
еще элемент – «Экасилицием» из-за
близости свойств его с кремнием.
В 1886 году немецкий химик К. Винклер,
исследуя минерал серебра – аргиродит Ag8GeS6
выяснил, что помимо серебра, ртути, железа и
оксида цинка в нём присутствует неизвестный
элемент.
Винклер изучил его свойства и понял, что
действительно нашел новый элемент. Винклер
назвал открытый им элемент в честь своего
отечества – Германий .
3
4.
Германий концентрируется вместорождениях многих металлов — в
сульфидных рудах цветных металлов, в
железных рудах, в некоторых окисных
минералах (хромите, магнетите, рутиле и
др.), в гранитах, диабазах и базальтах.
Аргиродит
Ag8GeS6
Германит
Cu26Ge4Fe4S32
4
5.
Оксид GeO – темно – серый порошок, плохорастворим в воде и легко – в кислотах с
образованием солей двухвалентного германия.
Диоксид GeO2 известен в различных
кристаллических монофигурациях.
GeCl4 – бесцветная тяжелая жидкость, дымящая на
воздухе
5
6.
• Синтез органических производных германия осуществляют, исходя изметаллического германия и его неорганических соединений – диоксида
GeO2, тетра – и тригалогенидов (GeHal4 и HGeHal3) и производного
двухвалентного германия – дигалогенида германия GeHal2.
Основные классы производных германия, которые схожи с
производными кремния:
• Галогениды и гидридгалогениды германия;
• Органогидридгерманы HnGeR4-n;
• Органогалогенгерманы RnGeHal4-n
• Алкокси-производные германия;
• Карбофункциональные германийорганические соединения;
6
7.
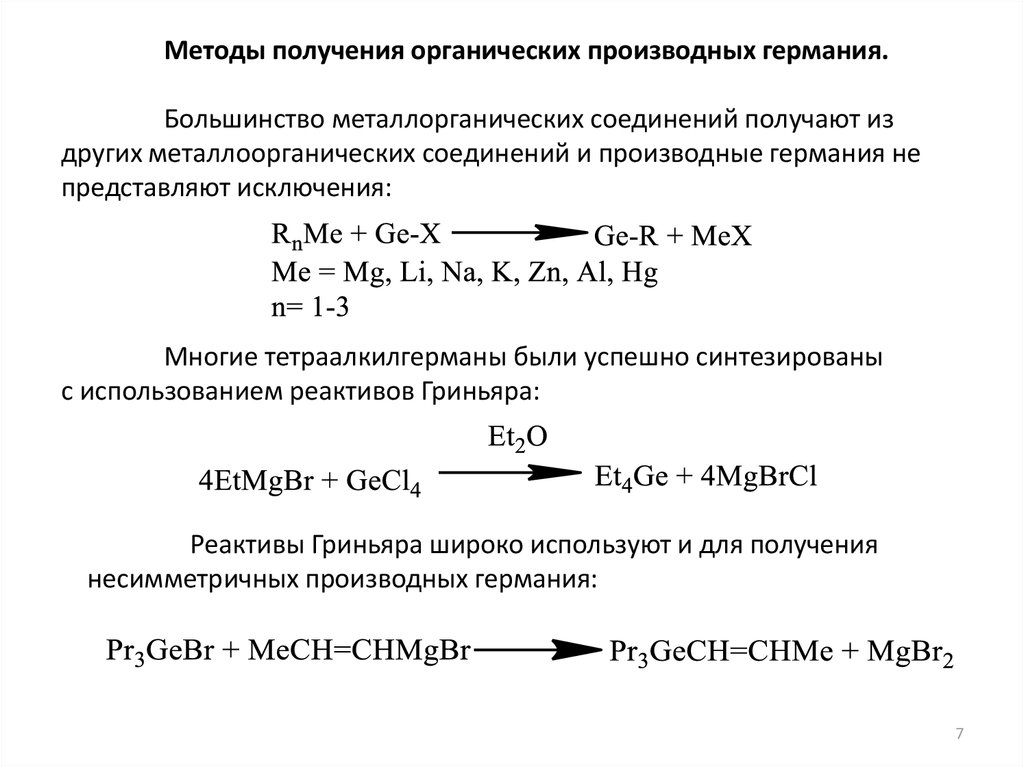
Методы получения органических производных германия.Большинство металлорганических соединений получают из
других металлоорганических соединений и производные германия не
представляют исключения:
Многие тетраалкилгерманы были успешно синтезированы
с использованием реактивов Гриньяра:
Реактивы Гриньяра широко используют и для получения
несимметричных производных германия:
7
8.
Тетраалкилгерманы могут быть получены присоединениемгидридов германия к соединениям с кратными связями:
Гексаалкилдигерманы можно получить взаимодействием
алкилгерманий галогенидов с щелочными металлами:
Прямой синтез заключается в нагревании германия с
алкилгалогенидами в присутствии медного катализатора:
8
9.
Действия металлоорганических соединений (соединений магния,цинка, лития, натрия, ртути и др.) на GeHal4 позволяет получить
органогалогенгерманы различного состава:
Галогензамещенные германийорганические соединения могут быть
получены путем разрыва связей Ge - С под действием галогенов:
Наиболее предпочтительным методом получения германийорганических
гидридов RnGeH4-n является восстановление соотвествующих галогенидов
алюмогидридом лития:
9
10.
Химические свойстваГерманий реагирует с кислотами:
• Ge + H2SO4 (конц) = Ge(SO4)2 + 2SO2↑ + 4H2O,
• Ge + 6HF = H2[GeF6] + 2H2↑,
• Ge + 4HNO3 (конц) = H2GeO3 + 4NO2↑ + 2H2O
С царской водкой:
• Ge + 4HNO3 + 12HCl = GeCl4 + 4NO↑ + 8H2O
С растворами щелочей:
• Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6]
10
11.
При нагревании на воздухе до 700 °C Ge загорается при температуреобразуется диоксид германия GeO2. Ge легко взаимодействует с галогенами
и серой:
• Ge + 2I2 = GeI4
С водородом, азотом, углеродом германий непосредственно в
реакции не вступает, соединения с этими элементами получают косвенным
путем. Например, нитрид Ge3N4 образуется при растворении дииодида
германия GeI2 в жидком аммиаке:
• GeI2 + NH3 (жидк) = [GeNH]n + Ge3N4
Оксид германия (IV) GeO2, — белое кристаллическое вещество,
существующее в двух модификациях. Одна из модификаций частично
растворима в воде с образование сложных германиевых кислот. Проявляет
амфотерные свойства.
11
12.
С щелочами GeO2 взаимодействует как кислотный оксид:GeO2 + 2NaOH = Na2GeO3 + H2O
GeO2 взаимодействует с кислотами:
GeO2 + 4HCl = GeCl4 + 2H2O
Тетрагалогениды Ge — неполярные соединения, легко
гидролизующиеся водой.
3GeF4 + 2H2O = GeO2 + 2H2GeF6
или термическим разложением:
BaGeF6 = GeF4 + BaF2
12
13.
Моногерман получают восстановлением диоксида германия GeO2борогидридом натрия NaBH4:
GeO2 + NaBH4 = GeH4↑ + NaBO2
Очень неустойчивый монооксид GeO образуется при умеренном
нагревании смеси германия и диоксида GeO2:
Ge + GeO2 = 2GeO
Соединения Ge (II) легко диспропорционируют с выделением Ge:
2GeCl2 = Ge + GeCl4
13
14.
Дисульфид германия GeS2 — белое аморфное или кристаллическоевещество, получается осаждением H2S из кислых растворов GeCl4:
GeCl4 + 2H2S = GeS2 + 4HCl
GeS2 растворяется в щелочах и сульфидах аммония или щелочных
металлов:
GeS2 + 6NaOH = Na2[Ge(OH)6] + 2Na2S,
GeS2 + (NH4)2S = (NH4)2GeS3
14
15.
Практическое использование германия игерманийорганических соединений
15














 chemistry
chemistry