Similar presentations:
Циклоалканы. Строение алициклов
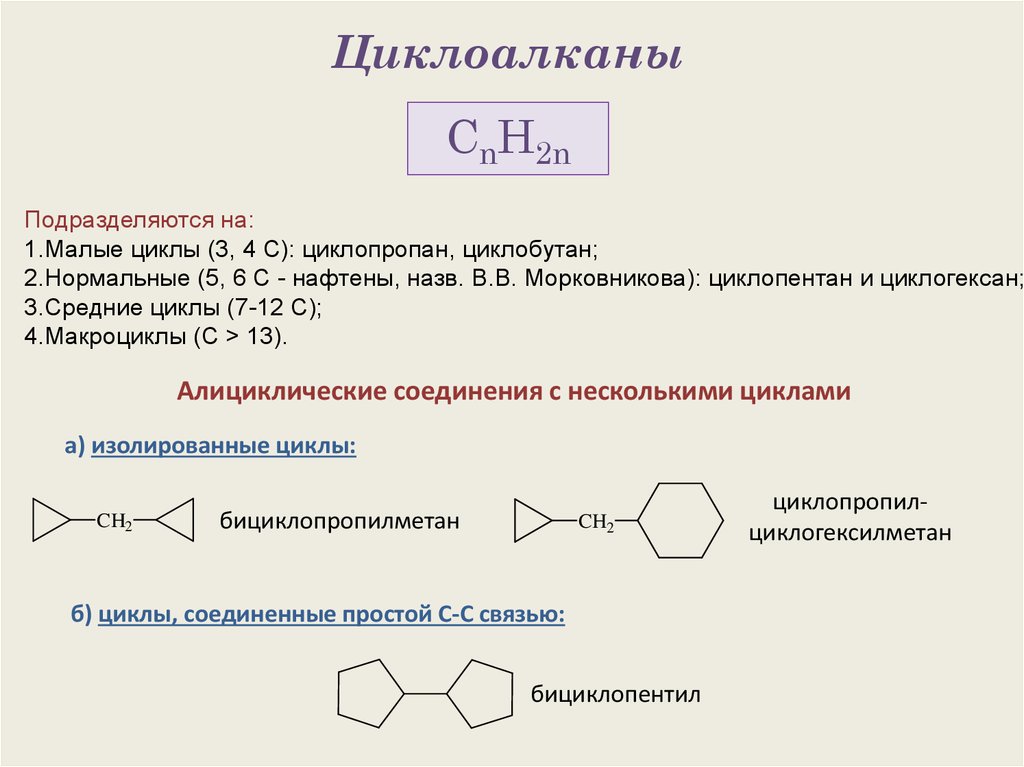
1. Циклоалканы
CnH2nПодразделяются на:
1.Малые циклы (3, 4 С): циклопропан, циклобутан;
2.Нормальные (5, 6 С - нафтены, назв. В.В. Морковникова): циклопентан и циклогексан;
3.Средние циклы (7-12 С);
4.Макроциклы (С > 13).
Алициклические соединения с несколькими циклами
а) изолированные циклы:
CH2
бициклопропилметан
CH2
б) циклы, соединенные простой С-С связью:
бициклопентил
циклопропилциклогексилметан
2.
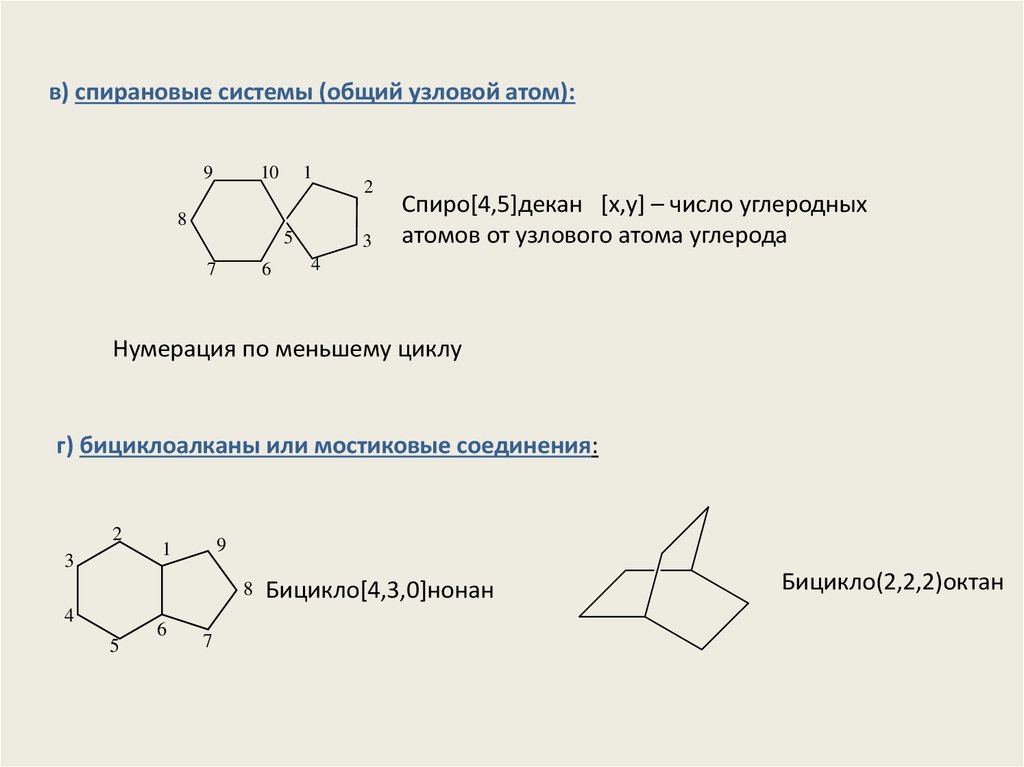
в) спирановые системы (общий узловой атом):9
10
1
2
8
5
7
6
3
Спиро[4,5]декан [x,y] – число углеродных
атомов от узлового атома углерода
4
Нумерация по меньшему циклу
г) бициклоалканы или мостиковые соединения:
2
3
9
1
8
4
5
6
7
Бицикло[4,3,0]нонан
Бицикло(2,2,2)октан
3. Строение алициклов
Особенность алициклов в наличии напряжения(исчезает с С14 (циклотетрадекан)).
Виды напряжений в циклах:
1. Угловое (Байер 1885г.)
Для плоских циклов углы составляют:
α
600
900
1080
1200
∆α
-490
-190
-10
+110
∆α – разница с тетраэдрическим углом 1090
Из плоских циклов самый стабильный циклопентан (!)
2. Торсионное (torsion angle – угол кручения) – это отталкивание
электронных оболочек атомов водорода
(рассматривали на алканах – заслоненная и заторможенная
конформации)
4.
3. Взаимодействие (Ван-дер-Ваальса) между пространственно сближенными атомамизаместителей или цикла (транс-аннулярное взаимодействие)
Определяется по теплоте сгорания, рассчитанной на одно СН2 - звено
Вещество
Теплота
сгорания на
одну СН2 –
группу
(ккал/моль)
166,6
164
158,2
157,4
Т.о. самый напряженный цикл – трехчленный.
158,3
5.
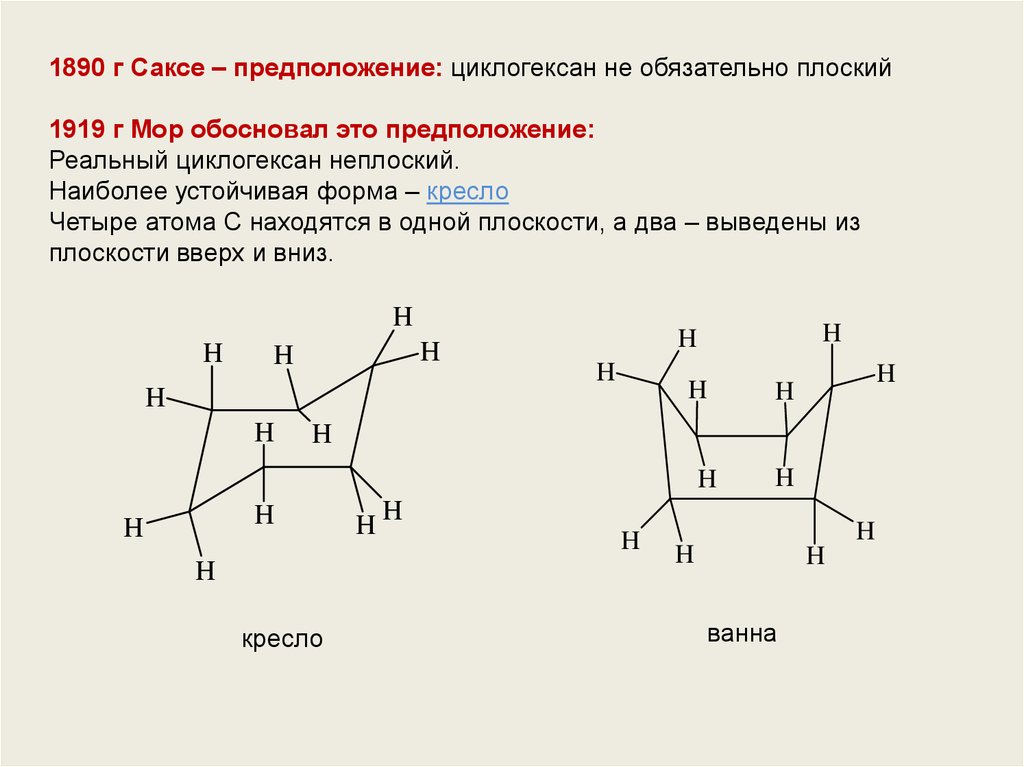
1890 г Саксе – предположение: циклогексан не обязательно плоский1919 г Мор обосновал это предположение:
Реальный циклогексан неплоский.
Наиболее устойчивая форма – кресло
Четыре атома С находятся в одной плоскости, а два – выведены из
плоскости вверх и вниз.
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
H
кресло
H
H
H
H
H
H
H
ванна
6.
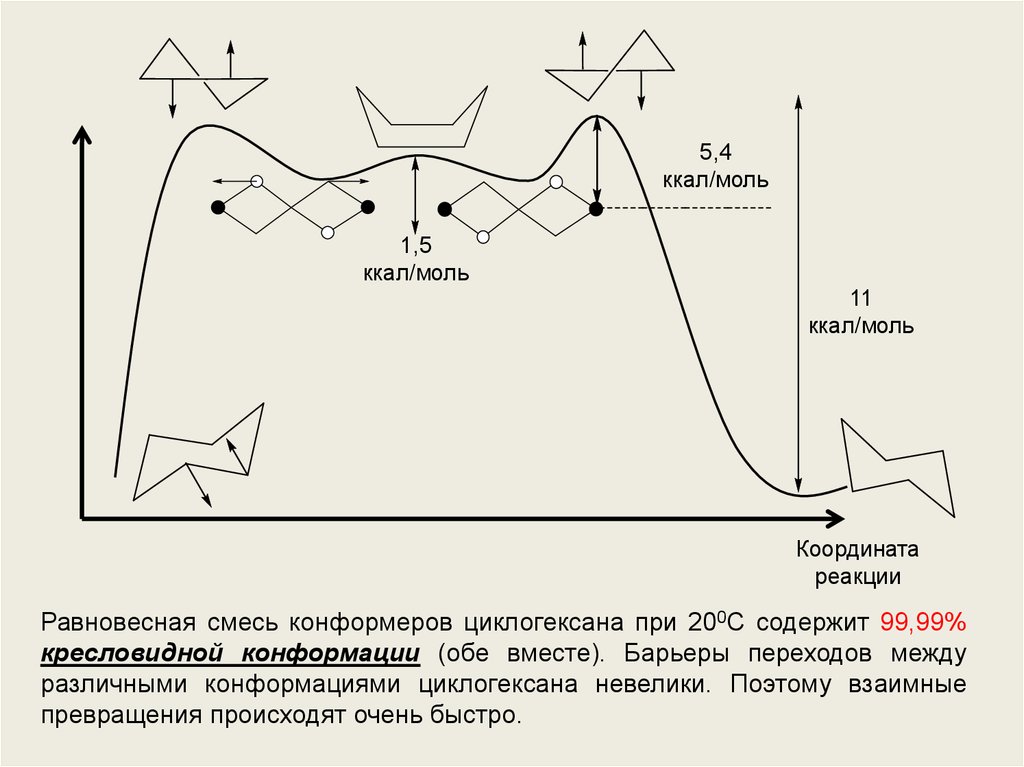
5,4ккал/моль
1,5
ккал/моль
11
ккал/моль
Координата
реакции
Равновесная смесь конформеров циклогексана при 200С содержит 99,99%
кресловидной конформации (обе вместе). Барьеры переходов между
различными конформациями циклогексана невелики. Поэтому взаимные
превращения происходят очень быстро.
7.
Напряжение циклопентана – это торсионное напряжение.В плоском циклопентане все атомы Н – в заслоненном положении. Поэтому
циклопентан неплоский. Он имеет форму конверта – е-конформация (envelope).
Скошенная конформация
Циклопентан – подвижная молекула: один «конверт» переходит
в другой: энергетический выигрыш при переходе от плоского
циклопентана к конверту оценивается примерно в 5,2 ккал/моль.
При таких последовательных переходах Е-Т-Е-… пятичленный
цикл как бы обегает волна.
Это явление называют псевдовращением.
8.
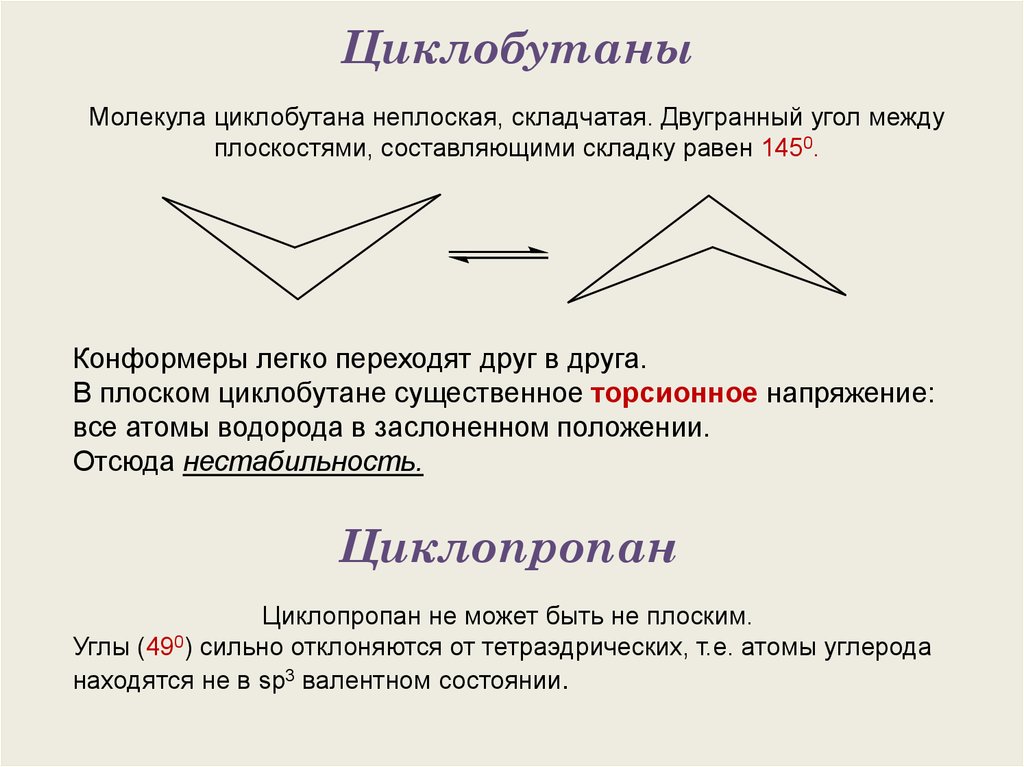
ЦиклобутаныМолекула циклобутана неплоская, складчатая. Двугранный угол между
плоскостями, составляющими складку равен 1450.
Конформеры легко переходят друг в друга.
В плоском циклобутане существенное торсионное напряжение:
все атомы водорода в заслоненном положении.
Отсюда нестабильность.
Циклопропан
Циклопропан не может быть не плоским.
Углы (490) сильно отклоняются от тетраэдрических, т.е. атомы углерода
находятся не в sp3 валентном состоянии.
9.
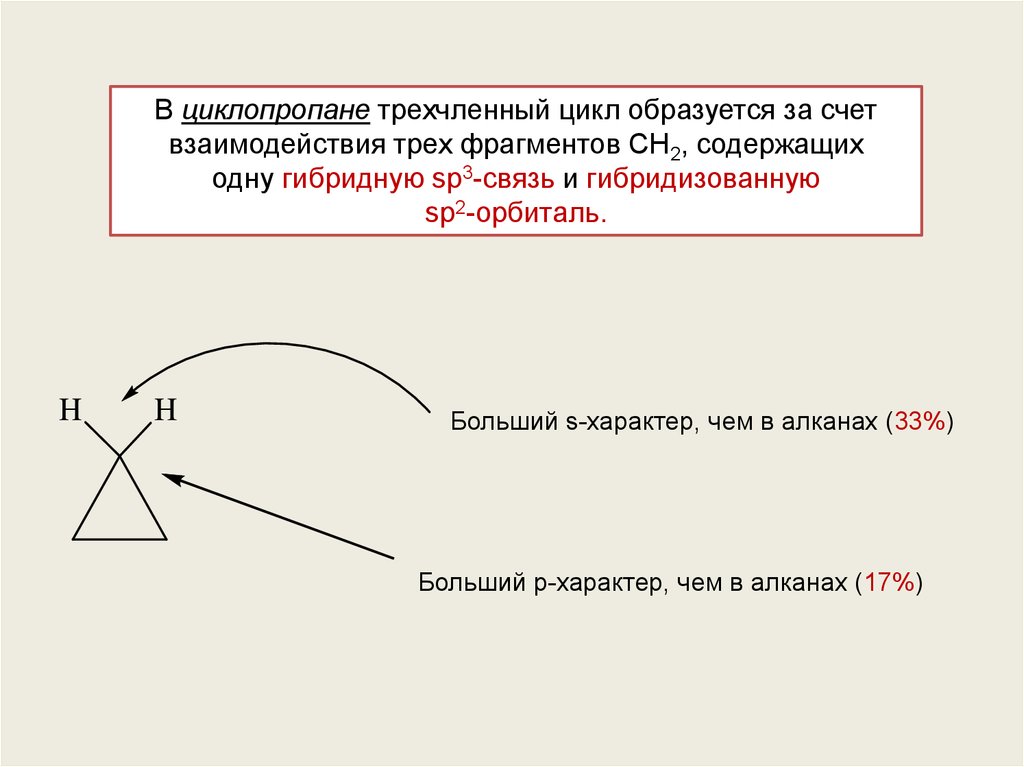
В циклопропане трехчленный цикл образуется за счетвзаимодействия трех фрагментов CH2, содержащих
одну гибридную sp3-связь и гибридизованную
sp2-орбиталь.
H
H
Больший s-характер, чем в алканах (33%)
Больший р-характер, чем в алканах (17%)
10.
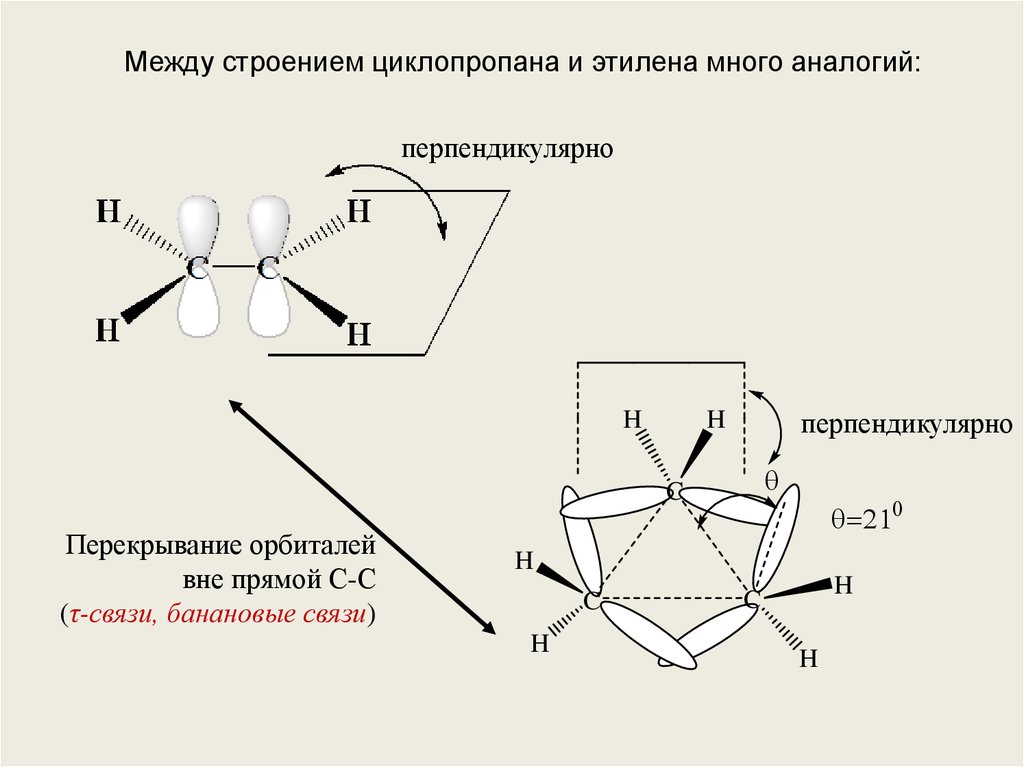
Между строением циклопропана и этилена много аналогий:перпендикулярно
H
перпендикулярно
H
C
Перекрывание орбиталей
вне прямой С-С
(τ-связи, банановые связи)
H
C
H
H
C
H
11.
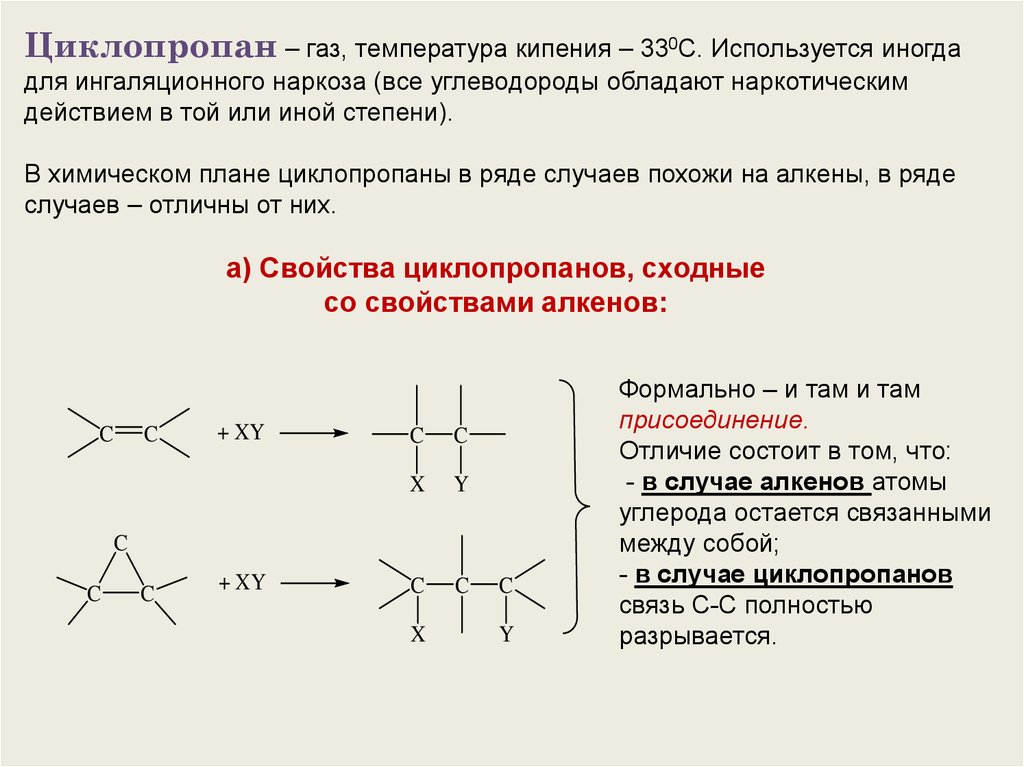
Циклопропан – газ, температура кипения – 330С. Используется иногдадля ингаляционного наркоза (все углеводороды обладают наркотическим
действием в той или иной степени).
В химическом плане циклопропаны в ряде случаев похожи на алкены, в ряде
случаев – отличны от них.
а) Свойства циклопропанов, сходные
со свойствами алкенов:
C
C
+ XY
C
C
X
Y
C
C
C
C
C
+ XY
X
C
Y
Формально – и там и там
присоединение.
Отличие состоит в том, что:
- в случае алкенов атомы
углерода остается связанными
между собой;
- в случае циклопропанов
связь С-С полностью
разрывается.
12.
В водных растворах HCl и HBr присоединяются к циклопропанам поправилу Марковникова:
H3C
CH2
C
H3C
CH2
CH3
HBr
H2O
H3C
C CH2 CH3
Br
«Сухие» HCl и HBr не реагируют с циклопропанами. Реакция идет
через протонированный циклопропан:
H3C
CH2
C
H3C
H3O+
CH2
H3C
CH2
C
H3C
Br-
CH2
CH3
H3C
C CH2 CH
3
Br
H
Аналогично идет сопряженное присоединение ацетата ртути:
H3C
C
C
H3C
C
H2
Hg(CH3COO)2
CH3OH
CH3
H3C
C CH2 CH2HgOCOCH3
OCH3
13.
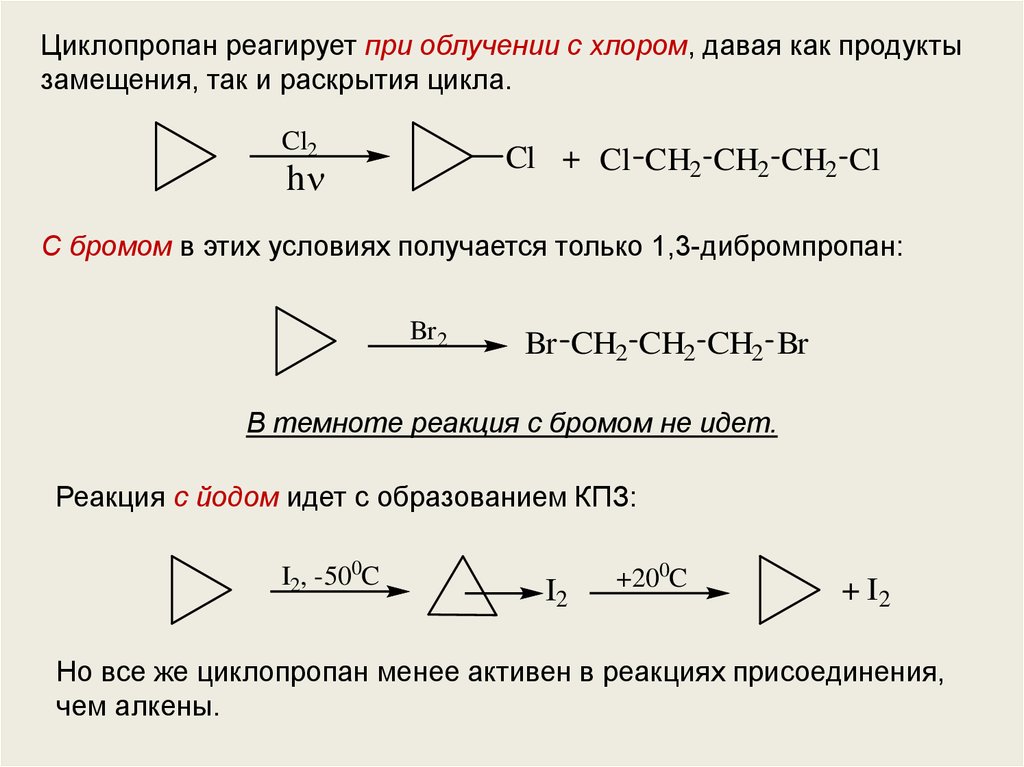
Циклопропан реагирует при облучении с хлором, давая как продуктызамещения, так и раскрытия цикла.
Cl2
Cl + Cl CH2 CH2 CH2 Cl
h
С бромом в этих условиях получается только 1,3-дибромпропан:
Br 2
Br CH2 CH2 CH2 Br
В темноте реакция с бромом не идет.
Реакция с йодом идет с образованием КПЗ:
I2, -500C
I2
+200C
+ I2
Но все же циклопропан менее активен в реакциях присоединения,
чем алкены.
14.
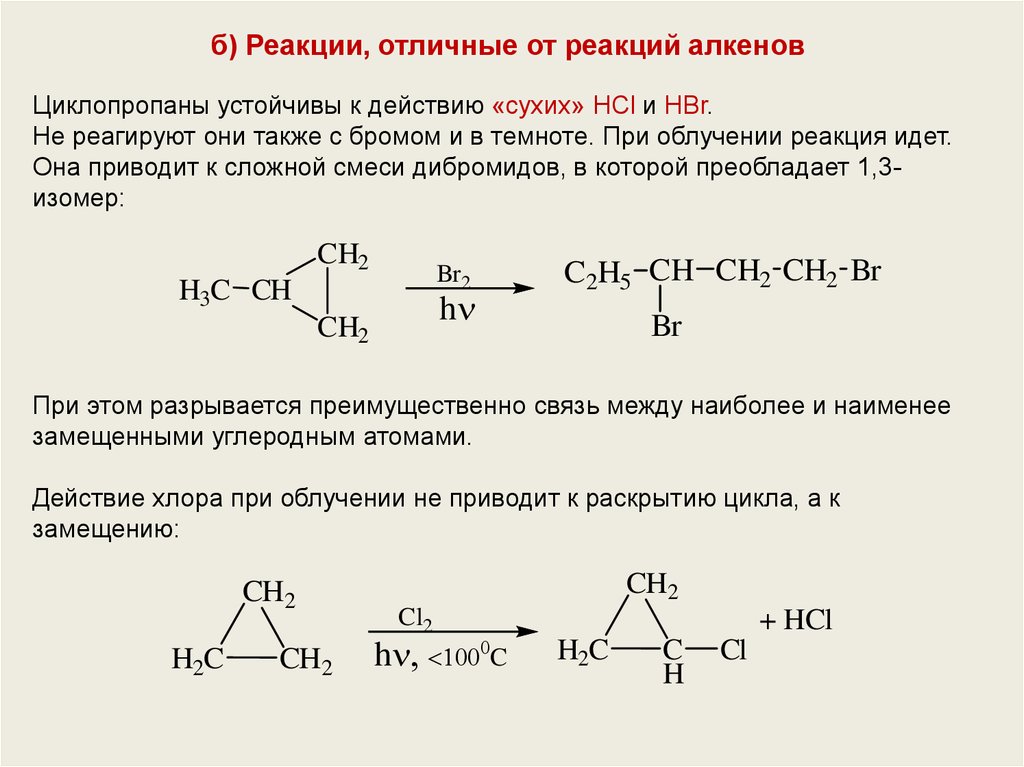
б) Реакции, отличные от реакций алкеновЦиклопропаны устойчивы к действию «сухих» HCl и HBr.
Не реагируют они также с бромом и в темноте. При облучении реакция идет.
Она приводит к сложной смеси дибромидов, в которой преобладает 1,3изомер:
CH2
Br 2
H3C CH
C2H5 CH CH2 CH2 Br
h
CH2
Br
При этом разрывается преимущественно связь между наиболее и наименее
замещенными углеродным атомами.
Действие хлора при облучении не приводит к раскрытию цикла, а к
замещению:
CH2
H2C
CH2
CH2
Cl2
h C
+ HCl
H2C
C
H
Cl
15.
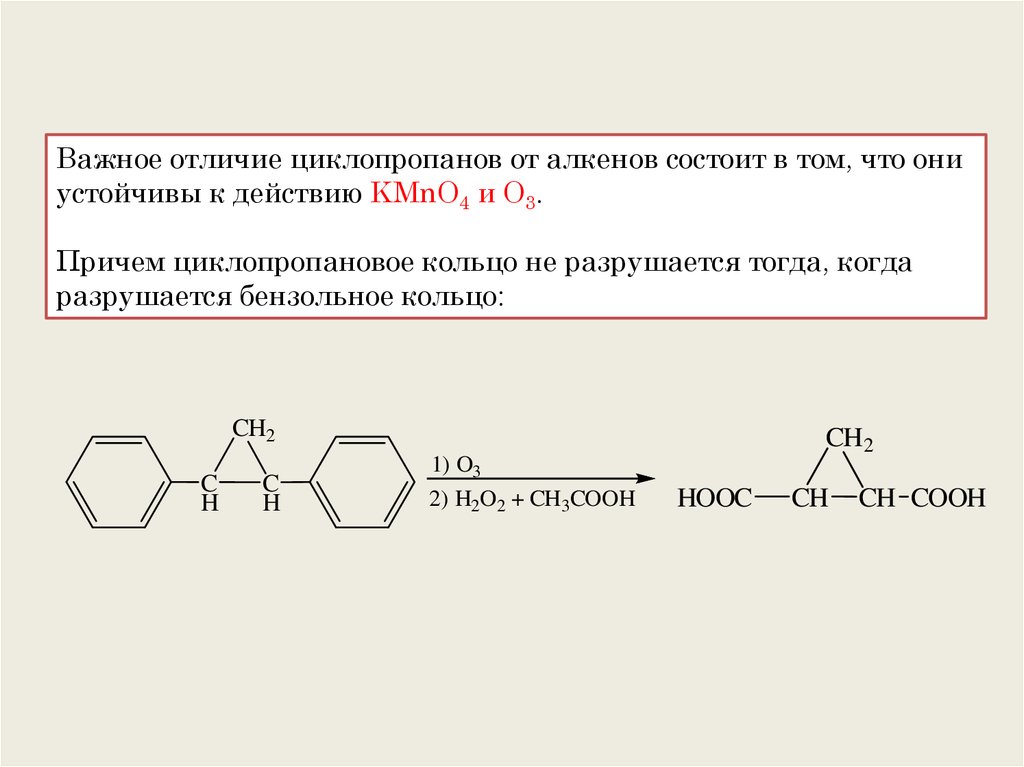
Важное отличие циклопропанов от алкенов состоит в том, что ониустойчивы к действию KMnO4 и O3.
Причем циклопропановое кольцо не разрушается тогда, когда
разрушается бензольное кольцо:
CH2
C
H
C
H
1) O3
2) H2O2 + CH3COOH
CH2
HOOC
CH
CH COOH
16.
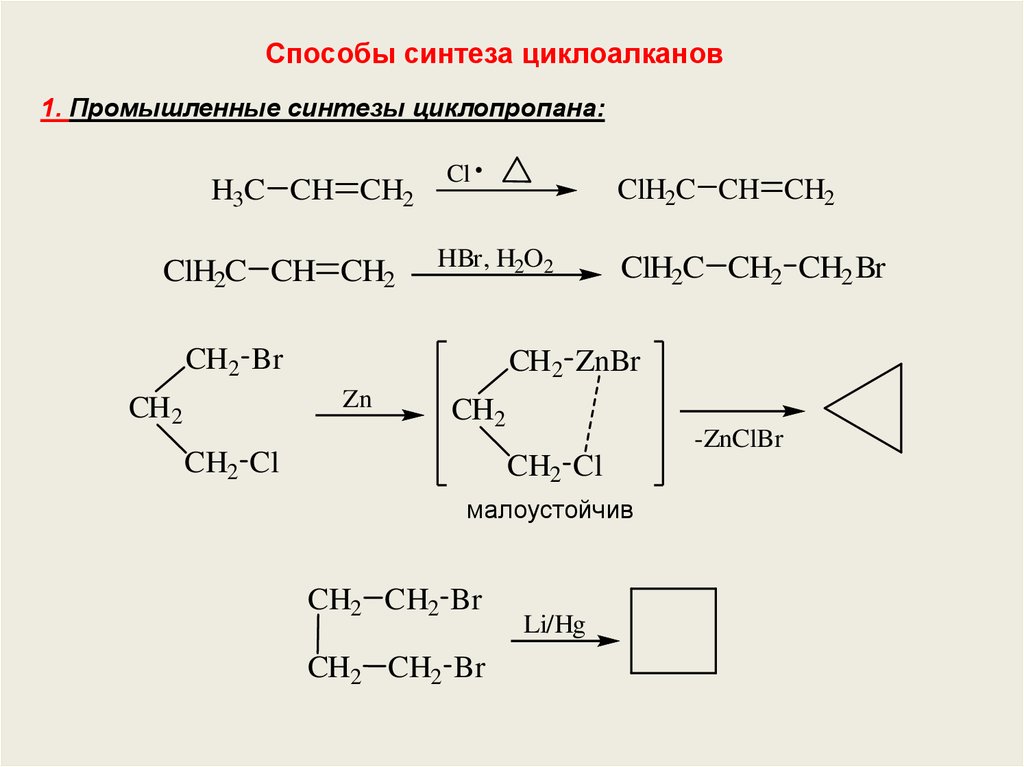
Способы синтеза циклоалканов1. Промышленные синтезы циклопропана:
H3C CH CH2
ClH2C CH CH2
Cl
HBr, H2O2
CH2 Br
ClH2C CH2 CH2 Br
CH2 ZnBr
Zn
CH2
ClH2C CH CH2
CH2
CH2 Cl
-ZnClBr
CH2 Cl
малоустойчив
CH2 CH2 Br
CH2 CH2 Br
Li/Hg
17.
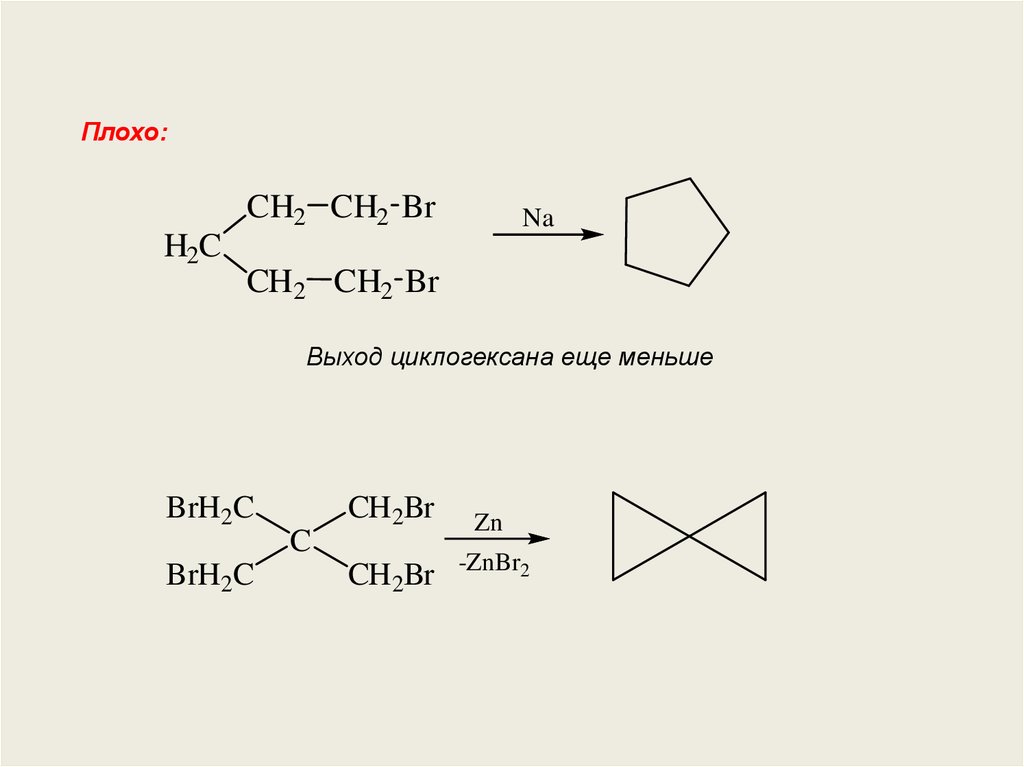
Плохо:CH2 CH2 Br
H2C
Na
CH2 CH2 Br
Выход циклогексана еще меньше
BrH2C
BrH2C
C
CH2Br
CH2Br
Zn
-ZnBr2
18.
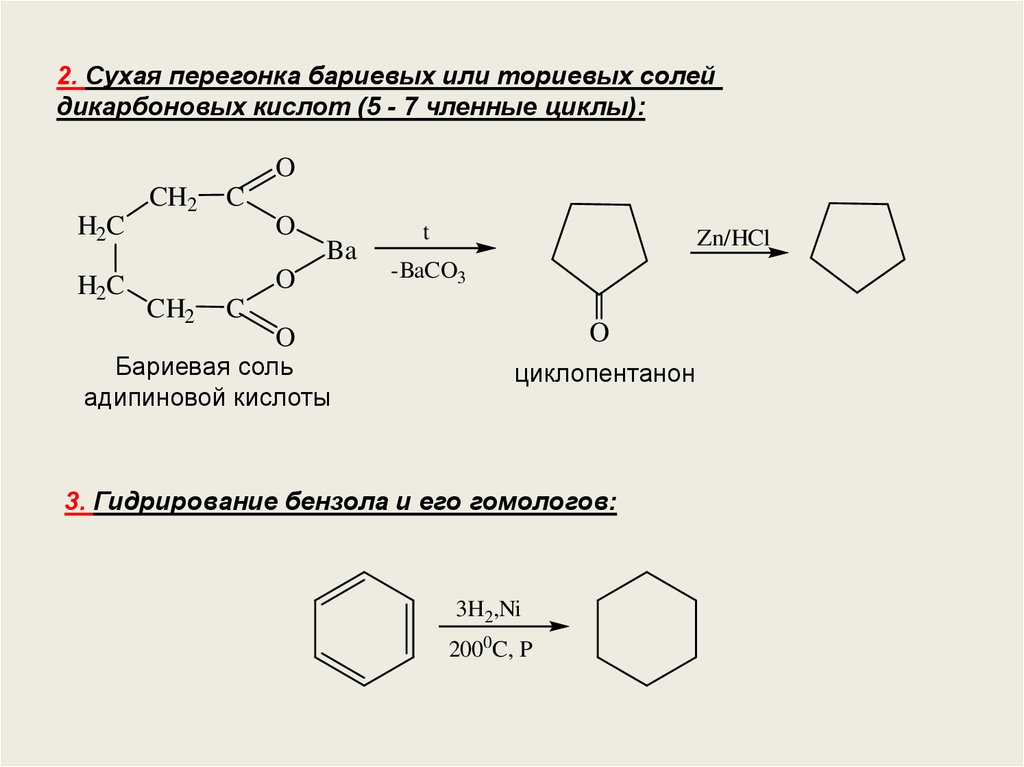
2. Сухая перегонка бариевых или ториевых солейдикарбоновых кислот (5 - 7 членные циклы):
O
H2C
H2C
CH2
C
O
Ba
O
CH2
t
Zn/HCl
-BaCO3
C
O
O
Бариевая соль
адипиновой кислоты
циклопентанон
3. Гидрирование бензола и его гомологов:
3H2,Ni
2000C, P
19.
4. Синтезы по расширению цикла с участием диазометана:CH2N2
-N2
CH2N2
-N2
Zn/HCl
O
O
O
5. Синтез Вальтера Реппе:
4 HC
CH
Ni(CN)4
PPh3
H2/Ni
ЦОТ
Циклооктан
20.
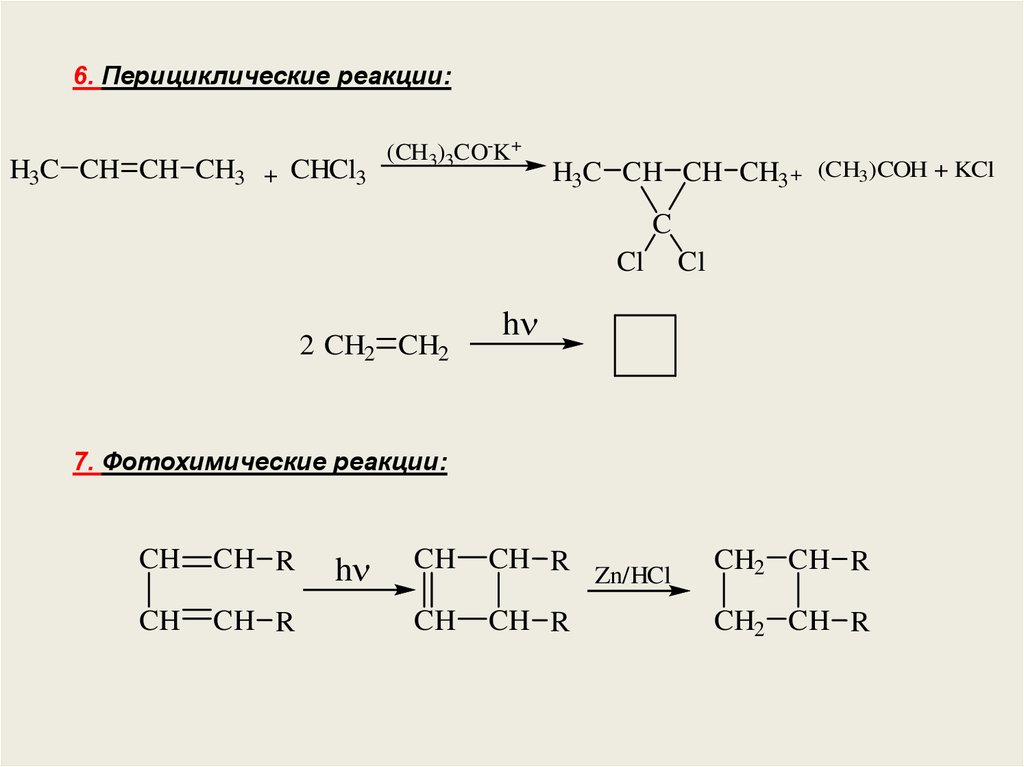
6. Перициклические реакции:H3C CH CH CH3 + CHCl3
(CH3)3CO-K+
H3C CH CH CH3 + (CH3)COH + KCl
C
Cl
2 CH2 CH2
Cl
h
7. Фотохимические реакции:
CH
CH R
CH
CH R
h
CH
CH R
Zn/HCl
CH2 CH R
CH
CH R
CH2 CH R





 chemistry
chemistry








