Similar presentations:
Решение задач по термодинамике
1.
Тема занятия:«Решение задач потермодинамике»
Цель занятия: закрепить умения решать задачи
по
химической
термодинамике,
обобщить
знания по теме "Энергетические эффекты и
направление течения химических реакций".
Задачи:
-углубение, обобщение и систематизация знаний
по законам термодинамики;
-применение полученных знаний при решении
качественных и расчетных задач;
-установление
связи
между
энтальпийным,
энтропийным факторами и самопроизвольностью
прохождения реакций;
-научиться
оценивать
возможность
или
невозможность самопроизвольного протекания
1
реакций при данных условиях.
2.
Вид завода в Оппау после взрыва№1 2H2 + N2 + 1,5 O2 = NH4NO3
№2 NH4NO3 = N2 + 2 H2O + 0,5O2
№3 NH4NO3 = N2O + 2 H2O
№4
NH4NO3 = 0,5 NO2 + 0,75N2 + 2H2O
2
3.
Объект изучениятермодинамики –
термодинамические системы
Системы бывают:
- открытые, закрытые и
изолированные;
- гомогенные и гетерогенные
- простые и сложные
Термодинамический процесс – последовательность состояний
системы,
ведущих
от
одного
начального
набора
термодинамических переменных к другому – конечному.
3
4.
Параметры химической термодинамикиU - внутренняя энергия
Н - энтальпия
S - энтропия
G - энергия Гиббса
Q=ΔU +A
Н
0
обр
Эндотермическая р-я
Экзотермическая р-я
Закон Гесса:
Тепловой эффект химической реакции
определяется
лишь
начальным
и
конечным
состояниями
системы
реагирующих веществ и не зависит от
пути ее протекания.
Следствие из закона Гесса?
Тепловой эффект химической реакции:
Н
0
хим. р .
(nпрод. Н
0
f , прод
) (nисх. Н
0
f ,исх
4
)
5.
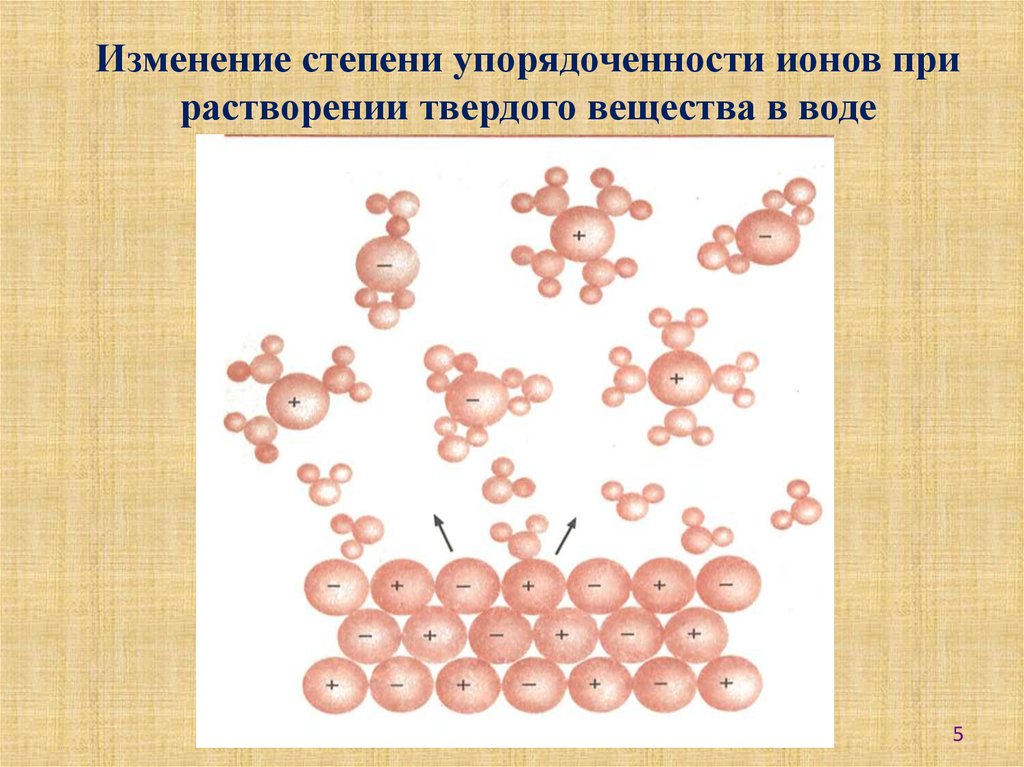
Изменение степени упорядоченности ионов прирастворении твердого вещества в воде
5
6.
Примеры колебательного и вращательногодвижения молекул воды
Сграфит тв. + СО2 = 2СОгаз
2Н2(г) + О2(г) = 2Н2О(г)
Третье начало
термодинамики
6
7.
Второй закон термодинамикиS R ln W
Дж
[S ]
энтропия
моль К
Энтропия химической реакции
S
0
хим. р .
(nпрод. S
0
f , прод
0
S f
) (nисх. S
0
f ,исх
)
Все процессы в изолированной системе происходят
в направлении увеличения энтропии
С(графит тв.) + СО2(газ)=2СО(газ)
2Н2(г) + О2(г) = 2Н2О(г) ΔS-?
7
8.
Возможность и направление протеканияхимических реакций
Энтропийный и энтальпийный факторы обычно действуют в
противоположных направлениях и общее направление реакции
определяется влиянием преобладающего фактора.
В неизолированных системах критерием является ΔG –энергия
Гиббса, ее рассчитывают при разных температурах.
Уравнение энергии Гиббса
G H T S
0
0
Величина и знак ΔG позволяют судить о принципиальной
возможности и направлении процесса.
G
(nпрод. G
0
G f
0
хим. р .
0
f , прод
) (nисх. G
0
f ,исх
)
8
9.
Термохимические расчетыNa2CO3 + 2HCl = 2NaCl + H2O + CO2 ↑
Энтальпию образования глюкозы нельзя
определить прямым экспериментом:
6C + 6H2 + 3O2 = C6H12O6
(∆Hх - ?)
Такая реакция невозможна
Вещество
Ho298,
кДж/моль
CO 32-
-677
H+
0
H2O (ж)
-286
CO2
-394
6CO2 + 6H2O = C6H12O6 + 6O2 (∆Hу - ?)
Реакция идет в зеленых листьях, но вместе с другими процессами.
Пользуясь законом Гесса, достаточно скомбинировать три уравнения
сжигания:
1) C = CO2 + O2
∆H1 = -394 кДж
2) H2 + 1/2O2 = H2O (пар)
∆H2 = -242 кДж
3) C6H12O6 + 6O2 = 6CO2 + 6H2O
∆H 3 = -2816 кДж
Hх = 6 H1 + 6 H2 - H3 = 6(-394) + 6(-242) -(-2816) = -1000 кДж/моль
Hу = - H 3 = +2816 кДж
9
10.
Любая реакция при постоянных температуре и давлениипротекает самопроизвольно в направлении убыли
энергии Гиббса.
Задача 1. Вычислите тепловой эффект реакции восстановления
оксида железа (II) водородом, исходя из следующих
термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г);
ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г)
ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г)
ΔН3 = -241,83 кДж.
Задача 2. Вычислите энергию Гиббса и определите возможность
протекания реакции при температурах 1000 и 3000 К.
Cr2O3 (т) + C (т) = Cr (т) + CO (г)
ΔH298, кДж/моль
ΔS298, Дж/(моль×К)
— 1141 0
81,2
5,7
0
23,6
— 110,6
197,7
10
11.
Задача 3. Оцените термодинамическую возможность прохожденияреакции CaO(т) + CO2(г) = CaCO3(т) в стандартных условиях.
Справочные данные приведены в таблице.
Решите двумя способами! Рассчитайте Т критическую!
Вещество
CaO(т)
CO2(г)
CaCO3(т)
∆H, кДж/моль ∆S, Дж/мольК ∆G,кДж/моль
- 635,2
- 393,6
- 1207,1
39,8
213,7
92,9
- 603,9
- 395,5
- 1129,0
11
12.
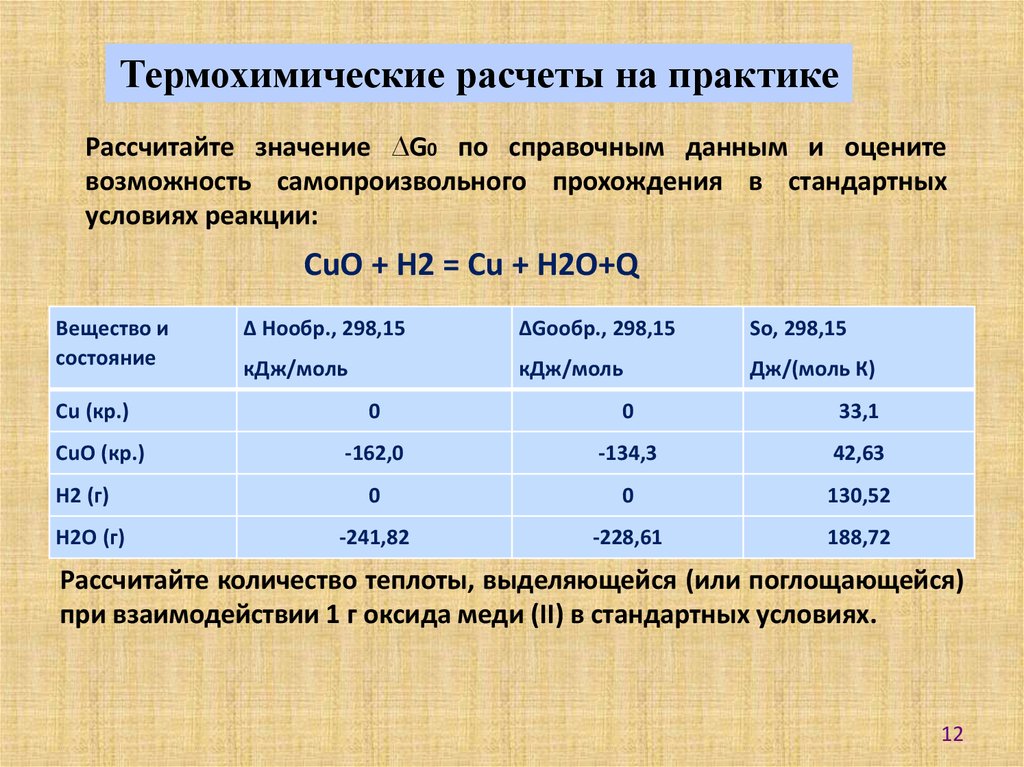
Термохимические расчеты на практикеРассчитайте значение ∆G0 по справочным данным и оцените
возможность самопроизвольного прохождения в стандартных
условиях реакции:
CuO + H2 = Cu + H2O+Q
Вещество и
состояние
Cu (кр.)
CuO (кр.)
H2 (г)
H2O (г)
Δ Hoобр., 298,15
ΔGoобр., 298,15
So, 298,15
кДж/моль
кДж/моль
Дж/(моль К)
0
0
33,1
-162,0
-134,3
42,63
0
0
130,52
-241,82
-228,61
188,72
Рассчитайте количество теплоты, выделяющейся (или поглощающейся)
при взаимодействии 1 г оксида меди (II) в стандартных условиях.
12
13.
Домашнее задание1. Ахметов Н.С. Общая и неорганическая химия. Учебник
для вузов. М.: Высш. шк. Издательский центр
«Академия» - 2001. стр. 175-192
2. Пользуясь термохимическим уравнением 2NH3 + H2O
+ SO3 = (NH4)2SO4; ΔH =-406,28 кДж, рассчитайте
стандартную энтальпию образования сульфата аммония.
3. Пользуясь данными таблиц приложения, установить,
какие из перечисленных восстановителей могут
восстановить Fe2О3 до свободного металла: а) Zn; б) Ni;
в) Н2S.
4. Определите изменение энтропии в стандартных
условиях для следующего химического процесса:
Al(к) + Cr2O3(к) → Cr(к) + Al2O3(к).
13
14.
Благодарю за занятие!14












 chemistry
chemistry








