Similar presentations:
Применение ингибиторов депептидилпептидазы-4 в лечении сахарного диабета 2 типа
1. «Западно-Казахстанский Государственный Университет им. М.Оспанова»
Специальность: ЭндокринологияТема: Применение ингибиторов
депептидилпептидазы-4 в лечении сахарного
диабета 2 типа.
Выполнила: Ан Екатерина
Проверила: Кошмаганбетова Г.К.
2.
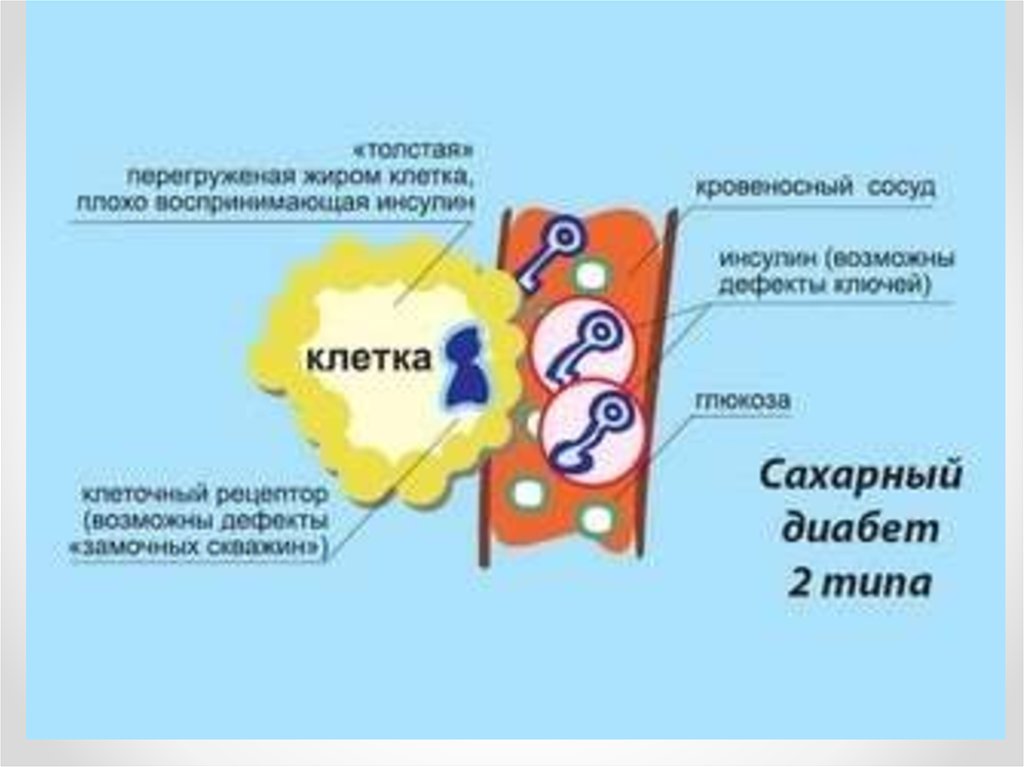
3. Актуальность
• Сахарный диабет 2 типа (СД) является одной из самых актуальных проблемсовременной медицины. Медико-социальная значимость СД 2 типа
определяется несколькими факторами, одним из которых является высокая
распространенность заболевания во всем мире. Среди всех форм диабета
на долю СД 2 типа приходится 85-90%. По данным экспертов ВОЗ в 2010 г.
согласно прогнозам на нашей планете будут жить около 215 млн. человек,
страдающих этим заболеванием. Обращает на себя внимание тот факт, что
истинная распространенность СД 2 типа в 2-3 раза превышает
регистрируемую по обращаемости.
• Диабет 2 типа являясь прогрессирующим заболеванием, которое часто
требует от пациента использования нескольких гипогликемических
препаратов для достижения гликемического контроля с прогрессированием
заболевания. Что является большой проблемой для больных диабетом, так
как пациенты забывают, отказываются от регулярного приема лекарств или
принимают их нерегулярно, что в конечном итоге ухудшает состояние и
приводит к быстрому развитию осложнений сахарного диабета.
4. Цель:
• Оценить эффективность примененияингибитора дипептидилпептидазы-4 у пациентов
с сахарным диабетом 2 типа для
гликемического контроля ,предотвращения
развития осложнений и улучшения качества
жизни .
5. Задачи
• Произвести литературный обзор• Определение групп пациентов генеральной
совокупности для формирования выборки
• Путем рандомизации разделить пациентов на 2
группы: 1 группа получающие ингибиторы
депептидилпептидазы-4 и 2 группа получающая
бигуаниды.
6. Дизайн
РКИВыборка.
Систематическая выборка.
Генеральная совокупность все пациенты с
сахарным диабетом 2 типа в ГП №4,ГП№5,ГП№1,
• КСМ в г.Актобе. Всего 1000 больных СД 2 типа.
• Для исследования необходимо 100 пациентов.
Предварительно пронумеровав всех пациентов
от 1-1000.(1000/100=10, будет выбирать каждый 10
элемент. Для начала отобрав первый элемент с
помощью генератора случайных чисел).
7.
• Получив 100 пациентов с сахарным диабетом 2типа, делим их на группы по 50 человек 1:1.В
каждой группе делим пациентов на подгруппы,
соответственно стадии и течения заболевания.
• 1 группа: получала ингибиторы
депептидилпептидазы-4(ситаглиптин)
• 2 группа: получала бигуаниды(метформин)
8. Критерии включения
• Больные с установленным диагнозом сахарныйдиабетом 2 типа в стадии компенсации и
субкомпенсации.
• Возраст 35-55 лет
• Уровень глюкозы натощак 7 и более ммоль/л
• Уровень гликированного гемоглобина 6,5% и
более.
• Длительность заболевания не менее 1 года.
9. Критерии исключения
Больные с сахарным диабетом 1 типаВозраст менее 35 лет и старше 55 лет
Беременные и кормящие
Тяжелое течение заболевания
Пациенты у которых в анамнезе: кетоацидоз,
инсульт, инфаркт, онкологические заболевания.
• Др. эндокринные заболевания
10. Этические аспекты
• Одобрено ЭК• Информированное согласие с полным
раскрытием всей необходимой информацией
(на понятном языке, согласие написано на 2
языках: казахском и русском), крупный шрифт
• Имеют право отказаться на любом этапе
исследования, без неблагоприятных последствий
• Получение необходимой медицинской помощи
• Участие строго добровольное и бесплатное
• Действие в интересах пациента
• Польза и безопасность для пациента и общества
11. Исследовательский вопрос
• Приводит ли к снижению уровня глюкозы игликированного гемоглобина применение
ингибитора дипептидилпептидазы-4 ситаглиптина
по сравнению с препаратами из группы
бигуанидов метформина у пациентов с
сахарным диабетом 2 типа в стадии
компенсации и субкомпенсации?
12. PICO
• P -Пациенты с сахарным диабетом 2 типа встадии компенсации и субкомпенсации
• I -ситаглиптин
• C –Метформин
• O –Снижение уровеня глюкозы и гликированного
гемоглобина
13.
A randomized, placebo- and sitagliptin-controlled trial of the safety and efficacy of omarigliptin, a
once-weekly dipeptidyl peptidase-4 inhibitor, in Japanese patients with type 2 diabetes.
Gantz I1, Okamoto T2, Ito Y2, Okuyama K2, O'Neill EA1, Kaufman KD1, Engel SS1, Lai E1; the
Omarigliptin Study 020 Group.
Abstract
AIMS:
To assess the safety and efficacy of omarigliptin in Japanese patients with type 2 diabetes (T2D).
METHODS:
In a 24-week double-blind trial, 414 patients with T2D were randomized to omarigliptin 25 mg once
weekly, sitagliptin 50 mg once daily or placebo. The double-blind period was followed by a 28-week
open-label extension during which all patients received omarigliptin 25 mg once weekly. Efficacy
endpoints were glycated haemoglobin (HbA1c), 2-hour postprandial glucose (PPG) and fasting
plasma glucose (FPG) levels.
RESULTS:
After 24 weeks, the least squares (LS) mean change from baseline in HbA1c was -0.66% for
omarigliptin, -0.65% for sitagliptin and 0.13% for placebo. The difference in LS mean for omarigliptin vs
placebo was -0.80% ( P < .001). The difference in LS mean for omarigliptin vs sitagliptin was -0.02%
(95% confidence interval -0.15, 0.12), which met the criterion for non-inferiority to sitagliptin. Both
active treatments provided significant reductions in FPG and 2-hour PPG compared with placebo
(P < .001). Over the 24-week double-blind period, there were no clinically meaningful differences in
the incidence rates of adverse events among the treatment groups. There was 1 episode of
symptomatic hypoglycaemia in the sitagliptin group and none in the omarigliptin or placebo groups.
In the 28-week open-label period, omarigliptin provided persistent improvements in glycaemic
control without notable change in safety profile compared with the double-blind period. Omarigliptin
had no meaningful effect on body weight.
CONCLUSIONS:
In Japanese patients with T2D, omarigliptin 25 mg once weekly provided significant glucose-lowering
compared with placebo and was non-inferior to sitagliptin 50 mg once daily. Omarigliptin was
generally well tolerated for up to 52 weeks.
14. Исследовательский вопрос по статье
• Приводит ли к снижению уровня глюкозы игликированного гемоглобина применение
омариглиптина по сравнению с плацебо или
ситаглиптином у пациентов с сахарным
диабетом 2 типа?
15. PICO
P- Пациенты с сахарным диабетом 2 типа
I- омариглиптин
C- плацебо или ситаглиптин
O- снижение уровня глюкозы и гликированного
гемоглобина
16. Дизайн исследования по статье
Исследование представляет собой рандомизированное, плацебо- и ситаглиптинконтролируемое параллельное групповое многоцентровое двойное слепое
исследование омариглиптина 25 мг один раз в неделю с расширением открытой
метки, при котором все пациенты получали омариглиптин 25 мг один раз в
неделю (рисунок S1). Исследование включало период скрининга до 2 недель,
период вымывания 6 недель для пациентов на пероральном AHA, двухнедельный
однократный период плацебо в режиме слепоты и 24-недельный двойной слепой
период лечения за которым следует 28-недельный период расширения открытой
метки. При рандомизации пациенты стратифицировали в соответствии с их
использованием перорального AHA при скрининге. Пациенты были
рандомизированы с использованием двойного манекена в соотношении 2: 2: 1:
омариглиптин 25 мг один раз в неделю / плацебо, сопоставляющий ситаглиптин 50
мг один раз в день; ситаглиптин 50 мг один раз в день / плацебо, соответствующий
омариглиптину 25 мг один раз в неделю; или плацебо, сопоставляющий
омариглиптин 25 мг один раз в неделю / плацебо, сопоставляющий ситаглиптин 50
мг один раз в день. Sitagliptin 50 мг один раз в день был выбран в качестве
соответствующей дозы для использования в исследовании, потому что это обычная
начальная доза и наиболее широко используемая доза в Японии. Для
рандомизации использовался интерактивный речевой ответ или
интегрированная система веб-ответов. Пациенты, не отвечающие заранее
заданным критериям гликемического контроля после рандомизации (с 4 по 24
неделю, FPG> 13,3 ммоль / л, после недели 24, FPG> 11,1 ммоль / л) были
прекращены из исследования.
17. Дизайн…
Тест на переносимость пищи проводился при рандомизации (1-й
день), а также в неделях 24 и 52 (или при прекращении приема).
Испытания на толерантность к еде должны проводиться в корыте
через 7 дней после предыдущей дозы омариглиптина или плацебо,
соответствующих омариглиптину, и до ежедневного ситаглиптина или
плацебо, соответствующих дозе ситаглиптина. Стандартный прием
пищи для теста на переносимость еды составлял ~ 500 ккал, с 75 г
углеводов, 14 г жира и 17 г белка. Ожидается, что пациент закончит
еду в течение 15 минут после начала еды. Образец крови для глюкозы
собирали непосредственно перед употреблением в пищу и через
30, 60 и 120 минут с начала приема пищи.
Исследование (Omarigliptin Protocol 020; ClinicalTrials.gov :
NCT01703221) проводилось в соответствии с принципами хорошей
клинической практики и было одобрено соответствующими
институциональными обзорными советами.
18. Критерии включения по статье
• Пациенты с СД 2 типа (мужчины и женщины)• Возраст 20 лет
• Индекс массы тела> 18 и <40 кг / м 2 .
• На скрининговом визите пациенты, которые не получали
лечение (никогда не были оральным
антигипергликемическим агентом [AHA]) или не
принимали лекарство от AHA в течение ≥6 недель и имели
Национальную программу стандартизации
Гликогемоглобина (NGSP) HbA1c ≥7,0% и ≤10,0%, были
право на участие в исследовании; при монотерапии
монотерапией AHA с использованием NGSP HbA1c ≥6,5% и
≤9,0%, а также после 6-недельного периода промывания
AHA, NGSP HbA1c ≥7,0% и ≤10,0%, также были пригодны для
исследования. На неделе -2 пациенты должны были иметь
уровень HbA1c между ≥7,0% и ≤ 10,0% и уровнем FPG ≤12,8
ммоль / л.
19. Критерии исключения по статье
• Пациенты были исключены из исследования, если у них былдиабет типа 1, история кетоацидоза, активное
заболевание печени, значительное сердечно-сосудистое
заболевание, история злокачественных новообразований
или гематологических расстройств или ранее были
обработаны ситаглиптином или омариглиптином в любое
время или с тиазолидиндионами или терапии инсулином в
течение 12 недель до посещения скрининга.
• Критерии лабораторного исключения включали оценочную
скорость клубочковой фильтрации <50 мл / мин / 1,73 м 2 ,
аланинаминотрансферазу или
аспартатаминотрансферазу> в 2 раза превышающую
верхний предел нормальных, триглицеридов> 6,78 ммоль /
л или тиреотропный гормон вне нормального диапазона
центральной лаборатории.
20. Литература
• 1. Biftu T, Sinha‐Roy R, Chen P, et al. Omarigliptin (MK‐3102): anovel long‐acting DPP‐4 inhibitor for once weekly treatment of
type 2 diabetes. J Med Chem. 2014;57(8):3205‐3212.
[PubMed]
• 2. Pratley RE, Salsali A. Inhibition of DPP‐4: a new therapeutic
approach for the treatment of type 2 diabetes. Curr Med Res
Opin. 2007;23(4):919‐931. [PubMed]
• 3. Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of
hyperglycemia in type 2 diabetes: a patient‐centered
approach: position statement of the American Diabetes
Association (ADA) and the European Association for the Study
of Diabetes (EASD). Diabetes Care. 2012;35(6):1364‐1379.
[PubMed]
• 4. Liang KY, Zeger SL. Longitudinal data analysis of continuous
and discrete responses for pre‐post designs. Indian J Stat.
2000;62:134‐148.
• 12. Hauber AB, Tunceli K, Yang JC, et al. A survey of patient
preferences for oral antihyperglycemic therapy in patients
with type 2 diabetes mellitus. Diabetes Ther. 2015;6(1):75‐84.
[PubMed]



















 medicine
medicine