Similar presentations:
Количество вещества. Моль. Молярная масса
1. Количество вещества. Моль. Молярная масса
8 классБазовый уровень
2.
t°2H2 + O2 → 2H2O
4 а.е.м. 32 а.е.м.
2 мол-лы 1 мол-ла
36 а.е.м.
2 мол-лы
Массовые отношения:
m(H2):m(O2):m(H2O)=1:8:9
Отношения числа частиц:
N(H2):N(O2):N(H2O)=2:1:2
3.
t°2H2 + O2 → 2H2O
m(H2):m(O2)=1:8
t°
Fe + S → FeS
m(Fe):m(S)=7:4
t°
2Na + Cl2 → 2NaCl
m(Na):m(Cl2)=46:71
4.
t°2H2 + O2 → 2H2O
N(H2):N(O2)=2:1
t°
Fe + S → FeS
N(Fe):N(S)=1:1
t°
2Na + Cl2 → 2NaCl
N(Na):N(Cl2)=2:1
5.
Количество вещества (n или ν) – это порциявещества, содержащая определенное число
частиц (атомов, молекул)
n=[моль]
Моль – это количество вещества, содержащее
столько же частиц (атомов, молекул), сколько
содержится атомов углерода в 12 г углерода
Моль был введен в систему СИ в качестве основной
единицы количества вещества решением 14-й
Генеральной конференции по мерам и весам (1971)
Слово «моль» склоняется, если стоит после
числительного, но не склоняется, если стоит после
числа.
Пример: «получили два моля воды»; «в 2 моль воды»
6.
Молярная масса вещества (M) – массаодного моля вещества
m
M
n
M=[г/моль]
7.
Молярная масса численносовпадает с массой атома или
молекулы в а. е. м. и
относительной атомной или
молекулярной массой


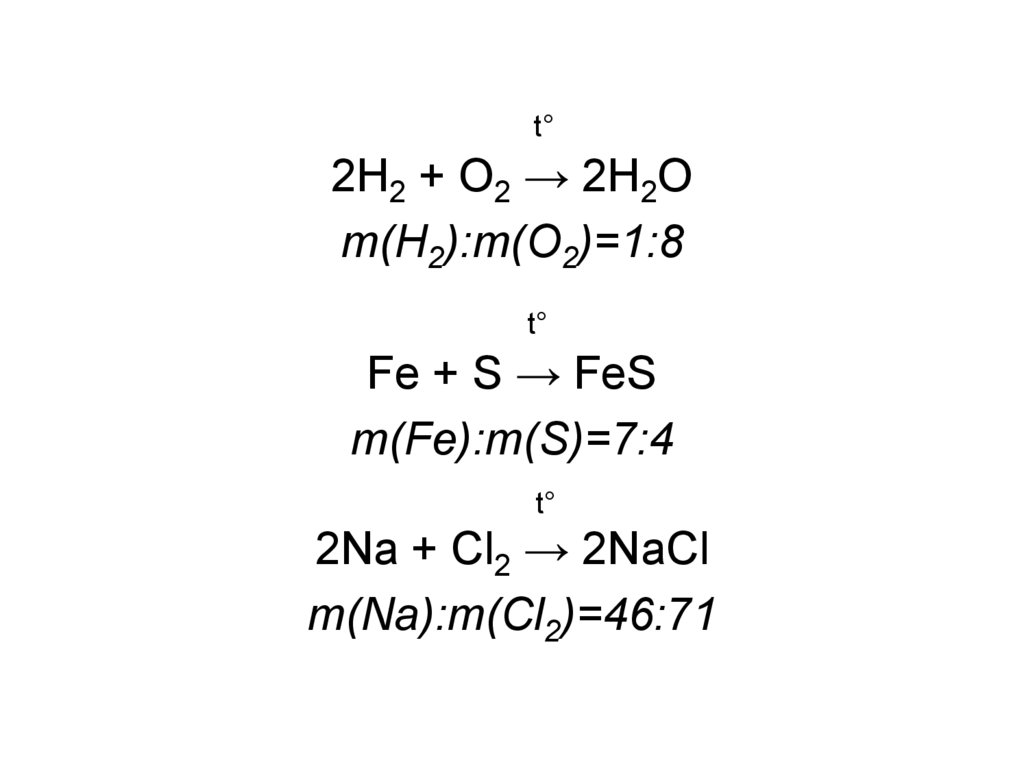
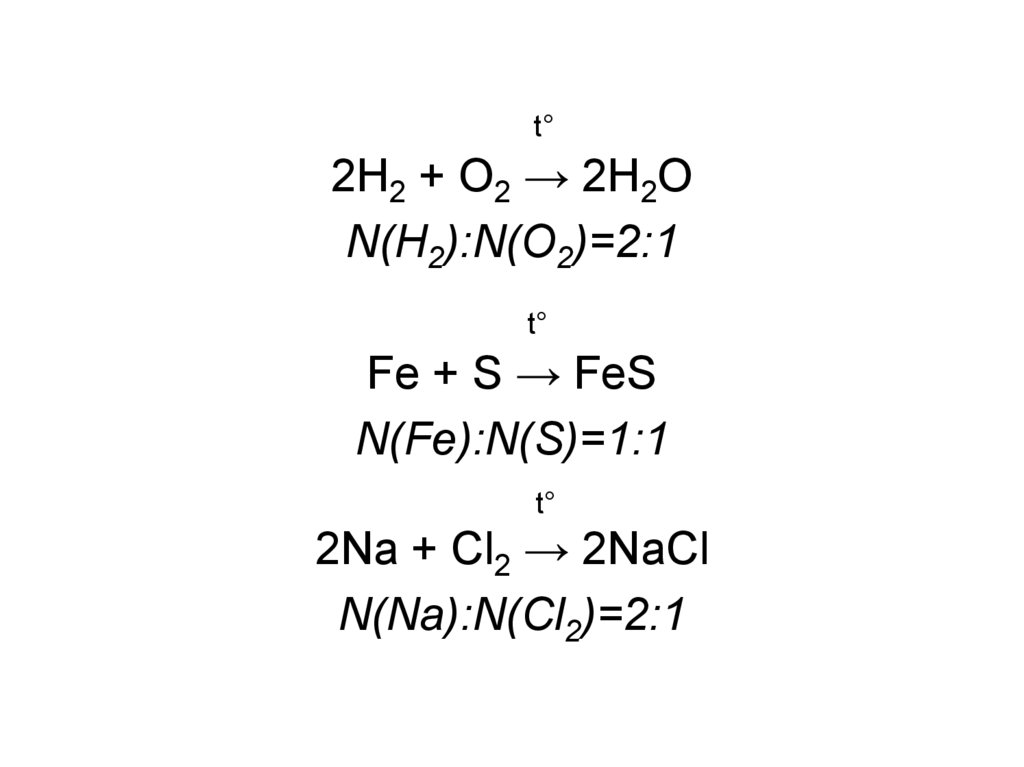



 chemistry
chemistry








