Similar presentations:
Количество вещества. Моль. Молярная масса
1. Тема урока «Количество вещества. Моль. Молярная масса»
ТЕМА УРОКА«КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЬ.
МОЛЯРНАЯ МАССА»
2. Химия – это наука о веществах. Как измерять вещество? В каких единицах?
ХИМИЯ – ЭТО НАУКА О ВЕЩЕСТВАХ.КАК ИЗМЕРЯТЬ ВЕЩЕСТВО? В КАКИХ
ЕДИНИЦАХ?
• МАССА ИЗМЕРЯЕТСЯ В ГРАММАХ, КИЛОГРАММАХ,
ТОННАХ
• ДЛИНА – В САНТИМЕТРАХ, МЕТРАХ, КИЛОМЕТРАХ
• ОБЪЁМ - В ЛИТРАХ, МЕТРАХ КУБ.
• ДЛЯ ИЗМЕРЕНИЯ ВЕЩЕСТВА БЫЛА ВЫБРАНА ОСОБАЯ
ЕДИНИЦА, В КОТОРОЙ КАК БЫ СОЕДИНИЛИСЬ ЧИСЛО
МОЛЕКУЛ И МАССА ВЕЩЕСТВА.
• ЭТА ЕДИНИЦА НАЗВАНА МОЛЬ
3. Чтобы отмерить 1 моль вещества, нужно взять столько граммов его, какова относительная атомная масса Аr или относительная
ЧТОБЫ ОТМЕРИТЬ 1 МОЛЬ ВЕЩЕСТВА, НУЖНО ВЗЯТЬСТОЛЬКО ГРАММОВ ЕГО, КАКОВА ОТНОСИТЕЛЬНАЯ
АТОМНАЯ МАССА АR ИЛИ ОТНОСИТЕЛЬНАЯ
МОЛЕКУЛЯРНАЯ МАССА МR ВЕЩЕСТВА
• 1 МОЛЬ ВОДЫ = 18Г, Т.К. МR (Н2О) = 18;
• 1 МОЛЬ КИСЛОРОДА = 32Г, Т.К. МR (О2) = 32;
• 1 МОЛЬ ЖЕЛЕЗА = 56Г, Т.К. МR (FE) = 56
• СООТВЕТСТВЕННО 0,5 МОЛЬ ИМЕЕТ МАССУ ВДВОЕ
МЕНЬШЕ:
• 0,5 МОЛЬ ВОДЫ = 9Г;
• 0,5 МОЛЬ КИСЛОРОДА = 16Г;
• 0,5 МОЛЬ ЖЕЛЕЗА = 28Г
4.
• МОЛЬ – ЭТО КОЛИЧЕСТВО ВЕЩЕСТВА,В
23
КОТОРОМ СОДЕРЖИТСЯ 6 * 10
МОЛЕКУЛ (АТОМОВ, ИОНОВ,
ЭЛЕКТРОНОВ И Т.Д.) ЭТОГО ВЕЩЕСТВА.
23
ЧИСЛО 6*10 НАЗВАНО ЧИСЛОМ
АВОГАДРО (В ЧЕСТЬ ИТАЛЬЯНСКОГО
УЧЁНОГО А.АВОГАДРО)
23
NА = 6 * 10 --- ПОСТОЯННАЯ АВОГАДРО
5. Как соотносятся масса вещества, количество вещества и число частиц
КАК СООТНОСЯТСЯ МАССА ВЕЩЕСТВА, КОЛИЧЕСТВОВЕЩЕСТВА И ЧИСЛО ЧАСТИЦ
Название
вещества
Кислород
Количество Масса
вещества
вещества
1 моль
32 г
Число
частиц
23
6 * 10
23
Вода
1 моль
18 г
6 * 10
23
Углекислый
газ
Железо
1 моль
44 г
6 * 10
23
1 моль
56 г
6 * 10
6.
• МОЛЬ – ЭТО КОЛИЧЕСТВО ВЕЩЕСТВА,В
23
КОТОРОМ СОДЕРЖИТСЯ 6 * 10
МОЛЕКУЛ (АТОМОВ, ИОНОВ,
ЭЛЕКТРОНОВ И Т.Д.) ЭТОГО ВЕЩЕСТВА.
23
ЧИСЛО 6*10 НАЗВАНО ЧИСЛОМ
АВОГАДРО (В ЧЕСТЬ ИТАЛЬЯНСКОГО
УЧЁНОГО А.АВОГАДРО)
23
NА = 6 * 10 --- ПОСТОЯННАЯ АВОГАДРО
7. Необходимые формулы:
НЕОБХОДИМЫЕ ФОРМУЛЫ:N= NA * n
N- число молекул, содержащихся в
определённом количестве вещества
n - число молей
N
n = ----NА
;
N
NА = ----n
8. Массу 1 моль вещества называют его молярной массой и обозначают буквой М
МАССУ 1 МОЛЬ ВЕЩЕСТВА НАЗЫВАЮТ ЕГОМОЛЯРНОЙ МАССОЙ И ОБОЗНАЧАЮТ
БУКВОЙ М
M
N = ------- ;
М
M
M = M*N ;
М = -------
N
МОЛЯРНАЯ МАССА – ЭТО ФИЗИЧЕСКАЯ ВЕЛИЧИНА, КОТОРАЯ
РАВНА ОТНОШЕНИЮ МАССЫ ВЕЩЕСТВА К КОЛИЧЕСТВУ ВЕЩЕСТВА.
9. Единицы измерения молярной массы
ЕДИНИЦЫ ИЗМЕРЕНИЯ МОЛЯРНОЙМАССЫ
• Г/МОЛЬ;
КГ/КМОЛЬ;
МГ/ММОЛЬ
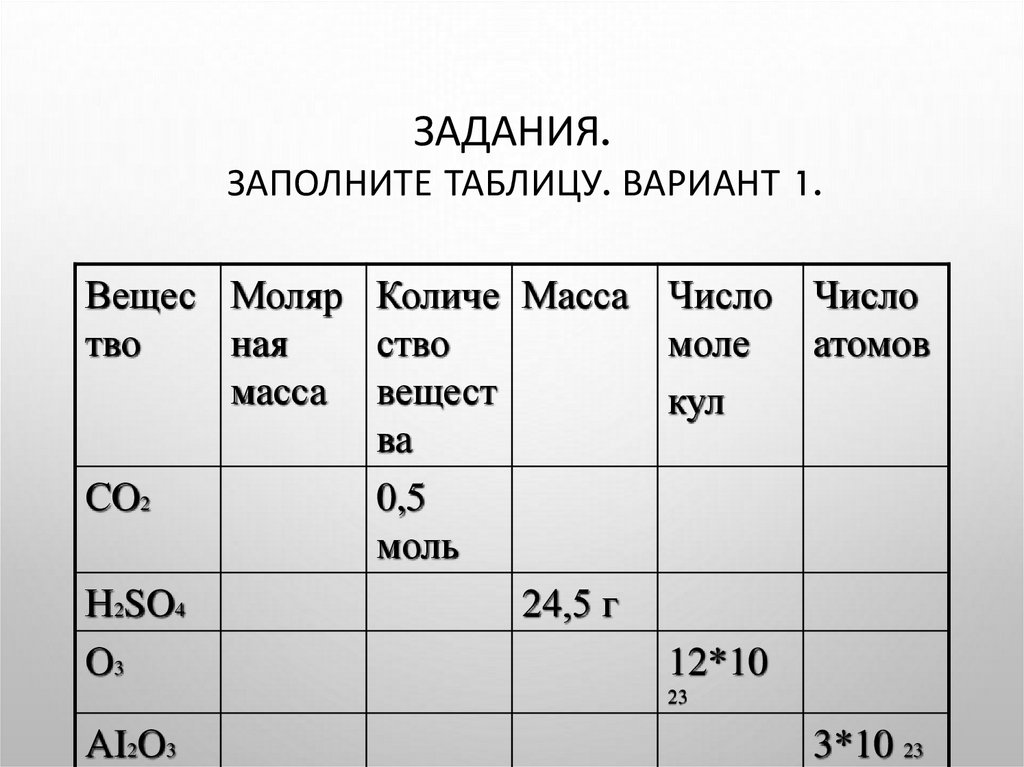
10. Задания. Заполните таблицу. Вариант 1.
ЗАДАНИЯ.ЗАПОЛНИТЕ ТАБЛИЦУ. ВАРИАНТ 1.
Вещес Моляр Количе Масса
тво
ная
ство
масса вещест
ва
СО2
0,5
моль
Н2SO4
24,5 г
О3
Число
моле
кул
Число
атомов
12*10
23
АI2О3
3*10 23
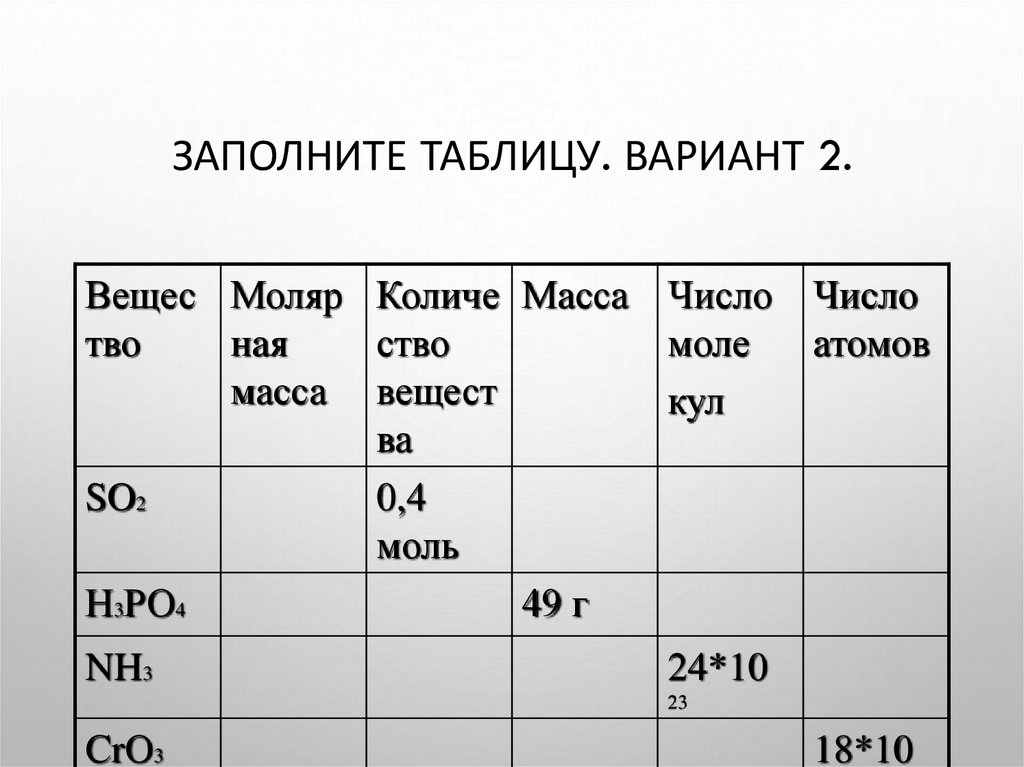
11. Заполните таблицу. Вариант 2.
ЗАПОЛНИТЕ ТАБЛИЦУ. ВАРИАНТ 2.Вещес Моляр Количе Масса Число
тво
ная
ство
моле
масса вещест
кул
ва
SO2
0,4
моль
Н3РО4
49 г
NH3
Число
атомов
24*10
23
СrО3
18*10
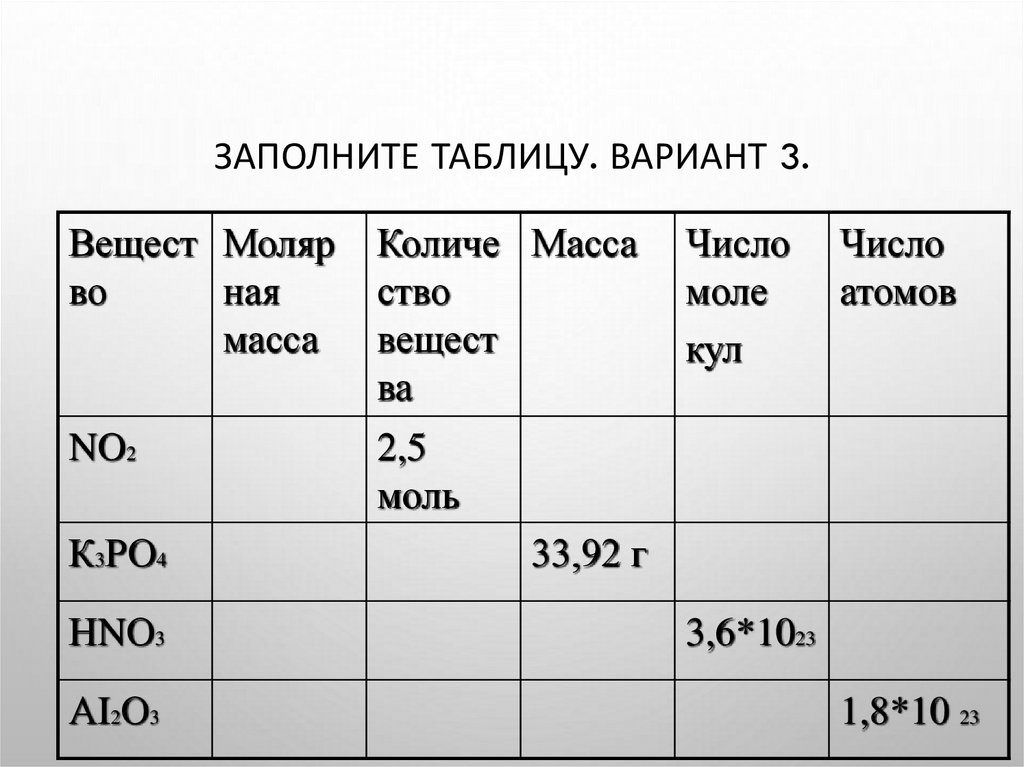
12. Заполните таблицу. Вариант 3.
ЗАПОЛНИТЕ ТАБЛИЦУ. ВАРИАНТ 3.Вещест Моляр
во
ная
масса
Количе Масса
ство
вещест
ва
NO2
2,5
моль
К3РО4
НNО3
АI2О3
Число
моле
кул
Число
атомов
33,92 г
3,6*1023
1,8*10 23
13. Заполните таблицу. Вариант 4.
ЗАПОЛНИТЕ ТАБЛИЦУ. ВАРИАНТ 4.Вещест Моляр
во
ная
масса
Са(Н2РО4)
2
Fe3O4
Zn(OH)2
СН4
Количе Масс Чис
Числ
ство
а
ло моле о атовещест
мов
кул
ва
0,7
моль
29 г
6,6*10
23
54*10
23
14. Задача 1.
ЗАДАЧА 1.• ОПРЕДЕЛИТЕ МАССУ СУЛЬФАТА МЕДИ (СUSO4), СОДЕРЖАЩЕГО
СТОЛЬКО ЖЕ АТОМОВ, СКОЛЬКО ИХ СОДЕРЖИТСЯ В 34 Г NANO3.
15. Задача 2.
ЗАДАЧА 2.• КАКОЕ КОЛИЧЕСТВО ВЕЩЕСТВА СОДЕРЖИТ 1 КГ ВОЗДУХА
(МВОЗДУХА =29Г/МОЛЬ)
16. Задача 1.
ЗАДАЧА 1.• ОПРЕДЕЛИТЕ МАССУ СУЛЬФАТА МЕДИ (СUSO4), СОДЕРЖАЩЕГО
СТОЛЬКО ЖЕ АТОМОВ, СКОЛЬКО ИХ СОДЕРЖИТСЯ В 34 Г NANO3.
17. Задача 3.
ЗАДАЧА 3.• ОПРЕДЕЛИТЬ, ЧТО ТЯЖЕЛЕЕ 0,125 МОЛЬ СU
ИЛИ 0, 125 МОЛЬ ZN?
18. Домашнее задание
ДОМАШНЕЕ ЗАДАНИЕ19. Задача 4.
ЗАДАЧА 4.• КАКУЮ МАССУ ИМЕЕТ
• А) 0,5 МОЛЬ ВОДОРОДА;
• Б) 3 МОЛЬ СЕРОВОДОРОДА;
• В) 18*10 23 МОЛЕКУЛ ХЛОРОВОДОРОДА
20. Задача 5.
ЗАДАЧА 5.• СКОЛЬКО МОЛЕКУЛ СОДЕРЖИТСЯ В:
• А) 5 МОЛЬ ВОДОРОДА;
• Б) 5 ММОЛЬ ВОДОРОДА;
• В) 5 КМОЛЬ ВОДОРОДА?
21. Задача 6.
ЗАДАЧА 6.• НАЙТИ МАССУ :
23
• 15* 10 МОЛЕКУЛ КИСЛОРОДА,
• 0,125 МОЛЬ ФОСФОРА,
• 7 КМОЛЬ СОЛЯНОЙ КИСЛОТЫ (НСI),
• 2 ММОЛЬ УГЛЕРОДА
22. Задача 7.
ЗАДАЧА 7.• СКОЛЬКО МОЛЕЙ КИСЛОРОДА ИЗРАСХОДУЕТСЯ НА ГОРЕНИЕ 44 Г
ВОДОРОДА?
23. Задача 8.
ЗАДАЧА 8.• В РЕАКЦИИ 50 Г АЛЮМИНИЯ С ИЗБЫТКОМ КИСЛОРОДА
ОБРАЗОВАЛОСЬ 0, 75 МОЛЬ ОКСИДА АЛЮМИНИЯ. ВЫЧИСЛИТЕ
МАССУ ПРИМЕСЕЙ В ОБРАЗЦЕ АЛЮМИНИЯ.




















 chemistry
chemistry








