Similar presentations:
Количество вещества. Моль. Молярная масса
1. Тема урока «Количество вещества. Моль. Молярная масса»
ТЕМА УРОКА«КОЛИЧЕСТВО ВЕЩЕСТВА.
МОЛЬ. МОЛЯРНАЯ МАССА»
Учитель химии
МОУ ТСШ № 16
Тельса Александр Владимирович
Г.Тирасполь
2. Химия – это наука о веществах. Как измерять вещество? В каких единицах?
Масса измеряется в граммах, килограммах,тоннах
Длина – в сантиметрах, метрах, километрах
Объём - в литрах, метрах куб.
Для измерения вещества была выбрана
особая единица, в которой как бы
соединились число молекул и масса
вещества.
Эта единица названа МОЛЬ
ХИМИЯ – ЭТО НАУКА О ВЕЩЕСТВАХ.
КАК ИЗМЕРЯТЬ ВЕЩЕСТВО? В КАКИХ
ЕДИНИЦАХ?
3. Чтобы отмерить 1 моль вещества, нужно взять столько граммов его, какова относительная атомная масса Аr или относительная
ЧТОБЫ ОТМЕРИТЬ 1 МОЛЬ ВЕЩЕСТВА, НУЖНОВЗЯТЬ СТОЛЬКО ГРАММОВ ЕГО, КАКОВА
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА АR ИЛИ
ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА
МR ВЕЩЕСТВА
1 моль воды = 18г, т.к.
Мr (Н2О) = 18;
1 моль кислорода = 32г, т.к. Мr (О2) = 32;
1 Моль железа = 56г, т.к. Мr (Fe) = 56
Соответственно 0,5 моль имеет массу вдвое
меньше:
0,5 моль воды = 9г;
0,5 моль кислорода = 16г;
0,5 моль железа = 28г
4.
Моль – это количество вещества, в23
котором содержится 6 * 10
молекул (атомов, ионов,
электронов и т.д.) этого вещества.
23
Число 6*10 названо числом Авогадро
(в честь итальянского учёного
А.Авогадро)
23
NА = 6 * 10 --- постоянная Авогадро
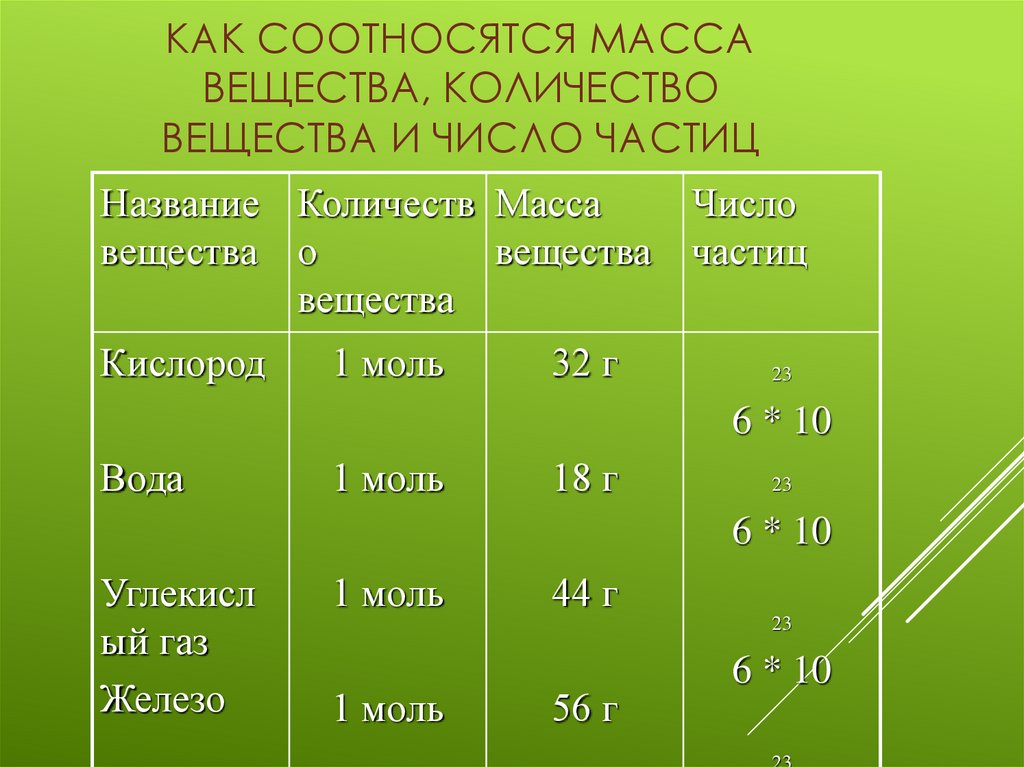
5. Как соотносятся масса вещества, количество вещества и число частиц
КАК СООТНОСЯТСЯ МАССАВЕЩЕСТВА, КОЛИЧЕСТВО
ВЕЩЕСТВА И ЧИСЛО ЧАСТИЦ
Название Количеств Масса
вещества о
вещества
вещества
Кислород
1 моль
32 г
Число
частиц
23
6 * 10
Вода
1 моль
18 г
23
6 * 10
Углекисл
ый газ
Железо
1 моль
44 г
23
1 моль
56 г
6 * 10
6.
Моль – это количество вещества, в23
котором содержится 6 * 10
молекул (атомов, ионов,
электронов и т.д.) этого вещества.
23
Число 6*10 названо числом Авогадро
(в честь итальянского учёного
А.Авогадро)
23
NА = 6 * 10 --- постоянная Авогадро
7. Необходимые формулы:
НЕОБХОДИМЫЕ ФОРМУЛЫ:N= NA * n
N- число молекул, содержащихся в
определённом количестве вещества
n - число молей
N
n = ----NА
;
N
NА = ----n
8. Массу 1 моль вещества называют его молярной массой и обозначают буквой М
mn = ------- ;
М
m
m = M*n ;
М = -------
n
Молярная масса – это физическая величина,
которая равна отношению массы вещества к
количеству вещества.
МАССУ 1 МОЛЬ ВЕЩЕСТВА
НАЗЫВАЮТ ЕГО МОЛЯРНОЙ
МАССОЙ И ОБОЗНАЧАЮТ
БУКВОЙ М
9. Единицы измерения молярной массы
г/моль;мг/ммоль
кг/кмоль;
ЕДИНИЦЫ ИЗМЕРЕНИЯ
МОЛЯРНОЙ МАССЫ
10. Задания. Заполните таблицу. .
ЗАДАНИЯ.ЗАПОЛНИТЕ ТАБЛИЦУ. .
Вещест Молярн Количес Масса
во
ая масса тво
веществ
а
СО2
0,5 моль
Н2SO4
О3
АI2О3
Число
моле
кул
Число
атомов
24,5 г
12*10 23
3*10 23
11. Заполните таблицу.
ЗАПОЛНИТЕ ТАБЛИЦУ.Вещест Молярн Количес Масса Число
во
ая масса тво
моле
веществ
кул
а
SO2
Н3РО4
NH3
СrО3
Число
атомов
0,4 моль
49 г
24*10 23
18*10 23
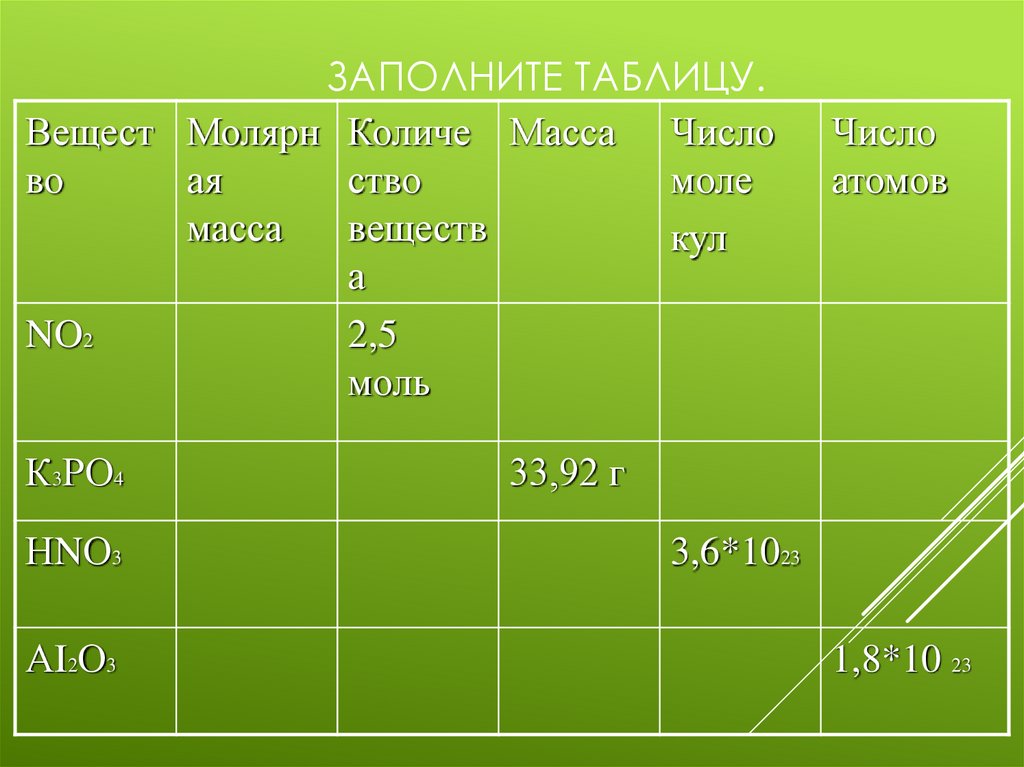
12. Заполните таблицу.
ЗАПОЛНИТЕ ТАБЛИЦУ.Вещест Молярн Количе Масса Число
во
ая
ство
моле
масса
веществ
кул
а
NO2
2,5
моль
К3РО4
НNО3
АI2О3
Число
атомов
33,92 г
3,6*1023
1,8*10 23
13. Задача 1.
Определите массу сульфата меди (СuSO4),содержащего столько же атомов, сколько их
содержится в 34 г NaNO3.
ЗАДАЧА 1.
14. Задача 2.
Какое количество вещества содержит 1 кгвоздуха (Мвоздуха =29г/моль)
ЗАДАЧА 2.
15. Задача 1.
Определите массу сульфата меди (СuSO4),содержащего столько же атомов, сколько их
содержится в 34 г NaNO3.
ЗАДАЧА 1.
16. Задача 3.
Определить, что тяжелее 0,125моль Сu или 0, 125 моль Zn?
ЗАДАЧА 3.
17. Задача 4.
Какую массу имеетА) 0,5 моль водорода;
Б) 3 моль сероводорода;
В) 18*10 23 молекул хлороводорода
ЗАДАЧА 4.
18. Задача 5.
Сколько молекул содержится в:А) 5 моль водорода;
Б) 5 ммоль водорода;
В) 5 кмоль водорода?
ЗАДАЧА 5.
19. Задача 6.
Найти массу :23
15* 10 молекул кислорода,
0,125 моль фосфора,
7 кмоль соляной кислоты (НСI),
2 ммоль углерода
ЗАДАЧА 6.
20. Задача 7.
Сколько молей кислорода израсходуется нагорение 44 г водорода?
ЗАДАЧА 7.
21. Задача 8.
В реакции 50 г алюминия с избыткомкислорода образовалось 0, 75 моль оксида
алюминия. Вычислите массу примесей в
образце алюминия.
ЗАДАЧА 8.




















 chemistry
chemistry








