Similar presentations:
Шкала рН
1. Шкала рН
Кафедра общей и медицинской химииШкала рН
1
2.
КИСЛОТНО-ОСНÓВНОЕ РАВНОВЕСИЕВода – слабый электролит и диссоциирует согласно уравнению:
Константа диссоциации этого равновесия называется ионным
произведением воды Кw [w – первая буква water – вода (англ.)] и,
в соответствии с ЗДМ для равновесия, имеет следующее
выражение ([…] – равновесные концентрации ионов;
равновесная концентрация жидкости [H2O] не входит в него):
[H ]·[OH ]
Кw
[H ]·[OH ]
1
Наряду с Kw используют показатель ионного произведения pKw
2
3.
Диссоциация – эндотермический процесс => Kw растет сповышением температуры:
По умолчанию температуру принимают равной 25 °С, а Kw = 10−14.
В любом водном растворе [H+] и [OH−] обратно пропорциональны
друг другу. Чем больше в растворе ионов H+ , тем меньше в нем
ионов OH−, и наоборот. Соотношение концентраций этих ионов и
определяет среду водного раствора.
3
4.
В нейтральной среде:[H ] [OH ] K w 10
10 моль/л.
14
7
В кислой среде:
[H ] 10 моль/л,
7
[OH ] 10 моль/л.
7
В щелочной среде:
[H ] 10 моль/л,
7
[OH ] 10 моль/л.
7
В соответствии с принципом Ле Шателье, при добавлении
катионов водорода или гидроксид-ионов равновесие
диссоциации воды смещается влево.
4
5.
Для количественной характеристики среды раствора используютводородный и гидроксидный показатели.
Водородный показатель pH («пэ-аш») – взятый с обратным знаком
десятичный логарифм равновесной молярной концентрации
(моль/л) катионов водорода (точнее, их активности).
Гидроксидный показатель рOH («пэ-о-аш») – это взятый с
обратным знаком десятичный логарифм равновесной молярной
концентрации (моль/л) гидроксид-ионов (точнее, их активности).
Интервал изменения обоих показателей равен примерно
(–1 ÷ 15) (при комнатной температуре).
Соотношение между pH и рOH:
5
6.
Для идеально чистой воды рН = 7Дождевая вода имеет рН ≈ 5,5 – 6,0 за счет растворенного СО2.
6
7.
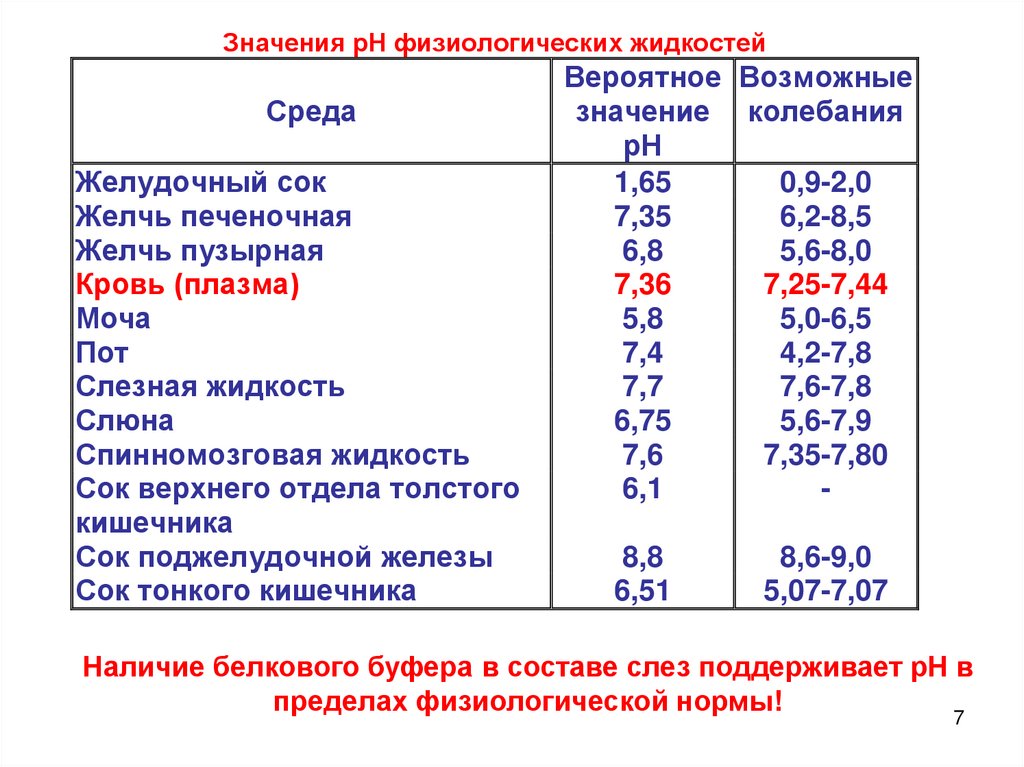
Значения рН физиологических жидкостейСреда
Желудочный сок
Желчь печеночная
Желчь пузырная
Кровь (плазма)
Моча
Пот
Слезная жидкость
Слюна
Спинномозговая жидкость
Сок верхнего отдела толстого
кишечника
Сок поджелудочной железы
Сок тонкого кишечника
Вероятное Возможные
значение колебания
рН
1,65
0,9-2,0
7,35
6,2-8,5
6,8
5,6-8,0
7,36
7,25-7,44
5,8
5,0-6,5
7,4
4,2-7,8
7,7
7,6-7,8
6,75
5,6-7,9
7,6
7,35-7,80
6,1
8,8
6,51
8,6-9,0
5,07-7,07
Наличие белкового буфера в составе слез поддерживает рН в
пределах физиологической нормы!
7
8.
Расчет равновесных концентраций катионов водорода [H+]и гидроксид-ионов [OH–], рН и pOH в растворах кислот и
оснований.
1. Раствор сильной кислоты HyAn (y = 1, 2).
2
2
c
c
4
K
/
y
w
[H ] y
,
2
где c − концентрация кислоты, моль/л; Kw – ионное произведение
воды; y – оснóвность кислоты.
В 10−7 M растворе HI
7
7 2
14
2
10
(
10
)
4
10
/
1
[H ] 1
1,6 10 7 моль/л.
2
При c > 5·10−7 моль/л используют более простое уравнение:
[H ] y c
pH lg [H ]; pOH 14 pH; [OH ] 10
pOH
Kw
.
[H ]
8
9.
Найти [H+], рН, рОН, [OH-] в 0,005 М растворе H2SO4.[H ] 2 0,005 0,01 моль/л; pH lg 0,01 2;
pOH 14 2 12; [OH ] 10 12 моль/л.
2. Раствор сильного основания M(OH)x (x = 1, 2).
c c 4 Kw / x
[OH ] x
,
2
2
2
где c − концентрация шелочи, моль/л; x – кислотность щелочи.
В 3·10−7 M растворе Ba(OH)2
7
7 2
14
2
3
10
(
3
10
)
4
10
/
2
[OH ] 2
6,2 10 7 моль/л.
2
−7
При c > 5·10
моль/л используют более простое уравнение:
[OH ] x c
pOH lg [OH ]; pH 14 pOH; [H ] 10
pH
Kw
.
[OH ]
9
10.
Найти [H+], рН, рОН, [OH−] в 0,03 М растворе KOH.[OH ] 1 0,03 0,03 моль/л; pOH lg 0,03 1,52;
14
10
pH 14 1,52 12,48; [H ]
3,3 10 13 моль/л.
0,03
3. Раствор слабой кислоты, константа диссоциации которой
равна Ka (если основность кислоты больше 1, то используется
константа I-ой ступени диссоциации Ka,I).
[H ]
2
Ka
4 Ka c Ka
2
В 0,05 М растворе H3PO4 (Кa,I = 7,2∙10−3)
c
0,05
6,9 100 .
3
K a ,I 7,2 10
3 2
3
3
(
7
,
2
10
)
4
7
,
2
10
0
,
05
7
,
2
10
[H ]
0,019 моль/л.
2
10
11.
При c/Ka > 100 используют более простое уравнение:1
[H ] K a c pH (pK a lg c)
2
pH lg [H ]; pOH 14 pH; [OH ] 10
pOH
Kw
.
[H ]
Найти [H+], рН, рОН, [OH−] в 0,3 М растворе HCOOH (Кa = 1,8∙10−4).
c
0,3
1667 100.
4
K a 1,8 10
4
[H ] 1,8 10 0,3 0,0073 моль/л;
pH lg 0,0073 2,13; pOH 14 2,13 11,87;
11, 87
12
[OH ] 10
1,4 10 моль/л.
11
12.
4. Раствор слабого основания, константа диссоциации которойравна Kb (если кислотность основания больше 1, то используется
константа I-ой ступени диссоциации Kb,I).
[OH ]
2
Kb
4 Kb c Kb
2
В 0,06 М растворе (C2H5)2NH2OH (Кb = 9,5∙10−4)
c
0,06
63 100 .
4
K b 9,5 10
4 2
4
4
(
9
,
5
10
)
4
9
,
5
10
0
,
06
9
,
5
10
[OH ]
0,0071 моль/л.
2
12
13.
При c/Kb > 100 используют более простое уравнение:1
[OH ] Kb c pOH (pKb lg c)
2
pOH lg [OH ]; pH 14 pOH; [H ] 10
pH
Kw
.
[OH ]
Найти [H+], рН, рОН, [OH−] в 0,07 М растворе (CH3)3NHOH (pКb = 4,20).
K b 10
4 , 20
c
0,07
6,3 10 ;
1111 100 .
5
K b 6,3 10
5
1
pOH (4,20 lg 0,07) 1,52; pH 14 1,52 12,48;
2 1, 52
[OH ] 10 0,030 моль/л; [H ] 10 12, 48 3,3 10 13 моль/л.
13
14.
[H ] с1 К a1 c2 K a2 ,где с1 и c2 молярные концентрации кислот, моль/л.
Найти [H+] и рН раствора, содержащего 0,2 моль/л HCOOH
(Кa = 1,8∙10−4) и 0,1 моль/л CH3COOH (Кa = 1,8∙10−5).
[H ] 0,2 1,8 10 0,1 1,8 10 0,0061 моль/л;
4
5
pH lg 0,0061 2,21.
14
15.
[OH ] c1 К b1 c2 K b2 ,где с1 и c2 молярные концентрации оснований,моль/л.
Найти [H+] и рН раствора, содержащего 0,05 моль/л (CH3)3NHOH
(pКb = 4,20) и 0,03 моль/л CH3NH3OH (pКb = 3,38).
K b1 10 4 , 20 6,3 10 5 ;
K b2 10 3, 38 4,2 10 4 ;
5
4
[OH ] 0,05 6,3 10 0,03 4,2 10 0,0040 моль/л;
pOH lg 0,0040 2,40; pH 14 2,40 11,60;
[H ] 10 11, 60 2,3 10 12 моль/л.
15
16.
рН яблочного сока равен 4,57. Найти [Н+] и [OH−] (моль/л).[H ] 10 4 , 57 2,7 10 5 моль/л;
14
10
10
[OH ]
3
,
7
10
моль/л.
5
2,7 10
Для растворов сильных электролитов с достаточно высокими
концентрациями (примерно 1 моль/л и больше) при расчетах pH и
pOH следует использовать значения активностей (не
концентраций!) соответствующих ионов.
16
17.
Активная, потенциальная и общая кислотность(щелочность) раствора.
Активная кислотность [H+]акт – концентрация свободных ионов Н+,
имеющихся в растворе при данных условиях.
Активная щелочность [OH–]акт – концентрация свободных ионов
OН–, имеющихся в растворе при данных условиях.
Потенциальная кислотность [H+]пот – концентрация ионов Н+,
связанных в молекулы или ионы слабых кислот, имеющихся в
растворе.
Потенциальная щелочность [OH–]пот – концентрация ионов OН–,
связанных в молекулы или ионы слабых оснований, имеющихся
в растворе.
Общая кислотность (щелочность) [H+]общ ([OH–]общ) – сумма
активной и потенциальной.
17
18.
Найти [H+]акт, [H+]пот и [H+]общ в 0,05 М растворе H2SO4.[H ]акт 2 0,05 0,1 моль/л;
[H ]пот 0 моль/л;
[H ]общ 0,1 моль/л.
Найти [H+]акт, [H+]пот и [H+]общ в 0,2 М растворе HCOOH (Кa = 1,8∙10−4).
c
0,2
1111 100 .
4
K a 1,8 10
4
[H ]акт 1,8 10 0,2 0,006 моль/л;
[H ]пот 0,2 0,006 0,194 моль/л;
[H ]общ 0,2 моль/л.
18
19.
Найти [OH–]акт, [OH–]пот и [OH–]общ в 0,01 М растворе NaOH.[OH ]акт 1 0,01 0,01 моль/л;
[OH ]пот 0 моль/л;
[OH ]общ 0,01 моль/л.
Найти [OH–]акт, [OH–]пот и [OH–]общ в 0,04 М растворе (CH3)3NHOH
(Кb = 6,3∙10–5).
c
0,04
635 100 .
5
K b 6,3 10
[OH ]акт 6,3 10 5 0,04 0,0016 моль/л;
[OH ]пот 0,04 0,0016 0,038 моль/л;
[OH ]общ 0,04 моль/л.
19



















 chemistry
chemistry








