Similar presentations:
Обмін білків
1. Обмін білків
2. Білки
Білки – біологічні полімерні молекули,мономерами яких є амінокислоти,
з'єднані пептидними зв'язками.
Індивідуальність білкових молекул
визначається порядком чергування
амінокислот та їх кількістю.
Білки мають м.м. від 5 тис. Д і більше.
3. Функції білків
Каталітична – ферментиПластична – структурні білки
Регуляторна – гормони, ферменти
Скорочувальна – білки м'язів і цитоскелету
Захисна – імуноглобуліни
Енергетична
Рецепторна – деякі білки мембран
Транспортна – білки крові, білки мембран.
Гістосумісність – деякі білки мембран.
В організмі тварин білків – 18-21%,
у рослин – 0,01-15%
4. Вміст білків у тканинах, %
ТвариниОрганізм – 18-21
М'язи – 19-23
Печінка – 18-19
Нирки – 16-18
Головний мозок – 8-10
Кістки – 8-9
Рослини
Зерна – 10-16
Стебла – 1,5-3
Листя – 1,2-3
5.
Прості білки1) альбуміни
2) глобуліни
3) гістони
4) протаміни
5) глютеліни
6) проламіни
7) склеропротеїни
6. Складні білки
1) нуклеопротеїни2) хромопротеїни
3) фосфопротеїни
4) глікопротеїни
5) ліпопротеїни
6) металопротеїни
7. Амінокислоти
ЗамінніГліцин
Аланін
Серин
Цистеїн
Аспарагінова кислота
Глутамінова кислота
Тирозин
Пролін
Аспарагін
Глютамін
Незамінні
Треонін
Метионін
Валін
Лейцин
Ізолейцин
Лізин
Аргінін
Фенілаланін
Гістидин
Триптофан
8. Класифікація білків за їх повноцінністю
Повноцінні білки містять всі незамінніамінокислоти. До них відносять білки
тваринного походження, за винятком
протеіноїдів.
Неповноцінні білки. В їх структурі відсутня
хоча б одна з незамінних амінокислот. До
них відносять, в основному, білки
рослинного походження, за винятком
деяких білків бобових і гречки.
9. АЗОТИСТИЙ БАЛАНС
Азотистий баланс — відношення між кількістю азоту,засвоєного організмом, і кількістю азоту, що виділяється в
складі кінцевих продуктів обміну (переважно у вигляді
сечовини і амонійних солей). Засвоєний азот – це різниця
між кількістю азоту, що надійшов з кормом і азоту, який
виділився в складі фекалій.
Види азотистого балансу:
1) позитивний
2) негативний
3) нульовий (азотиста рівновага).
Амінокислоти (вільні та в складі білків) містять майже 95%
всього азоту, тому саме вони підтримують азотистий
баланс організму.
10. Види азотистого балансу
Позитивний: кількість засвоєного азотубільше, ніж кількість виділеного азоту,
тобто процеси анаболізму переважають над
процесами катаболізму.
Цей вид балансу спостерігається:
- у молодих тварин, що ростуть;
- у продуктивних тварин;
- в період вагітності;
- у відновлювальний період після важкої
хвороби.
11.
Негативний азотистий баланс: кількістьвиділеного азоту більше, ніж кількість
засвоєного азоту, тобто процеси катаболізму в
організмі
переважають
над
процесами
анаболізму. Це спостерігається:
- при важких захворюваннях;
- при старінні тварин;
- в результаті голодування;
- при різних авітамінозах;
- при нестачі в раціоні незамінних амінокислот.
12.
Азотиста рівновага (нульовий баланс):кількість засвоєного та виділеного азоту порівну.
Це спостерігається у здорових непродуктивних
тварин, які закінчили ріст і розвиток, при
збалансованій годівлі.
13. Білкова недостатність
Відомо, що навіть тривале видалення з раціонулюдини жирів або вуглеводів не викликає важких
розладів здоров'я. Але безбілкове годування
(особливо тривале) призводить до порушення
обміну і неминуче закінчується загибеллю
організму. Відсутність навіть однієї незамінної
амінокислоти в харчовому раціоні приводить до
неповного засвоєння інших амінокислот і
супроводжується
розвитком
негативного
азотистого балансу, виснаженням, зупинкою
росту і порушеннями функцій нервової системи.
14. Білковий мінімум
Це найменша кількість білку в раціоні, яка необхіднадля забезпечення всіх його потреб, тобто при якій
організм зберігає азотисту рівновагу. Теоретично його
розраховують для окремих видів тварин з розрахунку
кількості грамів білку на один кілограм маси тіла.
- Свині дорослі − 1,0 г;
- Свині на відгодівлі – 3,0 г;
- Корови не лактуючі – 0,6-0,8 г;
- Корови лактуючі – 1,2-1,4 г;
- Вівці – 1,0 г;
- Коні, що не працюють – 0,8 г;
- Коні, що працюють – 1,2-1,4 г.
15. Норми протеїну в раціоні
Вони розраховуються з урахуванням виду тварини,віку, напрямку продуктивності та інших факторів
(детально в курсі годівлі). В них враховується
сумарна потреба протеїну, який використовується для
забезпечення основних функцій організму і
формування продукції з урахуванням фізіологічного
стану організму.
Сучасні технології тваринництва передбачають
збалансованість раціонів тварин не тільки за кількістю
білків в раціоні, але і за амінокислотним складом
(вмісту
незамінних
амінокислот
та
їх
співвідношенню).
16. Джерела амінокислот
В організмі людини за добу розпадається наамінокислоти приблизно 400 г білків, майже така
ж кількість синтезується. Тому тканинні білки не
можуть відшкодовувати витрати амінокислот при
їх катаболізмі та використання на синтез інших
сполук. Первинними джерелами амінокислот не
можуть бути і вуглеводи, так як з них синтезується
тільки вуглецева частина молекули більшості
амінокислот, а аміногрупа надходить від інших
амінокислот. Відповідно, основним джерелом
амінокислот організму є білки корму.
17. Кількість білку в деяких харчових продуктах
18.
19. Переварювання білків
Основним сенсом перетравлення білків є їх гідроліз довільних амінокислот, в результаті чого вони втрачають
свою видову специфічність та засвоюються організмом
у вигляді простих речовин – амінокислот. Цим організм
захищає себе від потрапляння до нього чужорідних
білків.
Винятком з цього правила є всмоктування
імуноглобулінів молозива (без попереднього їх
гідролізу) стінкою кишечнику новонароджених тварин,
завдяки якому виникає молозивний (колостральний)
імунітет, який забезпечує стійкість організму в перші
місяці життя.
20.
Переварювання білків здійснюється комплексомтравних
ферментів,
які
називаються
протеолітичними або протеазами.
Протеази відносять до класу Гідролази, підклас
Протеінази і Пептидази.
Протеази, які гідролізують пептидні зв'язки
всередині білкової молекули, відносять до групи
ендопептидаз (пепсин, трипсин, хімотрипсин).
Ферменти,
що
відносяться
до
групи
екзопептидаз, гідролізують пептидний зв'язок,
утворений
кінцевими
амінокислотами
(карбоксиполіпептидаза і амінополіпептидаза).
21. Переварювання білків у шлунку
Шлунковий сік – продукт декількох типів клітин.Обкладаючі (парієтальні) клітини стінок шлунку
утворюють соляну (хлоридну) кислоту, головні
клітини секретують пепсиноген. Додаткові та інші
клітини епітелію шлунку виділяють мукоїдний
секрет. Парієтальні клітини секретують в
порожнину шлунку також глікопротеїн, який
називають «внутрішнім фактором» (фактором
Касла). Цей білок зв'язує «зовнішній фактор» –
вітамін В12, запобігає його руйнуванню і сприяє
всмоктуванню.
22. Роль НСl у травленні
Під дією НСl відбувається денатурація білківкорму, які не підлягали термічній обробці,
що підвищує доступність пептидних
зв'язків для протеаз. НСl має бактерицидну
дію і запобігає потраплянню патогенних
бактерій в кишечник. Окрім того, хлоридна
кислота активує пепсиноген і створює
оптимум рН для дії пепсину.
23.
24. Механізм активації пепсину
При дії гастринів у головних клітинах шлунковихзалоз стимулюються синтез і секреція пепсиногену
− неактивної форми пепсину.
Пепсиноген − білок, який складається з одного
поліпептидного ланцюга з молекулярною масою
40 кД. При дії НСl він перетворюється в активний
пепсин (молекулярна маса 32,7 кД) з оптимумом
рН 1,0−2,5. В процесі активації в результаті
часткового протеолізу від N-кінця молекули
пепсиногену відщеплюються 42 амінокислотних
залишки, що містять майже всі позитивно
заряджені амінокислоти, які є в пепсиногені.
25. Особливості травлення білків у шлунку молодих тварин
У молочний період згодовування тварин в сичузі(шлунку) знаходиться фермент ренін (хімозин),
який викликає згортання молока. Основний білок
молока − казеїн. Ренін каталізує відщеплення від
казеїну глікопептиду, в результаті чого
утворюється параказеїн. Параказеїн приєднує іони
Са2+, утворюючи нерозчинний згусток, і цим
самим запобігає швидкому виведенню молока зі
шлунку. Білки встигають розщепитися під дією
пепсину. В шлунку дорослих тварин ренін
відсутній, молоко у них зтворожується під дією
НСl і пепсину.
26. Механізм дії пепсину
Білки раціону + НОН → високомолекулярніполіпептиди
Пепсин гідролізує внутрішні пептидні зв'язки, в
утворенні яких приймають участь аміногрупи
ароматичних амінокислот, а також зв'язки АлаАла, Ала-Сер і деякі інші.
27. Активація панкреатичних ферментів
Упідшлунковій
залозі
синтезуються
проферменти ряду протеаз: трипсиноген,
хімотрипсиноген, проеластаза, прокарбоксипептидази А і В.
В кишечнику вони шляхом часткового
протеолізу
перетворюються
в
активні
ферменти трипсин, хімотрипсин, еластазу і
карбоксипептидази А і В.
28.
Активація трипсиногену відбувається під дієюферменту епітелію кишечнику ентеропептидази
(ентерокінази):
Ентеропептидаза
Трипсиноген + НОН
→
Трипсин + гексапептид
(активна форма)
- Механізм дії:
Високомолекулярні поліпептиди + НОН →
(білки, що не перетравилися пепсином)
→ поліпептиди + олігопептиди + дипептиди +
+ вільні амінокислоти
Трипсин діє на пептидні зв'язки, в утворенні яких
приймають участь карбоксильні групи аргініну або
лізину.
29. Активація хімотрипсиногену
Трипсин, що утворився, активує хімотрипсиноген:трипсин
Хімотрипсиноген + НОН → Хімотрипсин
(неактивна форма)
(активна форма)
- Механізм дії:
хімотрипсин
Поліпептиди + НОН → низькомол. поліпептиди +
+ вільні амінокислоти
Хімотрипсин діє на пептидні зв'язки, в утворенні яких
приймають участь карбоксильні групи тирозину,
фенілаланіну, триптофану і метіоніну.
30.
Інші проферменти панкреатичних протеаз(проеластаза і прокарбоксипептидази А і
В) також активуються трипсином
шляхом часткового протеолізу. В
результаті утворюються активні
ферменти — еластаза і
карбоксипептидази А і В.
31. Специфічність дії протеаз
Карбоксипептидази А и В − цинквмісні ферменти,які відщеплюють С-кінцеві залишки амінокислот.
Причому карбоксипептидаза А відщеплює
переважно амінокислоти, що містять ароматичні
або гідрофобні радикали, а карбоксипептидаза В −
залишки аргініну і лізину.
Останній етап перетравлення − гідроліз невеликих
пептидів, відбувається під дією ферментів
амінопептидаз і дипептидаз, які синтезуються
клітинами тонкого кишечника в активній формі.
32. Місця дії протеаз
Амінопептидази послідовно відщеплюють N-кінцевіамінокислоти пептидного ланцюгу. Найбільш відома
лейцинамінопептидаза − Zn2+ - або Мn2+ - вмісний
фермент, не дивлячись на назву, він має широку
специфічність по відношенню до N-кінцевих
амінокислот.
Дипептидази
розщеплюють
дипептиди
на
амінокислоти, але не діють на трипептиди.
В результаті послідовної дії всіх травних протеаз
більшість харчових білків розпадаються до вільних
амінокислот.
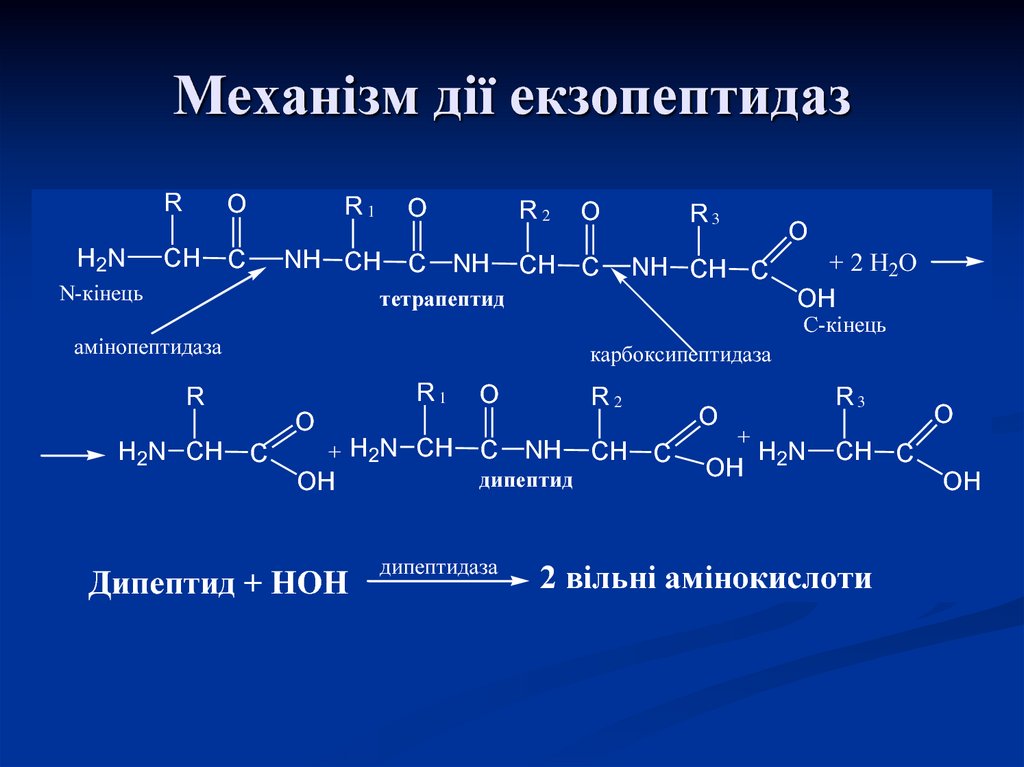
33. Механізм дії екзопептидаз
RH2N
O
CH
R1
C
O
NH CH
N-кінець
C
R2
NH
O
CH C
R3
O
NH CH C
тетрапептид
С-кінець
амінопептидаза
карбоксипептидаза
R1
O
+ H2N CH
C
R
R2
O
H2N CH
+ 2 Н2О
OH
C
OH
Дипептид + НОН
NH
дипептид
дипептидаза
CH C
O
R3
+
OH
H2N
O
CH C
2 вільні амінокислоти
OH
34.
Білок яйця та білки молока, звільнені віджиру, переварюються на 100%
М'ясо – 92-98 %
Рослинні білки – 65 %
Колагенові та еластинові волокна
переварюються погано
35. Захист клітин від дії протеаз
Клітини підшлункової залози захищені від діїтравних ферментів тим, що:
ці ферменти утворюються у вигляді неактивних
попередників в клітинах підшлункової залози та
активуються тільки після секреції в просвіт
кишечнику. Таким чином, місце синтезу і місце
дії цих ферментів просторово розділені.
в клітинах підшлункової залози є білок-інгібітор
трипсину, який утворює з активною формою
ферменту (у випадку передчасної активації)
міцний комплекс.
36.
У порожнині шлунку і кишечнику протеазине контактують з білками клітин, оскільки
слизова оболонка вкрита шаром слизу, а
кожна клітина містить на зовнішній
поверхні
плазматичної
мембрани
полісахариди, які не розщеплюються
протеазами і цим захищають клітину від їх
дії.
Руйнування клітинних білків протеазами
відбувається при виразковій хворобі
шлунку або дванадцятипалої кишки. Але
початкові механізми виникнення виразки
ще мало вивчені.
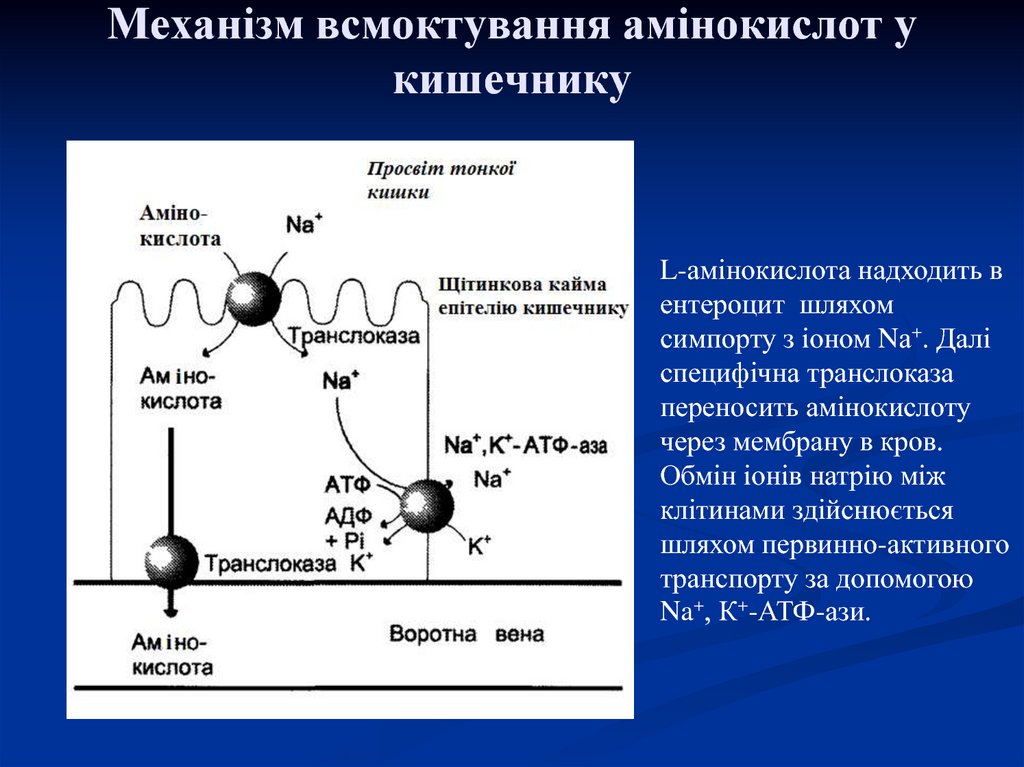
37. Механізм всмоктування амінокислот у кишечнику
L-амінокислота надходить вентероцит шляхом
симпорту з іоном Nа+. Далі
специфічна транслоказа
переносить амінокислоту
через мембрану в кров.
Обмін іонів натрію між
клітинами здійснюється
шляхом первинно-активного
транспорту за допомогою
Na+, К+-АТФ-ази.
38. Перенесення амінокислот
На сьогодні відомо принаймні п'ять специфічнихтранспортних систем, кожна з яких функціонує для
перенесення певної групи близьких за будовою
амінокислот:
нейтральних, з коротким бічним ланцюгом (аланін, серин,
треонін);
нейтральних, з довгим або розгалуженим боковим
ланцюгом (валін, лейцин, ізолейцин);
з катіонними радикалами (лізин, аргінін);
з
аніонними
радикалами
(глутамінова
і
аспарагінова кислоти);
імінокислот (пролін, оксипролін).
39. Гниття білків у товстому відділі кишечнику
БІЛКИ+НОН
гнилісні
бактерії
АМІНОКИСЛОТИ
гнилісні
бактерії
ОТРУЙНІ РЕЧОВИНИ
амоніак, сірководень, путресцин, кадаверин, фенол, крезол,
індол, скатол, ін.речовини
40. Перетравлення білків у жуйних
Білкиїжі
бактерії
амінокислоти
бактеріальний білок
Сечовина
Амонійні солі
Нітрати
NH3
сичуг
кишечник
бактерії
карбонові кислоти
амінокислоти
в кров
41.
Стінка рубця не синтезує ферменти, які можутьрозщеплювати білки.
В 1 мл рубцевого вмісту міститься 80 тис. – 2 млн.
інфузорій і 15-20 млрд. бактерій. Інфузорії
живляться АК і бактеріями.
Вільні АК використовуються бактеріями та
інфузоріями для синтезу білків власного тіла у
відповідності до їх генетичного коду. В процесі
синтезу білка інфузорії і бактерії розмножуються,
потрапляють до книжки, а потім в сичуг, де
піддаються дії HCl і перетравлюються як прості
білки.
42.
За добу покоління інфузорій змінюється 4-6 разів.Ті АК, які не були використані для синтезу
білків, підлягають дезамінуванню (молекулярне,
відновлювальне, міжмолекулярне). Вільний
амоніак, що утворився в результаті цих реакцій,
бактерії використовують для синтезу АК в
реакціях відновлювального амінування
кетокислот.
Кінцевий продукт обміну білків – сечовина
використовується для синтезу бактеріальних АК.








































 biology
biology








