Similar presentations:
Модель строения атома
1. Модель строения атома
МОДЕЛЬ СТРОЕНИЯАТОМА
УЧИТЕЛЬ: СВЕТЛАНА АВДЕЕВА
2.
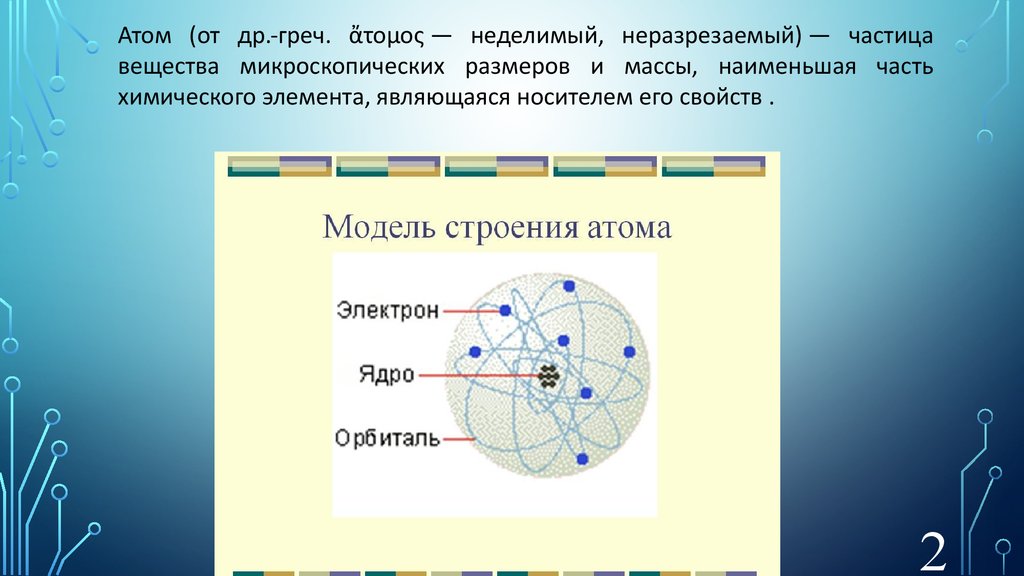
Атом (от др.-греч. ἄτομος — неделимый, неразрезаемый) — частицавещества микроскопических размеров и массы, наименьшая часть
химического элемента, являющаяся носителем его свойств .
2
3.
34. Модели строения атома
МОДЕЛИ СТРОЕНИЯ АТОМА5.
56.
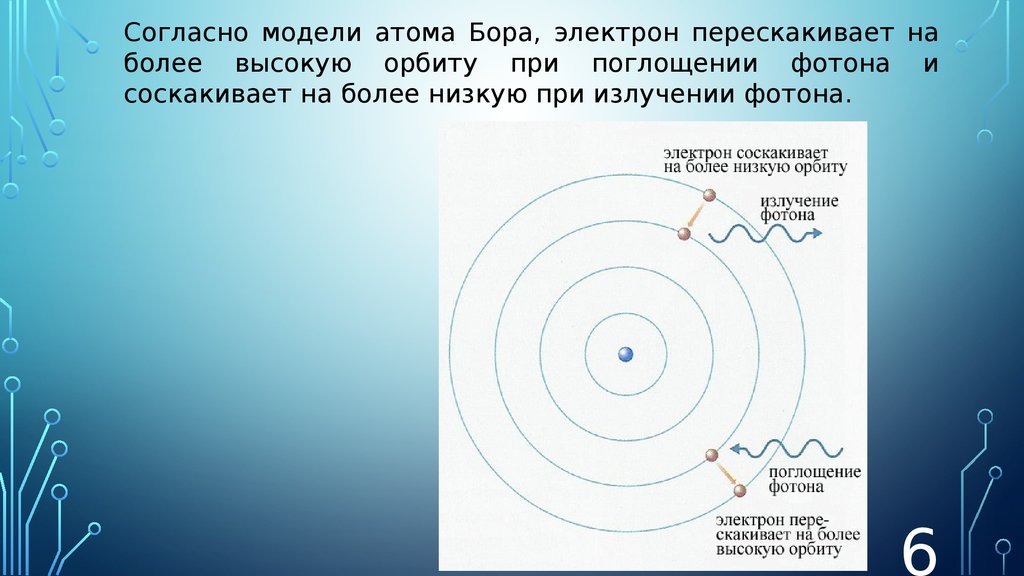
Согласно модели атома Бора, электрон перескакивает наболее высокую орбиту при поглощении фотона и
соскакивает на более низкую при излучении фотона.
6
7.
78. Электронное строение атома
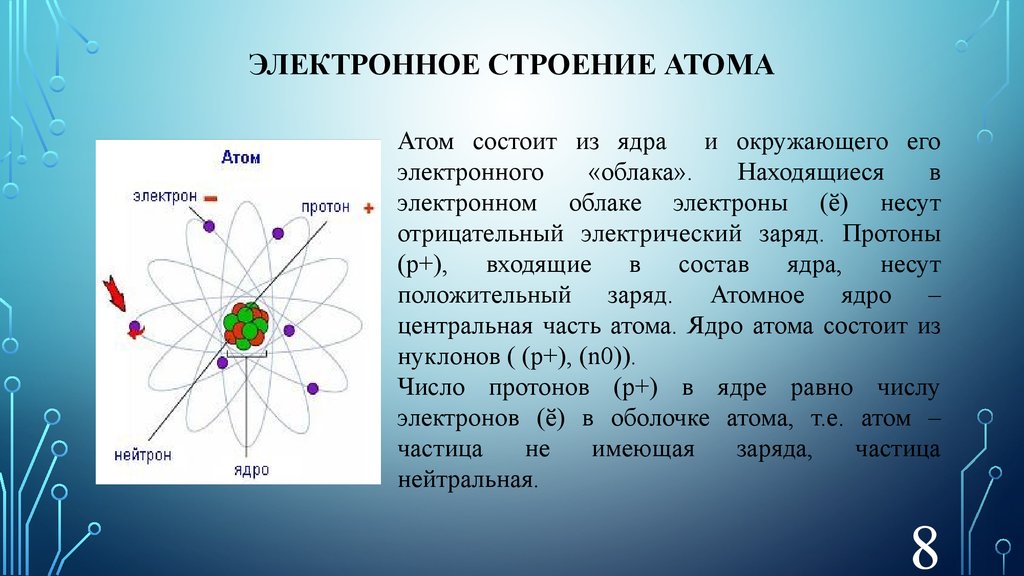
ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМААтом состоит из ядра и окружающего его
электронного
«облака».
Находящиеся
в
электронном облаке электроны (ӗ) несут
отрицательный электрический заряд. Протоны
(p+), входящие в состав ядра, несут
положительный заряд. Атомное ядро –
центральная часть атома. Ядро атома состоит из
нуклонов ( (p+), (n0)).
Число протонов (p+) в ядре равно числу
электронов (ӗ) в оболочке атома, т.е. атом –
частица
не
имеющая
заряда,
частица
нейтральная.
8
9.
Электронная оболочка атома представляет собой сложную систему. Онаделится на энергетические уровни.
Уровни
подразделяются
на
подуровни (на первом уровне – 1
подуровень, на втором уровне – 2
подуровня, на третьем уровне – 3
подуровня, на четвертом уровне – 4
подуровня).
На каждом подуровне расположены
атомные
орбитали
(отмечены
квадратом).
Oрбитали – место «проживания» электрона.
Орбитали обозначаются буквами s, p, d, f.
9
10. Электронные конфигурации атомов:
ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ:10
11. Заполнение атомных орбиталей:
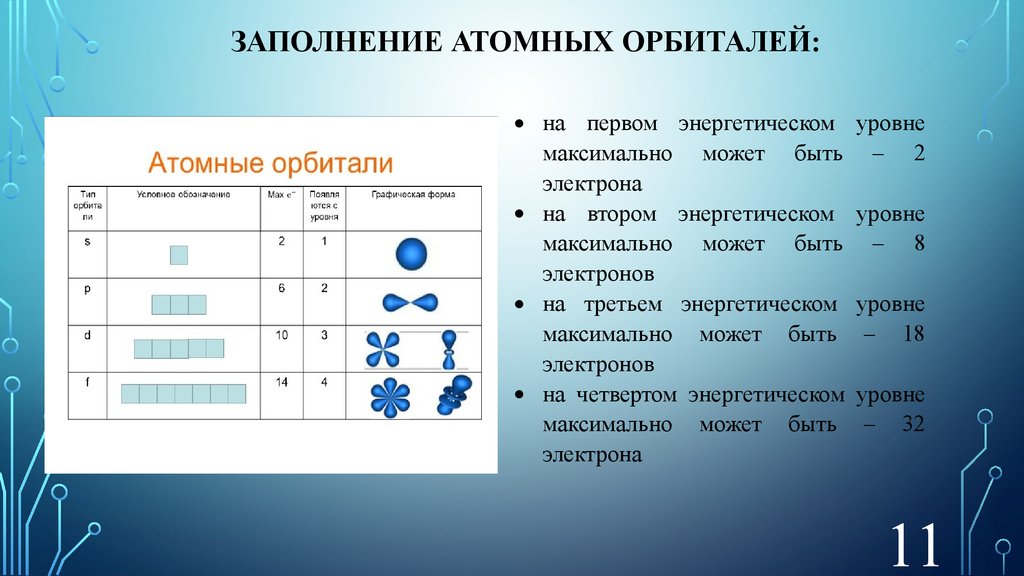
ЗАПОЛНЕНИЕ АТОМНЫХ ОРБИТАЛЕЙ:на первом энергетическом
максимально может быть
электрона
на втором энергетическом
максимально может быть
электронов
на третьем энергетическом
максимально может быть
электронов
на четвертом энергетическом
максимально может быть
электрона
уровне
– 2
уровне
– 8
уровне
– 18
уровне
– 32
11
12.
Номер периода равен числуэнергетических уровней.
У элементов А групп число
электронов на последнем уровне
равно номеру группы.
У элементов В групп число
электронов на последнем уровне
равно двум.
12
13. Пример:
ПРИМЕР:13
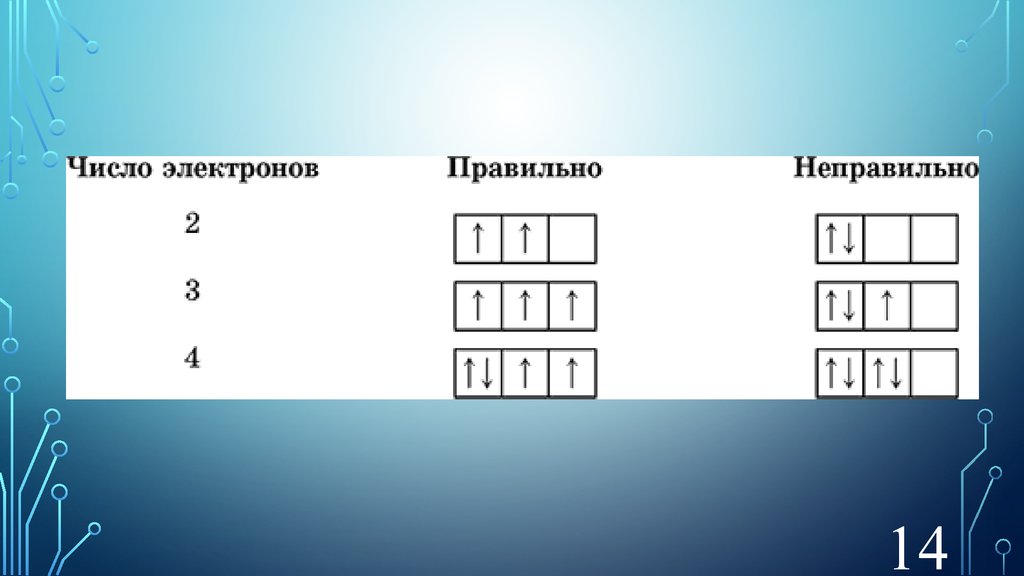
14.
1415.
заполнение лектронных орбиталей азота15











 physics
physics








