Similar presentations:
Вугдеводи. Моносахариди
1.
Лекція 12Вугдеводи. Моносахариди.
2.
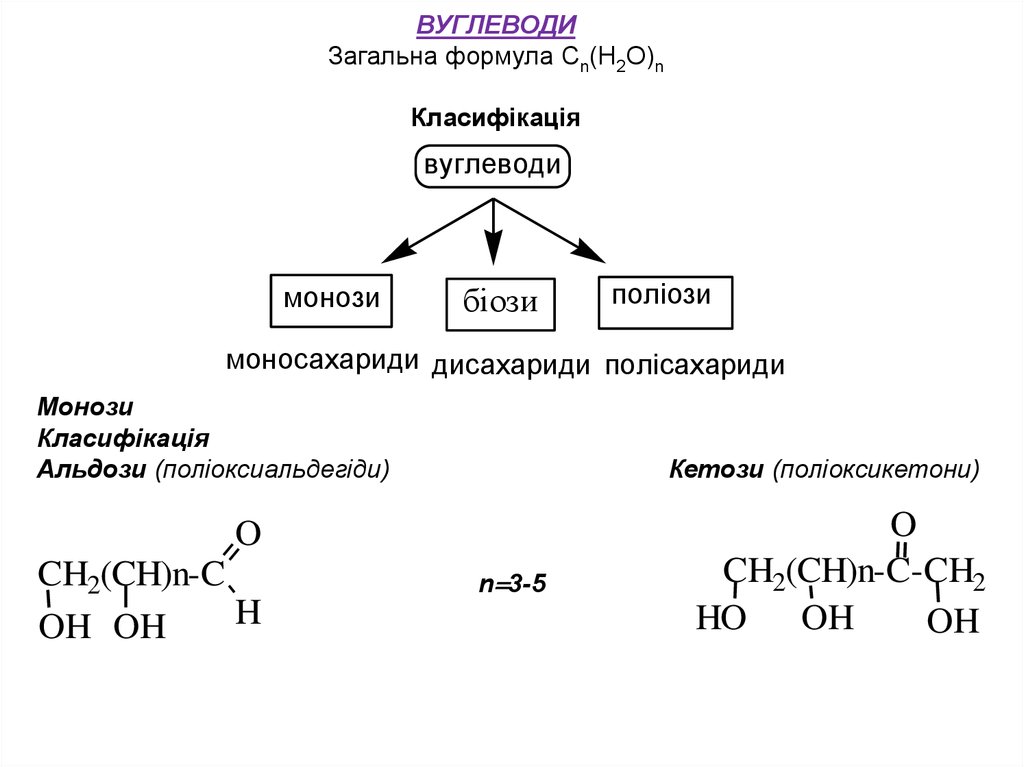
ВУГЛЕВОДИЗагальна формула Сn(H2O)n
Класифікація
вуглеводи
монози
біози
поліози
моносахариди дисахариди полісахариди
Монози
Класифікація
Альдози (поліоксиальдегіди)
Кетози (поліоксикетони)
O
CH2(CH)n-C
H
OH OH
n 3-5
O
CH2(CH)n-C-CH2
HO OH
OH
3.
За числом атомів вуглецю альдози і кетози діляться на триози (триатоми вуглецю), тетрози (чотири атоми вуглецю), пентози (п’ять атомів
вуглецю), гексози (шість атомів вуглецю) і гептози (сім атомів вуглецю).
Альдози, що мають п’ять атомів вуглецю називають альдопентозами,
шість атомів вуглецю – альдогексозами, сім атомів вуглецю –
альдогептозами.
Кетози,
відповідно
можуть
бути
кетопентозами,
кетогексозами і кетогептозами. В природі найбільше поширені гексози, далі
йдуть пентози і гептози.
Монози існують у двох формах – лінійній (або оксоформі) і
циклічній. Для опису їх будови зручно використовувати проекції Фішера (для
лінійної форми і проекції Хеуорса (для циклічної форми).
Термін "вуглеводи" (запропонований у 1844 р. К. Шмідтом) виник тому, що відомі
на той час представники цих речовин за складом можна розглядати як сполуки
вуглецю ("вугілля") з водою nС + mH2O, наприклад:
В подальшому, з розвитком вчення про хімічну будову, назва "вуглеводи"
втратила свій початковий зміст. Так як оцтова кислота відповідно з таким
визначенням є вуглевод: СН3СООН = С2(Н2О)2, а ряд вуглеводів взагалі не
відповідає указаному складу, наприклад: дезоксигексоза (С6Н12О5).
4.
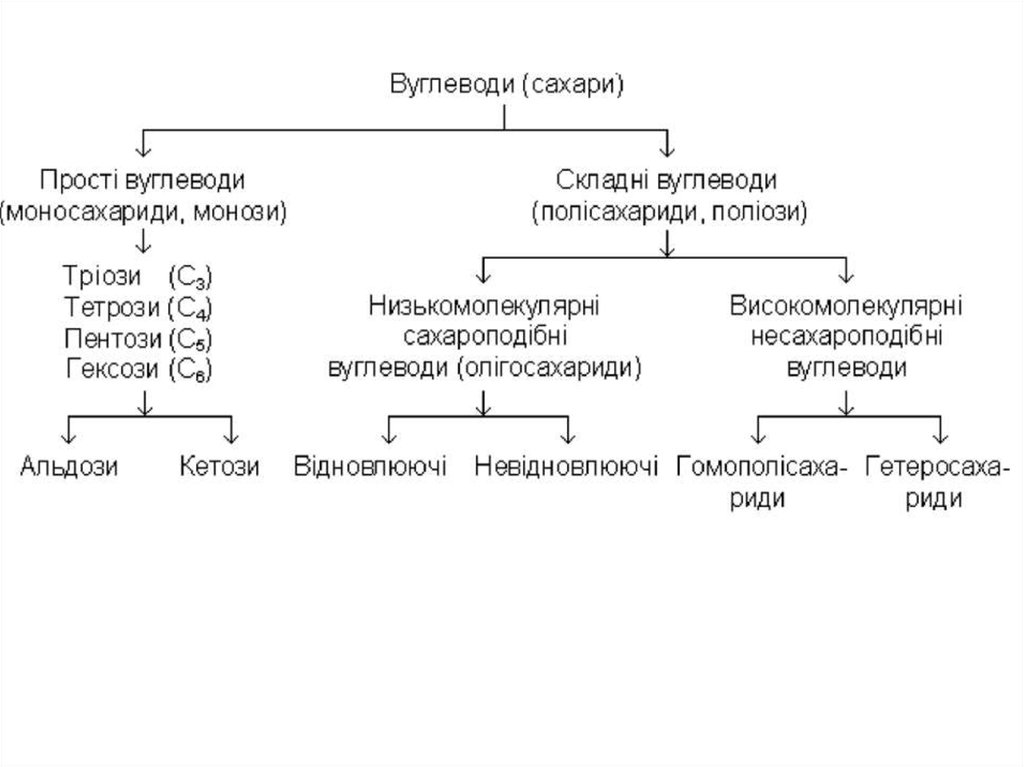
Низькомолекулярні (сахароподібні) полісахариди містять в молекулі невелике число залишків моноз (2-10). Вони добре розчиняються у воді, мають солодкий смак і яскраво виражену кристалічну будову. Одні з них (мальтоза,лактоза) відновлюють іони міді (ІІ) (фелінгову рідину), вони називаються
відновлюючими. Інші (сахароза, трегалоза) не відновлюють і тому їх відносять
до невідновлюючих олігосахаридів.
Високомолекулярні (несахароподібні) полісахариди містять від десятків
до декількох десятків тисяч залишків моноз; вони нерозчинні у воді, без смаку і
не мають яскраво вираженої кристалічної будови.
В залежності від складу складні вуглеводи (полісахариди) можна розділити
на 2 групи:
а)
гомополісахариди, складаються із залишків одного і того ж
моносахариду;
б) гетерополісахариди, складаються із залишків різних моносахаридів.
Викладене вище можна подати у вигляді такої схеми:
5.
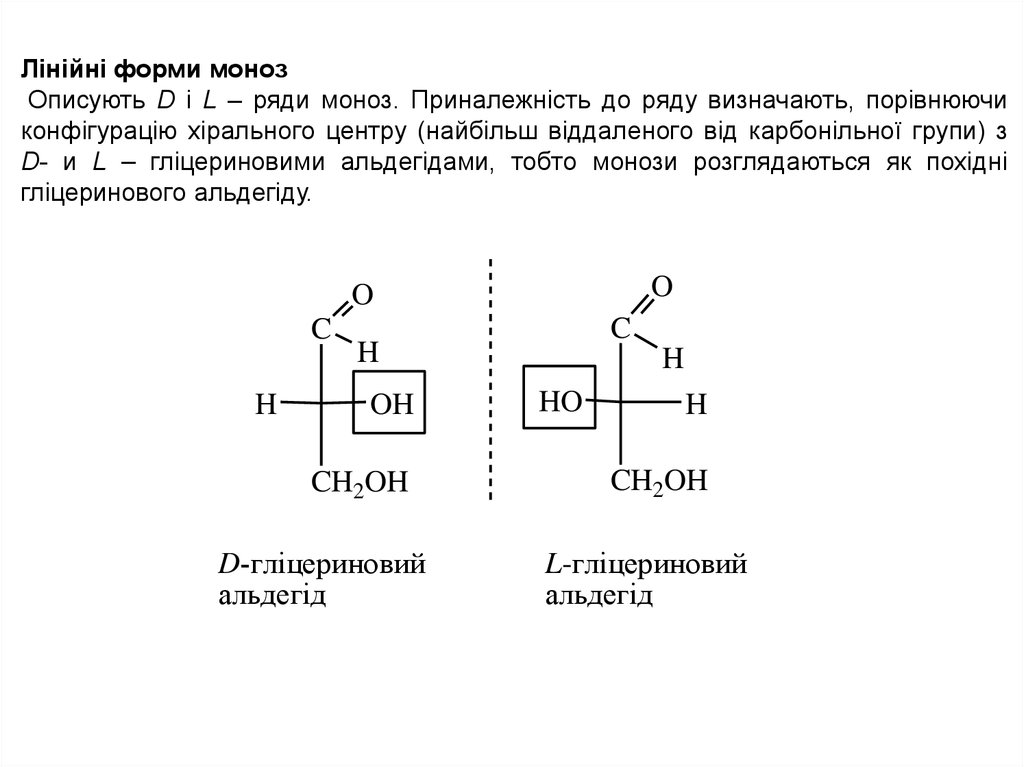
Лінійні форми монозОписують D і L – ряди моноз. Приналежність до ряду визначають, порівнюючи
конфігурацію хірального центру (найбільш віддаленого від карбонільної групи) з
D- и L – гліцериновими альдегідами, тобто монози розглядаються як похідні
гліцеринового альдегіду.
O
O
C
H
C
H
OH
CH2OH
D-глiцериновий
альдегiд
H
HO
H
CH2OH
L-глiцериновий
альдегiд
6.
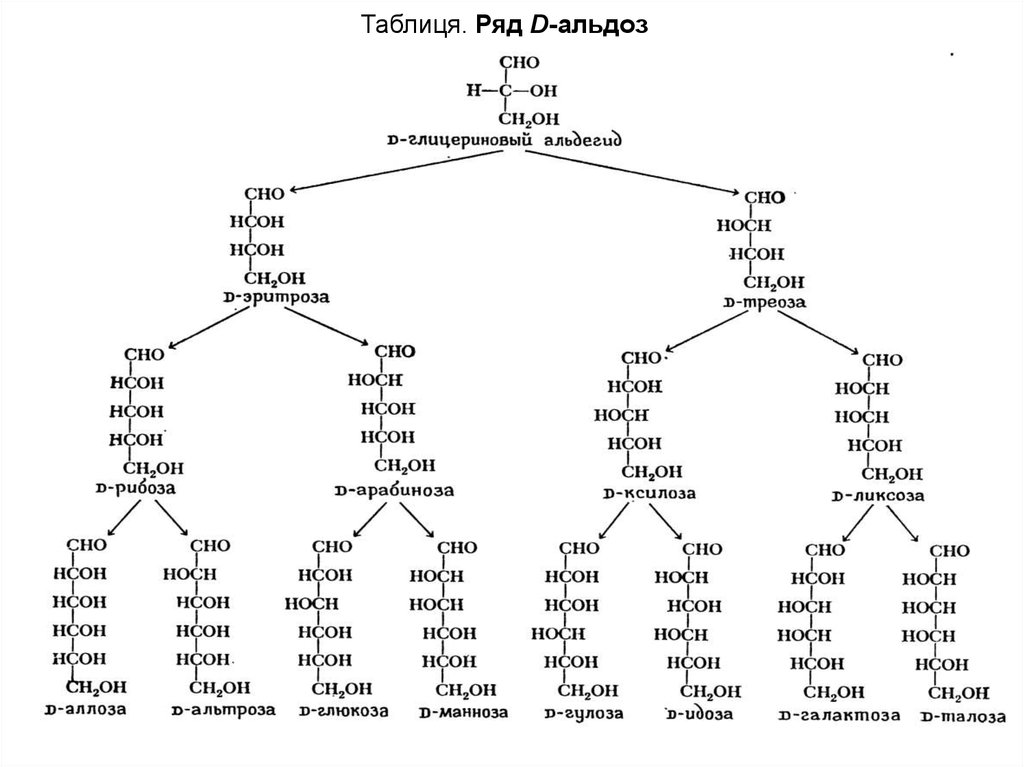
Таблиця. Ряд D-альдоз7.
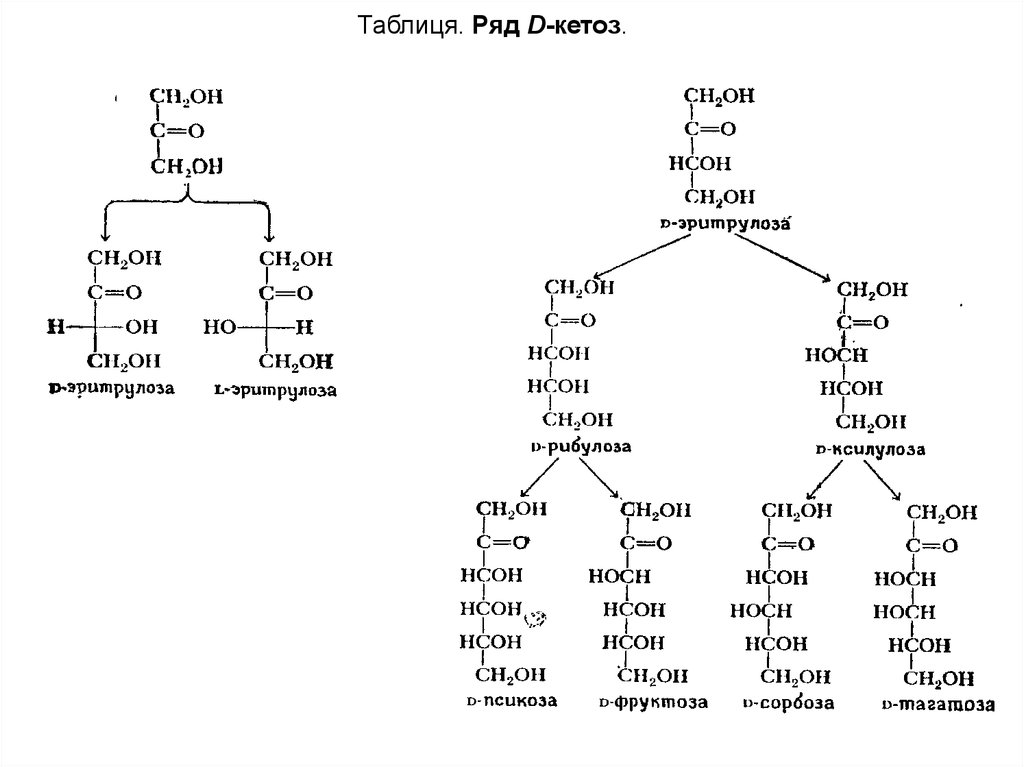
Таблиця. Ряд D-кетоз.8.
Окремі моносахариди звичайно мають тривіальні назви з суфіксом-оза, наприклад, глюкоза, маноза, фруктоза, рибоза. Відповідно до
пропозиції IUPAC, назву моносахаридів часто скорочують до перших трьох
літер їх тривіальної назви, наприклад, маноза позначається як Мan,
фруктоза - Fru, рибоза - Rib. Виняток робиться для глюкози, яку в
міжнародній літературі позначають СІс.
Моносахариди, які мають альдегідну групу, позначають префіксом альдо-, а
сполуки з кетогрупою мають префікс кето-. За цією системою гліцериновий
альдегід (2,3-діоксипропаналь) носить назву альдотриози, а 1,3діоксиацетон (1,3-ді-оксипропанон-2) називається кетотриозою. Глюкоза,
як представник альдегідо-сахарів з шістьма атомами кисню належить до
групи альдогексоз.
Будова альдогексоз
Загальна формула
6
5 4 3 2 1
O
CH2-CH-CH-CH-CH-C
H
OH OH OH OH OH
Чотири асиметричних атоми вуглецю
С*, 24=16 стереоізомерів, 8 D,L пар
(звідси 8 енантіомерних пар в таблиці
альдогексоз). Найбільше поширеною в
природі є D-глюкоза.
9.
OO
1C
H
2
1C
H
OH
HO
H
2
1C
H
H
3
3
H
HO
H
4
5
H
OH
HO
OH
HO
OH
4
5
O
O
H
H
6 CH2OH
6 CH2OH
D-глюкоза
L-глюкоза
2
HO
H
H
H
4
H
5
H
6
2
H
H
OH
3
3
HO
1C
HO
H
4
OH
HO
OH
H
CH2OH
D-маноза
H
5
OH
6 CH2OH
D-галактоза
асиметричний атом вуглецю, за яким визначають приналежність до D- або L-ряду.
Крім
D-глюкози,щов здатні
природі
часто зустрічаються
D-маноза
і DДіастереомери,
до найбільш
взаємного перетворення,
називаються
епімерами.
галактоза,
котрі є діастереомерами
Епімери відрізняються
конфігурацієюD-глюкози.
другого асиметричного атома вуглецю, тобто
як бачимо, D-глюкоза
и D-маноза – (від
епімери.
Діастереомери,
діастереоізомери
грец. diá — через, між, stereós —
просторовий, об'ємний і ізомери), просторові ізомери з декількома асиметричними
центрами, в яких конфігурація частини асиметричних атомів збігається, а
частини — протилежна. На відміну від антиподів оптичних, в яких конфігурація
всіх асиметричних центрів відповідно протилежна і які відрізняються один від
одного лише знаком оптичного обертання при повному збігу всіх ін.
властивостей, Д. відрізняються не лише кутом оптичного обертання, але і
іншими фізичними властивостями, наприклад температурами плавлення,
розчинністю. Вони відрізняються також деякими хімічними властивостями
(швидкостями реакцій).
10.
Циклічні форми альдогексозПоліоксиальдегіди (поліоксикетони), що містять 5,6 і 7 атомів вуглецю здатні
до внутрішньомолекулярної циклізації. Циклізація відбувається за рахунок
взаємодії карбонільної і однієї із доступних для циклізації гідроксильних груп,
при цьому отримуємо п’яти-, шести- та семичленні циклічні напівацеталі.
-
+ O
+
R-C
H
R,R1 - алкiли
+
H
-
OR1
H+
OH
R-CH-OR1 напівацеталь
*
Спочатку розглянемо як відбувається циклізація виходячи із проекцій Фішера.
Карбонільна група плоска, відповідно можливі два варіанти атаки гідроксильної
групи, при цьому виникає новий хіральний центр і утворюється пара просторових
ізомерів (пари енантіомерів, оптичних антиподів). Ці стереоізомери позначають
як α- і β-форми. Гідроксо-групу при аномерному атомі вуглецю на відміну від
інших спиртових груп називають глікозидною гідроксильною групою. В
фішеровських проекціях в D-ряді глікозидний гідроксил α-форми розміщують
праворуч, а в β-формі - ліворуч. Для сахарів L-ряду використовують зворотне
правило. У -аномера глікозидний гідроксил и гідроксил у С5, що брав участь в
утворенні циклічної форми, міститься в цис-, а у -аномера – в трансположеннях.
11.
HH
HO
+
1C
H
HO
2
3
-
H
O
H
H
H
2
OH
OH
3
H
4
O
OH
-аномер
5
CH2OH
H
OH
5
C
6
OH
4
H
1 *
глiкозидний
гiдроксил
O
-
6 CH OH
2
D-глюкоза
HO
H
+
глiкозидний
гiдроксил
H
HO
H
H
1 *
C
2
3
4
H
OH
H
OH
5
6
CH2OH
O
-аномер
12.
Діастереомерні циклічні напівацеталі можуть через проміжне утворенняоксоформи перетворюватися одна в одну:
Порівняно з проекційними формулами краще уявлення про конфігурацію
напівацетальних циклічних форм моносахаридів можна дати за допомогою
циклічних формул за Хеуорсом (1929 р.):
13.
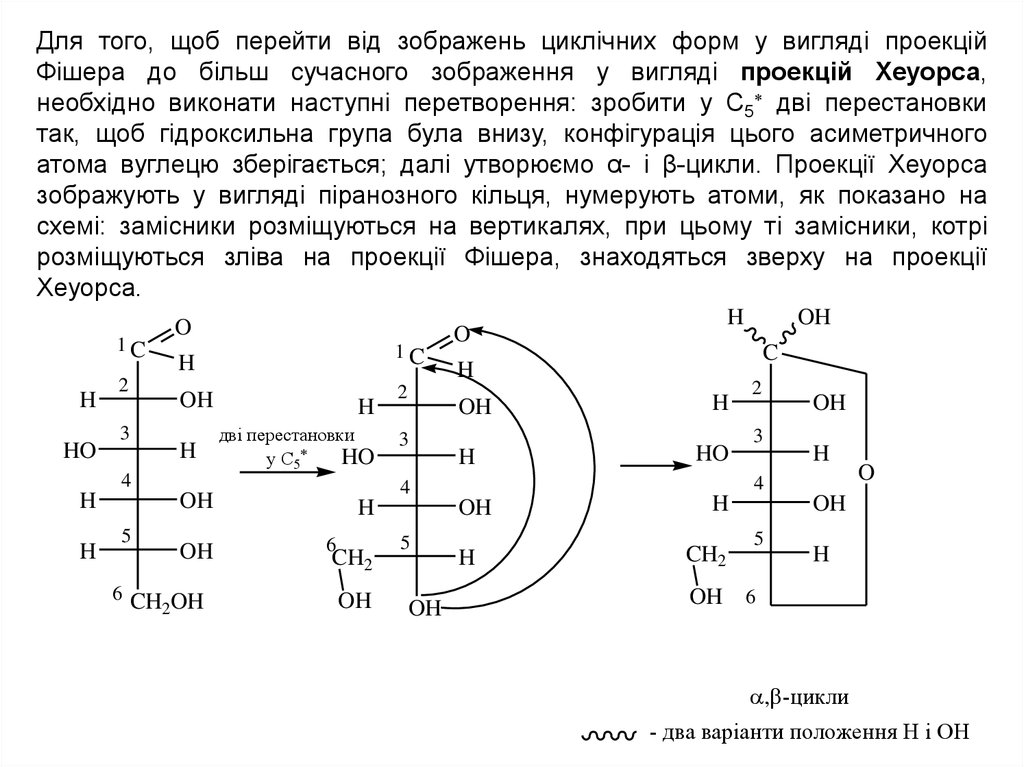
Для того, щоб перейти від зображень циклічних форм у вигляді проекційФішера до більш сучасного зображення у вигляді проекцій Хеуорса,
необхідно виконати наступні перетворення: зробити у С5 дві перестановки
так, щоб гідроксильна група була внизу, конфігурація цього асиметричного
атома вуглецю зберігається; далі утворюємо α- і β-цикли. Проекції Хеуорса
зображують у вигляді піранозного кільця, нумерують атоми, як показано на
схемі: замісники розміщуються на вертикалях, при цьому ті замісники, котрі
розміщуються зліва на проекції Фішера, знаходяться зверху на проекції
Хеуорса.
1C
H
HO
2
3
O
1C
H
OH
H
H
двi перестановки
HO
у С5
4
H
H
OH
6 CH OH
2
OH
3
H
H
6
CH2
OH
OH
H
HO
2
3
OH
H
4
OH
5
OH
C
H
4
OH
5
2
H
O
H
H
CH2
O
OH
5
H
OH 6
, -цикли
- два варiанти положення Н i ОН
14.
HOH
C
H
HO
2
3
OH
6
CH2
HO
O
OH
5
перехiд до
H
4
H
6
H
Хеуорса
CH2OH
O H
H H
4
1
OH H
OH
OH
2
3
H
OH
H H
5
O
4Н-тетрагiдропiран
напівацетальный ОН
-D-глюкопiраноза
зверху в проекції
Хеуорса
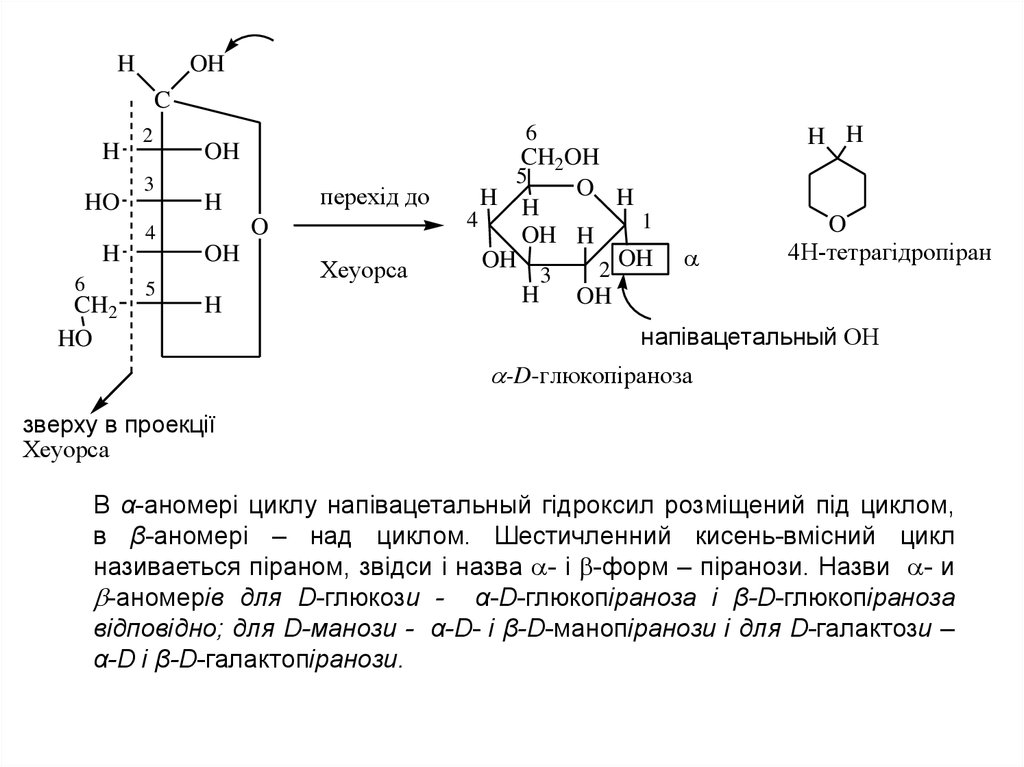
В α-аномері циклу напівацетальный гідроксил розміщений під циклом,
в β-аномері – над циклом. Шестичленний кисень-вмісний цикл
називаеться піраном, звідси і назва - і -форм – піранози. Назви - и
-аномерів для D-глюкози - α-D-глюкопіраноза і β-D-глюкопіраноза
відповідно; для D-манози - α-D- і β-D-манопіранози і для D-галактози –
α-D і β-D-галактопіранози.
15.
O1C
HO
HO
H
H
2
3
H
O
1C
двi перестановки
біля С4
1C
H
H
2
HO
OH
H
HO
2
H
В α-аномері циклу напівацетальный
гідроксил розміщений під
3
4
O
3
циклiзацiя
HO
H
H
OH
H
HO
циклом,
в β-аномері
– над циклом.
Шестичленний
кисень-вмісний
цикл
6
H5 4
6 5 H Назви
5
4
називаеться
піраном,
звідси
і
назва
- H
і -форм – піранози.
- и
H2C
H
OH
H2C
H
-аномерів для D-глюкози - α-D-глюкопіраноза і β-D-глюкопіраноза
CH2OH
OH OH
OH
OHD-галактози
OH
відповідно;
для D-манози - α-Dі β-D-манопіранози
і для
–
α-D і β-D-галактопіранози.
зверху в проекції
В природі поширені, головним чином, сполуки,
що мають
шестичленні цикли, бо найбільше термодинамічно стійкі.
Крім шестичленного можливе утворення пятичленного –
фуранозного циклу (фуран – пятичленный
кисень-вмісний цикл). При
6
6
HOH2C
цьому
в2Cциклизації бере участь гідроксил
при С*-4.
HOH
HO
5
4
H
O
HO
H
H
2
3
H
1
OH
OH
H
-D-манофураноза
HO
5
H
4 HO
H
OH
O
OH
1
2
H
3
H
H
-D-манофураноза
O
тетрагiдрофуран
16.
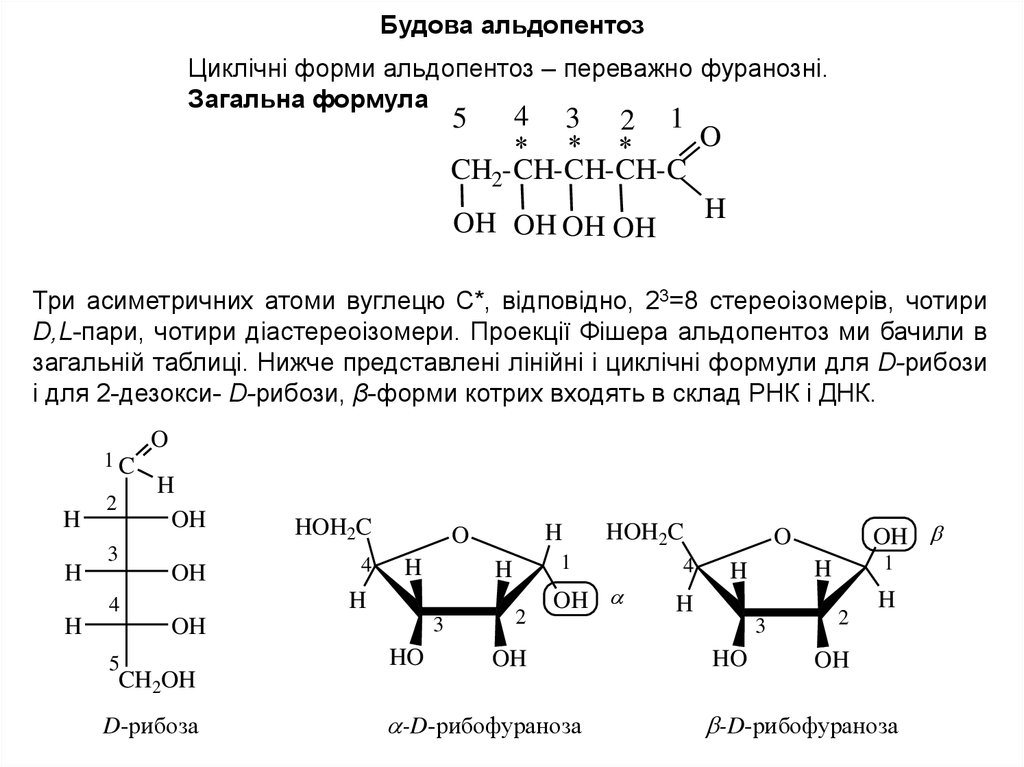
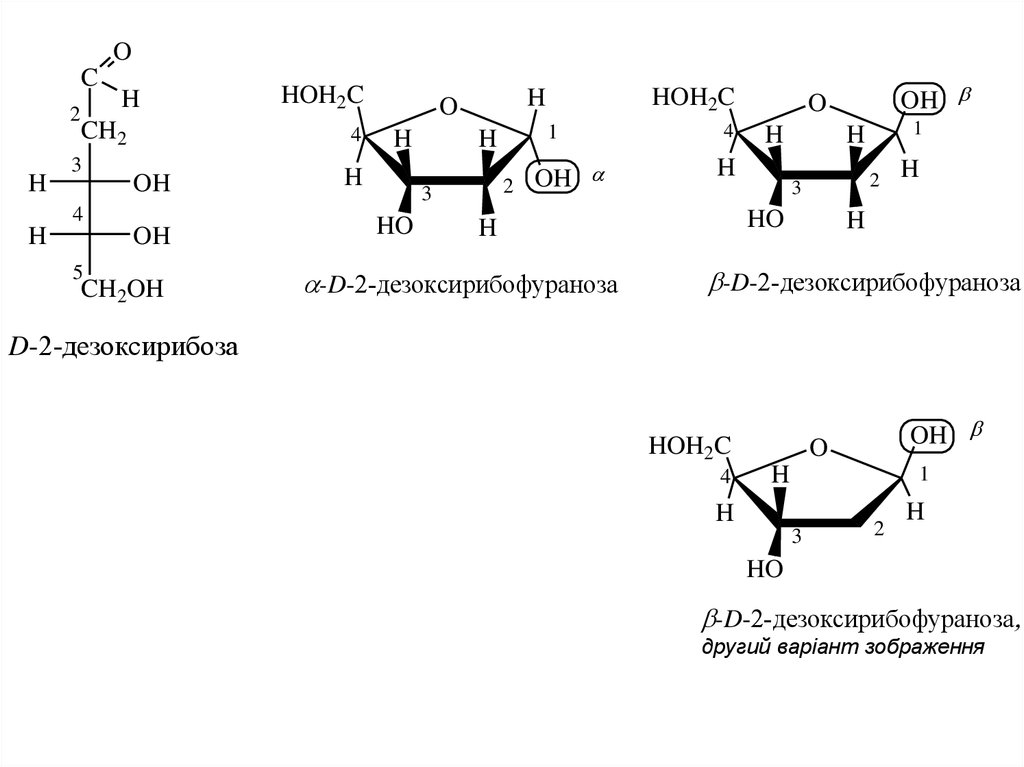
Будова альдопентозЦиклічні форми альдопентоз – переважно фуранозні.
Загальна формула
4 3 2 1
O
CH2-CH-CH-CH-C
H
OH OH OH OH
5
Три асиметричних атоми вуглецю С*, відповідно, 23=8 стереоізомерів, чотири
D,L-пари, чотири діастереоізомери. Проекції Фішера альдопентоз ми бачили в
загальній таблиці. Нижче представлені лінійні і циклічні формули для D-рибози
і для 2-дезокси- D-рибози, β-форми котрих входять в склад РНК і ДНК.
O
1C
H
H
2
3
H
OH
OH
4
H
O
H
3
OH
2
OH
5
HO
D-рибоза
-D-рибофураноза
CH2OH
HOH2C
1
H
H
4
H
HOH2C
OH
4
OH
O
H
3
HO
1
H
H
2
H
OH
-D-рибофураноза
17.
OC
2
H
H
CH2
3
4
OH
4
H
HOH2C
OH
5
CH2OH
H
H
1
H
2
3
HO
HOH2C
H
O
OH
4
-D-2-дезоксирибофураноза
H
H
1
H
2
3
HO
H
OH
O
H
H
-D-2-дезоксирибофураноза
D-2-дезоксирибоза
HOH2C
4
OH
O
H
1
H
3
2
H
HO
-D-2-дезоксирибофураноза
другий варіант зображення
18.
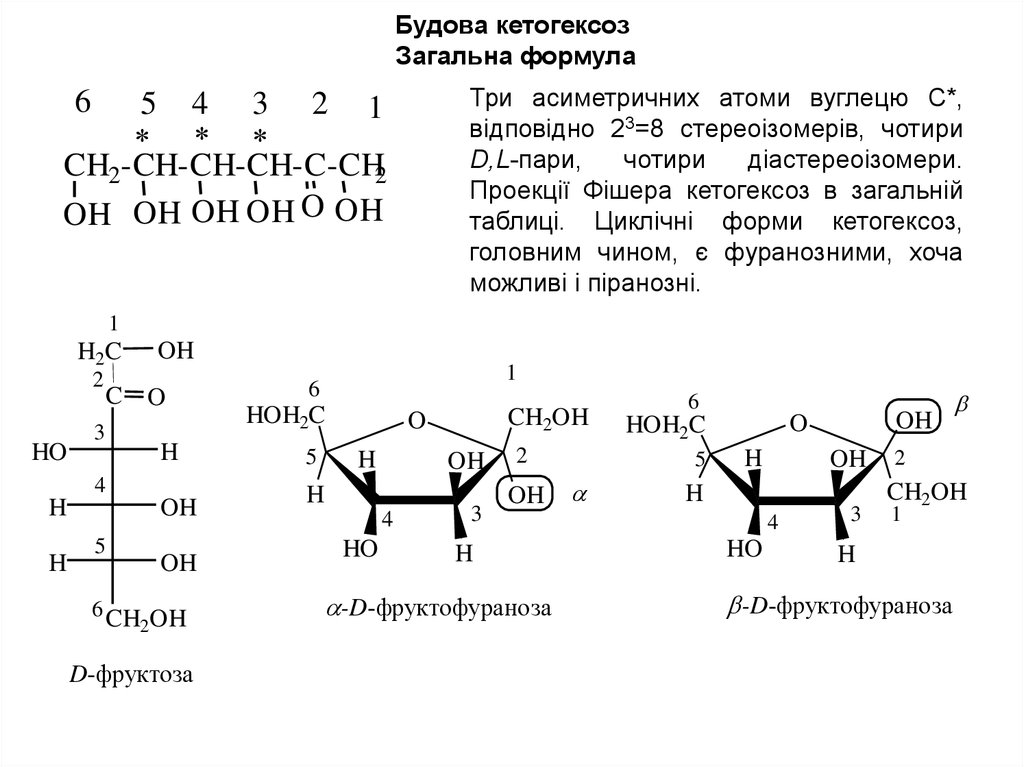
Будова кетогексозЗагальна формула
Три асиметричних атоми вуглецю С*,
відповідно 23=8 стереоізомерів, чотири
D,L-пари,
чотири
діастереоізомери.
Проекції Фішера кетогексоз в загальній
таблиці. Циклічні форми кетогексоз,
головним чином, є фуранозними, хоча
можливі і піранозні.
6
5 4 3 2 1
CH2-CH-CH-CH-C-CH2
OH OH OH OH O OH
1
H2C
2
HO
C
3
OH
O
H
4
H
H
OH
5
OH
6 CH OH
2
D-фруктоза
1
6
HOH2C
5
CH2OH
O
H
OH
H
4
HO
3
2
OH
H
-D-фруктофураноза
6
HOH2C
5
OH
O
H
OH
H
4
HO
3
2
CH2OH
1
H
-D-фруктофураноза
19.
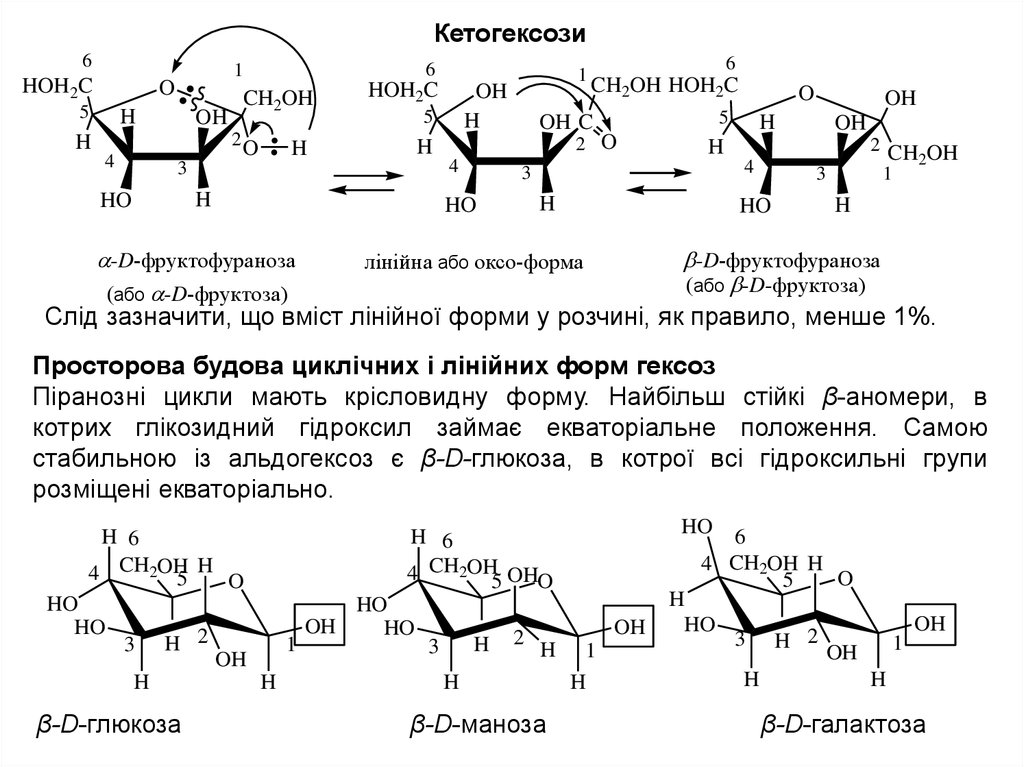
Цикло-ланцюгова таутомерія монозВсі монози в кристалічному стані мають циклічну будову (α-або β-). При
розчиненні у воді циклічний напівацеталь руйнується, перетворюючись на
лінійну форму. Лінійна форма, в свою чергу циклізуєтся, утворюючи α і β цикли. Лінійна форма і обидві циклічні взаємно перетворюються і знаходяться
в стані динамічної рівноваги, тобто є таутомерами, звідси термін - циклоланцюгова таутомерія (або аномеризація - перетворення α-або β-аномера
через лінійну (оксо) форму).
Альдогексози
6
6
6
CH2OH
CH2OH
5
O H
H
H
4
1
OH H
HO
H
2O
3
H
OH
O -
H
4
C 1
OH H + H
OH
-D-глюкопiраноза
(або -D-глюкоза)
лiнiйна або оксо-форма
H
- +
5
OH
3
2
H HO
CH2OH
O OH
H
H
4
1
OH H
H
OH
2
3
H
OH
5
-D-глюкопiраноза
àáî -D-глюкоза)
20.
Кетогексози6
HOH2C
O
5
H
CH2OH
OH
2
H
4
6
1
O
HOH2C
OH
H
5
O
5
OH
H
OH
2 CH OH
2
1
H
4
3
H
HO
-D-фруктофураноза
або -D-фруктоза)
CH2OH HOH2C
2 O
4
H
6
OH C
H
H
3
HO
1
3
H
HO
-D-фруктофураноза
або -D-фруктоза)
лiнiйна або оксо-форма
Слід зазначити, що вміст лінійної форми у розчині, як правило, менше 1%.
Просторова будова циклічних і лінійних форм гексоз
Піранозні цикли мають крісловидну форму. Найбільш стійкі β-аномери, в
котрих глікозидний гідроксил займає екваторіальне положення. Самою
стабильною із альдогексоз є β-D-глюкоза, в котрої всі гідроксильні групи
розміщені екваторіально.
H 6
H
4 CH2OH
5
O
HO
HO
3
H 2
H
β-D-глюкоза
HO
6
4 CH2OH H
O
5
H 6
4 CH2OH5 OHO
1
OH
H
HO
OH
HO
H
3
2
OH
H
H
β-D-маноза
1
H
H
HO
3
H
H 2
1
OH
OH
H
β-D-галактоза
21.
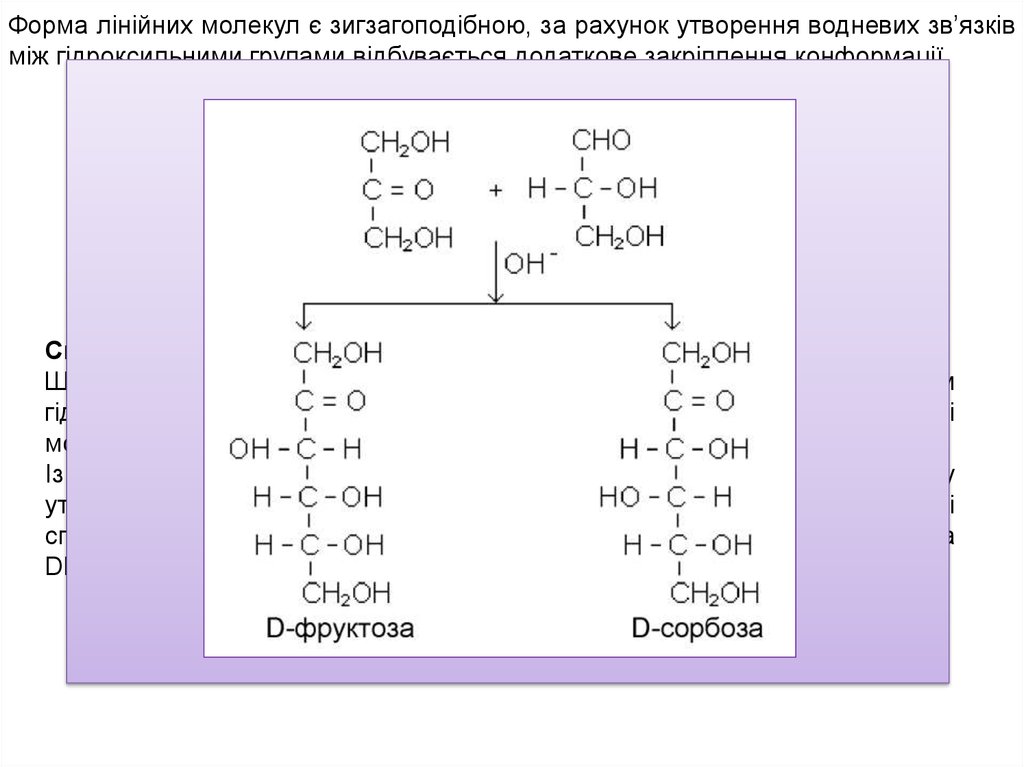
Форма лінійних молекул є зигзагоподібною, за рахунок утворення водневих зв’язківміж гідроксильними групами відбувається додаткове закріплення конформації.
OH
OH
5
HO 6
CH2
4
OH
3
2
1 O
C
H
OH
Синтез моносахаридів
Ще в 1861 році Бутлеров при взаємодії формальдегіду з водним розчином
гідроксиду кальцію отримав цукровий сироп. Вилучити індивідуальні
моносахариди з таких сумішей вперше вдалося в 1889 році Е.Фішеру.
Із формальдегіду через стадію утворення гліколевого альдегіду
утворюється суміш DL-гліцеринового альдегіду й 1,3-діоксіацетону. Ці
сполуки в лужному розчині реагують далі, утворюючи суміш DL-фруктози та
DL-сорбози:
22.
Реакційна здатністьДля хімічних властивостей моноз характерні дві групи реакцій – по карбонільній
групі і гідроксильним групам, причому лінійна оксо-форма переважно реагує за
участю карбонільної групи, а циклічні форми – за участю гідроксильних груп.
I. Реакції по оксо-формі (лінійна форма) моноз
Ці реакції проходять в полярних розчинниках (часто у водних розчинах) з
обов’язковою участю карбонільної групи. В розчині циклічна форма дає лінійну,
як показано нижче, і при написанні реакцій ми зображуємо лише лінійну форму.
По мірі протікання реакції всі циклічні форми перетворюються в лінійні.
O
6
CH2OH
5
H
H
4
OH
OH
3
H
O
H
2
OH
C
HOH2C 6
H
5
H
1
O H
-D-глюкопiраноза
( -D-глюкоза)
4
H
OH
OH
H
OH
H
3
H
H
OH
O
HO
C
1H
H
OH
H
OH
H
2
HO
CH2OH
D-глюкоза
23.
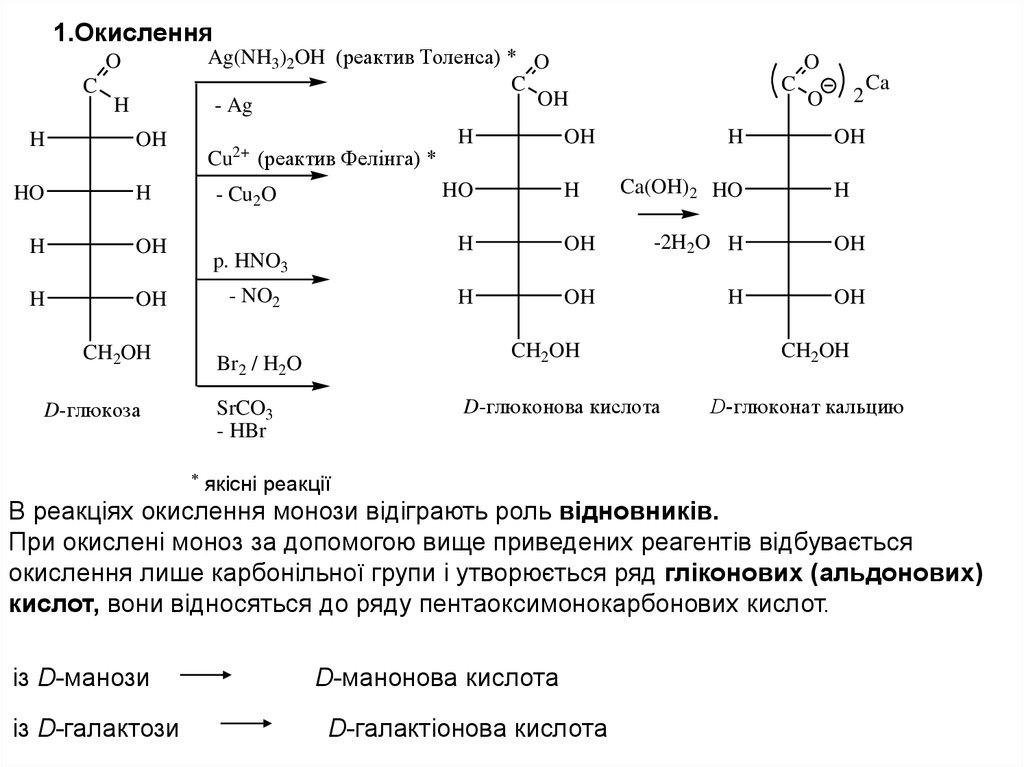
1.ОкисленняAg(NH3)2OH (реактив Толенса) * O
C
OH
- Ag
OH
H
2+
Cu (реактив Фелiнга) *
O
C
H
HO
H
OH
H
H
OH
H
OH
p. HNO3
- NO2
CH2OH
H
Ca(OH)2 HO
2
O
Ca
OH
H
H
OH
-2H2O H
OH
H
OH
H
OH
D-глюконова кислота
SrCO3
- HBr
C
CH2OH
Br2 / H2O
D-глюкоза
H
HO
- Cu2O
O
CH2OH
D-глюконат кальцию
якісні реакції
В реакціях окислення монози відіграють роль відновників.
При окислені моноз за допомогою вище приведених реагентів відбувається
окислення лише карбонільної групи і утворюється ряд гліконових (альдонових)
кислот, вони відносяться до ряду пентаоксимонокарбонових кислот.
із D-манози
із D-галактози
D-манонова кислота
D-галактіонова кислота
24.
б) Окислення конц. HNO3.O
O
C
H
HO
C
H
H
OH
конц. HNO3
H
H
OH
H
OH
- NO
OH
OH
HO
H
H
OH
H
OH
C
CH2OH
O
OH
D-глюкарова кислота
D-глюкоза
При використанні конц. HNO3, крім карбонільної групи, окислюється кінцева
CH2-OH група, і утворюється ряд глікарових (арових, альдарових, цукрових)
кислот, вони відносяться до ряду тетраоксидикарбоновых кислот.
із D-манози
із D-галактози
D-манарова кислота
D-галактарова кислота
25.
Гліконові і глікарові кислоти самочинно утворюють γ- і δ-лактони, наприклад:O
O
C
H
C
OH
OH
H
OH
HO
O
H
HO
H
O
H
OH
H
H
- H2O
CH2OH
D-глюконова кислота
H
H
OH
CH2OH
D-γ-глюконолактон
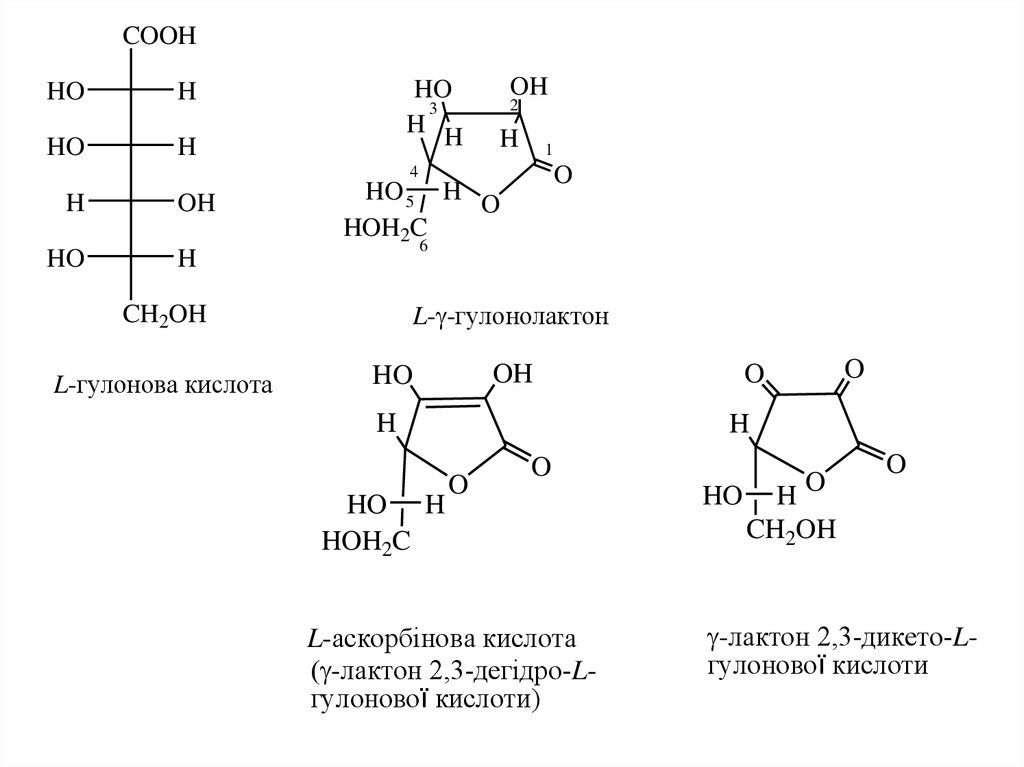
Вітамін С – L-аскорбінова і L-дегідроаскорбінова кислоти є похіднимим Lгулонової кислоти. Вітамін С забезпечує імунологічний статус людського
організму. В промисловості аскорбінові кислоти одержують із D-глюкози
синтетично.
26.
COOHHO
H
HO
H
HO
3
H H
OH
2
H
1
O
4
H
HO
OH
HO 5 H O
HOH2C
6
H
CH2OH
L-гулонова кислота
L- -гулонолактон
OH
HO
H
HO H
HOH2C
O
O
H
O
O
L-аскорбiнова кислота
-лактон 2,3-дегiдро-Lгулонової кислоти)
HO
O
O
H
CH2OH
-лактон 2,3-дикето-Lгулонової кислоти
27.
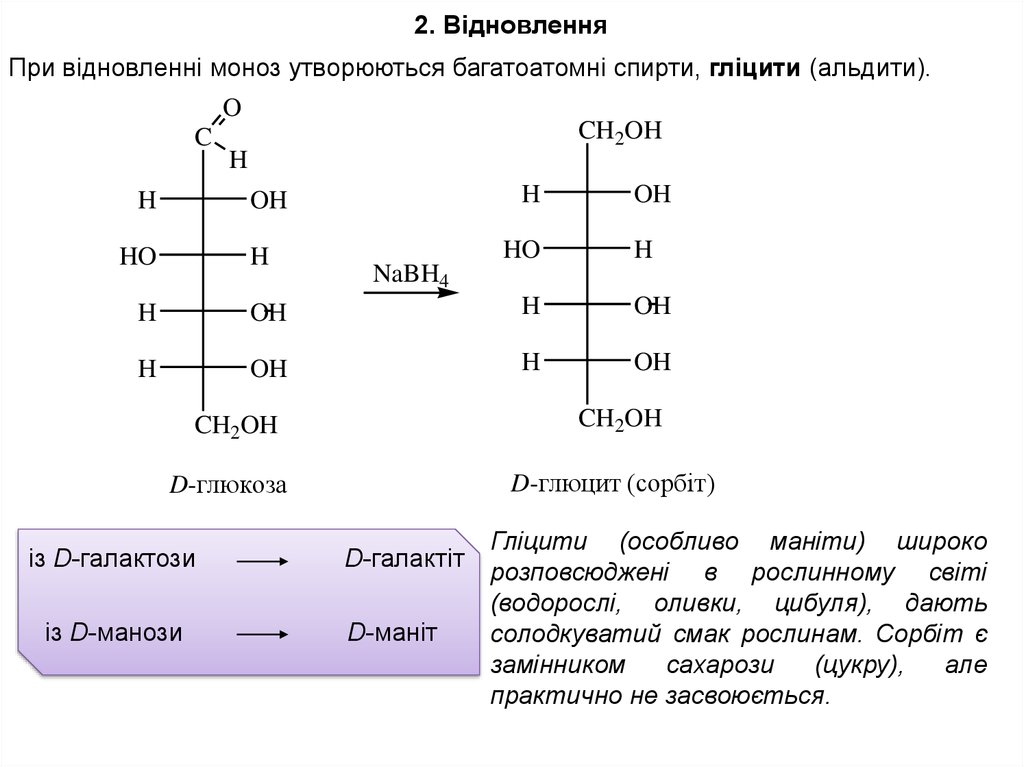
2. ВідновленняПри відновленні моноз утворюються багатоатомні спирти, гліцити (альдити).
O
C
H
CH2OH
H
H
OH
HO
H
HO
OH
H
NaBH4
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-глюцит (сорбiт)
D-глюкоза
із D-галактози
із D-манози
D-галактіт
D-маніт
Гліцити (особливо маніти) широко
розповсюджені в рослинному світі
(водорослі, оливки, цибуля), дають
солодкуватий смак рослинам. Сорбіт є
замінником
сахарози
(цукру),
але
практично не засвоюється.
28.
При відновленні кетоз утворюються два діастереомерних альдити.CH2OH
C O
HO
H
HOH2C
NaBH4
CH2OH
HO
H
H
HO
H
HO
H
OH
H
OH
H
OH
CH2OH
H
OH
D-фруктоза
CH2OH
D-манiт
+
OH
H
H
OH
H
OH
CH2OH
D-глюцит
29.
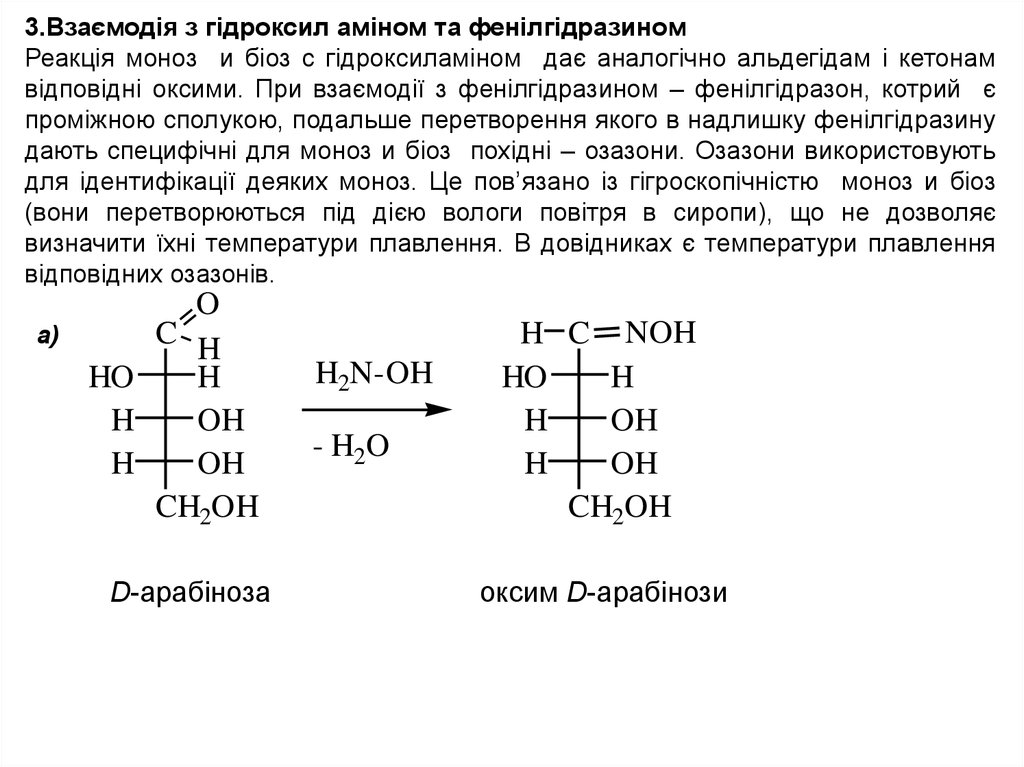
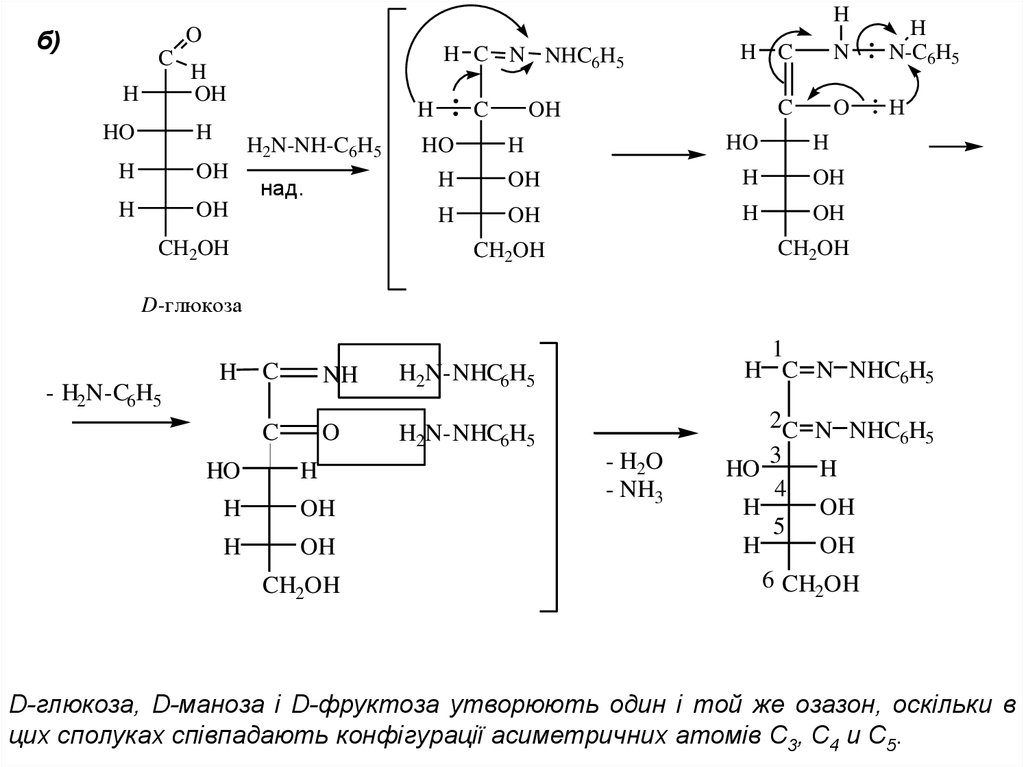
3.Взаємодія з гідроксил аміном та фенілгідразиномРеакція моноз и біоз с гідроксиламіном дає аналогічно альдегідам і кетонам
відповідні оксими. При взаємодії з фенілгідразином – фенілгідразон, котрий є
проміжною сполукою, подальше перетворення якого в надлишку фенілгідразину
дають специфічні для моноз и біоз похідні – озазони. Озазони використовують
для ідентифікації деяких моноз. Це пов’язано із гігроскопічністю моноз и біоз
(вони перетворюються під дією вологи повітря в сиропи), що не дозволяє
визначити їхні температури плавлення. В довідниках є температури плавлення
відповідних озазонів.
а)
O
C
H
HO
H
H
OH
H
OH
CH2OH
D-арабіноза
H2N-OH
- H2O
H C NOH
HO
H
H
OH
H
OH
CH2OH
оксим D-арабінози
30.
Hб)
O
C
H
HO
H C N NHC6H5
H
OH
H
H
H2N-NH-C6H5
H
OH
H
OH
над.
CH2OH
C
HO
H C
N
H
N-C6H5
C
O
H
OH
HO
H
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
D-глюкоза
- H2N-C6H5
H
HO
C
NH
H2N-NHC6H5
C
O
H2N-NHC6H5
H
H
OH
H
OH
CH2OH
1
H C N NHC6H5
- H2O
- NH3
2C N NHC H
6 5
3
HO
H
4
H
OH
5
H
OH
6 CH2OH
D-глюкоза, D-маноза і D-фруктоза утворюють один і той же озазон, оскільки в
цих сполуках співпадають конфігурації асиметричних атомів С3, С4 и С5.
31.
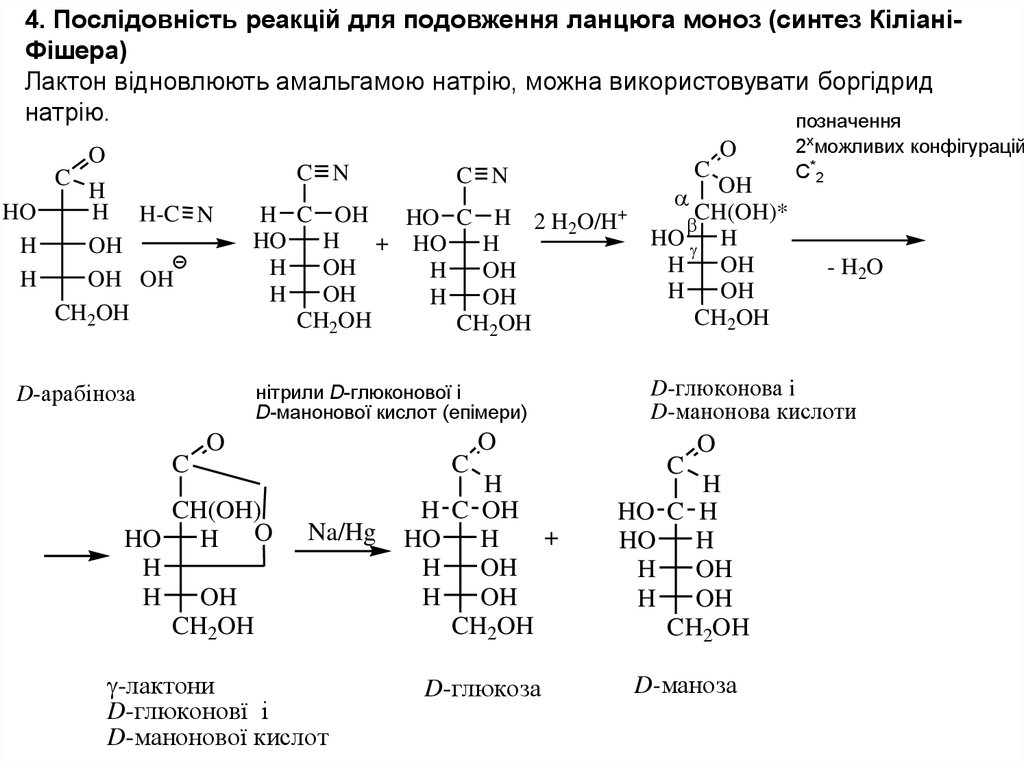
4. Послідовність реакцій для подовження ланцюга моноз (синтез КіліаніФішера)Лактон відновлюють амальгамою натрію, можна використовувати боргідрид
натрію.
позначення
O
C N
C
H
HO
H H-C N
H
OH
H
OH OH
CH2OH
D-арабiноза
C
C N
C
O
2хможливих конфігурацій
С*2
H C OH
HO C H 2 H2O/H+
HO
H
+ HO
H
H
OH
H
OH
H
OH
H
OH
CH2OH
CH2OH
OH
CH(OH)*
HO H
H
OH
H
OH
CH2OH
нiтрили D-глюконової і
D-манонової кислот (епімери)
D-глюконова i
D-манонова кислоти
O
CH(OH)
HO
H O
H
H
OH
CH2OH
C
Na/Hg
-лактони
D-глюконовї і
D-манонової кислот
H
HO
H
H
O
H
C OH
+
H
OH
OH
CH2OH
D-глюкоза
C
HO
HO
H
H
O
H
C H
H
OH
OH
CH2OH
D-маноза
- H2O
32.
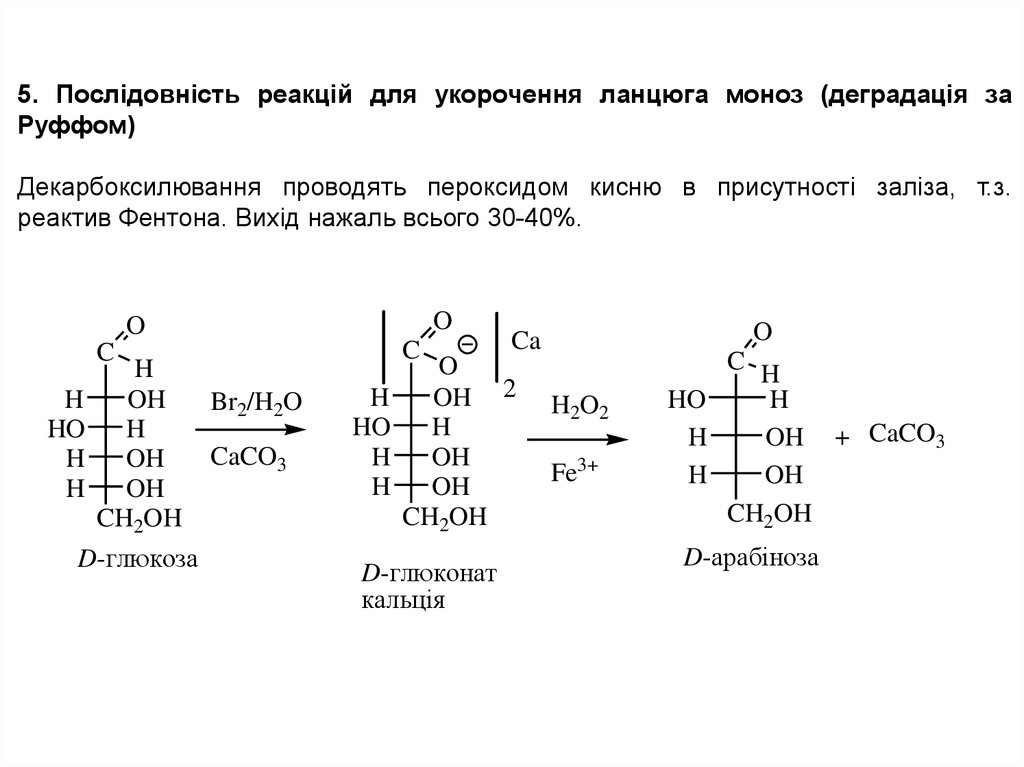
5. Послідовність реакцій для укорочення ланцюга моноз (деградація заРуффом)
Декарбоксилювання проводять пероксидом кисню в присутності заліза, т.з.
реактив Фентона. Вихід нажаль всього 30-40%.
O
O
C
C
H
HO
H
H
H
OH
H
OH
OH
CH2OH
D-глюкоза
Br2/H2O
CaCO3
H
HO
H
H
O
OH 2
H
OH
OH
CH2OH
D-глюконат
кальцiя
O
Ca
C
H2O2
Fe3+
H
HO
H
H
OH + CaCO3
H
OH
CH2OH
D-арабiноза
33.
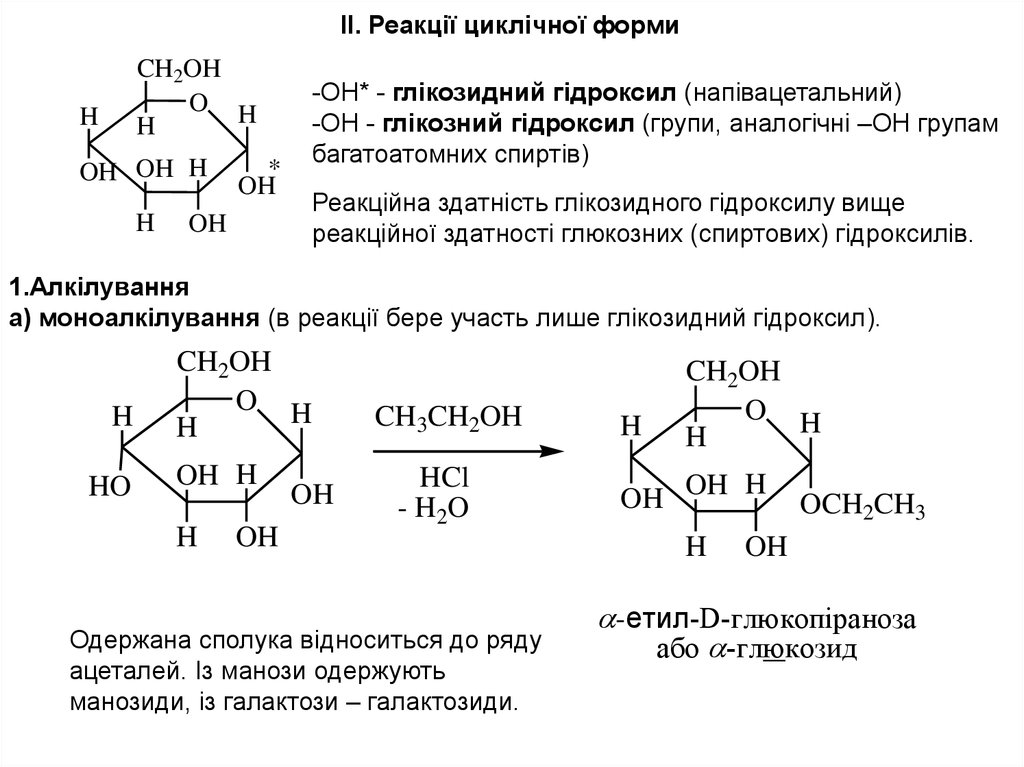
II. Реакції циклічної формиCH2OH
O H
H
H
OH OH H
H
*
OH
OH
-ОН* - глікозидний гідроксил (напівацетальний)
-ОН - глікозний гідроксил (групи, аналогічні –ОН групам
багатоатомних спиртів)
Реакційна здатність глікозидного гідроксилу вище
реакційної здатності глюкозних (спиртових) гідроксилів.
1.Алкілування
а) моноалкілування (в реакції бере участь лише глікозидний гідроксил).
H
HO
CH2OH
O H
H
OH H
H
OH
OH
CH3CH2OH
HCl
- H2O
Одержана сполука відноситься до ряду
ацеталей. Із манози одержують
манозиди, із галактози – галактозиди.
H
CH2OH
O H
H
H
OH OH
H
OCH2CH3
OH
-етил-D-глюкопіраноза
або -глюкозид
34.
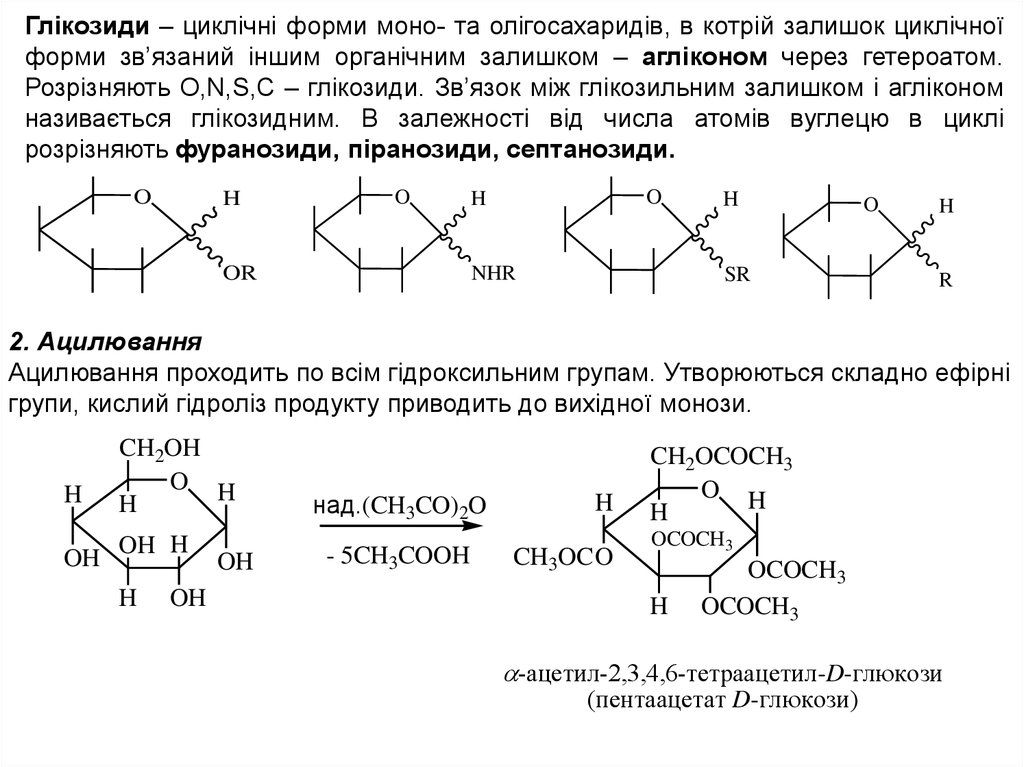
Глікозиди – циклічні форми моно- та олігосахаридів, в котрій залишок циклічноїформи зв’язаний іншим органічним залишком – агліконом через гетероатом.
Розрізняють О,N,S,C – глікозиди. Зв’язок між глікозильним залишком і агліконом
називається глікозидним. В залежності від числа атомів вуглецю в циклі
розрізняють фуранозиди, піранозиди, септанозиди.
O
H
O
O
H
NHR
OR
H
SR
O
H
R
2. Ацилювання
Ацилювання проходить по всім гідроксильним групам. Утворюються складно ефірні
групи, кислий гідроліз продукту приводить до вихідної монози.
H
CH2OH
O H
H
H
OH OH
H
OH
OH
над.(CH3CO)2O
- 5CH3COOH
H
CH3OC O
CH2OCOCH3
O H
H
OCOCH3
H
OCOCH3
OCOCH3
-ацетил-2,3,4,6-тетраацетил-D-глюкози
(пентаацетат D-глюкози)
35.
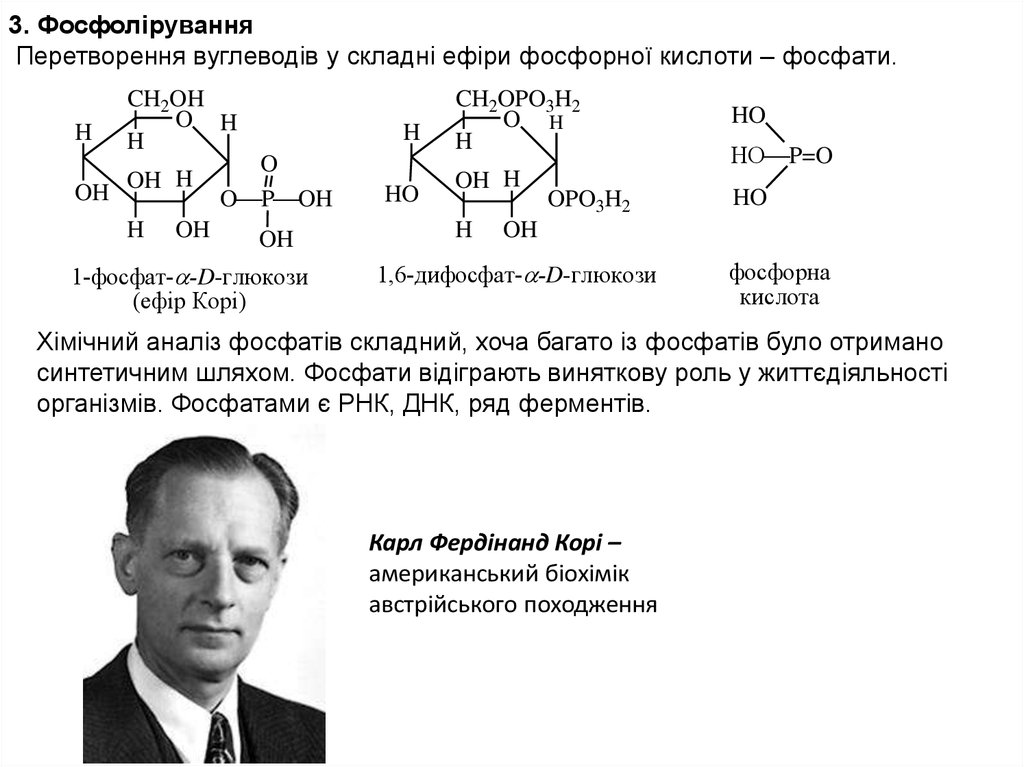
3. ФосфоліруванняПеретворення вуглеводів у складні ефіри фосфорної кислоти – фосфати.
H
OH
CH2OH
O H
H
OH H
H
OH
H
O
O P OH
OH
1-фосфат- -D-глюкози
(eфiр Корi)
HO
CH2OPO3H2
O H
H
OH H
H
OPO3H2
HO
P=O
HO
OH
1,6-дифосфат- -D-глюкози
фосфорна
кислота
Хімічний аналіз фосфатів складний, хоча багато із фосфатів було отримано
синтетичним шляхом. Фосфати відіграють виняткову роль у життєдіяльності
організмів. Фосфатами є РНК, ДНК, ряд ферментів.
Карл Фердінанд Корі –
американський біохімік
австрійського походження
36.
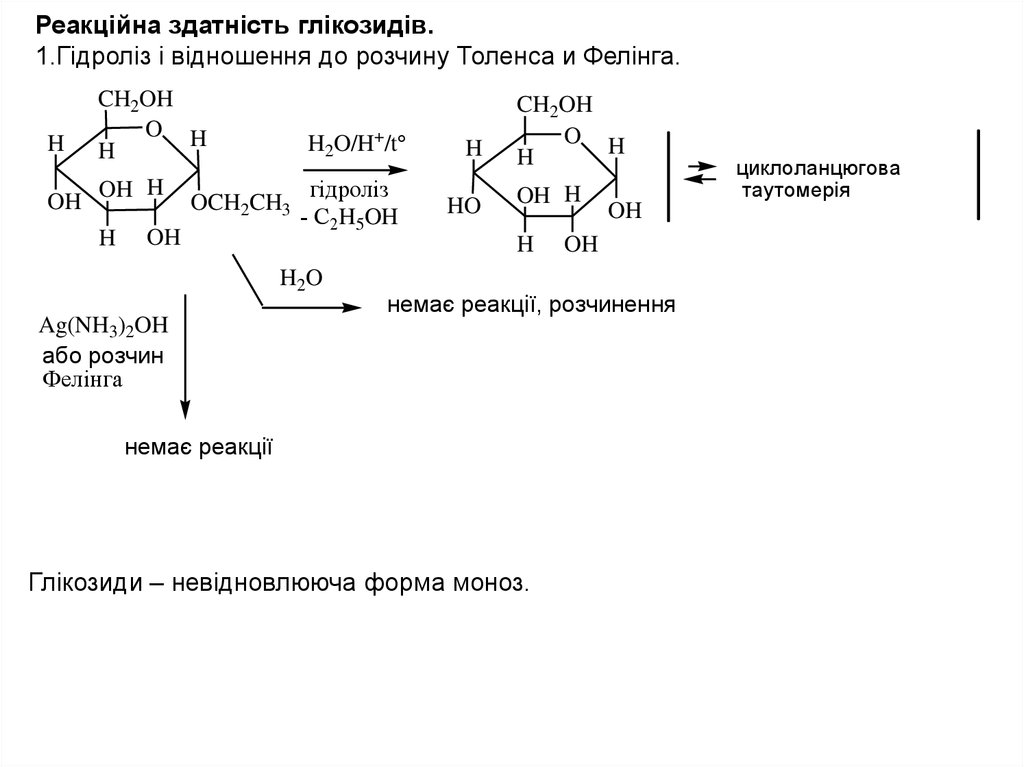
Реакційна здатність глікозидів.1.Гідроліз і відношення до розчину Толенса и Фелінга.
H
OH
CH2OH
O H
H
OH H
H
H2O/H+/t
OCH2CH3
OH
гiдролiз
- С2H5OH
HO
OH H
H
H2O
Ag(NH3)2OH
або розчин
Фелінга
H
CH2OH
O H
H
OH
OH
немає реакції, розчинення
немає реакції
Глікозиди – невідновлююча форма моноз.
циклоланцюгова
таутомерія













 chemistry
chemistry








