Similar presentations:
Ферменты
1. Ферменты
2. Ферменты
Ферменты — белки, участвующие в процессаханаболизма (синтеза) и катаболизма (распада), т.е.
в метаболизме. Ферменты распознают
соответствующие им метаболиты (субстраты),
вступают с ними во взаимодействие и ускоряют
химические реакции.
Фермент – это белковая молекула, которая
ускоряет протекание биохимических реакций в
организме человека. Синонимом понятия
фермент является термин энзим.
3. Ферменты
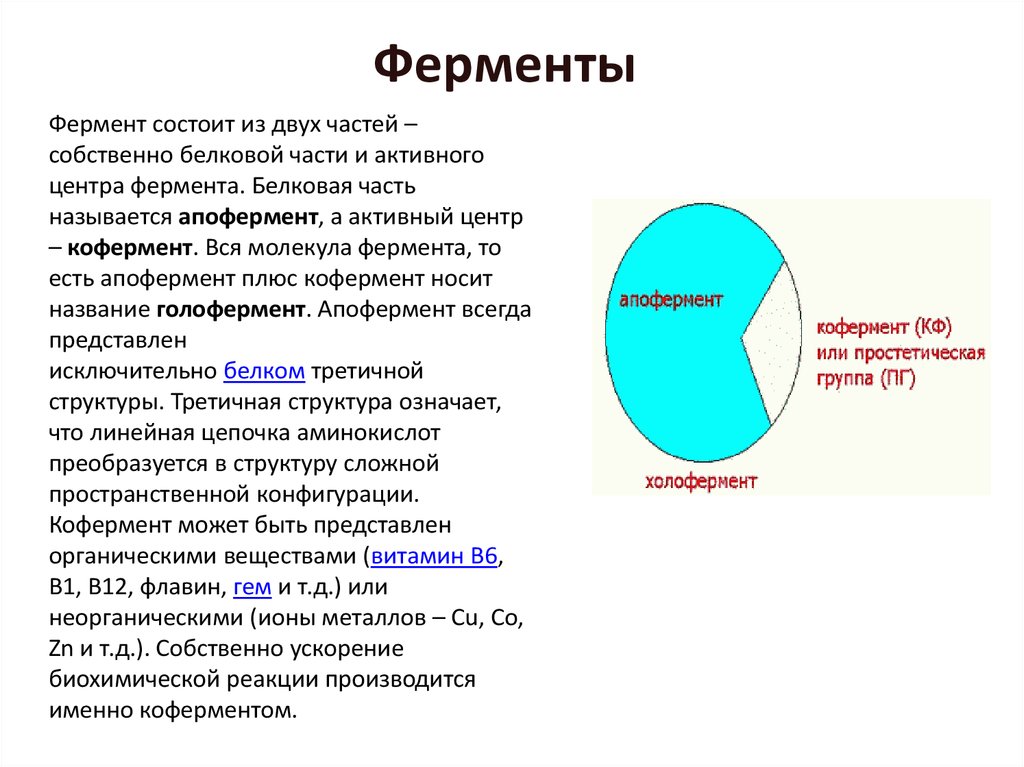
Фермент состоит из двух частей –собственно белковой части и активного
центра фермента. Белковая часть
называется апофермент, а активный центр
– кофермент. Вся молекула фермента, то
есть апофермент плюс кофермент носит
название голофермент. Апофермент всегда
представлен
исключительно белком третичной
структуры. Третичная структура означает,
что линейная цепочка аминокислот
преобразуется в структуру сложной
пространственной конфигурации.
Кофермент может быть представлен
органическими веществами (витамин В6,
В1, В12, флавин, гем и т.д.) или
неорганическими (ионы металлов – Cu, Co,
Zn и т.д.). Собственно ускорение
биохимической реакции производится
именно коферментом.
4. Ферменты
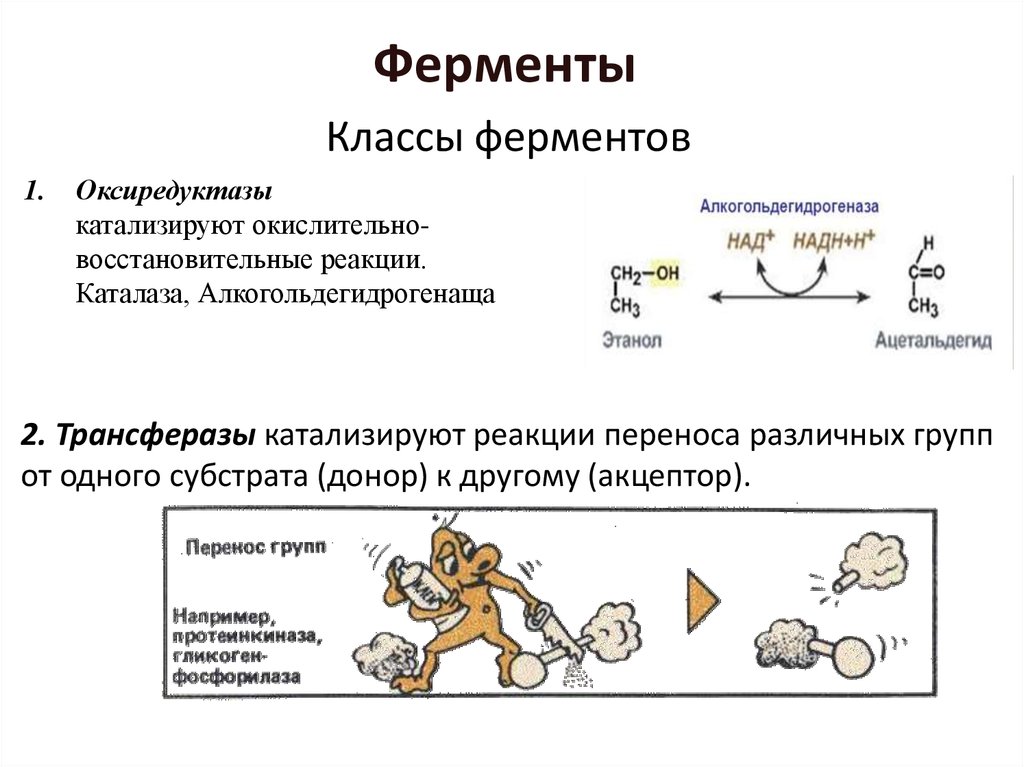
Классы ферментов1.
Оксиредуктазы
катализируют окислительновосстановительные реакции.
Каталаза, Алкогольдегидрогенаща
2. Трансферазы катализируют реакции переноса различных групп
от одного субстрата (донор) к другому (акцептор).
5. Ферменты
Классы ферментов3. Гидролазы катализируют гидролиз химических связей.
4. Лиазы катализируют разрыв химических связей без
гидролиза с образованием двойной связи в одном из продуктов
Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаз
а.
6. Ферменты
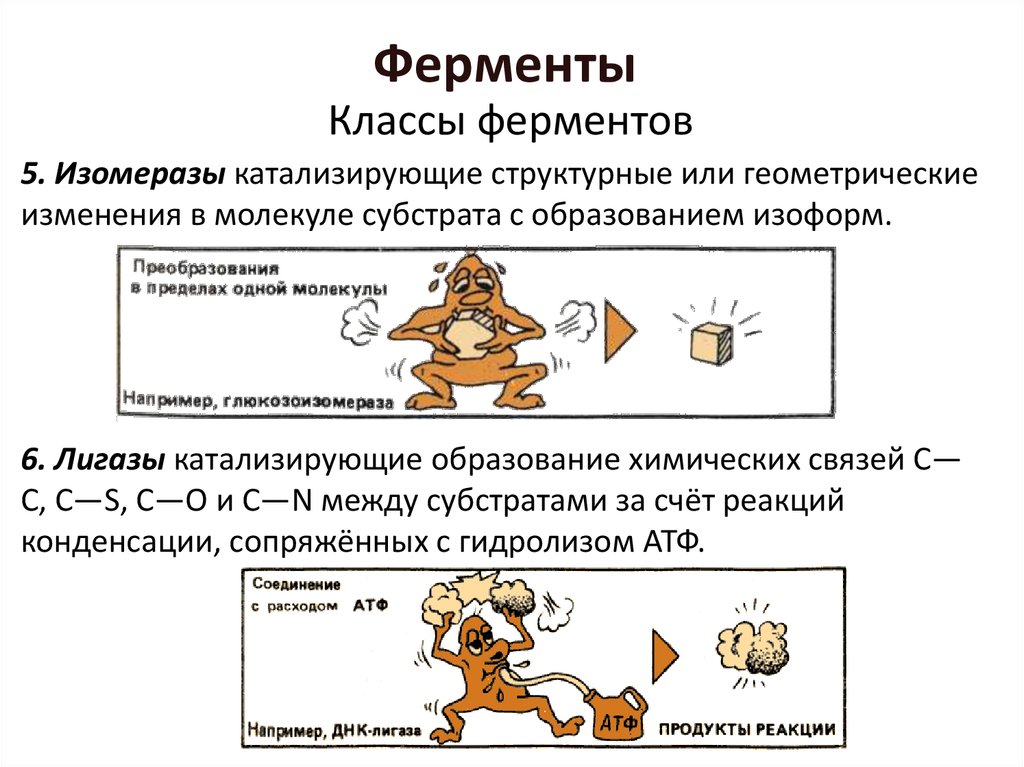
Классы ферментов5. Изомеразы катализирующие структурные или геометрические
изменения в молекуле субстрата с образованием изоформ.
6. Лигазы катализирующие образование химических связей C—
C, C—S, C—O и C—N между субстратами за счёт реакций
конденсации, сопряжённых с гидролизом АТФ.
7. Ферменты
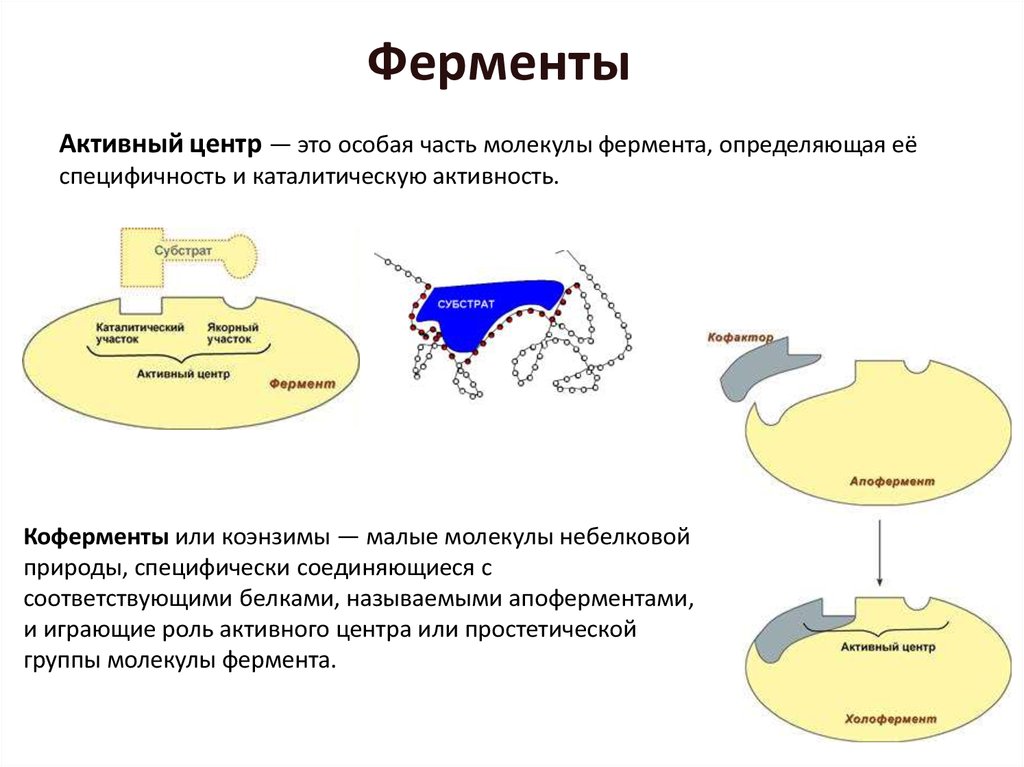
Активный центр — это особая часть молекулы фермента, определяющая еёспецифичность и каталитическую активность.
Коферменты или коэнзимы — малые молекулы небелковой
природы, специфически соединяющиеся с
соответствующими белками, называемыми апоферментами,
и играющие роль активного центра или простетической
группы молекулы фермента.
8. Изменение количества фермента в крови
• Гиперферментемия- нарушение проницаемости клеточных
мембран (пример - воспалительный процесс)
- лизис клеток (цитолиз) при действии разных
факторов (токсины, гипоксия, недостаток АТФ и др.)
- клеточная пролифирация (опухоль)
9. Изменение количества ферментов
Гипоферментемия
- генетически обусловленная (первичная)
- нарушение синтеза фермента (вторичная)
- нарушение функций органа,
синтезирующего фермент (например, печень)
Дисферментемия -нарушение
соотношения ферментов (АЛТ и АСТ)
10. Разделение ферментов по месту синтеза и выполнения функции
Секреционные
Индикаторные
Экскреционные
Оценка ферментативных соотношений в сыворотке
с позиции данной классификации используется для
диагностики и дифференциальной диагностики
патологии органов и тканей.
11. СЕКРЕционНЫЕ ферменты
Ферменты, синтезируемые клетками органов итканей, поступающие в кровь, где и выполняют
свои специфические функции
(ферменты свертывающей системы крови,
холинэстераза)
При патологии в органах и тканях синтез этих
ферментов нарушается и уровень в сыворотке
крови снижается (пример, снижение активности
холинэстеразы при заболеваниях печени
печени)
12. Клеточные (индикаторные) ферменты
Ферменты, синтезируемые клетками органов и тканей ивыполняющие функции в этих клетках (АЛТ, АСТ, ГЛДГ и
др).
Количество их в крови зависит от
внутриклеточной локализации фермента
проницаемости клеточных мембран
усиления клеточной пролифирации
наличия и степени цитолиза клеток
ПРИ ПАТОЛОГИИ УРОВЕНЬ ЭТИХ ФЕРМЕНТОВ В СЫВОРОТКЕ
КРОВИ УВЕЛИЧИВАЕТСЯ (ПРИМЕР, ПЕЧЕНЬ)
13. Экскреционные ферменты
Ферменты, синтезирующиеся клетками желез
ЖКТ, или, в частности, клетками внутри- и
внепеченочных желчных протоков (ЩФ, ГГТ, ЛАП)
При патологии (например, холестазе) уровень
этих ферментов в сыворотке крови повышается.
Оценка ферментативных соотношений в сыворотке с
позиции данной классификации используется для
диагностики и дифференциальной диагностики
патологии органов и тканей.
14. Амилаза
Амилаза вырабатывается поджелудочной железой и участвует врасщеплении крахмала и гликогена до глюкозы. Амилаза – это один
из ферментов, участвующих в пищеварении. Наибольшее содержание
амилазы определяется в поджелудочной железе и слюнных железах.
Активность α-амилазы в моче в 10 раз выше, чем активность αамилазы в крови. Определение активности α-амилазы и диастазы
используют для диагностики панкреатитов и некоторых других
заболеваний поджелудочной железы. При хронических и подострых
панкреатитах используют определение активности α-амилазы в соке
двенадцатиперстной кишки
20-100 Ед/л
• активность амилазы крови
• активность диастазы (амилазы) мочи до 1000 Ед/л
15.
Повышение амилазы крови
Повышение активности α-амилазы в крови называется гиперамилаземия, а повышение активности диастазы
мочи – гиперамилазурия.
Повышение амилазы крови выявляется при следующих состояниях:
в начале острого панкреатита, максимум достигается через 4 часа от начала приступа, а снижается до нормы на
2-6 сутки от начала приступа (повышение активности α-амилазы возможно в 8 раз)
при обострении хронического панкреатита (при этом активность α-амилазы возрастает в 3-5 раз)
при наличии опухолей или камней в поджелудочной железе
острая вирусная инфекция – свинка
алкогольная интоксикация
внематочная беременность
Когда амилаза мочи повышена?
Повышение концентрации амилазы в моче развивается в следующих случаях:
при остром панкреатите происходит увеличение активности диастазы в 10-30 раз
при обострении хронического панкреатита активность диастазы возрастает в 3-5 раз
при воспалительных заболеваниях печени наблюдается умеренное повышение активности диастазы в 1,5-2
раза
острый аппендицит
холецистит
кишечная непроходимость
алкогольная интоксикация
кровотечения из язвы желудочно-кишечного тракта
при лечении сульфаниламидными препаратами, морфином, мочегонными средствами и оральными
контрацептивами
При развитии тотального панкреонекроза, раке поджелудочной железы и хроническом панкреатите активность
α-амилазы может не увеличиваться.Снижение амилазы крови и мочи
Существуют состояния организма, при которых активность α-амилазы может снижаться. Низкая активность
диастазы мочи выявляется при тяжелом наследственном заболевании – муковисцидозе.
16. Липаза
Липаза – это один из пищеварительных ферментов, который участвует в расщеплении жиров.Для
работы данного фермента необходимо присутствие желчных кислот и кофермента, который
называется колипаза. Липаза вырабатывается различными органами человека – поджелудочной
железой, легкими, лейкоцитами.
активность липазы крови -------- 13 - 60Ед/мл
Наибольшее диагностическое значение имеет липаза, которая синтезируется в поджелудочной
железе. Поэтому определение активности липазы применяют преимущественно в диагностике
заболеваний поджелудочной железы.
Когда липаза крови повышена?
При каких состояниях повышается активность липазы в сыворотке крови:
острый панкреатит
различные опухоли и опухолевидные образования поджелудочной железы
холециститы
холестаз
прободение язв
болезни обмена веществ – сахарный диабет, подагра, ожирение
прием лекарств (гепарин, наркотические обезболивающие, снотворные барбитурового
ряда, индометацин)
Также повышение активности липазы возможно при травмах, ранениях, операциях, переломах и
острой почечной недостаточности. Однако повышенная активность липазы при указанных состояниях
не является специфичной для них, поэтому в диагностике данных заболеваний не используется.
Когда уровень липазы крови понижен?
Снижение активности липазы в сыворотке крови наблюдается при опухолях различной локализации
(кроме поджелудочной железы), удаленной поджелудочной железе,неправильном питании или
наследственной триглицеридемии.
17. ЛДГ
Лактатдегидрогеназа (ЛДГ) – это фермент, который содержится в цитоплазме клеток почек, сердца, печени, мышц,селезенки, поджелудочной железы. Коферментом ЛДГ являются ионы цинка и никотинамидадениндинуклеотид
(НАД). ЛДГ участвует в обмене глюкозы, катализируя превращение лактата (молочной кислоты) в пируват
(пировиноградную кислоту). В сыворотке крови имеется пять изоформ данного фермента.ЛДГ1 и ЛДГ2 изоформы
сердечного происхождения, то есть содержатся преимущественно в сердце. ЛДГ3, ЛДГ4 и ЛДГ5 – печеночного
происхождения.
Взрослые 0,8-4 мкмоль/ч*л140-350 Ед/л
Новорожденные 2,0-8 мкмоль/ч*л400-700 Ед/л
ЛДГ в диагностике инфаркта миокарда
Рассмотрим диагностическое значение определения суммарной активности ЛДГ. Определение активности ЛДГ
используют для поздней диагностики инфаркта миокарда, поскольку увеличение его активности развивается через 1224 часа после приступа и может сохраняться на высоком уровне до 10-12 суток. Это очень важное обстоятельство при
обследовании больных, поступивших в лечебное учреждение после приступа. Если увеличение активности ЛДГ
незначительно, значит, мы имеем дело с мелкоочаговым инфарктом, если, напротив, увеличение активности
длительное – значит, речь идет об обширном инфаркте.У больных стенокардией активность ЛДГ увеличена в первые
2-3 дня после приступа.
ЛДГ в диагностике гепатита
Активность суммарной ЛДГ может увеличиваться при остром гепатите (за счет увеличения активности ЛДГ4 и ЛДГ5).
При этом активность ЛДГ в сыворотке крови повышается в первые недели желтушного периода, то есть в первые 10
дней.
Норма ЛДГ у здоровых людей:
Возможно повышение активности ЛДГ у здоровых людей (физиологическое) после физических нагрузок, во время
беременности и после принятия алкоголя. Кофеин, инсулин, аспирин, ацебутолол, цефалоспорины, гепарин,
интерферон, пенициллин, сульфаниламиды также вызывает увеличение активности ЛДГ. Поэтому при приеме данных
препаратов нужно учитывать возможность повышенной активности ЛДГ, которая не говорит о наличии патологических
процессов в организме.
18. АЛТ
Аланинаминотрансфераза (АЛТ, АлАТ) – фермент, относящийся к аминотрансферазам
(трансаминазам), то есть осуществляющим перенос аминокислот с одной биологической
молекулы на другую. Поскольку в названии фермента присутствует аминокислота аланин, это
означает, что данный фермент переносит именно аминокислоту аланин. Коферментом АСТ
является витамин В6. АЛТ синтезируется в клетках, поэтому в норме его активность в крови
невысока. Преимущественно синтезируется в клетках печени, но также имеется в клетках почек,
сердца, мышцах и поджелудочной железе.
для мужчин
до 40Ед/л
для женщин
до 32Ед/л
Повышение активности АЛТ у здоровых людей (физиологическое) может быть вызвано приемом
некоторых лекарственных препаратов (антибиотиков, барбитуратов,наркотиков,
противоопухолевых препаратов, оральных контрацептивов, нестероидных
противовоспалительных препаратов, дикумаринов, эхинацеи, валерианы), сильными
физическими нагрузками, травмами. Также высокая активность АЛТ наблюдается у подростков в
период интенсивного роста.
АЛТ в диагностике заболеваний печени
При диагностике патологических состояний организма повышение активности АЛТ является
специфическим признаком острого заболевания печени. Повышение активности АЛТ в крови
выявляется за 1-4 недели до проявления симптомов болезни и за 7-10 дней до появления
максимального уровня билирубина в крови. Увеличение активности АЛТ при остром заболевании
печени составляет 5-10 раз. Повышенная активность АЛТ в течение длительного времени или
повышение ее в поздние сроки заболевания свидетельствует о начале массивного некроза
печени.
19. АСТ
AСТ - строение и функция фермента
Аспартатаминотрансфераза (АСТ, АсАТ) – фермент из группы трансаминаз, который осуществляет перенос аминокислоты аспартата
с одной биологической молекулы на другую. Коферментом АСТявляется витамин В6. АСТ является внутриклеточным ферментом, то
есть в норме находится в клетках. В клетках фермент может присутствовать в цитоплазме и митохондриях. Наибольшая активность
АСТ выявлена в сердце, печени, мышцах и почках. В крови присутствует в основном цитоплазматическая фракция АСТ.Норма
для мужчин
для женщин
15-31Ед/л
20-40Ед/л
Аспартатаминотрансферазы (АСТ / АсАТ)
Возможны более высокие значения активности АСТ у здоровых людей (физиологические) при чрезмерных мышечных нагрузках,
приеме некоторых лекарств, например, эхинацеи,валерианы,алкоголя, больших доз витамина А, парацетамола, барбитуратов,
антибиотиков и т.д.
Активность АСТ в сыворотке крови повышается в 4-5 раз при инфаркте миокарда и сохраняется таковой в течение 5 дней. Если
активность АСТ держится на высоком уровне и не снижается в течение 5 дней после приступа, то это говорит о неблагоприятном
прогнозе для больного с инфарктом миокарда. Если наблюдаются ещё повышения активности фермента в крови, то данный факт
свидетельствует о расширении зоны инфаркта.
При некрозе или повреждении печеночных клеток также повышается активность АСТ. Причем чем выше активность фермента, тем
больше степень повреждения.
Почему Аспартатаминотрансфераза (АСТ, АсАТ) повышена?
Повышение активности АСТ крови присутствует в следующих случаях:
гепатиты
некроз печени
цирроз
алкоголизм
рак печени и метастазы в печени
инфаркт миокарда
наследственные и аутоиммунные заболевания мышечной системы (миодистрофия Дюшена)
мононуклеоз
гепатоз
холестаз
Существует еще целый ряд патологических состояний, при которых также происходит увеличение активности АСТ. К таким
состояниям относят – ожоги, травмы, тепловой удар, отравление ядовитыми грибами.
Низкая активность АСТ наблюдается при дефиците витамина В6 и наличии обширных повреждений печени (некроз, цирроз).
Однако в клинике используют определение активности АСТ в основном для диагностики повреждений сердца и печени. При
других патологических состояниях активность фермента также изменяется, однако ее изменение не является специфичным,
следовательно, не представляет высокой диагностической ценности.
20. ШФ
Щелочная фосфатаза (ЩФ) – является мембранным ферментом, который локализован в щеточной каемке желчных
канальцев. ЩФ может быть кишечной, плацентарной и неспецифичной (в тканях печени, почек и костей). Данный
фермент является ключевым в обмене фосфорной кислоты.
Норма щелочной фосфатазы крови
взрослые
Подростки
Беременные
30-90Ед/л
до 400Ед/л
до 250Ед/л
Возрастает активность ЩФ в крови здоровых людей (физиологическое повышение) при передозировке витамина С,
недостаточности кальция и фосфора в пищевом рационе, приеме оральных контрацептивов, гормональных препаратов
эстрогенов и прогестеронов, антибиотиков, сульфаниламидов, магнезии, омепразола, ранитидина и прочее.
Щелочная фосфатаза в диагностике заболеваний печени и желчных путей
Высокой специфичностью и диагностическим значением обладает определение активности ЩФ при подозрении на
заболевания печени. При обтурационной желтухе происходит увеличение активности ЩФ крови в 10 раз относительно
нормы. Определение данного показателя используется для лабораторного подтверждения именно этой формы желтухи.
В меньшей степени увеличение активности ЩФ происходит при гепатитах, холангитах, язвенном колите, кишечных
бактериальных инфекциях и тиреотоксикозе.
Значение щелочной фосфатазыпри заболеваниях костей и в травматологии
ЩФ является маркерным ферментом остеосинтеза, то есть увеличивается активность при заболеваниях костей или
метастазах опухолей в кость, а также при заживлении переломов.
Причины повышения щелочной фосфатазы
Высокую активность ЩФ выявляют при следующих патологиях:
обтурационная желтуха
опухоли кости или метастазы в кости
гипертиреоз
заболевания крови (миеломная болезнь, лимфогранулематоз, мононуклеоз)
рахит
деструктивные заболевания печени (цирроз, рак, туберкулез)
белые инфаркты (почки, легкого)
амилоидоз
















 biology
biology








