Similar presentations:
Ферменты в медицине
1.
ФЕРМЕНТЫ В МЕДИЦИНЕ2. Энзимология – наука о ферментах
Фермент – биологический катализаторбелковой природы.
Энзимология появилась на стыке химической,
биологической и медицинской наук.
3. Значение ферментов
любые химические превращения веществ в
организме происходят при участии ферментов,
практическое применение ферментов во всех
областях деятельности, где речь идёт о живых
существах:
хлебопечение,
виноделие,
сыроварение,
чайное, кожевенное, меховое производство.
4. История развития энзимологии
Появилась энзимология в 1814 году, когда Кирхгофпоказал, что в вытяжке из проросшего ячменя содержится
вещество, которое вызывает превращение крахмала в сахар
(амилаза).
В 1836 году Т.Шванн выделил из желудочного сока
пепсин.
В настоящее время известно более
10 000 ферментов, многие получены
в кристаллическом состоянии.
5. Доказательства белковой природы ферментов
все выделенные ферменты – белки,методы получения ферментов и белков одинаковы,
факторы, вызывающие денатурацию белка, вызывают
инактивацию ферментов,
при гидролизе ферменты дают аминокислоты,
ферменты обладают высокой специфичностью.
6. Ферменты - простые белки
пепсин,трипсин,
уреаза,
лизоцим.
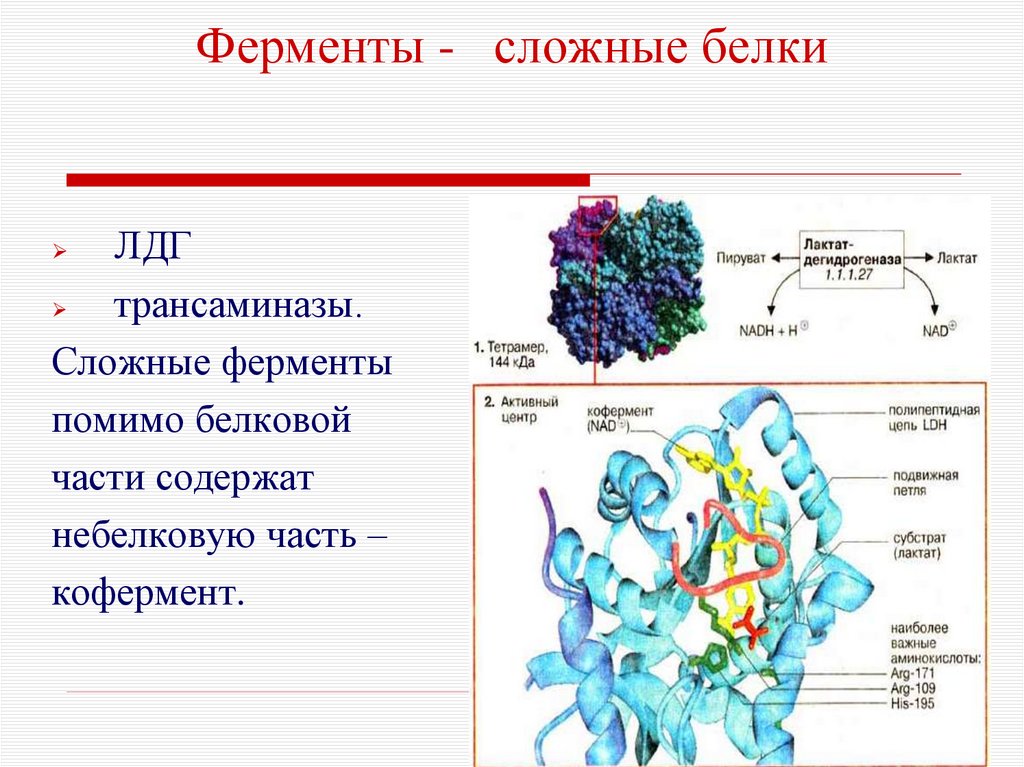
7. Ферменты - сложные белки
ЛДГтрансаминазы.
Сложные ферменты
помимо белковой
части содержат
небелковую часть –
кофермент.
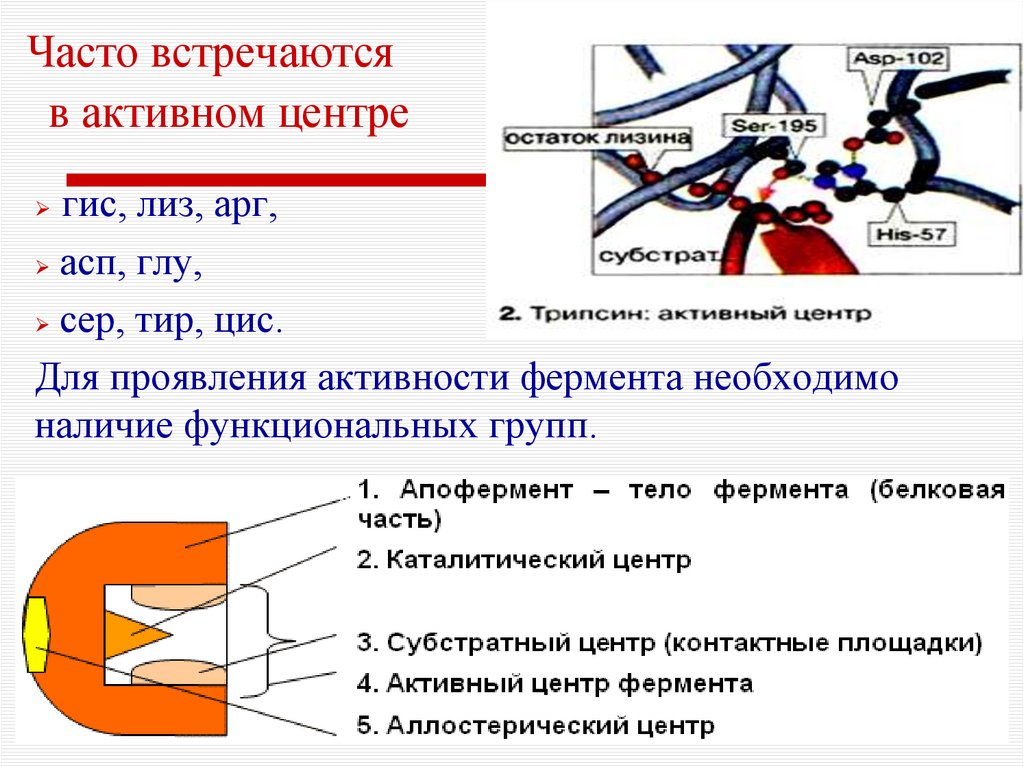
8. Активный центр фермента
Активный центр фермента – несколько аминокислотныхостатков (3-5), которые в ходе ферментативного катализа
взаимодействуют с субстратом.
У сложных ферментов в активный центр входят
коферменты.
Для формирования активного центра имеют значение
третичная и четвертичная структуры фермента.
9. Часто встречаются в активном центре
гис, лиз, арг,асп, глу,
сер, тир, цис.
Для проявления активности фермента необходимо
наличие функциональных групп.
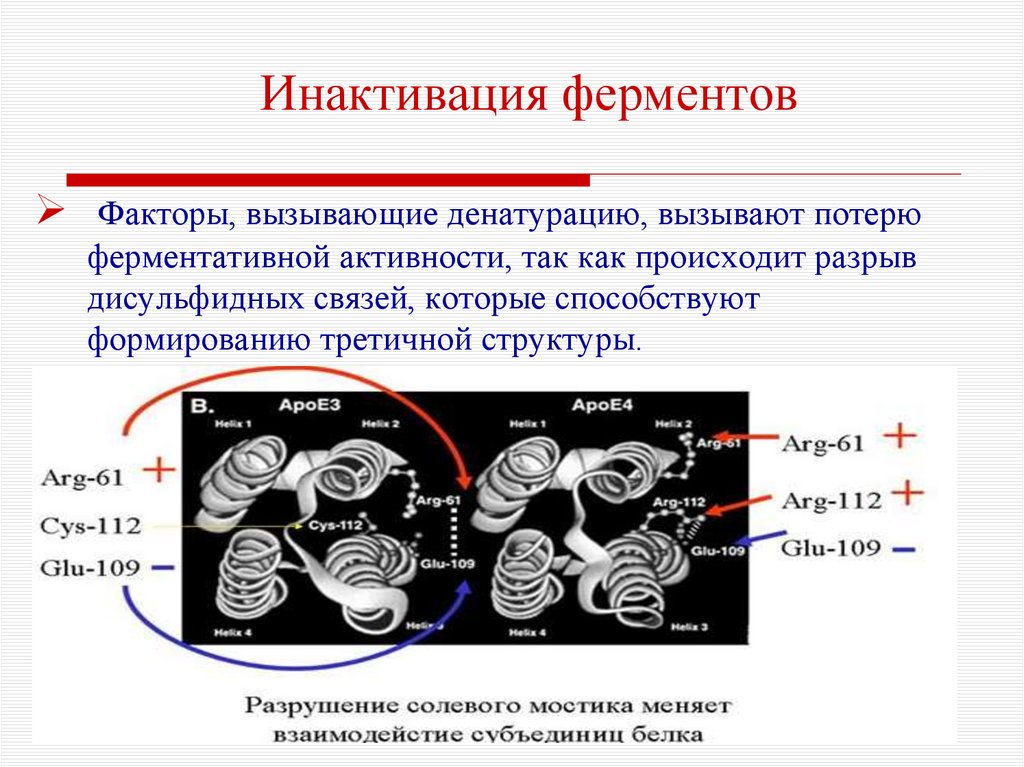
10. Инактивация ферментов
Факторы, вызывающие денатурацию, вызывают потерюферментативной активности, так как происходит разрыв
дисульфидных связей, которые способствуют
формированию третичной структуры.
11. Отличия ферментов от неорганических катализаторов
высокая молекулярная активностьлабильность - ферменты действуют в мягких
условиях
специфичность действия
регуляция ферментов нейрогуморальным путём с
участием других ферментов
12. Влияние температуры на активность ферментов
Термолабильность – чувствительность ферментов ктемпературе.
При температуре 60º наступает денатурация.
Миокиназа мышц выдерживает нагревание до 100º.
Оптимум температуры 37-40º С.
При температуре 50º снижается активность ферментов.
Эффект температуры в отношении скорости реакции
объясняется её влиянием на кинетическую энергию молекул.
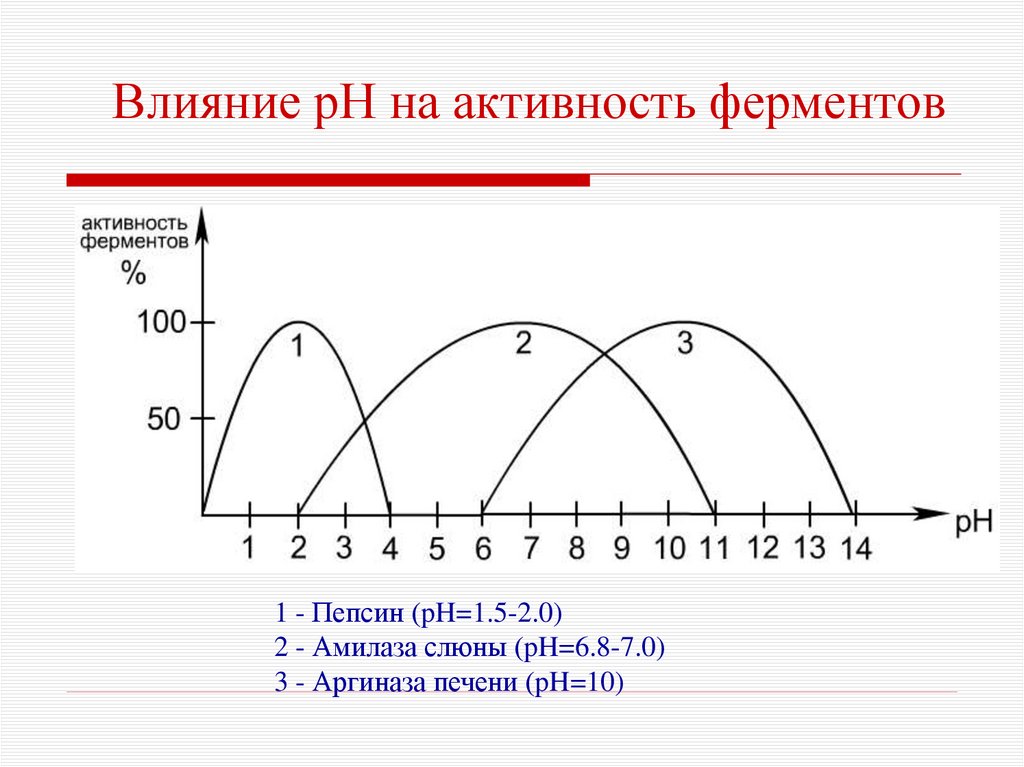
13.
Влияние рН на активность ферментовна скорость реакции,
на сродство фермента к субстрату,
на стабильность фермента.
Ферменты активны в определённом интервале рН,
имеют оптимум рН.
Изменение рН приводит к изменению степени ионизации
ионогенных групп в активном центре фермента.
14. Влияние рН на активность ферментов
1 - Пепсин (pH=1.5-2.0)2 - Амилаза слюны (pH=6.8-7.0)
3 - Аргиназа печени (pH=10)
15. Специфичность действия ферментов
Каждый фермент действует строго на одно вещество илиочень небольшое число близкородственных веществ.
Если бы ферменты не обладали специфичностью, их
действие приводило бы к распаду клеточного материала.
Структура активного центра фермента комплементарна
структуре его субстрата.
16. Абсолютная специфичность
Фермент катализирует превращение только одногосубстрата
уреаза,
аргиназа.
17. Стереоспецифичность
фермент катализирует превращение одногоиз стереоизомеров,
оксидазы L и D аминокислот.
18. Относительная специфичность ферментов
Фермент действует на субстраты разныхгрупп химических соединений.
Специфичность по типу реакции.
Цитохром Р450.
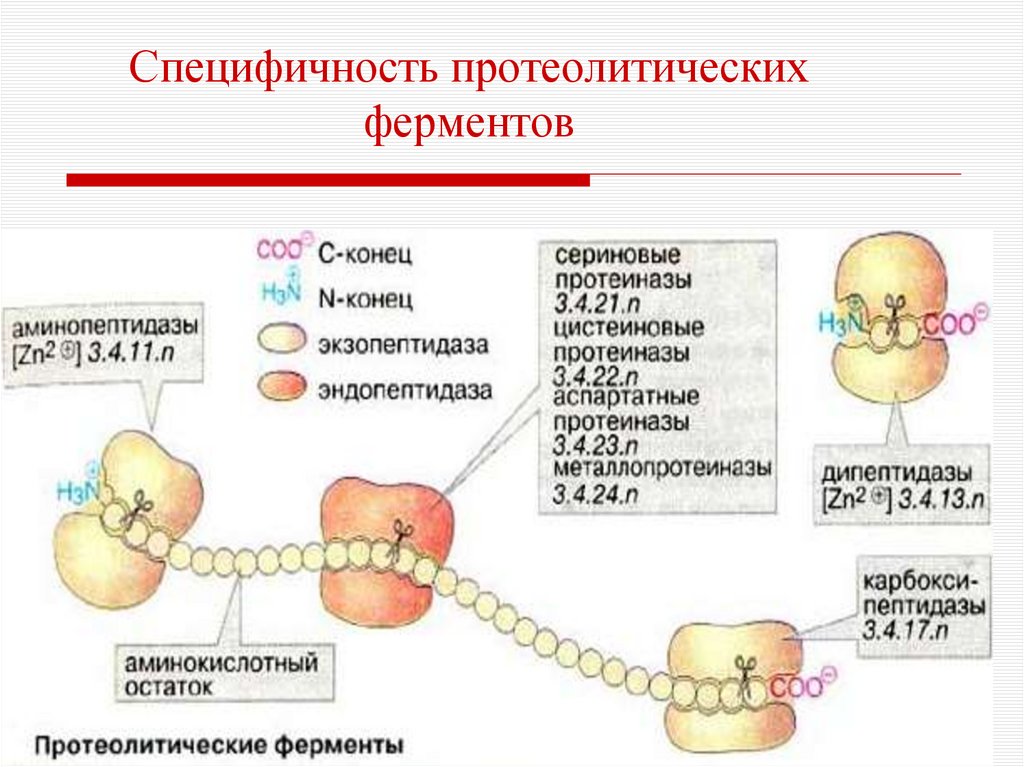
19. Групповая специфичность ферментов
Фермент действует на отдельные связи определённойгруппы субстратов.
Пепсин расщепляет пептидные связи, образованные
аминогруппой тирозина или фенилаланина.
Трипсин гидролизует пептидные связи, в образовании
которых принимают участие СООН-группы лиз и арг.
Химотрипсин гидролизует пептидные связи, в
образовании которых участвуют СООН-группы
ароматических АМК.
Эластаза гидролизует пептидные связи, в образовании
которых участвуют СООН-группы гли, ала.
20. Специфичность протеолитических ферментов
21. Энзимопатология
раздел медицины,изучающий заболевания,
связанные с нарушением
функционирования
ферментов.
22. Энзимопатии
наследственные (сфинголипидозы, гликогенозы),токсические (передозировка лекарств, воздействие
токсинов инфекционных агентов),
алиментарные (при недостаточном поступлении в организм
витаминов, микроэлементов),
из-за нарушения организации ферментных процессов в
клетке (нарушение кровоснабжения тканей).
23. Энзимодиагностика
Активность ферментов определяют вжидкостях и биоптатах.
биологических
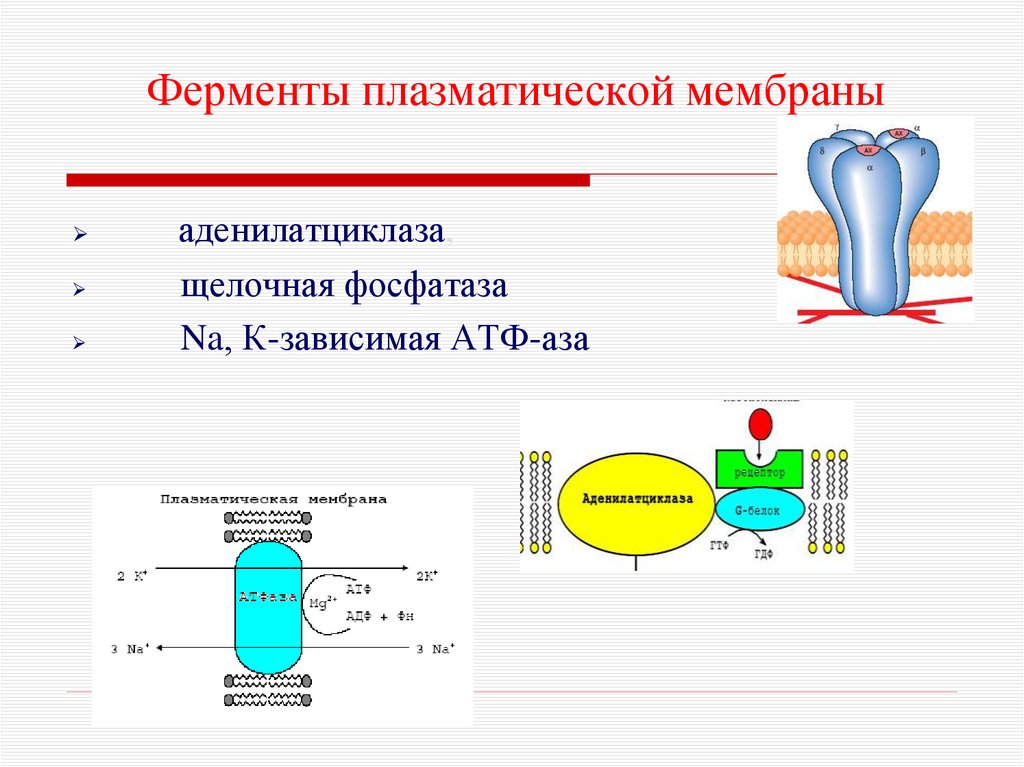
24. Ферменты плазматической мембраны
аденилатциклаза,щелочная фосфатаза
Na, К-зависимая АТФ-аза
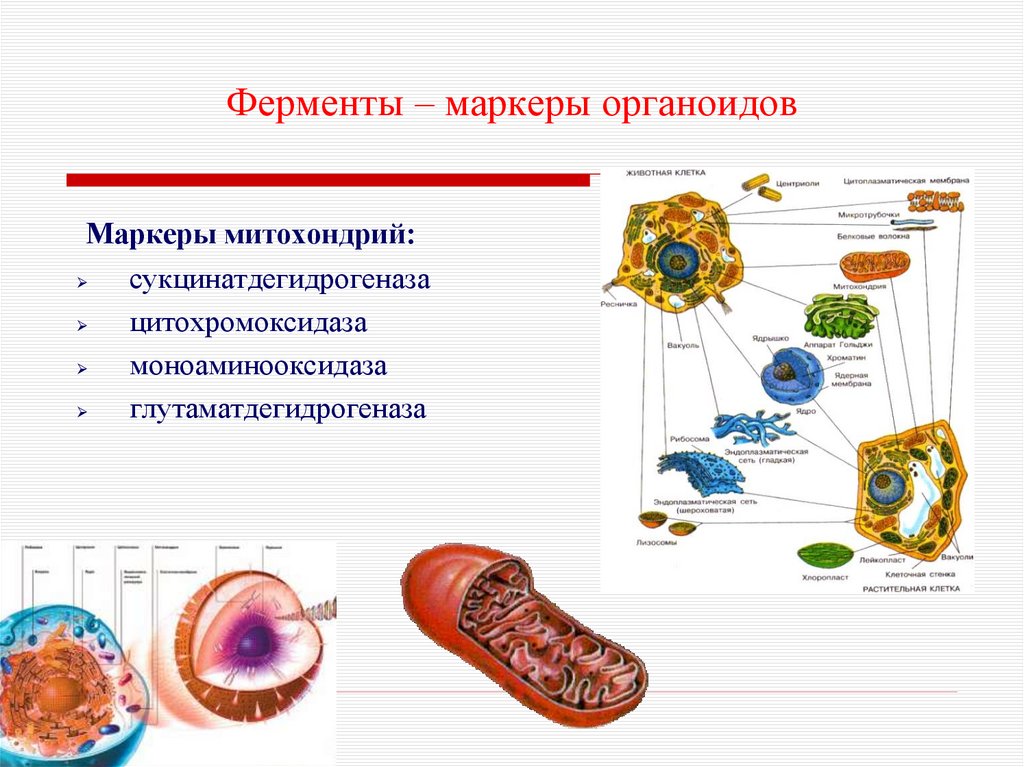
25. Ферменты – маркеры органоидов
Маркеры митохондрий:сукцинатдегидрогеназа
цитохромоксидаза
моноаминооксидаза
глутаматдегидрогеназа
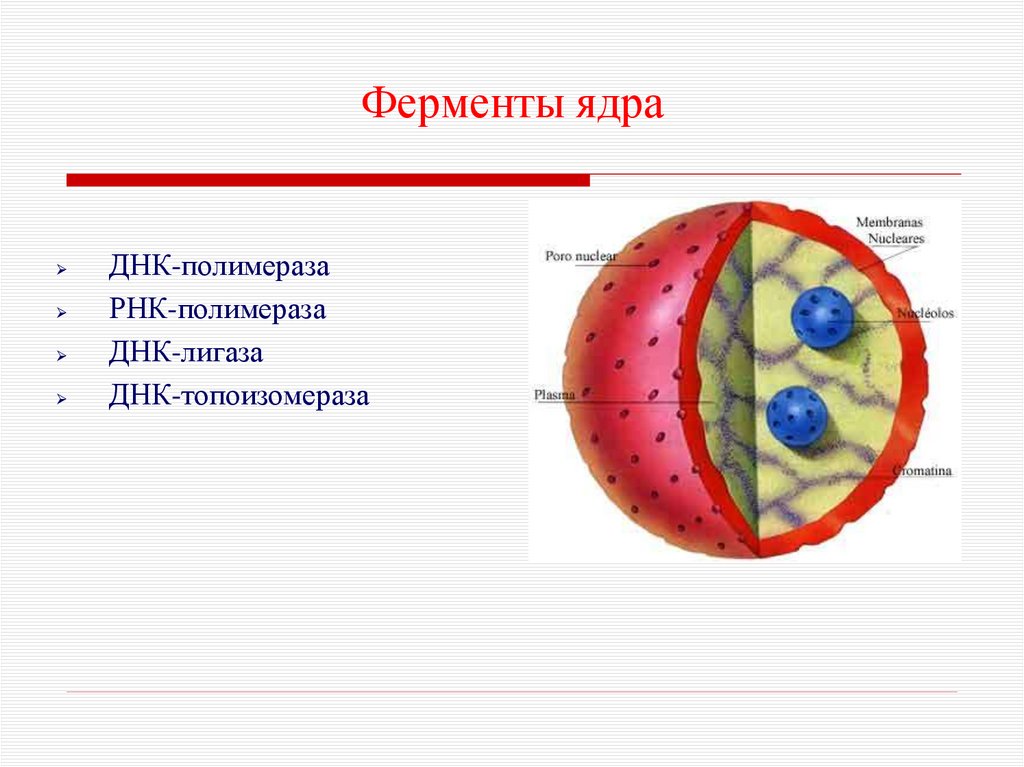
26. Ферменты ядра
ДНК-полимеразаРНК-полимераза
ДНК-лигаза
ДНК-топоизомераза
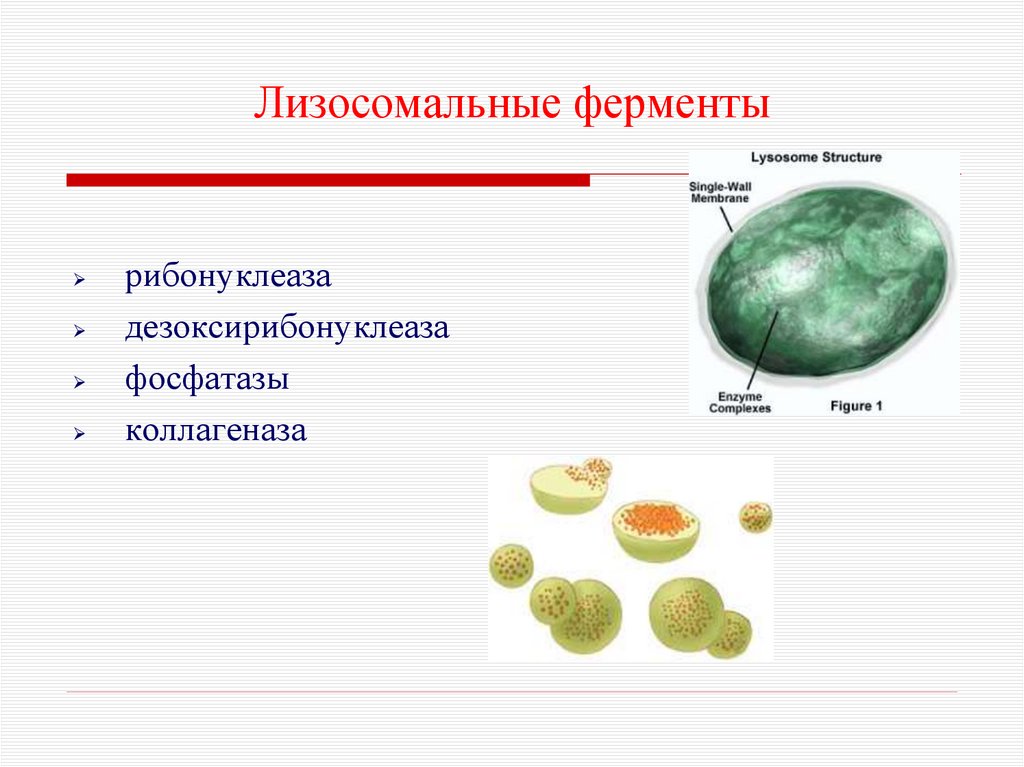
27. Лизосомальные ферменты
рибонуклеазадезоксирибонуклеаза
фосфатазы
коллагеназа
28. Факторы, влияющие на активность ферментов в сыворотке крови
«Старение» клетоки их отмирание
Внутрисосудистая
инактивация
«Утечка» через
повреждённые
мембраны
Некроз ткани
Повышенный
биосинтез
Экскреция
(моча, желчь, кал)
Активность ферментов
в сыворотке крови
Изменение
каталитической
активности
Поглощение клетками
ретикулоэндотелиальной
системы
29. Диагностическое значение исследования ферментов можно повысить двумя путями
определение изоферментов,определение активности нескольких ферментов.
30. Изоферменты- множественные молекулярные формы фермента данной особи, катализирующие одну и ту же реакцию, но разделяющиеся при
помощи физико-химическихметодов, так как отличаются по физико-химическим свойствам:
электрофоретические свойства,
адсорбционные свойства,
оптимум рН,
термостабильность,
чувствительность к ингибиторам,
сродство к субстрату.
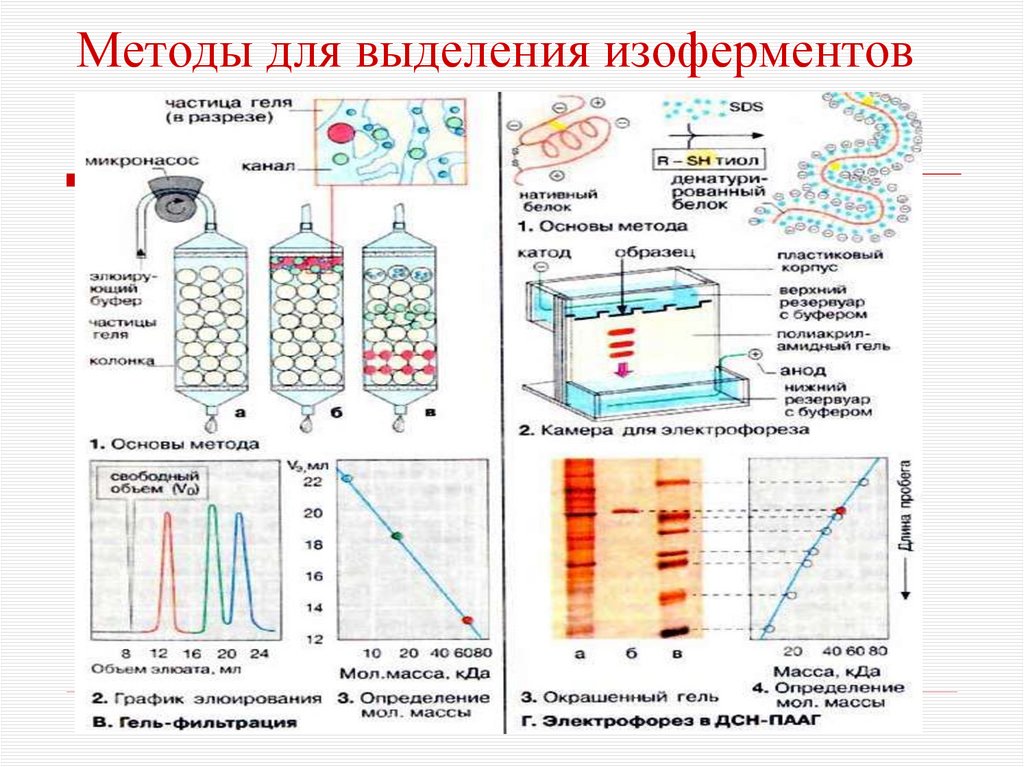
31. Методы для выделения изоферментов
электрофорез,ионообменная хроматография,
гельфильтрация,
избирательная адсорбция,
иммунохимический метод.
32. Методы для выделения изоферментов
33. Изоферменты
Генетически детерминированные изоферментывозникают в результате множественности аллелей в
одном локусе.
Посттрансляционные (вторичные) изоферменты
возникают в результате химической модификации
исходного фермента или его частичного протеолиза.
34. Применение изоферментов
С помощью изоферментного анализа удаётся выявитьнебольшие мутации.
Изоферменты изменяются в процессе развития и
дифференцировки (в печени эмбриона – ГК1, а в печени
взрослого – ГК3 и ГК4).
Изоферменты играют роль в регуляции метаболизма.
35. ЛДГ
Ткани человека продуцируют 2электрофоретически различающихся
субъединицы ЛДГ: Н и М.
Так как ЛДГ – фермент-тетрамер, то образуется
5 изоферментов.
H
H
H
H
H
H
H
M
M
M
H
H
H
M
M
M
M
M
M
M
ЛДГ1
ЛДГ2
ЛДГ3
ЛДГ4
ЛДГ5
36.
+НАД+
лактат
пируват
ЛДГ1
ЛДГ5 катализирует образование лактата, а ЛДГ1 – его
утилизацию.
В тканях с высоким уровнем аэробного обмена (сердце)
содержится ЛДГ1.
37. Лактатдегидрогеназа
СH3|
C=O + НАДH + Н+
|
COOH
Пируват
ЛДГ
СH3
|
H– C –OH
|
COOH
Лактат
+
+ НАД
38. Изоферменты ЛДГ – органоспецифические ферменты
В тканях, в которых преобладает аэробный распад глюкозыприсутствуют ЛДГ1,ЛДГ2 (низкое сродство к ПВК).
В тканях с анаэробным распадом глюкозы присутствуют
ЛДГ4,ЛДГ5.
В миокарде главный изофермент - ЛДГ1.
В эритроцитах –ЛДГ1 и ЛДГ2.
В плазме крови – ЛДГ2.
В селезёнке, надпочечниках –ЛДГ3.
В скелетных мышцах – ЛДГ5, ЛДГ4.
В печени –ЛДГ5.
ЛДГ3 отмечена в лимфоидной ткани, тромбоцитах, опухолях.
39. Диагностическое значение определения изоферментов
При инфаркте миокарда в крови повышается активностьЛДГ1, а при патологии печени – ЛДГ5 и ЛДГ4.
В опухолевых тканях повышается ЛДГ5 и уменьшается
ЛДГ1.
При детском церебральном параличе повышается ЛДГ5 и
ЛДГ4.
40. Показатели ЛДГ при патологии
При инфаркте миокарда ЛДГ1= ЛДГ2 всыворотке, либо даже превышает её.
При гепатитах и циррозе печени ЛДГ5 и ЛДГ4
повышаются.
При остром лейкозе повышаются в сыворотке
ЛДГ2 и ЛДГ3.
При пневмонии возрастает ЛДГ3.
При стенокардии ЛДГ не меняется.
41.
ЛактатдегидрогеназаВозможность повышения ЛДГ1 при
тестикулярных опухолях следует учитывать при
диагностике инфаркта миокарда.
ЛДГ1 и ЛДГ2 начинают нарастать через
12-24 часа после инфаркта миокарда.
Максимальное повышение через 48-72 часов.
42. Креатинфосфокиназа
АТФ + креатинКФК
АДФ + креатинфосфат
Активность фермента высока в мышцах, миокарде.
В сыворотке креатинфосфокиназа содержится в
следовых количествах.
43. Значительное повышение креатинфосфокиназы при
шоке и циркуляторной недостаточности,инфаркте миокарда,
мышечной дистрофии.
44. Умеренное повышение КФК при
механических повреждениях мышц,воспалении мышечной ткани,
миокардите,
после хирургических вмешательств,
физической перегрузке,
травмах,
после внутримышечных инъекций,
гипертиреозе,
алкоголизме,
инсульте, повреждении ткани мозга,
после приступа тяжёлой лихорадки,
инфекциях,
отравлениях
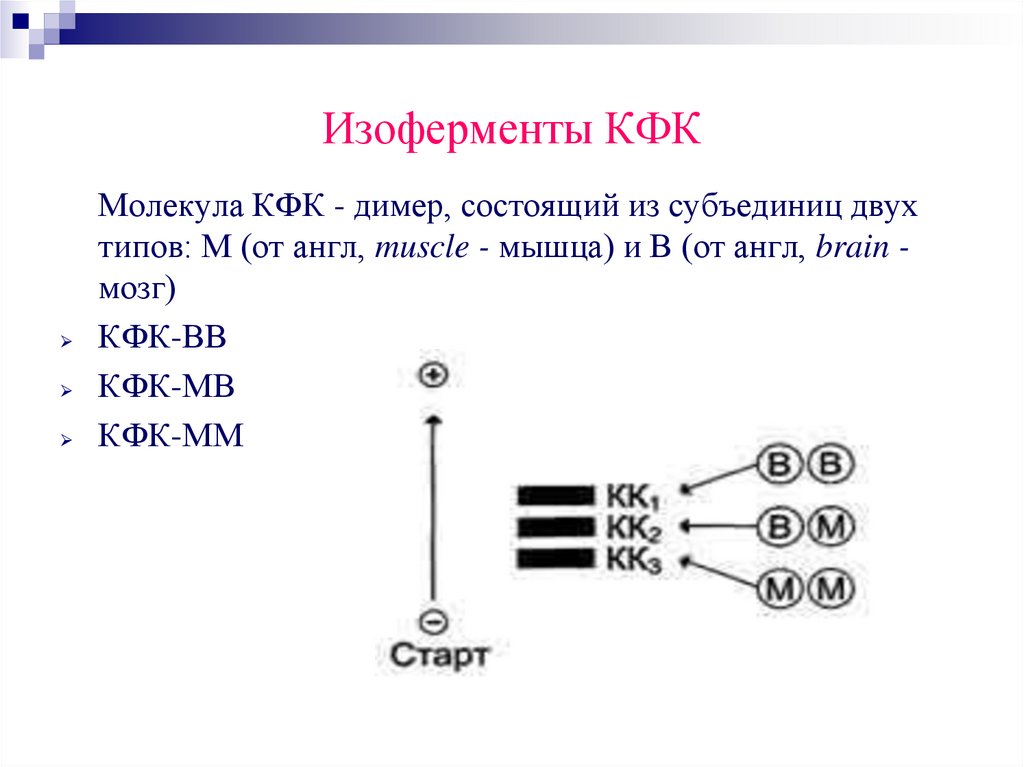
45. Изоферменты КФК
Молекула КФК - димер, состоящий из субъединиц двухтипов: М (от англ, muscle - мышца) и В (от англ, brain мозг)
КФК-ВВ
КФК-МВ
КФК-ММ
46. Креатинфосфокиназа
через 2-4 часа после инфаркта миокарда возрастаетактивность КФК, через 3 дня – нормализация.
Обнаружение изофермента МВ – ранний маркёр инфаркта
миокарда. Доля МВ-КФК среди общей КФК,
превышающая 5-6%, является специфичным признаком
некроза миокарда.
47.
Ферменты кровиВсе ферменты крови можно условно
разделить на три группы: секреторные, индикаторные,
экскреторные.
Секреторные ферменты синтезируются в печени,
выводятся в кровь. Это ферменты свертывающей и
антисвертывающей системы крови, сывороточная
холинэстераза, ЛХАТ, лизоцим, липопротеинлипаза,
церулоплазмин.
48.
Индикаторные ферментыИндикаторные (клеточные) ферменты попадают в кровь из
тканей, где они выполняют определенные внутриклеточные
функции. В крови они в норме отсутствуют или
определяются в следовых количествах. При патологических
процессах, вследствие деструкции тканей, индикаторные
ферменты выходят в кровь, их активность в крови резко
возрастает.
КФК
АСТ
49. АЛТ наиболее активна в
печени,поджелудочной железе,
сердце,
скелетных мышцах.
Особенно резко активность АЛТ повышается при
инфекционном гепатите (за два дня до желтухи).
50. АСТ наиболее активна в
миокарде,печени,
головном мозге,
почках.
Активность АСТ в миокарде
в 10 000 раз выше,
чем в сыворотке крови.
51. При инфаркте миокарда в крови увеличивается активность АСТ
Активность АСТ начинает нарастать в 2- 20 раз через 6-8часов после инфаркта миокарда.
При стенокардии активность фермента в норме.
52. При заболеваниях печени определяют активность
АЛТ,АСТ,
ЩФ,
γ-ГТП,
органоспецифические ферменты печени аргиназу, гистидазу.
53. При остром вирусном гепатите
Повышается в сыворотке крови активность:АЛТ,
АСТ,
ЛАП,
γ-ГТП.
Коэффициент де Ритиса меньше 1.
Снижается активность холинэстеразы.
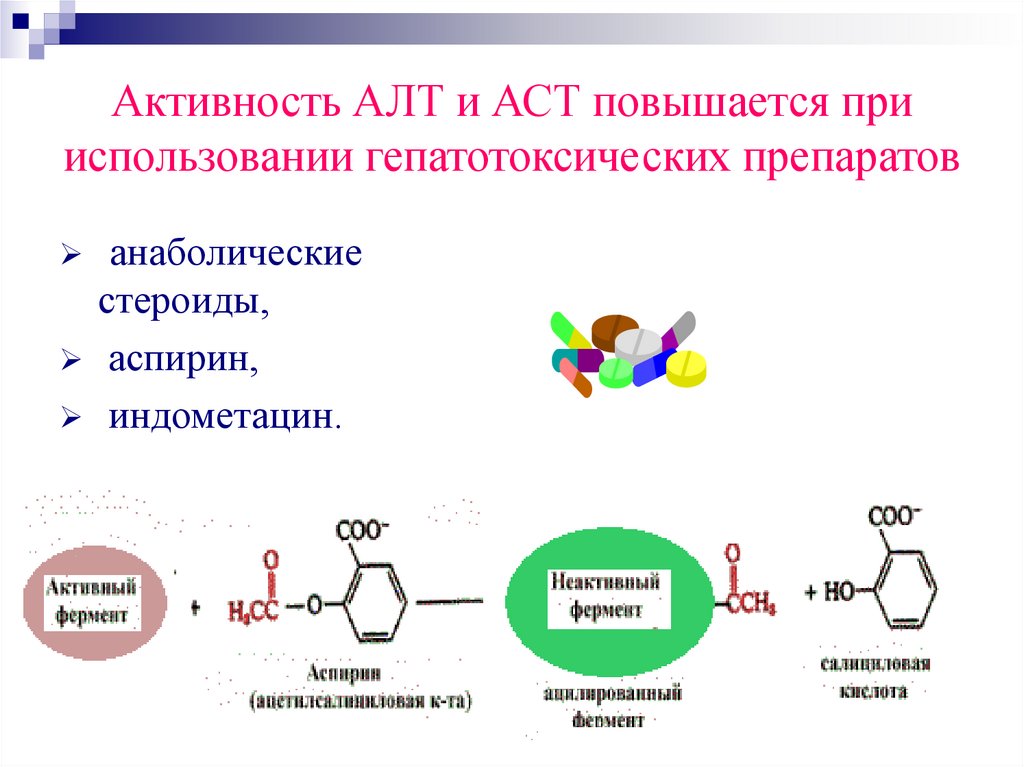
54. Активность АЛТ и АСТ повышается при использовании гепатотоксических препаратов
анаболическиестероиды,
аспирин,
индометацин.
55. Индикаторные ферменты
неспецифические (общие для всех тканей),органоспецифические (маркёрные).
Для печени: аргиназа,
гистидаза,
уроканиназа.
56.
Экскреторные ферментыЭкскреторные ферменты синтезируются главным образом в
печени(лейцинаминопептидаза, щелочная фосфатаза,
гаммаглутамилтранспептидаза). В физиологических условиях
эти ферменты в основном выделяются с желчью. При многих
патологических процессах выделение экскреторных ферментов
с желчью нарушается, а активность в плазме крови повышается
(механическая желтуха, цирроз, опухоли печени). Ряд экскреторных
ферментов синтезируется в поджелудочной и слюнных железах.
ГГТП
ЩФ
57. Гаммаглутамилтранспептидаза (ГГТП)
катализирует перенос γ-глутамильногоостатка с γ-глутамилпептидов на
аминокислоты с образованием новых γглутамилпептидов.
58. Активность ГГТП в органах
в почках - 100%,в поджелудочной железе – 68%,
в печени – 4%,
в селезёнке -1,5%.
59. Фермент обнаруживается в
сыворотке крови,моче,
желчи.
ГГТП сыворотки крови печёночного
происхождения.
60. Резко повышается ГГТП в 10 раз при
алкогольном поражении печени,холестазе,
раке поджелудочной железы с обструкцией
желчного протока,
механической желтухе,
холангите,
опухоли печени.
61. Диагностическое значение определения активности γ-ГТП
При отсутствии желтухи определение γ-ГТП –чувствительный тест для выявления патологии печени.
При онкозаболеваниях нормальная активность γ-ГТП в
крови свидетельствует об отсутствии метастазов в печени.
62. Диагностическое значение определения активности ЩФ
Определение активности ЩФ в крови имеетдиагностическое значение при заболеваниях
печени и костной ткани.
63. Активность ЩФ возрастает при
рахите,остеомаляции,
остеопорозах,
остеосаркомах,
туберкулёзе костей,
механической желтухе,
циррозе печени,
инфаркте миокарда,
саркоидозе, амилоидозе.
Повышение в крови активности ЩФ может быть
единственным признаком злокачественного
образования в печени.
64. Причины гиперферментемии ЩФ при холестазе
повышенный синтез фермента,экстракция фермента с плазматической мембраны,
поступление в циркуляцию ЩФ, ЛАП, ГГТП.
Активность ЩФ – чувствительный индикатор
холестаза.
65. Для диагностики острого панкреатита можно использовать определение активности ферментов
α-амилазаЛипаза
Эластаза
Фосфолипаза
Химотрипсин
Трипсин
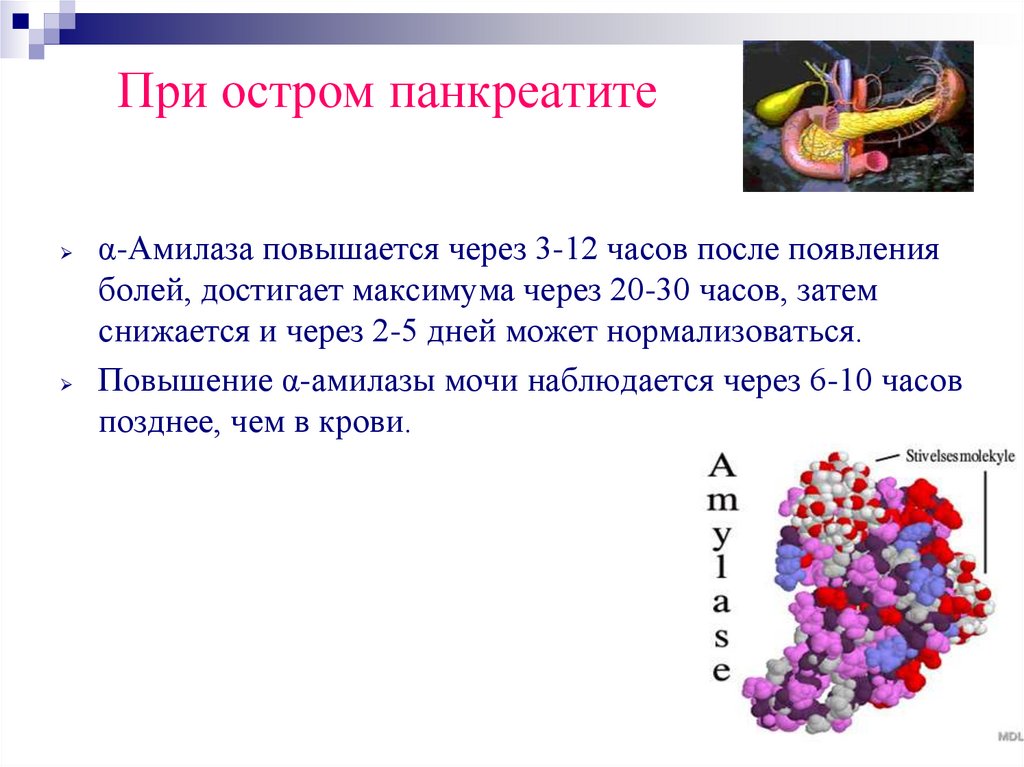
66. При остром панкреатите
α-Амилаза повышается через 3-12 часов после появленияболей, достигает максимума через 20-30 часов, затем
снижается и через 2-5 дней может нормализоваться.
Повышение α-амилазы мочи наблюдается через 6-10 часов
позднее, чем в крови.
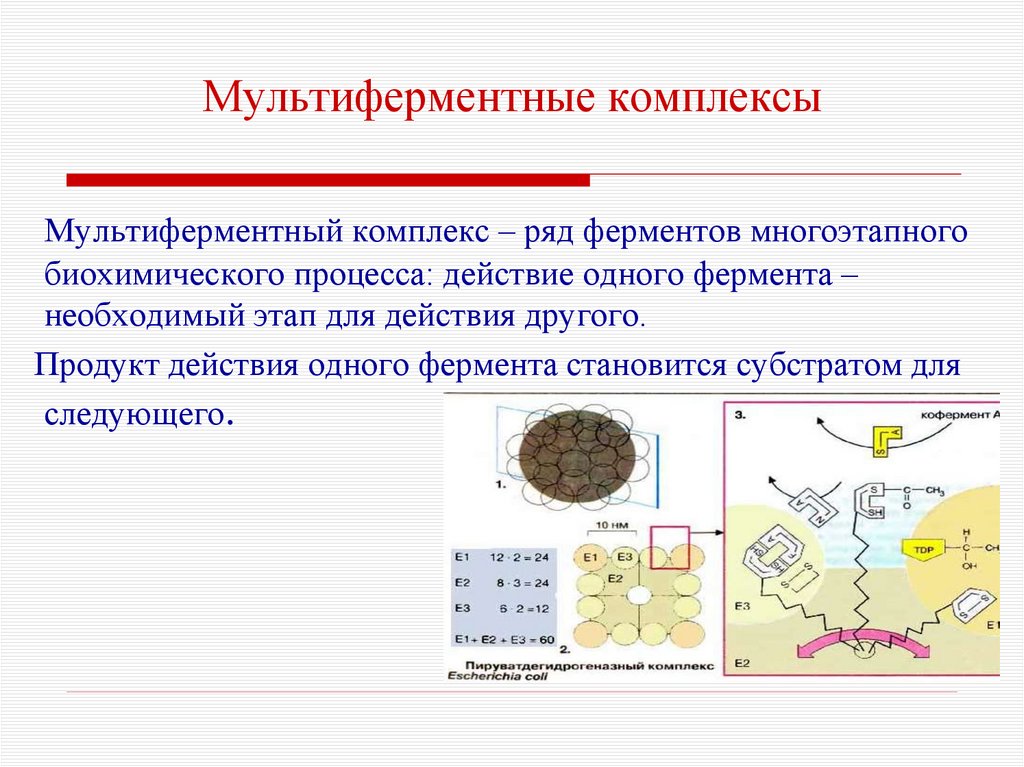
67. Мультиферментные комплексы
Мультиферментный комплекс – ряд ферментов многоэтапногобиохимического процесса: действие одного фермента –
необходимый этап для действия другого.
Продукт действия одного фермента становится субстратом для
следующего.
68. Мультиферментные комплексы
синтетаза жирных кислот,пируватДГ комплекс,
дыхательная цепь,
ферменты гликолиза.




















































 biology
biology








