Similar presentations:
Ферменты и изоферменты
1. Ферменты и изоферменты
Заведующая кафедройклинической лабораторной
диагностики
Новикова И.А.
2. Ферменты
Ферменты — это специфические белки, выполняющие ворганизме роль биологических катализаторов.
Простые ферменты (однокомпонентные) - при гидролизе дают
только аминокислоты (альдолаза, рибонуклеаза и др.)
Сложные белки - распадаются на аминокислоты и соединения
небелкового характера.
Белковый компонент сложного белка-фермента— апофермент.
Небелковый компонент сложного белка-фермента - кофермент.
Каждый компонент по отдельности (белковый и небелковый)
лишены ферментативной активности.
Многие коферменты представлены витаминами или их
производными → нарушение деятельности ферментных
систем при гиповитаминозах.
3. Коферменты
3 группы в зависимости от функций в ферментативныхреакциях:
1. Переносчики протонов и электронов, участвуют в
окислительно-восстановительных реакциях. Пример –
НАД, НАДФ, ФАД.
2. Коферменты,
связанные
с
ферментами,
катализирующими реакции переноса химических
групп.
Пример
–
пиридоксальфосфат
(фосфорилированная форма В6) входит в состав АлАТ,
АсАТ
3. Коферменты, принимающие участие в реакциях
синтеза, изомеризации и расщепления углеродуглеродных связей. Пример – производные тиамина
(В1).
4. Свойства ферментов
Термолабильны (инактивация при 800С)Имеют температурный оптимум действия (40-500С,
при 00С прекращают свое действие. Колебания температуры на
100С изменяют активность фермента на 10%.
Каждый фермент имеет свой оптимум РН
Каждый фермент обладает специфичностью действия
(действует
только
на
определенный
субстрат).
Специфические
свойства
ферментов
определяются
апоферментом.
Участвует в химической реакции не всей молекулой, а
только активным центром (эта часть связывается с
субстратом)
Механизм взаимодействия фермент-субстрат (Михаэлис): Е
+ S ↔ ЕS →Р + Е
Наибольшая скорость ферментативной реакции отмечается
в первые минуты
5. Основные классы ферментов
Оксидоредуктазы –окислительно-восстановительныереакции (ЛДГ, каталаза)
Трансферазы – реакции межмолекулярного переноса
химических групп (АлАТ, АсАТ, ГГТ)
Гидролазы - реакции расщепления в/молекулярных
связей в присутствии воды (альфа-амилаза, ХЭ)
Лиазы –реакции присоединения групп по двойным
связям и обратные реакции (альдолазы)
Изомеразы
–
реакции
изомеризации
(глюкозофасфатизомераза)
Синтетазы (лигазы) – реакции синтеза (соединение
2-х молекул субстрата) (ацетилкоэнзимсинтетаза)
6. ИЗОФЕРМЕНТЫ
Изофермент (изоэнзимы) - группа или семейство ферментов,катализирующих одну и ту же реакцию, но отличающихся по
целому ряду физико-химических свойств.
Изоферменты отличаются друг от друга по:
электрофоретической подвижности
адсорбционным свойствам
оптимуму рН
термостабильности
чувствительности к ингибиторам
сродству к субстрату
способности образовывать комплексы с аналогами коферментов
Около 100 ферментов в тканях человека находятся в нескольких
молекулярных формах (ЛДГ, аспартатаминотрансфераза,
альдолаза, креатинкиназа, фосфатаза, холинэстераза и др.).
7. ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ В КЛЕТКЕ
Ферменты функционируют внутри тех клеток, в которых происходит ихбиосинтез. Исключение
- ферменты пищеварительного тракта,
ферменты плазмы (свертывание).
Внутри клетки ферменты локализуются в определенных структурах:
Ядрышки - РНК — полимеразы (катализируют образование и-РНК, рРНК и т-РНК)
Ядро - ферменты, участвующие в процессе репликации ДНК, синтеза
НАД.
Митохондрии - ферменты пируватдегидрогеназного комплекса, цикла
трикарбоновых кислот, окисления жирных кислот и некоторых
аминокислот, синтеза мочевины, а также ферменты переноса
электронов и окислительного фосфорилирования.
Лизосомы - гидролитические ферменты.
Рибосомы - ферменты белкового синтеза.
Эндоплазматический ретикулум - ферменты синтеза липидов, реакций
гидроксилирования
(ферментная
система
микросомального
окисления).
8. ЛОКАЛИЗАЦИЯ ФЕРМЕНТОВ В КЛЕТКЕ (продолжение)
Плазматическая мембрана - АТФ-аза (транспорт Na+ и К+,аденилатциклаза.
Гиалоплазма ферменты гликолиза, глюконеогенеза,
пентозного цикла окисления углеводов, синтеза жирных
кислот, синтеза мононуклеотидов.
Приуроченность ферментных систем к определенным
участкам клетки (компартментализация) обеспечивает:
интеграцию внутриклеточных процессов и контроль их
скорости
(последовательность
реакций
строго
скоординирована во времени и пространстве).
протекание в клетке в одно и то же время химически
несовместимых реакций Пример - в клетке одновременно
происходит окисление высших жирных кислот до ацетилКоА (митохондрии) и их синтез из ацетил-КоА
(гиалоплазма)
9. РАСПРЕДЕЛЕНИЕ ФЕРМЕНТОВ СРЕДИ ОРГАНОВ И ТКАНЕЙ
Большинство ферментов широко распространены ворганах и тканях (ЛДГ, аминотрансферазы и др.).
Некоторые ферменты активны лишь в одной или
нескольких
тканях
(кислая
фосфатаза
предстательная железа).
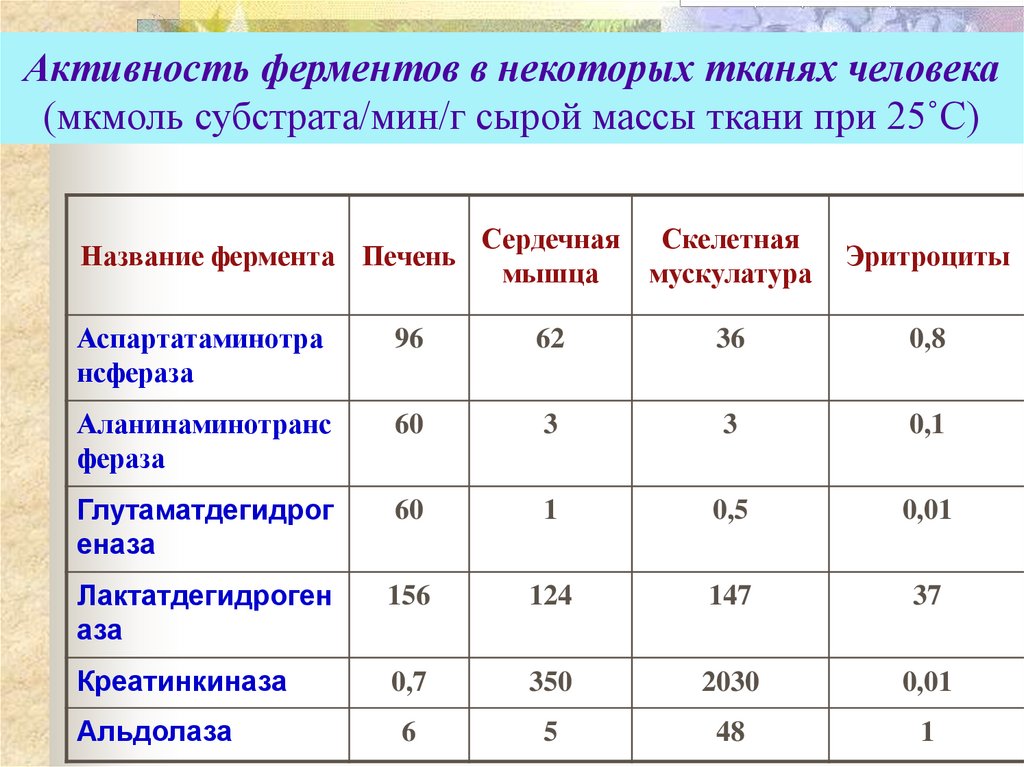
10. Активность ферментов в некоторых тканях человека (мкмоль субстрата/мин/г сырой массы ткани при 25˚С)
Название фермента ПеченьСердечная
мышца
Скелетная
мускулатура
Эритроциты
Аспартатаминотра
нсфераза
96
62
36
0,8
Аланинаминотранс
фераза
60
3
3
0,1
Глутаматдегидрог
еназа
60
1
0,5
0,01
Лактатдегидроген
аза
156
124
147
37
Креатинкиназа
0,7
350
2030
0,01
Альдолаза
6
5
48
1
11. МЕХАНИЗМЫ ГИПЕРФЕРМЕНТЕМИИ ПРИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЯХ
1.2.
3.
Выход энзимов из поврежденных органов и тканей в
кровяное русло. Подтверждение: ↓ в пораженном
органе и ↑ в сыворотке. Противоречие: отсутствие
прямой связи между активностью ферментов в
поврежденной ткани и в сыворотке.
Выход энзимов в плазму из непораженных органов в
результате общей реакции организма как проявление
неспецифического острого синдрома.
Продолжающийся синтез энзимов в пораженном очаге
(выход ферментов из пораженных тканей и снижение
их содержания в клетках стимулируют по принципу
обратной связи синтез последних); увеличение
каталитической активности ферментов (механизм не
ясен).
12. Факторы, влияющие на скорость высвобождения ферментов из тканей
1. Концентрационный градиент (соотношениевнутриклеточной к внеклеточной активности).
Пример: в гепатоцитах содержание ЛДГ в 3000
раз выше, чем вне клеток → фермент быстрее
уходит из клетки.
2. Размер ферментных молекул. Более мелкие
молекулы высвобождаются на ранней стадии
повреждения.
3. Внутриклеточная локализация ферментов.
Наиболее легко высвобождаются ферменты
цитозоля, из митохондрий намного медленнее
(лишь при распаде внутриклеточных органелл).
13. Механизмы инактивации и удаления энзимов
Плохо изучены.1. Экскреция с мочой (амилаза), желчью.
Противоречие: активность ферментов в
сыворотке падает быстро, а число
ферментов, выводимых путем экскреции
ограничено ММ.
2. Первоначальная инактивация ферментов в
плазме и катаболизм в клетках различных
тканей
14. Период "полужизни" некоторых ферментов в плазме крови
Период "полужизни" некоторых ферментов в плазме кровиНазвание фермента
Период "полужизни"
Аспартатаминотрансфераза
17 ± 5 ч.
Аланинаминотрансфераза
47 ± 10 ч.
Глутаматдегидрогеназа
18 ± 1 ч.
ЛДГ1
113 ±60 ч.
ЛДГ5
10 ±2 ч
Креатинкиназа
15 ч.
Щелочная фосфатаза
γ-Глутамилтранспептидаза
3 — 7 дней
3 — 4 дня
Холинэстераза
10 дней
Амилаза
Липаза
3 — 6 ч.
3 — 6ч
15. ОБЩИЕ ПРАВИЛА ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ФЕРМЕНТОВ
О количестве фермента можно судить только косвеннопо его активности, т. е. по производимому
ферментом действию. Присутствие и количество
фермента распознается по специфичности и
скорости катализируемой им реакции.
Методы определения активности фермента:
по скорости накопления продуктов ферментативной
реакции
по скорости убыли субстрата
Рекомендуется активность ферментов определять по
начальной скорости реакции, когда количество
превращенного субстрата не превышает 20% от
исходного.
16. Основные условия при определении активности ферментов
Буферный раствор должен поддерживать рНинкубационной смеси, близкой к оптимальному для
данного
фермента.
Результаты
определения
активности фермента, полученные с помощью одного
и того же метода, но с разными буферными
растворами, хотя одного и того же рН, несравнимы.
Температура в пределах 25—40°С, как правило 37°С.
При необходимости длительной инкубации к
реакционной смеси добавить антисептики (толуол,
хлороформ, тимол и др.), при этом не влияющие на
активность определяемого фермента.
Поддерживать оптимальный состав реакционной
смеси (присутствие коферментов, ионов металлов и
др.).
17. Методы определения активности ферментов
ВКДЛ наиболее часто - колориметрические и
спектрофотометрические методы.
Колориметрические
методы
измерение
(ФЭК)
интенсивности окраски вещества, образующегося при
взаимодействии субстрата или продукта действия
фермента
со
специфическими
реактивами,
добавленными в пробу, как правило, после остановки
ферментативной реакции.
Спектрофотометрические методы – основаны на
изменении светопоглощения в ультрафиолетовом
спектре при переходе вещества из окисленной формы в
восстановленную. Определение активности ферментов,
основанное
на
разнице
спектров
поглощения
окисленной и восстановленной форм НАД и НАДФ,
получило название оптического теста Варбурга.
18. Требования к материалу при определении ферментов
Кровь натощак или не ранее, чем через 4 ч. послеприема пищи.
Только негемолизированная сыворотка
Быстро отделять сыворотку от сгустка крови (не позже 2
ч. с момента взятия крови).
Хранение сыворотки при комнатной температуре для
большинства ферментов не более 6—8 ч., при 4°С —
около одной недели, а в замороженном состоянии — в
течение одного месяца. Исключение: ЛДГ (активность в
течение первых трех дней лучше сохраняется при
комнатной температуре)
Избегать повторных замораживаний и оттаиваний →
денатурация белка, потеря ферментативной активности.
19. Требования к материалу при определении ферментов (продолжение)
Если определение проводится в замороженной сыворотке,оттаивание сыворотки должно производиться на водяной
бане при температуре 37°С.
Сыворотка лучше, чем плазма. Если в качестве материала
используется плазма учитывать, что многие
антикоагулянты могут ингибировать ферментативную
активность.
ЛДГ и амилаза теряет активность в
"оксалатной" плазме, альдолазы – при использовании
фторидов, . Фториды нельзя использовать при определении
альдолазной активности. Оксалат и цитрат ингибируют
амилазную активность и т.д.
Интерференция лекарств
- салицилаты повышают
активность аминотрансфераз, сульфаниламиды подавляют
активность карбоангидразы, препараты опия могут
увеличивать активность амилазы и т.д.
20. Выражение результатов определения активности ферментов
Единица активности (Е) фермента - количествофермента, которое катализирует превращение 1
мкмоль субстрата (или образование 1 мкмоль
продукта реакции) за 1 мин при заданных
условиях. При этом необходимо указывать
температуру,
при
которой
проводилась
ферментативная реакция. Активность ферментов
в сыворотке или плазме крови следует выражать
в единицах на 1 л.
Возможно выражение результата в каталах (долях
катала) на литр (1 мкат = 60 ЕД).
21. ЛАКТАТДЕГИДРОГЕНАЗА
ЛДГ—гликолитический
фермент,
обратимо
катализирующий
окисление
лактата
в
пировиноградную кислоту.
L-лактат + НАД ↔ пируват + НАДН + Н+
Активность в тканях: практически во всех органах,
нааибольшая активность в почках, сердечной мышце,
скелетной мускулатуре и печени. Много в эритроцитах.
Требования к материалу: полное отсутствие гемолиза (ЛДГ
в эритроцитах ↑ в 100 раз, чем в сыворотке).
Определяют
спектрофотометрическими
и
колориметрическими методами.
Норма в сыворотке – до 195 МЕ (при 250С).
22. Клиническое значение определения активности ЛДГ сыворотки крови
Инфаркт миокарда. ↑ЛДГ спустя несколько часов после ИМ ,max через 36_48 ч (в 10—15 раз по сравнению с нормой). У
больных стенокардией не повышается. Диагностическая
точность при трансмуральном инфаркте 97±1,7% .
Заболевания печени. ↑ЛДГ в сыворотке при поврежедении
целостности гепатоцитов- паренхиматозная желтуха. При
механической желтухе в начале заболевания активность
ЛДГ в норме, а на более поздних стадиях ↑ ЛДГ.
Прогрессирующая мышечная дистрофия ↑ЛДГ
Активность ЛДГ возрастает также при хронических
лимфогранулематозах, лейкозах, пернициозной анемии и
других заболеваниях
23. Изоферменты ЛДГ и их диагностическое значение
Активность изоферментов ЛДГ в сыворотке крови в порядкеубывания: ЛДГ2 > ЛДГ1 > ЛДГ3 > ЛДГ4 > ЛДГ5.
Изоферменты ЛДГ в лейкоцитах в норме: ЛДГ3 > ЛДГ2, > ЛДГ4 >
ЛДГ1 > ЛДГ5.
Инфаркт миокарда: ↑↑↑ ЛДГ1, ↑ ЛДГ2. ЛДГ1/ЛДГ2 > 1. Изменения в
активности изоферментов сохраняются дольше, чем суммарной
активности фермента. При неясной клинической картине и
нормальной общей активности ЛДГ повышение активности
ЛДГ1 указывает на мелкие некротические очаги в миокарде, не
регистрируемые другими способами.
Паренхиматозная желтуха: ↑↑↑ ЛДГ5 и ЛДГ4, ↓ЛДГ1 и ЛДГ2.
Мышечные дистрофии: в мышечной ткани ↓↓ЛДГ4 и ЛДГ5
(степень снижения коррелирует с тяжестью заболевания), ↑↑
ЛДГ1, ЛДГ2, и ЛДГ3. В сыворотке крови ↑↑ ЛДГ1, ЛДГ2 и ЛДГ3.
24. Диагностическое значение изоферментов ЛДГ
Острый лейкоз:↑↑↑ ЛДГ2, ↑ЛДГ3 . Прямо
пропорциональная зависимость между увеличением
ЛДГ2 и количеством незрелых клеток.
Опухолевые заболевания: ↑↑ ЛДГ3 ЛДГ4 и ЛДГ5 в
опухолевой (приближение к эмбриональному типу).
Различия
между
злокачественными
и
доброкачественными максимальны по ЛДГ5. Степень
изменения спектра изоферментов коррелирует с
ростом опухоли.
Заболевания легких: ↑↑ ЛДГ3 при пневмониях. При
выраженной гипоксии ↑ЛДГ4 и ЛДГ5 (активация
гликолиза в связи с перестройкой метаболизма на
анаэробный тип).
25. Аминотрансферазы (трансаминазы) сыворотки.
АсАТ и АлАТ осуществляют межмолекулярный переносаминогрупп между аминокислотами и кетокислотами.
Отличаются по названиям аминокислоты, от которой
отщепляется аминогруппа.
Содержание АсАТ в тканях (по убывающей) – сердечная
мышца, печень, скелетная мускулатура, головной мозг,
почки, семенники. Активность в сердечной мышце в 10000
раз выше, чем в сыворотке. В эритроцитах – в 10 раз
больше, чем в сыворотке. Поэтому сыворотка не должна
содержать даже следов гемолиза.
Содержание АлАТ в тканях (по убывающей)– печень,
поджелудочная, сердце, скелетная мускулатура.
Методы
определения:
спектрофотометрические,
колориметрические, хроматографические.
Норма в сыворотке: АсАТ — 10-30 МЕ/л при 30˚С; АлАТ — 7-40
МЕ/л при 30˚С.
26. Диагностическое значение определения АсАТ и АлАТ в сыворотке
Инфаркт миокарда ↑↑↑ АсАТ (в 2-20 раз), ↑↑ АлАТ в 98% случаев. Ч/з6-12 час., максимум – 24-48 часов, нормализация ч/з 4-5 дней.
Степень повышения коррелирует с прогнозом. При стенокардии–
в норме.
Заболевания печени: ↑↑↑ АлАТ, ↑ АсАТ при поражении гепатоцитов.
Максимум на 6-10 день, нормализуется на 15-20 день. ↑↑↑ АлАТ
отмечается рано (уже в инкубационом периоде) и даже при
безжелтушных формах.
Снижение АсАТ и АлАТ
- при недостаточности пиридоксина
(витамина В6), процедуры гемодиализа; ХПН, Беременность.
Коэффициент де Ритиса: АсАТ / АлАТ = 1,33.
Коэффициент Шмидта: для дифференциальной диагностики
заболеваний печени – (АсАТ + АлАТ) /ГлДГ (глютамат
дегидрогеназа). При паренхиматозном гепатите ГлДГ меняется
незначительно, а при механических желтухах – ↑↑↑ ГлДГ, но АсАТ
+ АлАТ ↑.
27. α- амилаза сыворотки и мочи
Гидролазы,катализирующие
гидролиз
полисахаридов. В плазме амилаза двух
изоэнзимных типов - панкреатическая –
Р-тип (составляет 40%) и слюнная – S-тип
(60%). С мочой выделяется в основном Ртип.
Норма в сыворотке 16-30 г/чхл, в моче – до
160 г/чхл.
28. Клиническое значение определения α- амилазы
Диагностика заболеваний поджелудочной железы (особенноуроамилаза в суточной моче). При о. панкреатите амилаза крови
и мочи ↑↑↑ через 4-6 часов от начала заболевания, максимум 1224 часа (в 10-30 раз), затем быстро снижается и приходит к
норме на 2-6 день. Диагностическая чувствительность амилазы
сыворотки для острого панкреатита – 95%, специфичность –
88%. Уровень повышения сывороточной амилазы не
коррелирует с тяжестью панкреатита.
Дополнительный диагностический признак при о. почечной
недостаточности с олигурией, прободной язве, диабетическом
кетоацидозе (↑ в 5-10 раз);
ХПН, паротит - ↑ менее чем в 5 раз
Снижение показателя имеет место при остром и хроническом
гепатите, недостаточности поджелудочной железы, иногда при
токсикозе беременности.
29. Креатинфосфокиназа сыворотки (КФК)
Катализирует обратимую реакцию переносафосфорильного остатка с АТФ на креатин и с
креатинфосфата на АДФ.
Норма в сыворотке — 195МЕ/л при 30°С.
Требования к материалу: фермент нестабилен,
содержимое эритроцитов ингибирует активность
фермента, сыворотка должна быть быстро
отделена от сгустка. Если исследование не может
быть произведено немедленно, сыворотку
необходимо заморозить.
Методы
определения:
колории
спектрофотометрические.
30. Клиническое значение определения КФК и изоферментов
КФК- ММ – содержится в скелетных мышцах (в норме всыворотке он составляет 97 — 100%). ↑↑↑ при
повреждении скелетных мышц, мышцы сердца,
мозга?; после тяжелой физической нагрузки.
КФК - MB - характерен для миокарда(в сыворотке 0—
3%). ↑↑↑ в течение 2-4 час после ИМ, сохраняется до
72 ч (если больше – распространение ИМ)
Увеличивается при тяжелом поражении мышц.
КФК - ВВ – характерен для мозга (в норме в сыворотке
отсутствует). Появляется при тяжелом шоке, при
некоторых карциномах, атрезии желчных протоков
31. Гамма-глутамилтранспептидаза сыворотки
Переносит глутаминовую кислоту от глутатиона илидругого γ-глутамилпептида на акцепторный
пептид или на L-аминокислоты. Индуцируется
алкоголем.
Норма: мужчины — 10,4-33,8 МЕ/л, у женщин – 8,822 МЕ/л (определение проводить в пробе без
гемолиза).
Содержание в органах - почки (локализован
преимущественно в щетковидной каемке извитых
канальцев, а в клубочках и собиральных
канальцах ГГТП не обнаружен), в меньшем
количестве в поджелудочной, печени, селезенке.
32. Основные процессы, повышающие активность ГГТ в сыворотке
ЦитолизХолестаз
Интоксикация алкоголем
Опухолевый рост в печени
Лекарственная интоксикация
33. Клиническое применение определения ГГТ в сыворотке
Высокочувствительный индикатор при заболеванияхпечени, особенно у детей. ГГТ часто повышен, когда
трансаминазы и щелочная фосфатаза в норме.
Специфичный показатель алкогольного нарушения
функции печени (у злоупотребляющих алкоголем
сывороточный ГГТ коррелирует с количеством
потребляемого
алкоголя).
Контроль
лечения
алкоголизма.
Маркер
рака
поджелудочной
железы,
предстательной железы, гепатомы (оценка рецидива)
34. Липаза сыворотки
Катализирует расщепление глицеридов на глицерин ивысшие жирные кислоты. Норма: 0-190МЕ/л
Клинико-диагностическое значение:
При панкреатитах ↑↑↑ (до 200 раз) в течение
нескольких часов после острого приступа, максимум
через 12-24 часа, нормализуется через 10-12 дней.
Диагностическая чувствительность теста – 86%,
специфичность – 99%. Одновременное определение
уровня амилазы (кровь и моча) и липазы – основа
диагностики острого панкреатита.
Липаза сыворотки ↑ при инфаркте кишки,
перитоните, желчной колике, разрушении жировой
ткани – костных переломах, ранении мягких тканей,
после операций.
35. Кислая фосфатаза сыворотки
Содержится почти во всех органах и тканях, в наибольшемколичестве в клетках крови, предстательной железе, печени,
почках, костях. В предстательной железе активность в 100 раз
выше, чем в других тканях. У мужчин половину сывороточной
КФ вырабатывает простата, а остальную часть – печень,
разрушающиеся тромбоциты и эритроциты. У женщин фермент
вырабатывается печенью, эритроцитами, тромбоцитами.
Норма (варьирует в зависимости от метода): 0-6,5 МЕ/л
Требования к материалу: для исследования нельзя брать кровь в
течение 24 ч после массажа простаты или ее инструментального
исследования. Исследование необходимо выполнять быстро, т.к.
активность фермента, быстро падает. Проба не должна быть
гемолизированной. Для иммунологических исследований
сыворотку можно хранить замороженной до 3—4 дней.
36. Клинико-диагностическое значение определения КФ
Диагностика рака простаты. КФ ↑↑↑ у 20-25%больных раком без метастазов и у 60% больных с
метастазами. При карциноме простаты в
сыворотке
повышается
т.н."простатическая
фракция" КФ (норма менее 4 МЕ/л)
Дополнительный диагностический признак при
болезни Гоше, злокачественном поражении
костей,
болезнях
почек,
заболеваниях
гепатобилиарной
системы,
ретикулоэндотелиальной системы, тромбоэмболиях.
37. Щелочная фосфатаза сыворотки
Щелочнаяфосфатаза
присутствует
в
высокой
концентрации в растущих костях (вырабатывается
остеобластами), в желчи и в плаценте. В сыворотке
щелочная фосфатаза содержится в виде смеси
изоферментов,
еще
не
достаточно
идентифицированных.
Норма (варьирует в разных методах): 24 -71 МЕ/л при
30°С.
Требования к материалу:
хранить в холодильнике не более 48 ч (значения
могут повышаться до 10%). В размороженном
состоянии активность падает.
В качестве антикоагулянтов не использовать
фтористые соединения и оксалат.
38. Клинико-диагностическое значение определения ЩФ
Повышение щелочной фосфатазы в сыворотке наблюдается:у детей (нормальный рост костей) - в связи с ростом костей вплоть
до периода полового созревания.
при костных заболеваниях, связанных с увеличением количества
остеобластов, гиперпаратиреозе, рахите, остеомаляции, опухолях
костей (остеосаркома, метастазы опухоли), болезни Педжета
(деформирующий остеит), при саркоидозе Бека;
при закупорке желчных протоков. Ранний признак обтурации,
причем при механической желтухе на почве опухоли степень
повышения выше, чем при желтухе на почве камня. Может быть
при гепатитах и циррозах без признаков холестаза (по неясному
механизму)
при
лекарственно-индуцированных
поражениях
печени
(хлорпромазин, метилтестостерон).
при беременности в норме. Но очень высокие цифры могут быть
у женщин с преэклампсией как следствие повреждения плаценты.
Снижение ЩФ - при гипотиреозе и при замедленном росте у детей.
39. Холинэстераза
Имеется 2 типа ХЭ:ацетилхолинэстераза (истинная ХЭ) –
преимущественно в нервной ткани,
скелетных мышцах, в более низкой
концентрации – эритроцитах
сывороточная
–
псевдохолинэстераза,
присутствует в печени, пожделудочной,
секретируется
печенью
в
кровь.
Катализирует реакцию гидролиза АХ.
Норма сывороточной ХЭ - 5300-12900 МЕ/л
40. Клинико-диагностическое значение определения ХЭ в сыворотке
Высокочувствительный индикатор нарушения синтетическойфункции печени. Обратно пропорционально
тяжести
заболевания (наиболее низкие показатели накануне печеночной
комы).
Для контроля за применением релаксантов в хирургической
практике. ХЭ сыворотки разрушает курареподобные вещества
(дитилин, сукцинилхолин). При недостатке ХЭ возможны
осложнения - апное, холинэргический шок.
Диагностика отравлений фосфорорганическими веществами
(ингибиторы ХЭ)
Дополнительный тест при ИМ (снижение ХЭ под действием
веществ, поступающих из очага некроза)
Повышение ХЭ наблюдается при нефротическом синдроме
(связывают с увеличением синтеза альбуминов в печени из-за
быстрой потери этой фракции белков с мочой), при ожирении, в
меньшей степени при гипертонии, сахарном диабете, хорее,
депрессивных неврозах.
41. Глутаматдегидрогеназа
Ãëóòàìàò Í 2Î ÍÀÄ êåòîãëóòàð àò NH3 ÍÀÄ ÍЛокализация:
преимущественно
клетки
печени
(митохондрии), мало в нервной ткани, скелетных
мышцах, миокарде.
Определение: оптический тест Варбурга
Норма в сыворотке – практически отсутствует
Диагностическое значение – заболевания печени, степень
повышения отражает глубину цитолиза.
Динамика сходна с ГГТ. Отличия: наиболее высокий
ГлДГ при острых повреждениях, а ГГТ – при
хронической патологии печени
42. Сорбитолдегидрогеназа (идитолдегидрогеназа)
СДГСорбитол НАД Фруктоза НАД Н Н
Локализация: печень-цитоплазма (57%), простата (14%),
почки (12%), в других органах мало.
Определение: оптический тест Варбурга.
Норма в сыворотке – следы.
Диагностическое
значение:
повышение
отражает
поражение печени, однако нормальные значения не
говорят об отсутствии поражения. Используется в
сочетании с другими показателями. ↑ СДГ(в 5-20 раз)–
в первые 10 дней при всех формах острого гепатита,
при хр. гепатите и циррозе - ↑ при обострении. При
механических желтухах повышается мало (в 2-3- раза).
43. Энзимодиагностика заболеваний печени
Маркеры цитолиза гепатоцитов – ↑АлАТ,АсАТ, ГлДГ, ЛДГ, ГГТ
Маркеры холестаза
- ↑ ЩФ, ГГТ,
желчные кислоты, билирубин, ХС, ↓
ПТИ.
Гепатоцеллюлярная недостаточность ↓ХЭ, АсАТ> АлАТ, ↓ альбумин,
фибриноген, ПТИ.
44. Энзимодиагностика при заболеваниях поджелудочной железы
Острый панкреатит - ↑ α-амилаза - (изофермент Р),с тяжестью заболевания не коррелирует. При
панкреонекрозе отсутствует.
↑ α-амилаза мочи - (позже, но держится дольше)
↑ липаза крови (макс 2-3 сут, норма- на 10-12 сутки)
↑ трипсин ( в 10-40 раз)
↑ эластаза, уже на субклинической стадии (первые
48 часов, с постепенным снижением) – высоко
чувствителен и специфичен.
45. Энзимодиагностика острого инфаркта миокарда
Изучаемыйпараметр
Начало
увеличения
активности, ч
Максимум
увеличения
активности, ч
Возвращение
к норме, сут
Кратность
увеличения,
раз
КК
2-4
24-36
3-6
3-30
КК-МВ
2-4
12-18
2-3
До 8
ЛДГ
8-10
48-72
6-15
»8
ЛДГ1
8-10
30-72
7-20
»8
Миоглобин
0,5-2
6-12
2-3
» 20
3,5-10
12-18
(и 3 - 5-й
день
7-20
» 400
Тропонин Т
46. Энзимодиагностика болезней мышц и костей
Маркер при заболеваниях костной ткани –ЩФ.
Остеопороз -N
Остеомаляция - ↑↑↑
Болезнь Педжета ↑↑↑
Маркер при заболеваниях мышц - ↑↑↑КК
(оценка эффективности терапии), ↑АсАТ
Мышечная дистрофия
Полимиозит
Дерматомиозит
47. Наследственные энзимопатии
Основные последствия ферментативных дефектов:Уменьшенное образование продукта реакции
(если это жизненно важный продукт - клиника)
Накопление субстрата (если он токсичен –
клиника)
Усиление образования других метаболитов (если
продукты второстепенного пути токсичны –
клиника)
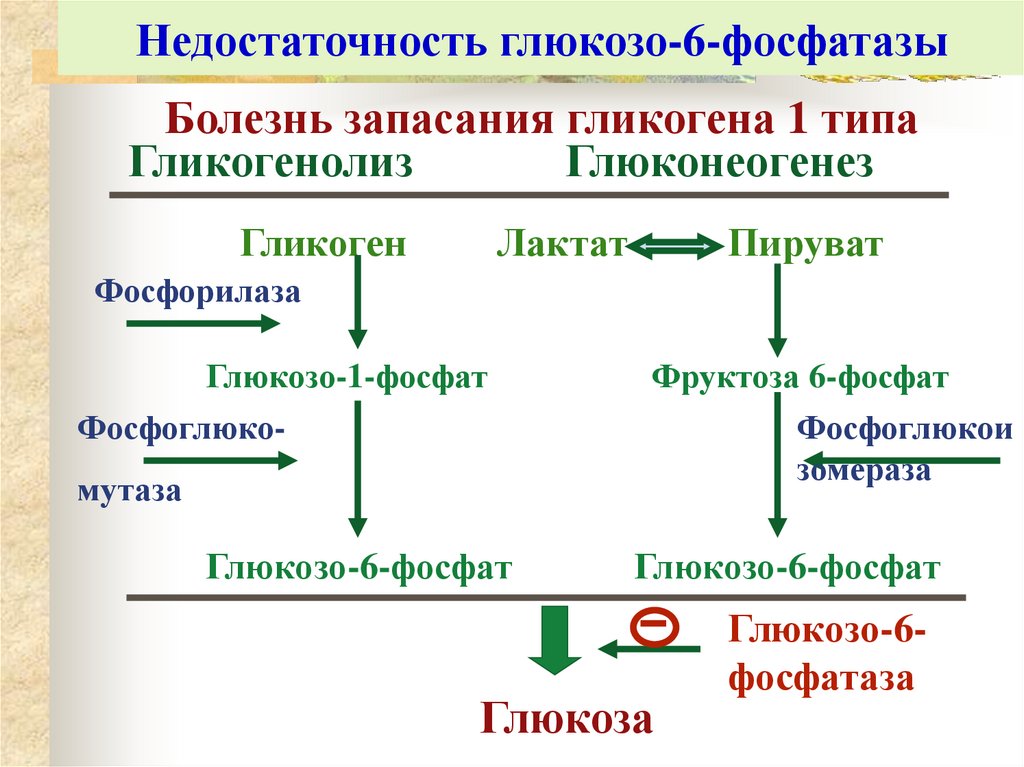
48. Недостаточность глюкозо-6-фосфатазы
Болезнь запасания гликогена 1 типаГликогенолиз
Глюконеогенез
Гликоген
Лактат
Пируват
Фосфорилаза
Глюкозо-1-фосфат
Фруктоза 6-фосфат
Фосфоглюко-
Фосфоглюкои
зомераза
мутаза
Глюкозо-6-фосфат
Глюкозо-6-фосфат
Глюкоза
Глюкозо-6фосфатаза
49. Клинические последствия и диагностика дефицита глюкозо-6-фосфатазы
Тяжелаягипогликемия голодания (единственный
источник глюкозы – поступление с пищей)
Накопление гликогена в печени → гепатомегалия
Блокирование глюконеогенеза → накопление лактата
→ ацидоз
Усиление
синтеза жиров (компенсаторно) →
гиперлипидемия
Нарушение
функции
тромбоцитов
вследствие
отложения гликогена → склонность к кровотечениям
Окончательная
диагностика
–
отсутствие
ферментативной активности в биопсийном материале
печени
50. Галактоземия
Отсутствиефермента
галактозо-1фосфатуридилтрансферазы,
превращающего
галактозу в глюкозу → накопление галактозо -1фосфата → токсические проявления.
Клинические проявления: задержка роста, рвота,
гепатомегалия,
желтуха,
инфекции
E.coli,
гипогликемия, нарушение функции почечных
канальцев, катаракта.
Диагностика: измерение активности галактозо-1фосфатуридилтрансферазы в эритроцитах.
Лечение: исключение галактозы и лактозы.
51. Фенилкетонурия
Частота заболевания в Европе: 1 : 10000Белки
Белок пищи
тканей
Фенилаланин
Белки
тканей
Тирозин
Меланин
Фенилаланингидроксилаза
Фенилпировиноградная
кислота (Фенилкетон)
Моча (
Фенилкетонурия)
Тироксин
Катехоломины
52. Клинические проявления и диагностика фенилкетонурии
Клиника:Нарушение умственного развития (токсическое
действие фенилаланина на мозг)
Особенности внешности – светлые волосы,
голубые
глаза
(недостаточность
синтеза
меланина
Диагностика: ↑↑↑ фенилаланин в крови. Скрининг:
на 6-10 день после рождения.
Лечение: ограничение потребления фенилаланина
(специальные белки и аминокислоты), особенно
в первые 4 года жизни, компенсация тирозина.
53. Муковисцидоз
Фиброзно-кистозная дегенерация, кистозный фиброзподжелудочной железы.
Эпидемиология:
приблизительно 1:1500-2500 в Европе.
Генерализованное расстройство экзокринной секреции с
увеличением
вязкости
секретов,
нарушение
транспорта хлоридов.
Механизм неизвестен.
Клиника:
Рецидивирующие респираторные инфекции
Недостаточность
поджелудочной
железы
→
мальабсорбция
Закупорка кишечника вследствие гипервязкости
кала (в младенческом возрасте)
54. Лабораторная диагностика муковисцидоза
Повышениеуровня
трипсина
в
сыворотке новорожденных (первые
несколько недель) - неонатальный
иммунореактивный
трипсин
(IRT).
Позже показатель снижается вследствие
истинной
недостаточности
поджелудочной железы.
Определение уровня хлора в поте
Молекулярно-генетические
исследования
55. Наследственные дефекты лизосомных ферментов
1 тип: полное отсутствие активности лизосомных ферментов.Пример- болезнь Помпе (гликогеноз II типа) – отсутствие
активности α-1,4 –глюкозидазы →накопление гликогена в
печени и мышцах → гепатоспленомегалия, нарушение
функции печени, дистрофия разных органов.
2 тип: резкое снижение активности определенного фермента
(активность 5-30% от нормы). Пример – болезнь Гоше –
недостаточность
α–глюкозидазы
→
накопление
глюкоцереброзидов в клетках РЭС → гепатоспленомегалия.
3 тип: снижение общей активности фермента и селективный
блок синтеза отдельных изоферментов. Пример – болезнь
Тей-Сакса
–
отсутствие
А-формы
фермента,
расщепляющего GM2-ганглиозид → накопление GM2 в
мозге → макроцефалия, психомоторная дегенерация,
слепота.
56. Ферменты как опухолевые маркеры
Простатический специфический антиген (PSA) –сериновая протеаза из семейства калликреинов.
Синтез – эпителиальные клетки выводящих
протоков предстательной железы.
В сыворотке:
В свободной форме (10% от общего)
Связанный с α1-антихемотрипсином (90%).
Клиническое применение:
Определяют общий ПСА (tPSA) и свободный (fPSA),
соотношение fPSA/cPSA (свободный).
Показания: диагностика, мониторинг лечения и оценка
прогноза рака простаты.
Референтный интервал – 2,5-4 мкг/мл
57. Ферменты как опухолевые маркеры
Нейронспецифическая енолаза – NSE –цитоплазматический гликолитический
фермент, присутствует в нейронах.
Норма в сыворотке – до 13,2 нг/мл.
Диагностическое значение:
диагностика и мониторинг эффективности
терапии мелкоклеточного рака легкого.
диагностика и мониторинг эффективности
терапии нейробластомы
























































 biology
biology








