Similar presentations:
Современные схемы лечения хронического гепатита С, 1 генотипа
1. СОВРЕМЕННЫЕ СХЕМЫ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ГЕПАТИТА С, 1 ГЕНОТИПА
2.
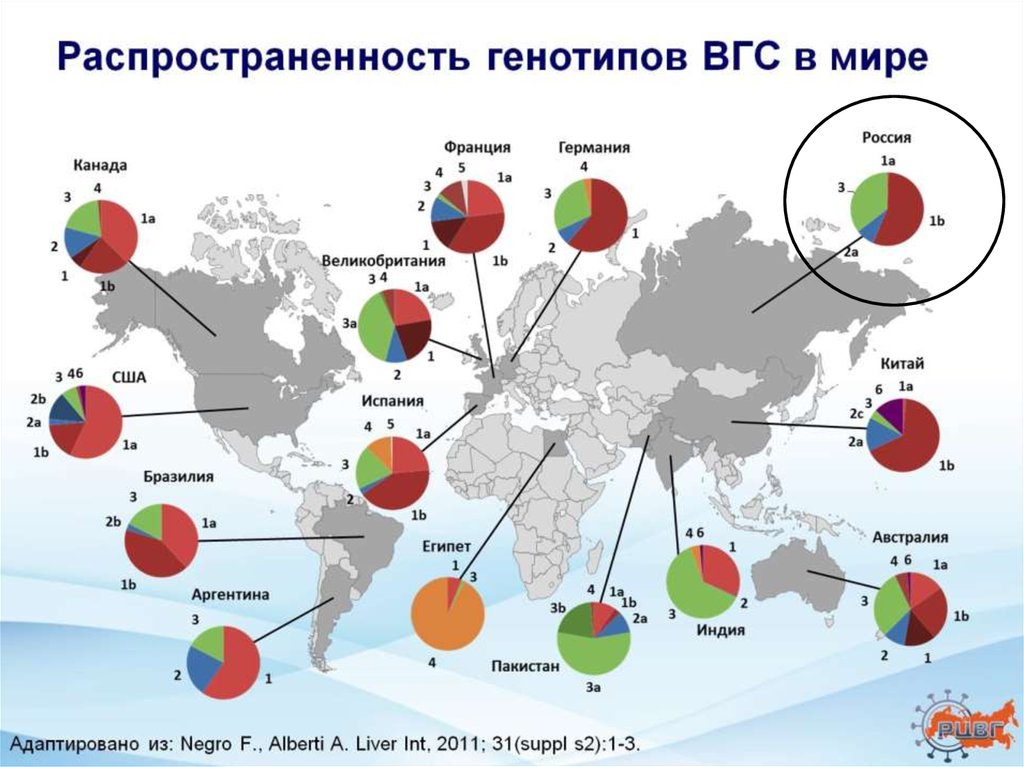
Хронический гепатит С3. Распространенность генотипов ВГС в мире
4.
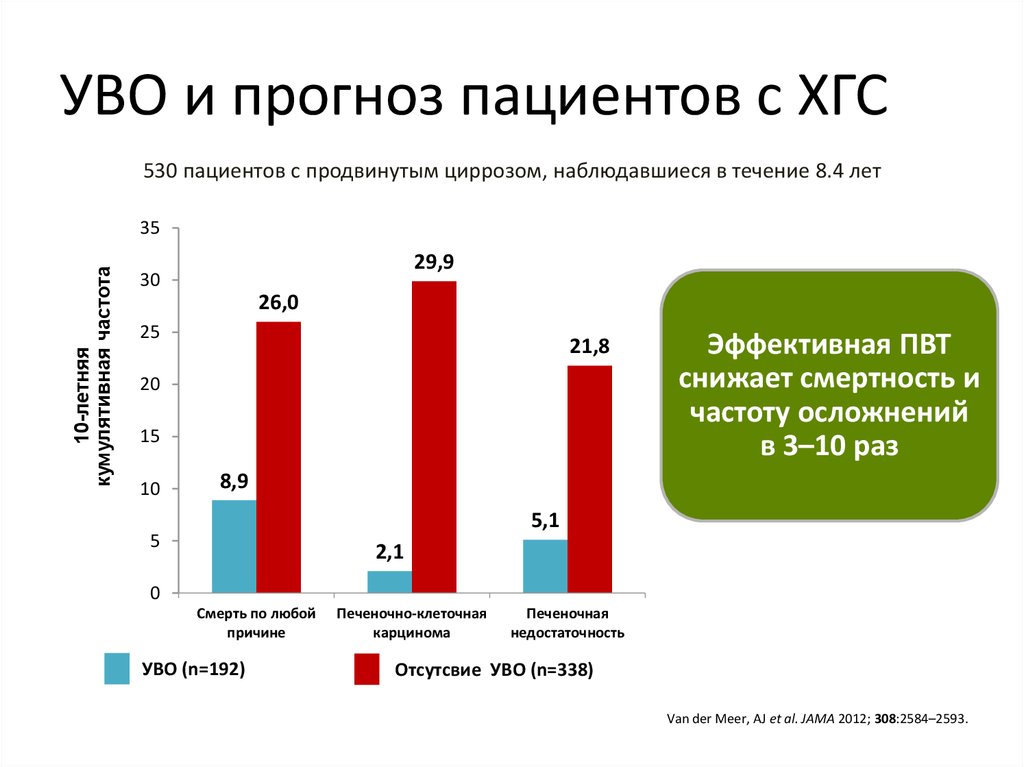
5. УВО и прогноз пациентов с ХГС
530 пациентов с продвинутым циррозом, наблюдавшиеся в течение 8.4 лет10-летняя
кумулятивная частота
35
29,9
30
26,0
25
21,8
20
15
10
Эффективная ПВТ
снижает смертность и
частоту осложнений
в 3–10 раз
8,9
5,1
5
2,1
0
Смерть по любой
причине
УВО (n=192)
Печеночно-клеточная
карцинома
Печеночная
недостаточность
Отсутсвие УВО (n=338)
Van der Meer, AJ et al. JAMA 2012; 308:2584–2593.
6. Эволюция схем лечения хронического гепатита C
ПППД±ПЭГ-ИФН±РБВ
(3-6 мес)
100
ИП+ПЭГ-ИФН/РБВ
(6-12 мес)[8,9, 10]
ПЭГ-ИФН/РБВ
(6-12 мес)[6,7]
УВО (%)
80
ИФН/РБВ
(6-12 мес)[3,4]
60
40
ИФН
(6 мес)[1]
20
ИФН
(12-18 мес)[2,3]
80-99
70-75
50-60
38-43
15-20
8-12
0
1991
1995
1998
2001
2011
2015
1. Carithers RL Jr., et al. Hepatology. 1997;26(3 suppl 1):83S-88S. 2. Zeuzem S, et al. N Engl J Med. 2000;343:1666-1672. 3. Poynard T, et
al. Lancet. 1998;352:1426-1432. 4. McHutchison JG, et al. N Engl J Med. 1998;339:1485-1492. 5. Lindsay KL, et al. Hepatology.
2001;34:395-403. 6. Fried MW, et al. N Engl J Med. 2002;347:975-982. 7. Manns MP, et al. Lancet. 2001;358:958-965. 8. Poordad F, et
al. N Engl J Med. 2011;364:1195-1206. 9. Jacobson IM, et al. N Engl J Med. 2011;364:2405-2416. 10. Sherman KE, et al. N Engl J Med.
2011;365:1014-1024.
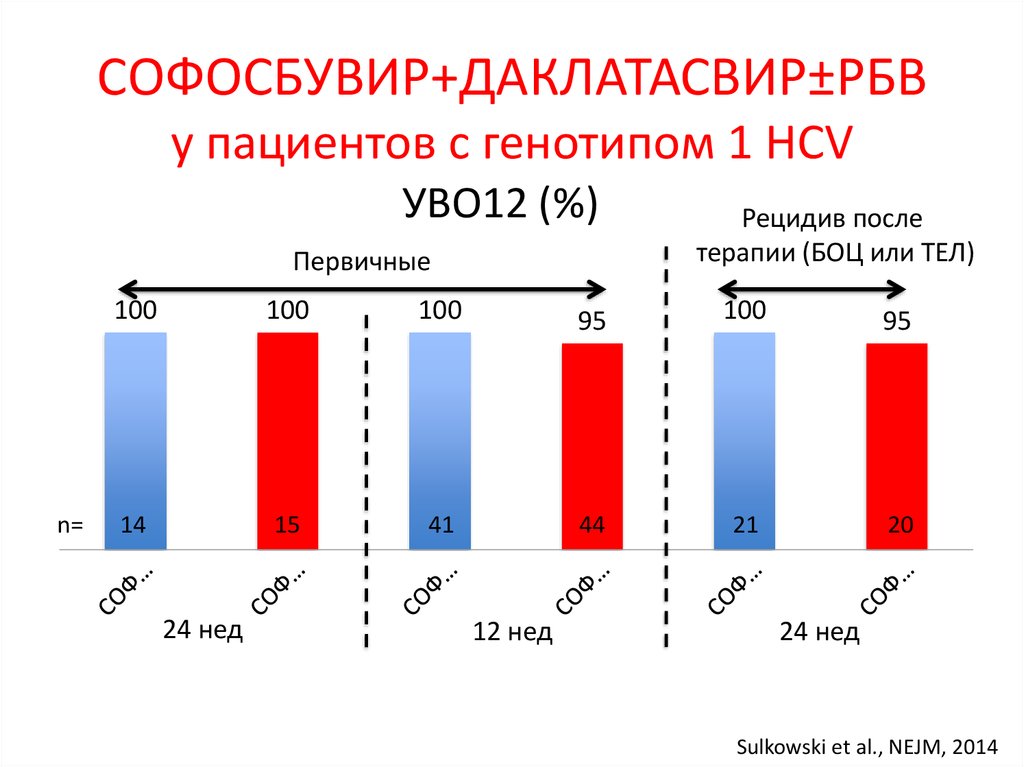
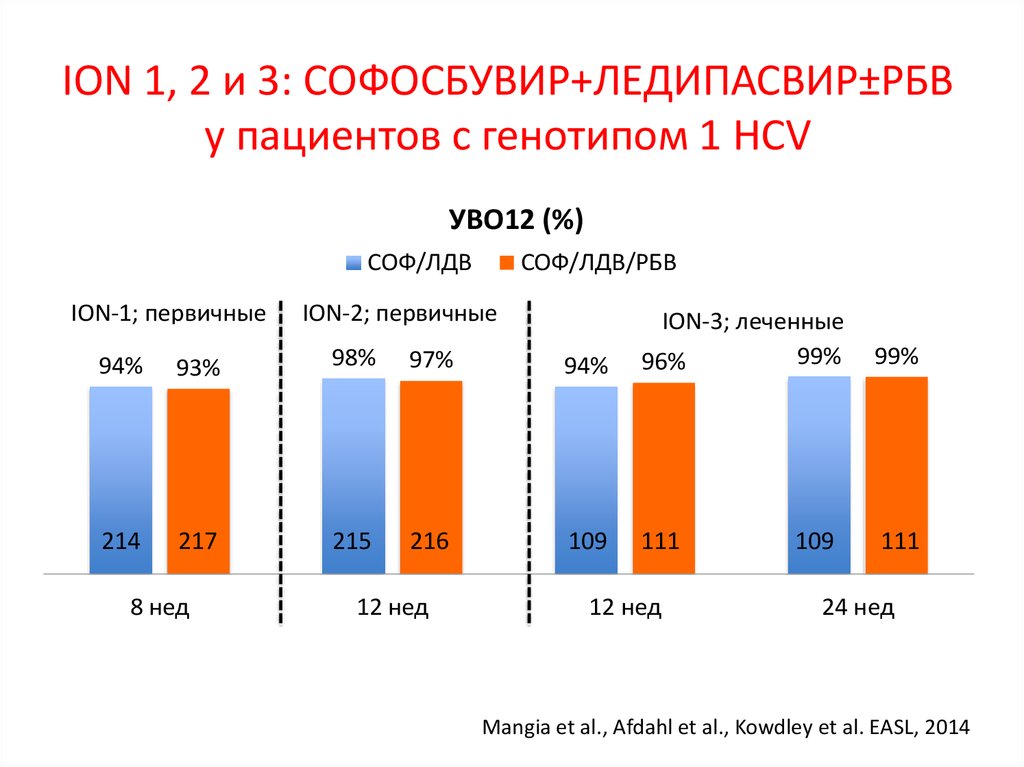
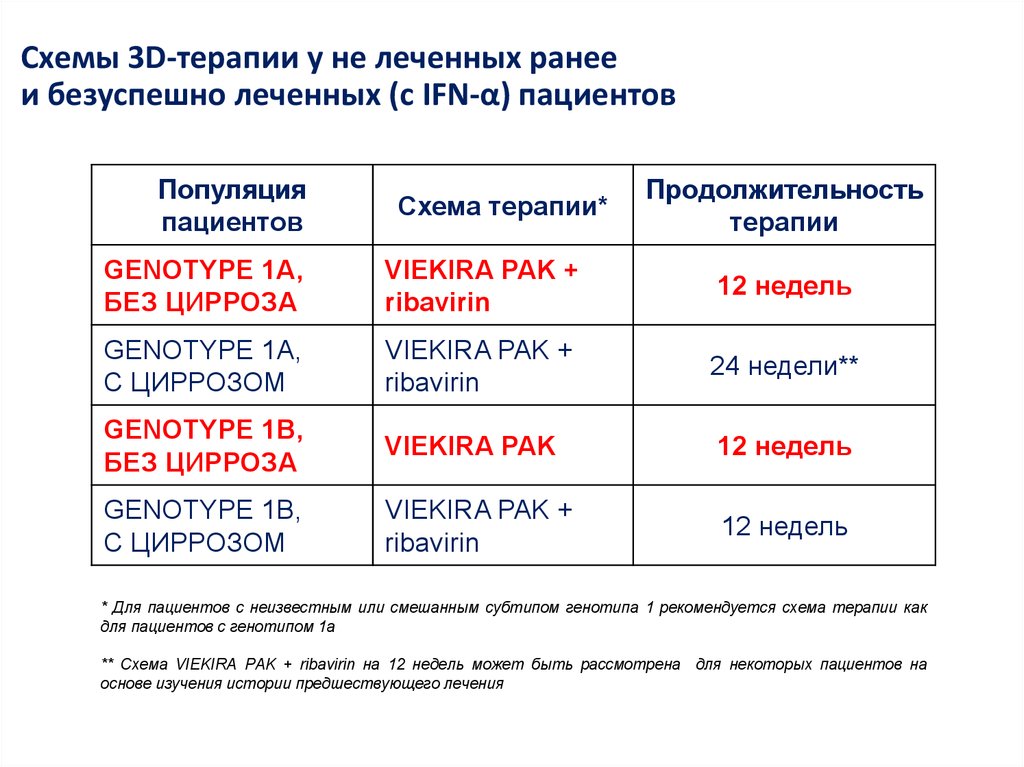
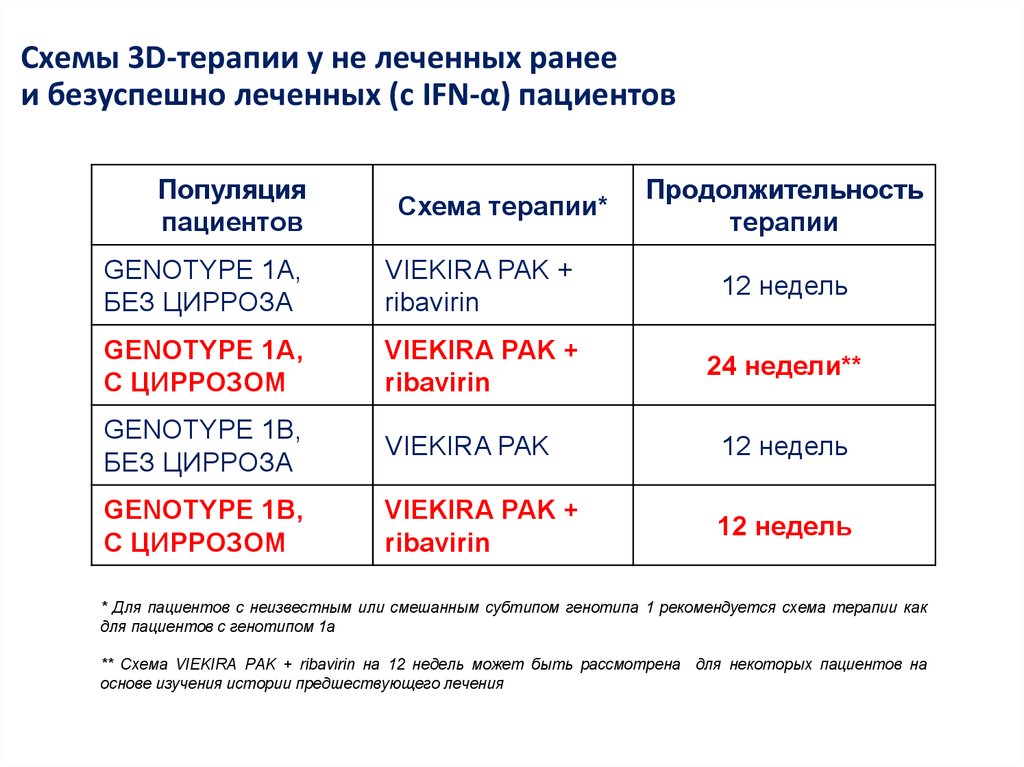
7. Лечение хронического гепатита С (генотип 1) – 2016
неделиЛечение хронического гепатита С
(генотип 1) – 2016
0
12
24
48
Нет противопоказаний к интерферону
ПЭГ-ИФН+РБВ+СОФ
ПЭГ-ИФН+РБВ+НПР
ПЭГ-ИФН/РБВ
ПЭГ-ИФН+РБВ+СМВ
ПЭГ-ИФН/РБВ
Противопоказания или непереносимость интерферона
СОФ+СМВ
СОФ+ДАК
СОФ+ЛЕД
ПАР/РИТ/ОМБ +ДАС
ГРА+ЭБВ
АСУ+ДАК
СОФ+ЛЕД
СОФ+ДАК
Ранее леченные
БОЦ или ТПР
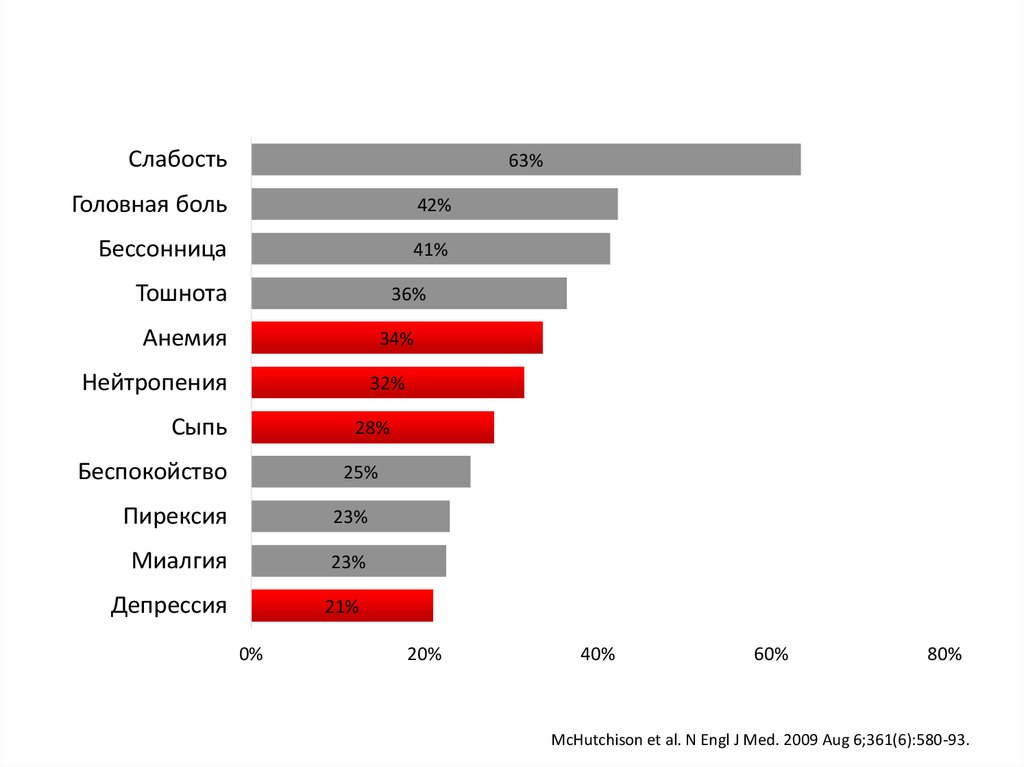
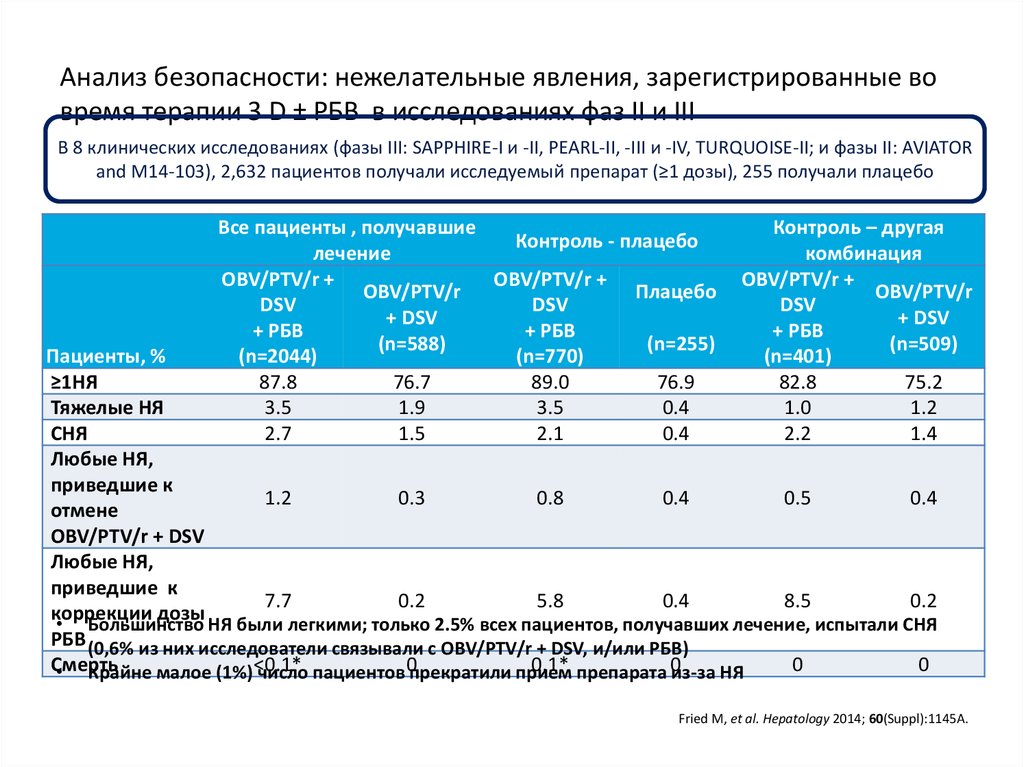
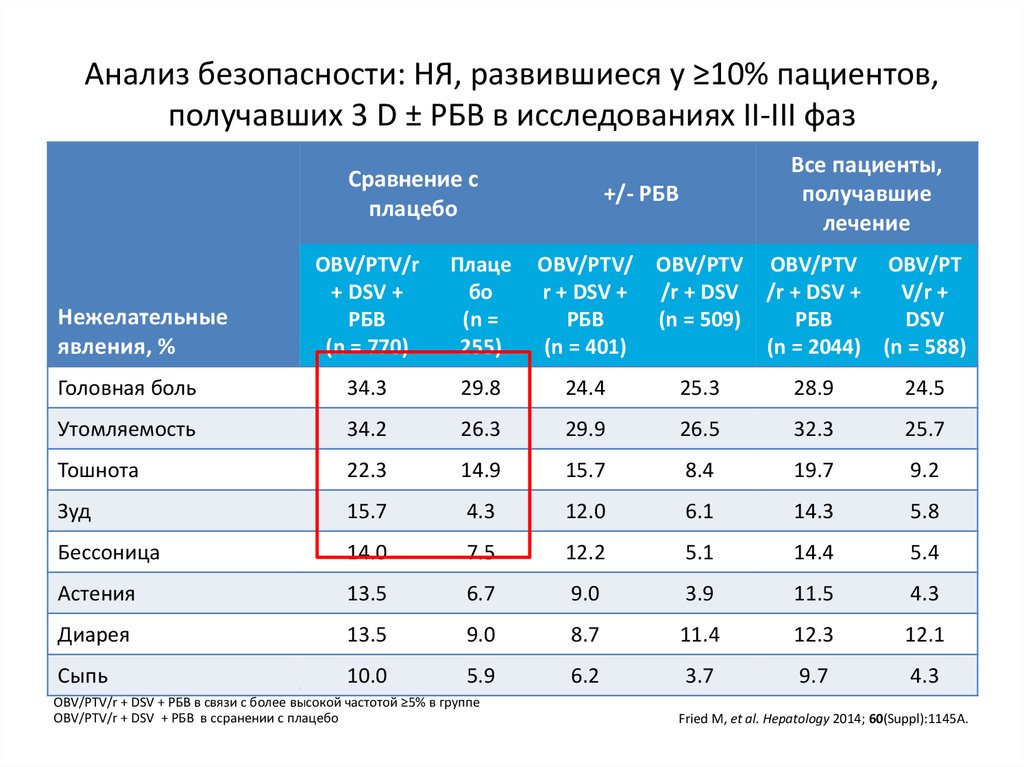
8. озникающие на фоне двойной терапии ПЭГ-ИФНa2a/РБВ (n=1019)
Слабость63%
Головная боль
42%
Бессонница
41%
Тошнота
36%
Анемия
34%
Нейтропения
32%
Сыпь
28%
Беспокойство
25%
Пирексия
23%
Миалгия
23%
Депрессия
21%
0%
20%
40%
60%
80%
McHutchison et al. N Engl J Med. 2009 Aug 6;361(6):580-93.
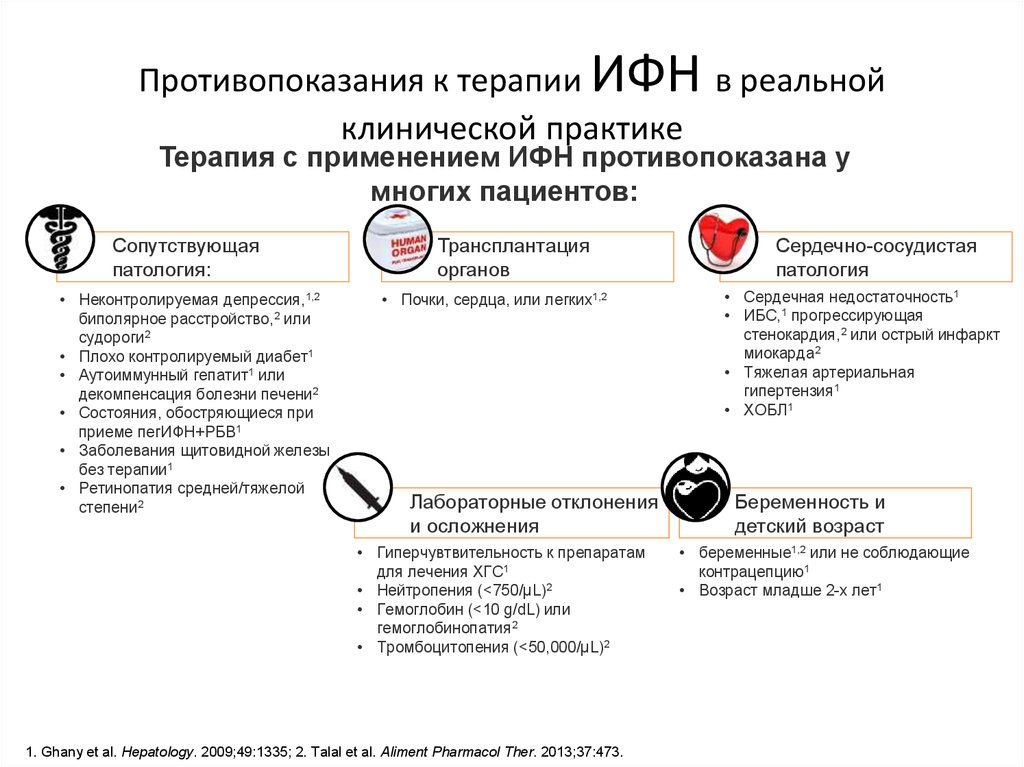
9. Противопоказания к терапии ИФН в реальной клинической практике
ИФНПротивопоказания к терапии
в реальной
клинической практике
Терапия с применением ИФН противопоказана у
многих пациентов:
Сопутствующая
патология:
• Неконтролируемая депрессия,1,2
биполярное расстройство,2 или
судороги2
• Плохо контролируемый диабет1
• Аутоиммунный гепатит1 или
декомпенсация болезни печени2
• Состояния, обостряющиеся при
приеме пегИФН+РБВ1
• Заболевания щитовидной железы
без терапии1
• Ретинопатия средней/тяжелой
степени2
Трансплантация
органов
• Почки, сердца, или легких1,2
Лабораторные отклонения
и осложнения
• Гиперчувтвительность к препаратам
для лечения ХГС1
• Нейтропения (<750/µL)2
• Гемоглобин (<10 g/dL) или
гемоглобинопатия2
• Тромбоцитопения (<50,000/µL)2
1. Ghany et al. Hepatology. 2009;49:1335; 2. Talal et al. Aliment Pharmacol Ther. 2013;37:473.
Сердечно-сосудистая
патология
• Сердечная недостаточность1
• ИБС,1 прогрессирующая
стенокардия,2 или острый инфаркт
миокарда2
• Тяжелая артериальная
гипертензия1
• ХОБЛ1
Беременность и
детский возраст
• беременные1,2 или не соблюдающие
контрацепцию1
• Возраст младше 2-х лет1
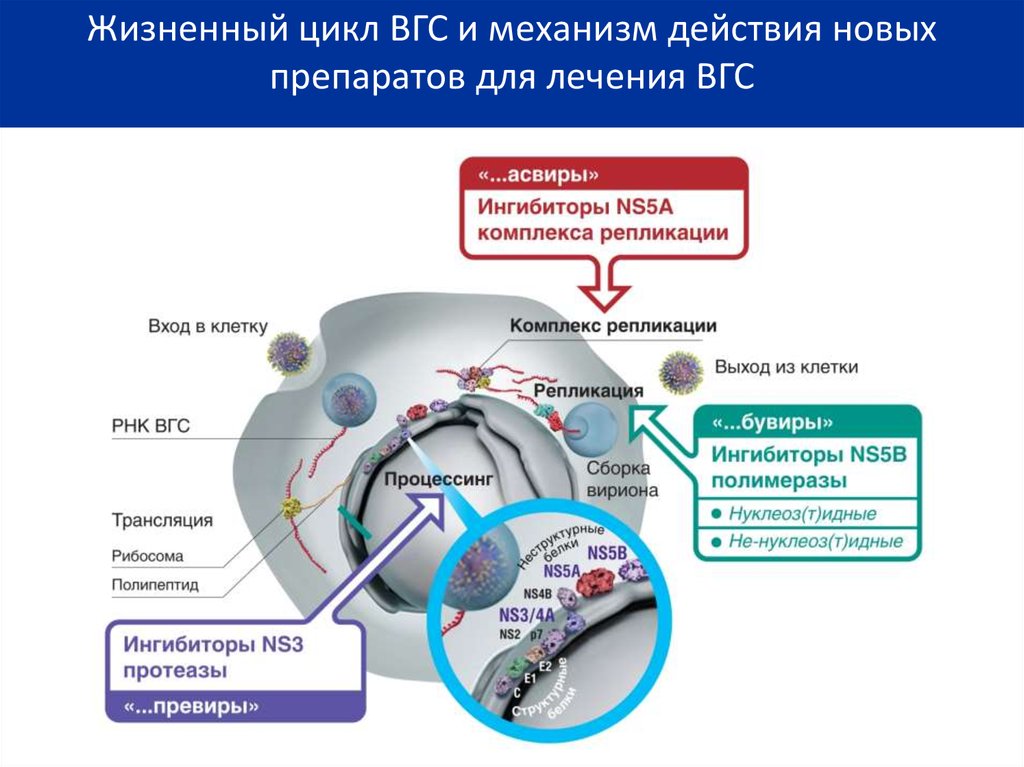
10.
Жизненный цикл ВГС и механизм действия новыхпрепаратов для лечения ВГС
11. Даклатасвир (DCV): ключевые свойства
Высокоселективный ингибитор комплекса репликации NS5A ВГС
Высокая активность (пикомолярная EC50) in vitro
■ Пангенотипическое действие (активен in vitro
против 1-6 генотипов ВГС)
■ Дозирование: 1 таб 60 мг 1 раз в день, вне
зависимости от приема пищи
Основной путь метаболизма - CYP3A4. 88% выводится с калом, 6.6% с мочой
Изменения дозы у пациентов с почечной недостаточностью любой степени
не требуется. Может применяться у пациентов на гемодиализе.
Изменения дозы у пациентов с печеночной недостаточностью не требуется.
В исследованиях при легкой (класс А по шкале Чайлд-Пью), умеренной (класс
В по шкале Чайлд-Пью) и тяжелой (класс С по шкале Чайлд-Пью) печеночной
недостаточности не было выявлено значимых изменений фармакокинетики
препарата.
Инструкция
по медицинскому
применениюизучен
препарата даклатасвир
■ Профиль взаимодействия
в целом
хорошо
12. Асунапревир (ASV): ключевые свойства
• Высокоселективный in vitro ингибитор протеазы NS3 ВГС• Противовирусная активность против HCV генотипов 1, 4, 5 и 6 in
vitro
• Мощное действие (наномолярная EC50)
• Дозирование: 100мг 2 раза в день вне зависимости от приема
пищи
• Изменения дозы у пациентов с почечной недостаточностью
любой степени не требуется. Может применяться у пациентов на
гемодиализе.
• Без изменения дозы применяется у пациентов с
компенсированным ЦП (класс А по шкале Чайлд-Пью) не
требуется. Терапия препаратом пациентов со средней и тяжелой
степенью печеночной недостаточности (класс В и С по шкале
Чайлд-Пью) и декомпенсированным ЦП противопоказана.
Инструкция по медицинскому применению препарата асунапревир
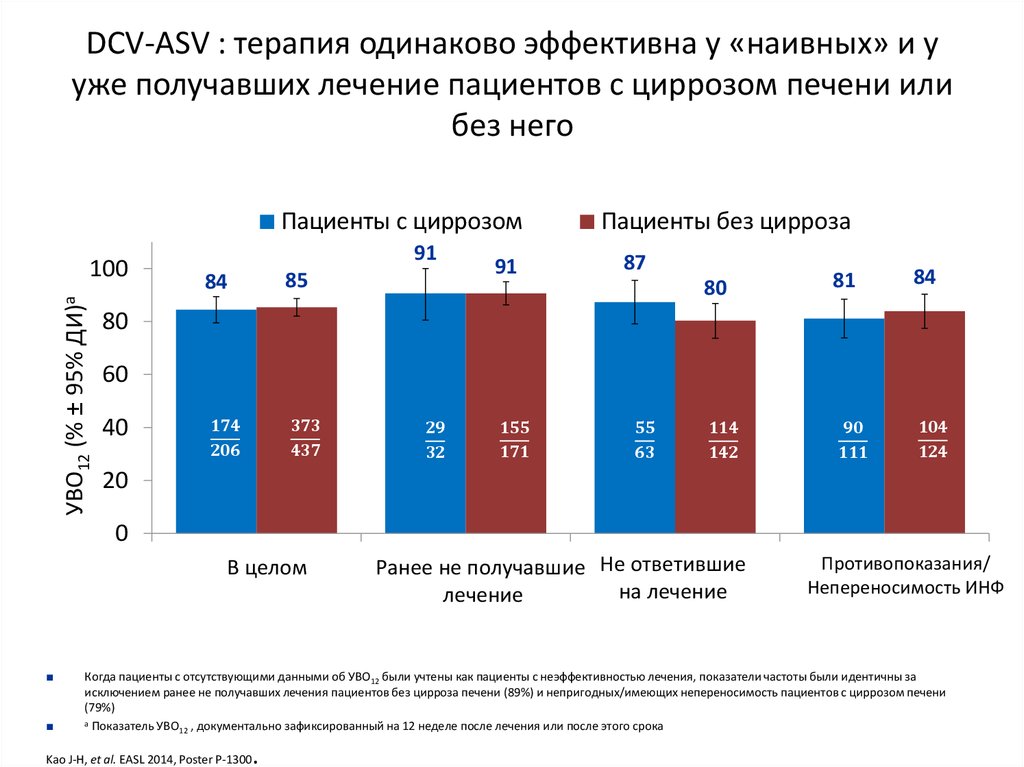
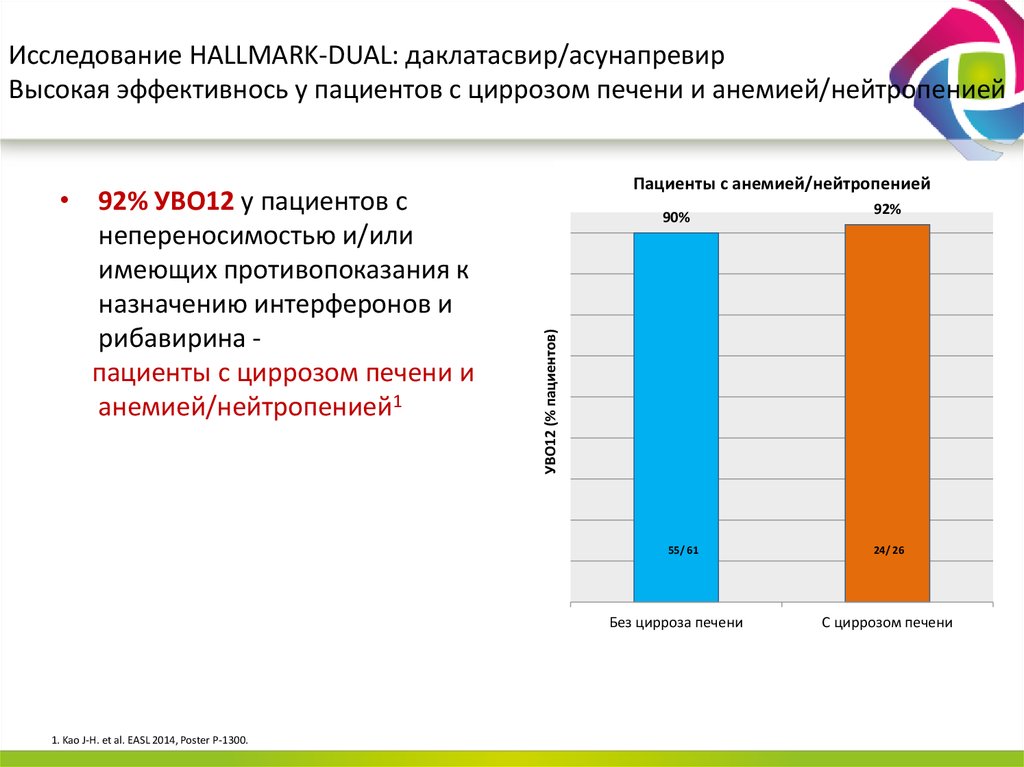
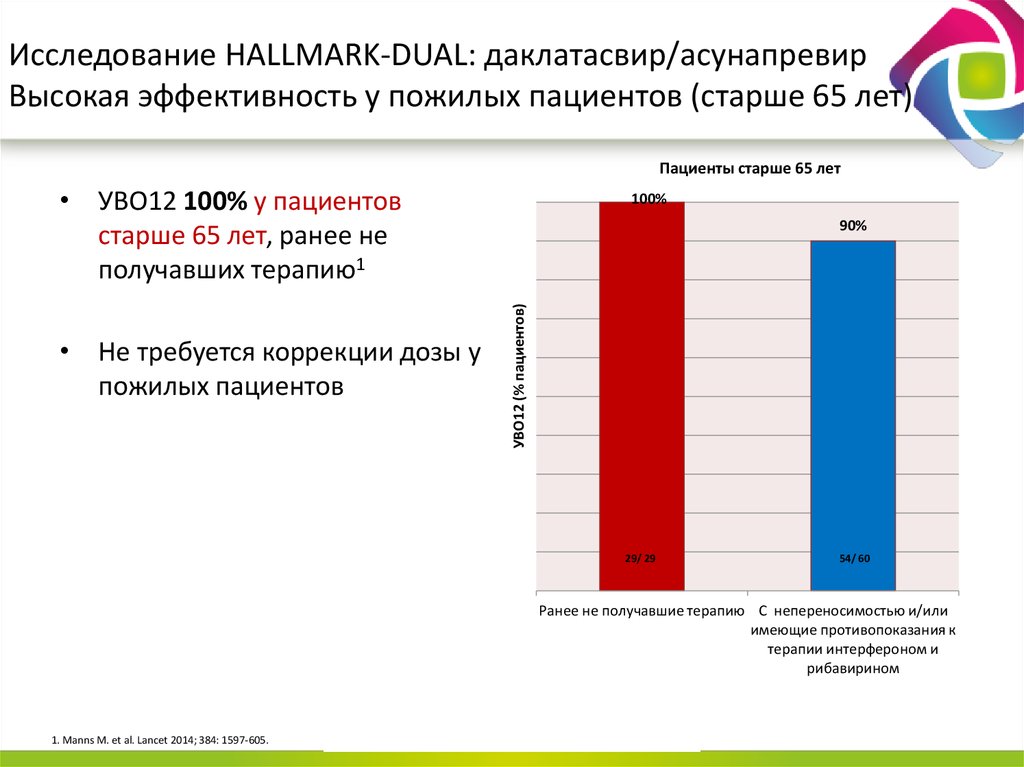
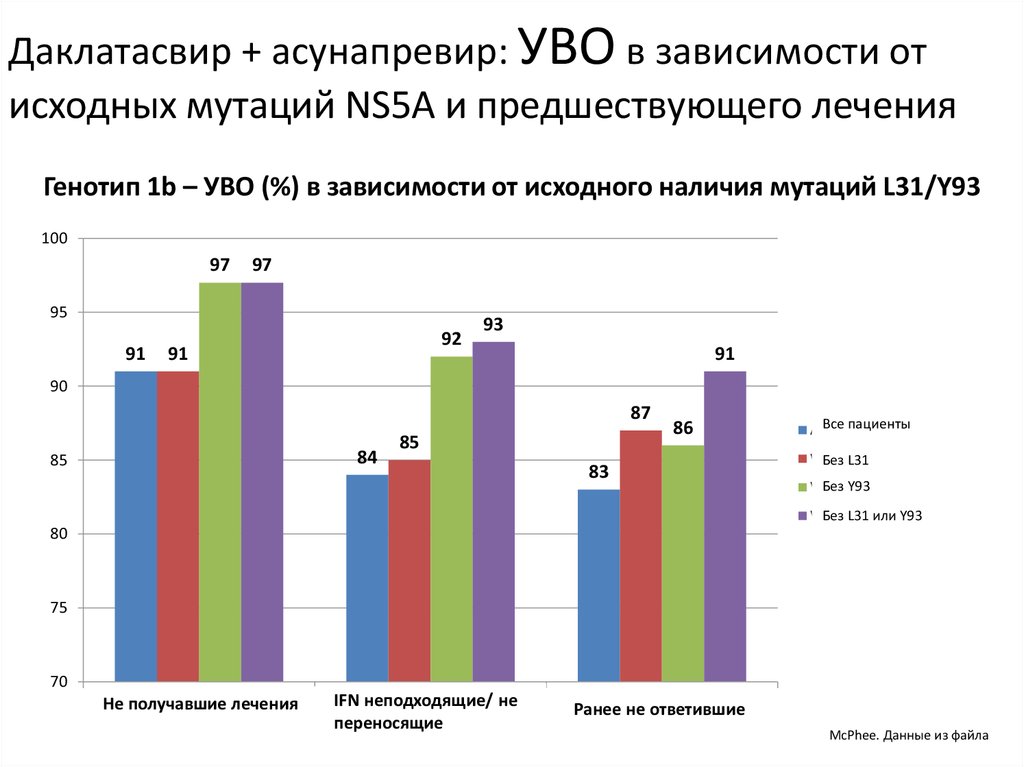
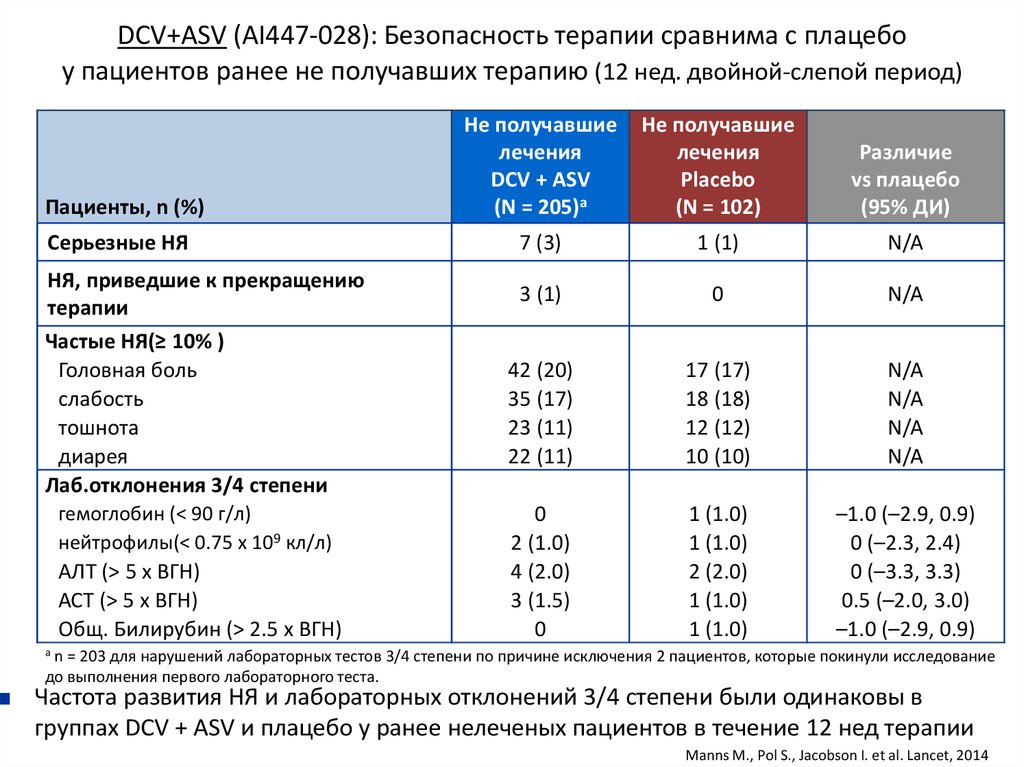
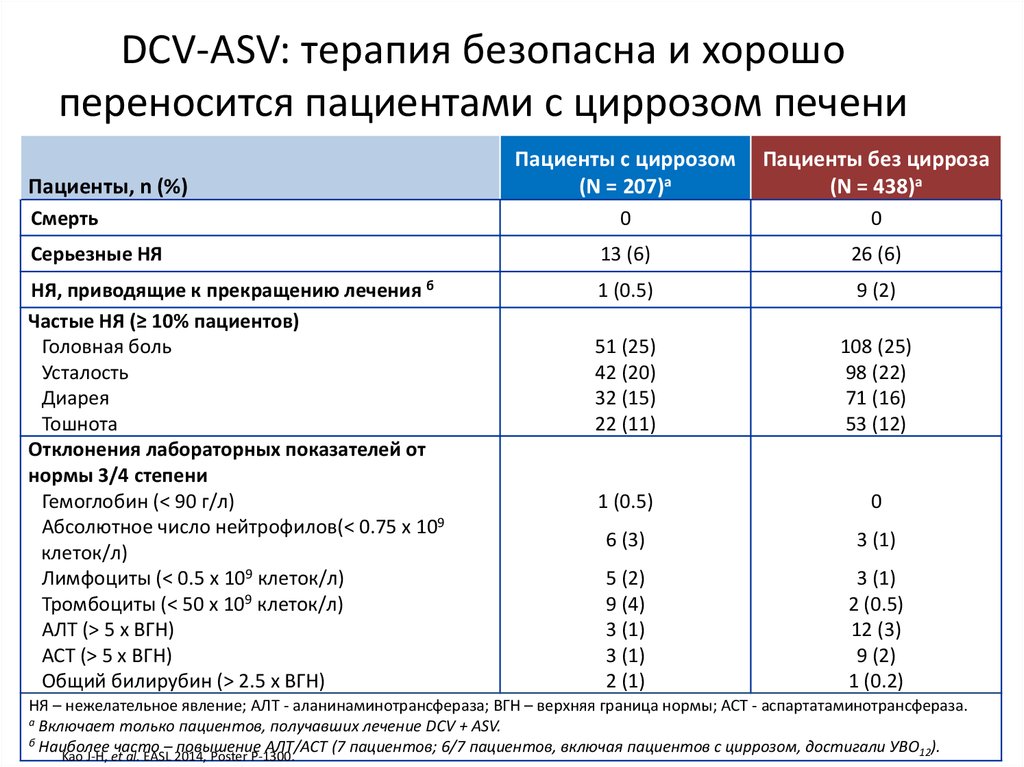
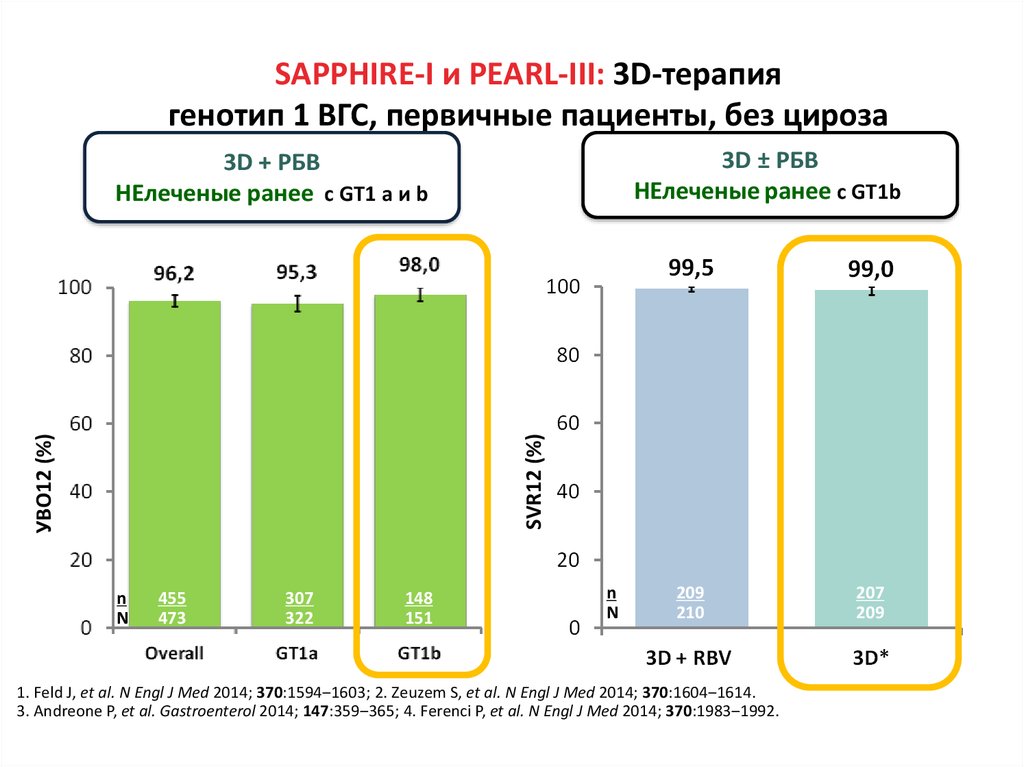
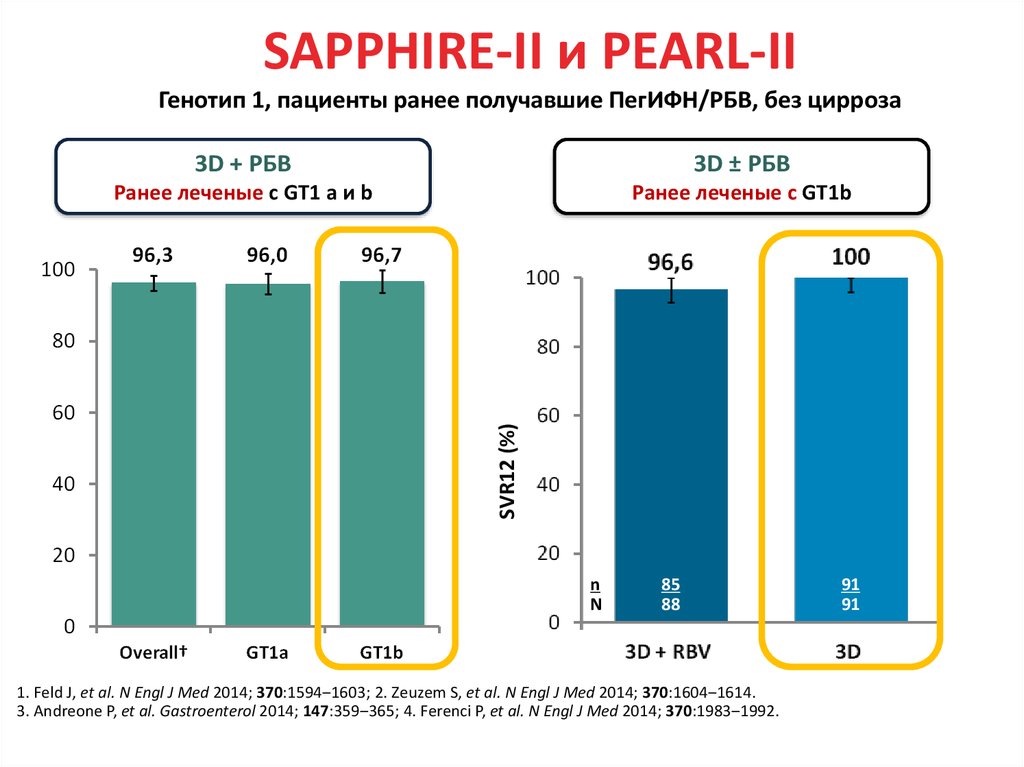
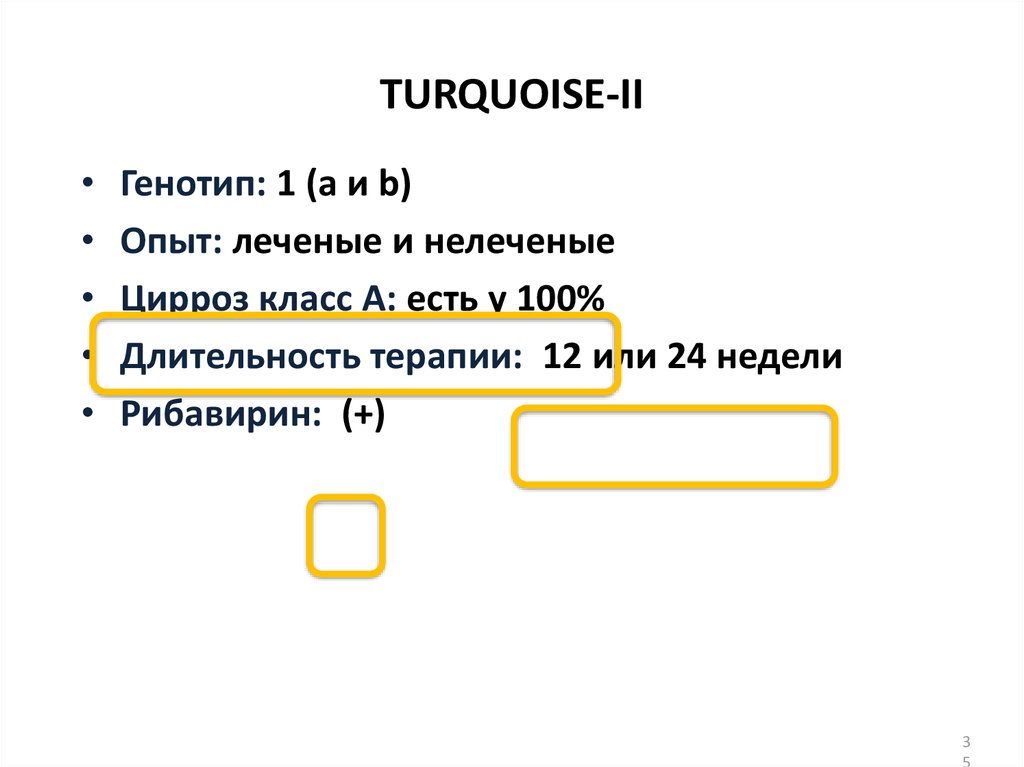
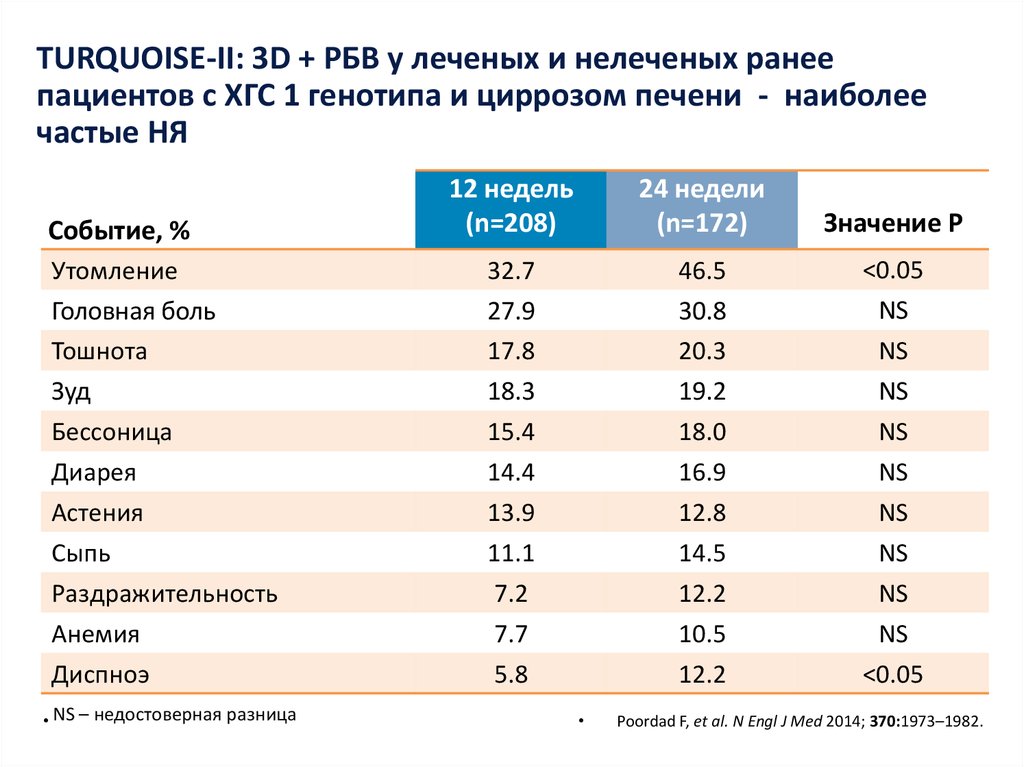
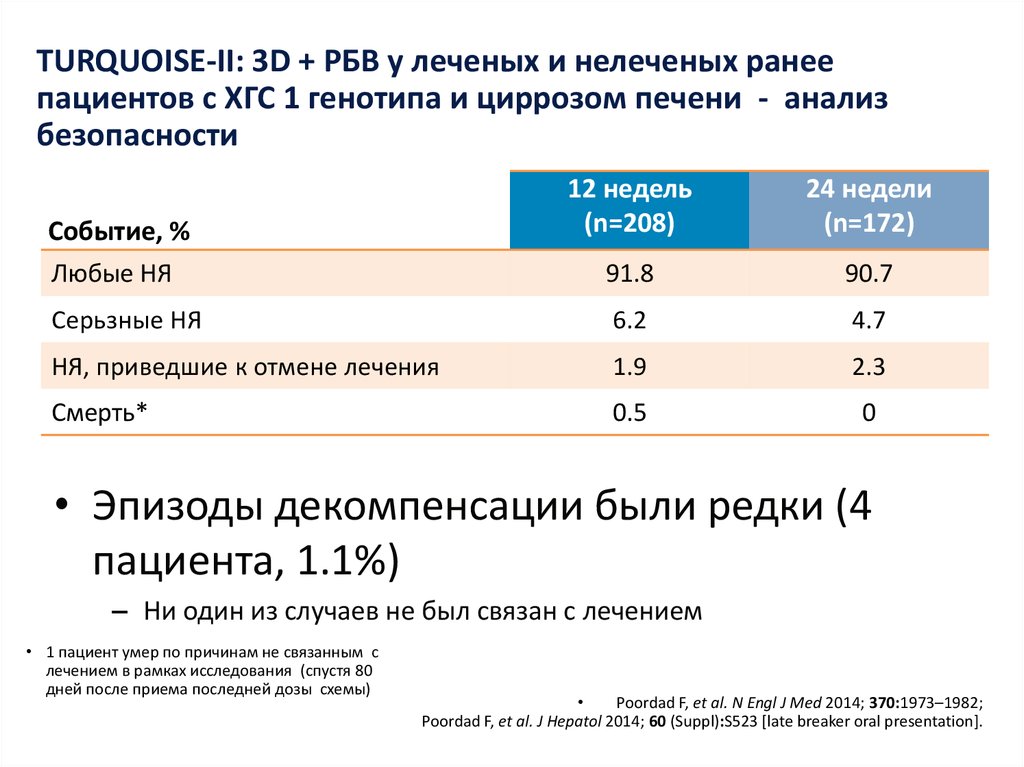
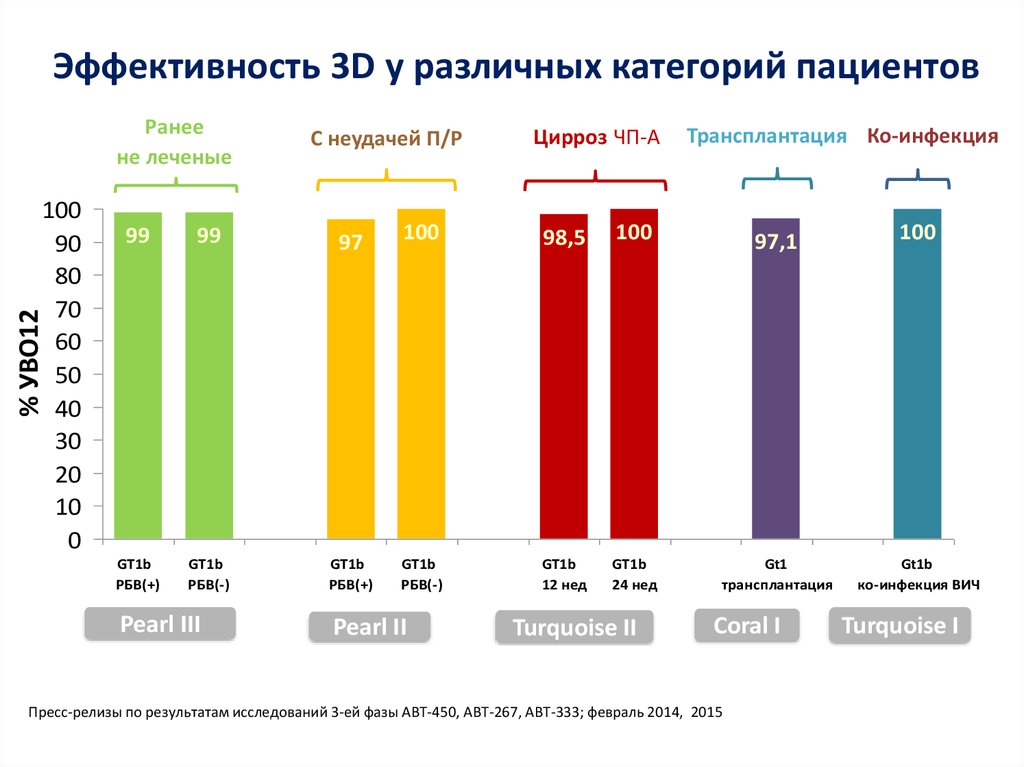
13. Даклатасвир + Асунапревир для лечения пациентов с GT 1b: исследование HALLMARK-DUAL (AI447-028)
Ранее не получавшиетерапию
Рандомизация
1:2
День1
12 нед
24 нед
DCV 60 мг 1 р/д + ASV 100 мг 2 р/д 24 нед
(N = 203)a
DCV-PBO + ASV-PBO
СТОП
12 нед (N = 102)
Не ответившие на
терапию
Противопоказания/
непереносимость
pegIFNα/RBV
48 нед
Наблюдение 24 недели
Включенны в другое
исследование: DCV + ASV 24 нед
DCV + ASV 24 недели
(N = 205)
Наблюдение 24 недели
DCV + ASV 24 недели
(N = 235)
Наблюдение 24 недели
a
Исключая 2 пациентов, которым был назначены DCV + ASV, несмотря на рандомизацию; пациенты
были исключены из анализа эффективности, но оба достигли УВО12.
УВО12
■ Пациенты, инфицированные ВГС генотипа 1b
– Не получавшие ранее терапии
– Не ответившие: нулевой или частичный ответ на терапию pegIFNα/RBV
– Пациенты, имеющие противопоказания/непереносимость(получавшие и не
получавшие ранее терапию pegIFNα/RBV) ввиду:
■ Депрессии
■ Анемии/нейтропении
■ Компенсированного фиброза/цирроза (F3/F4) с тромбоцитопенией
Manns M., Pol S., Jacobson I. et al. Lancet, 2014
14.
DCV+ASV (AI447-028):исходные характеристики пациентов
Параметр
Возраст, годы, медиана
Муж, n (%)
Раса, n (%)
Европ.
Негр.
Азиат.
HCV RNA, n (%)
< 800,000 МЕ/мл
≥ 800,000 МЕ/мл
Цирроз, n (%)
IL28B генотип, n (%)
CC
Non-CC
Не получавшие
лечения
DCV + ASV
(N = 205)
55
101 (49)
Не получавшие
лечения
Placebo
(N = 102)
54
54 (53)
Не ответившиеa
(N = 205)
58
111 (54)
135 (66)
14 (7)
52 (25)
59 (58)
8 (8)
33 (32)
148 (72)
10 (5)
45 (22)
169 (72)
10 (4)
56 (24)
53 (26)
152 (74)
33 (16)
26 (25)
76 (75)
16 (16)
27 (13)
178 (87)
63 (31)
48 (20)
187 (80)
111 (47)
76 (37)
129 (63)
N/A
N/A
29 (14)
173 (84)
82 (35)
143 (61)
Противопоказания/
непереносимостьb
(N = 235)
60
98 (42)
a
Включая 119 (58%) не ответивших, 84 (41%) частично ответивших, и 2 (1%) с возвратом виремии.
Включая 71 (30%) пациентов с депрессией, 87 (37%) с анемией/нейтропенией и 77 (33%) с компенсированным выраженным
фиброзом/циррозом с тромбоцитпенией (6 с выраженным фиброзом [F3], 70 с циррозом [F4] и у 1 не сообщалось).
b
Manns M., Pol S., Jacobson I. et al. Lancet, 2014
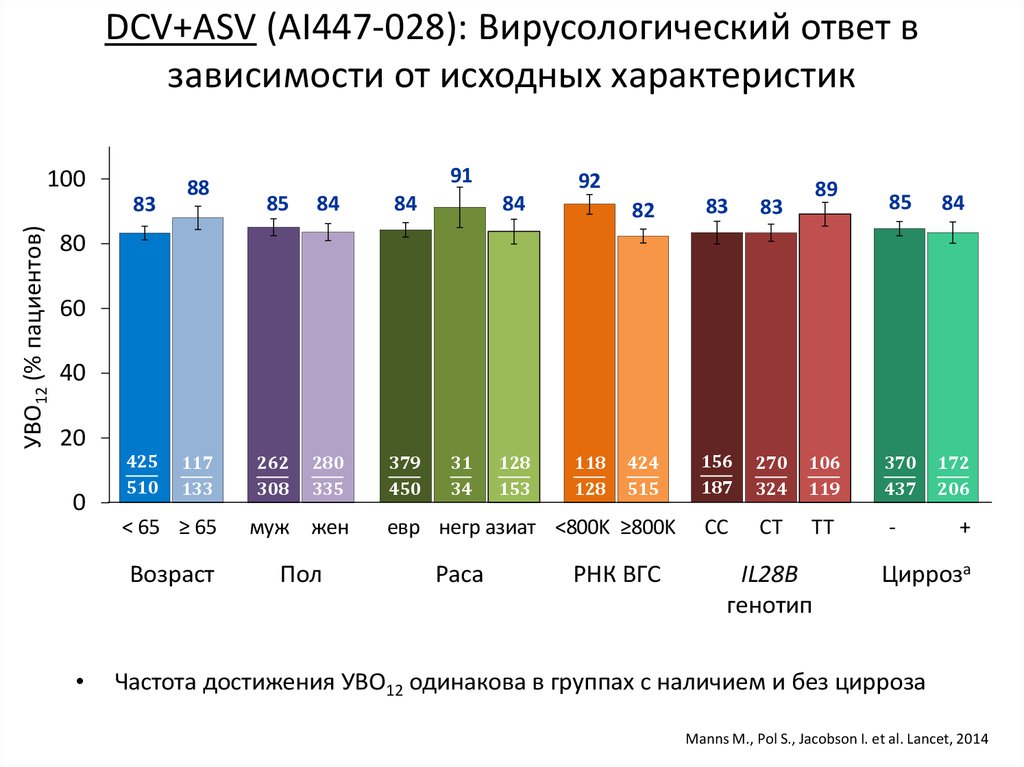
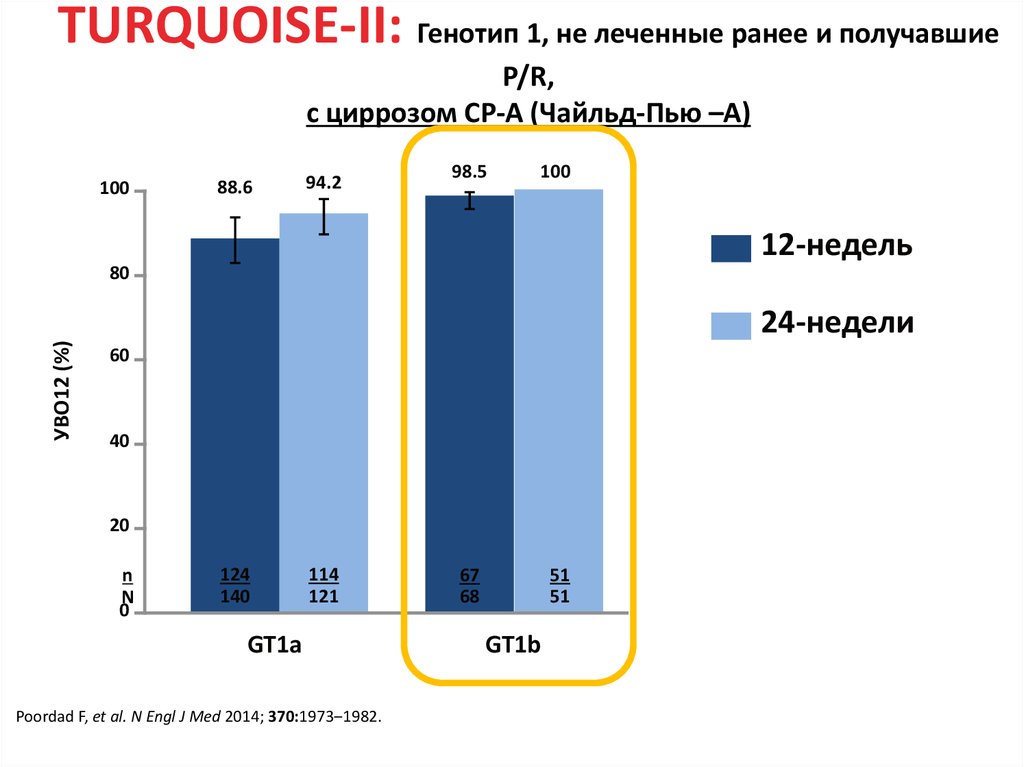
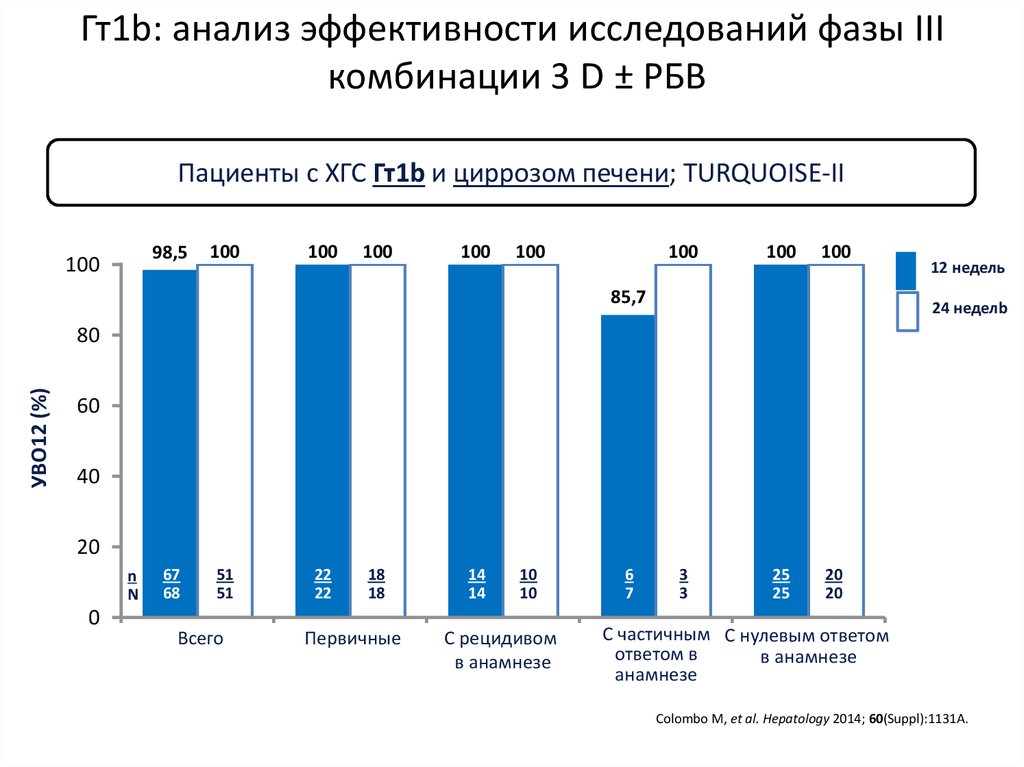
15. DCV+ASV (AI447-028): УВО12
УВО12 (% пациентов)a,b100
91
82
83










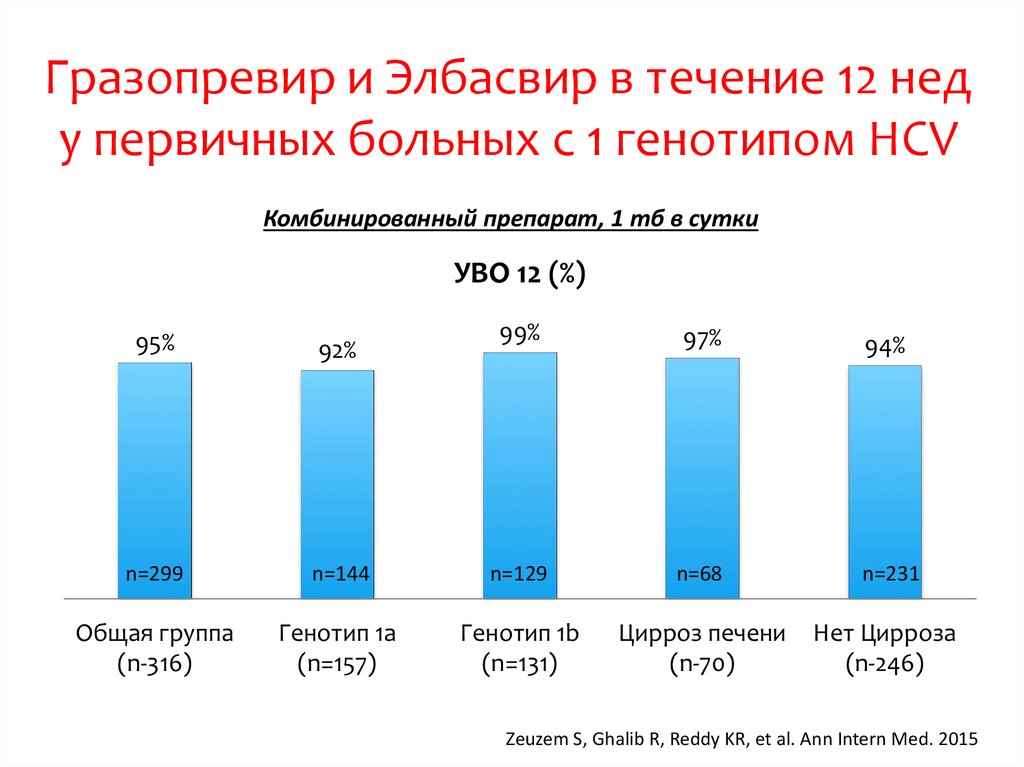
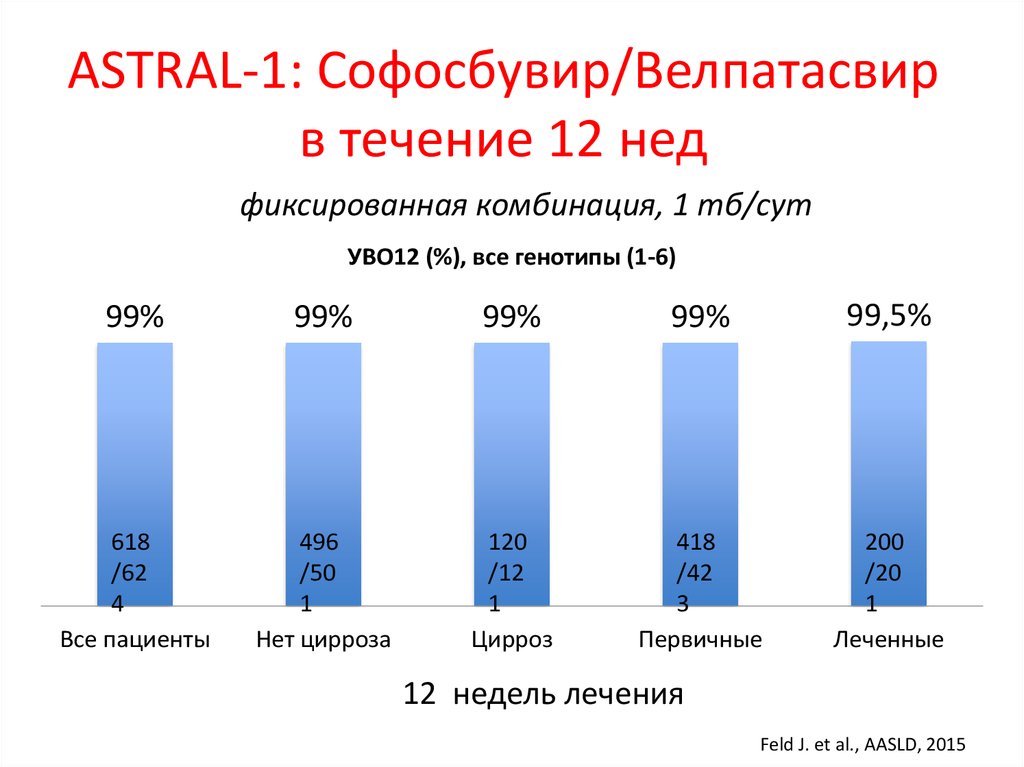
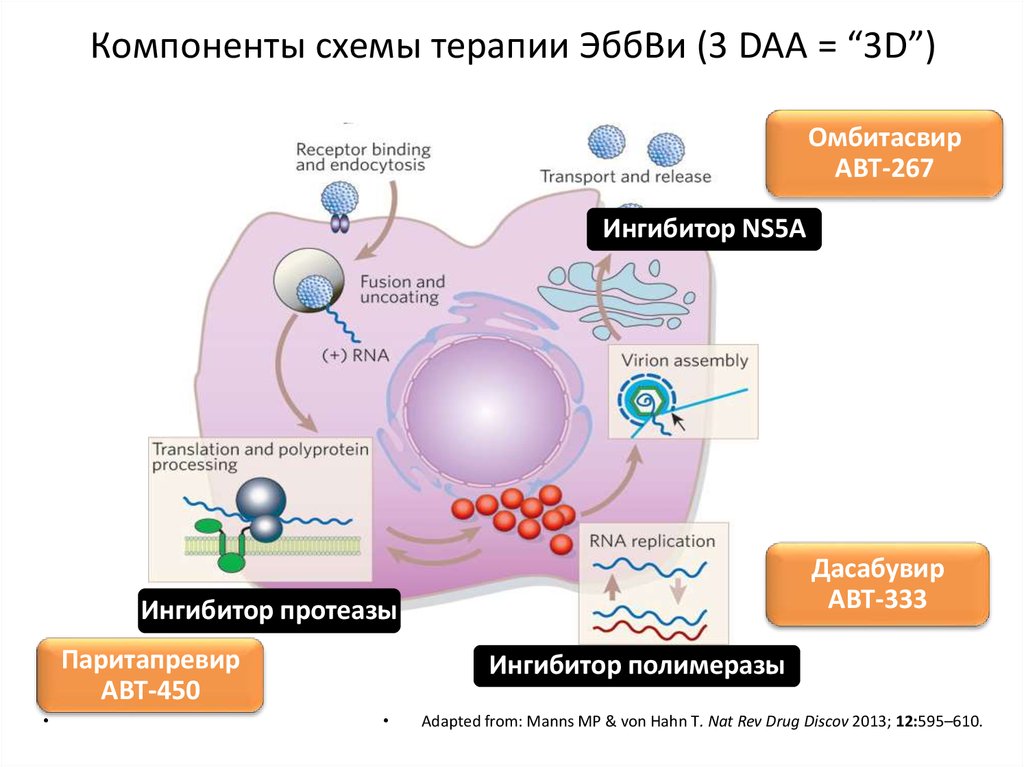
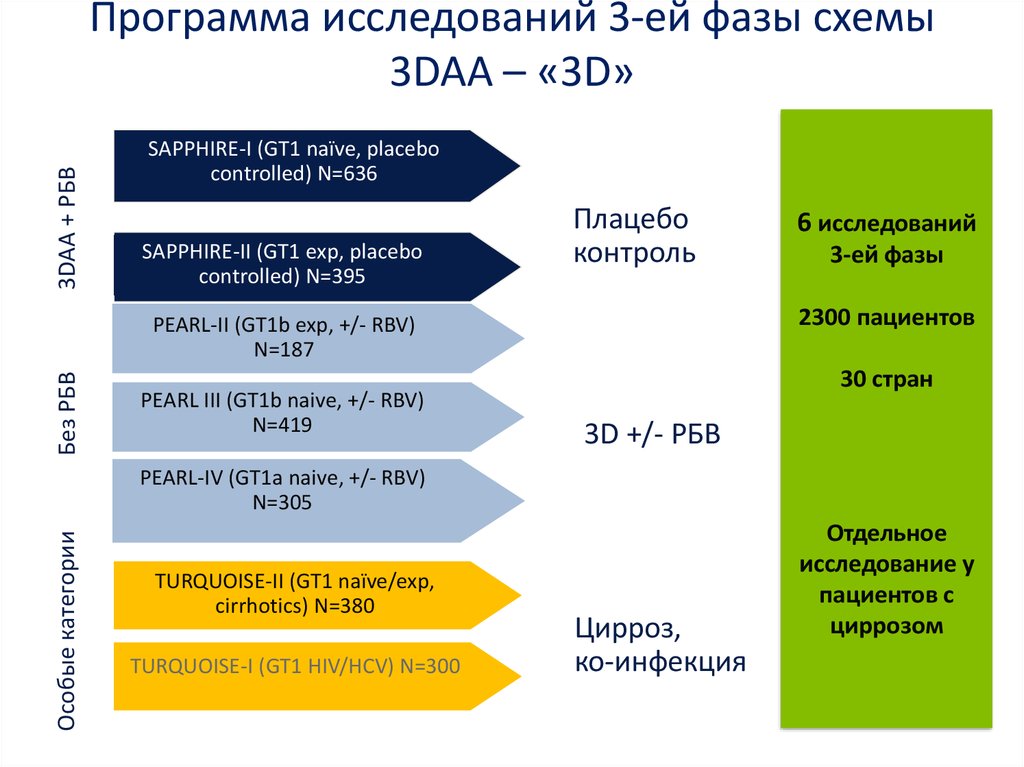

 medicine
medicine